向日葵芽苗期离子对复合盐胁迫的响应*
2017-05-09侯佩臣王晓冬
马 荣, 王 成, 马 庆, 侯佩臣, 王晓冬
向日葵芽苗期离子对复合盐胁迫的响应*
马 荣1,3, 王 成2,4, 马 庆3, 侯佩臣2, 王晓冬1,4**
(1. 北京农业智能装备技术研究中心 北京 100097; 2. 北京农业信息技术研究中心 北京 100097; 3. 内蒙古农业大学农学院 呼和浩特 010019; 4. 数字植物北京重点实验室 北京 100097)
研究向日葵耐盐的离子响应机制, 可为快速筛选耐盐向日葵品种提供科学依据。本试验以油用向日葵盐敏感品种‘YK18’、中度耐盐品种‘YK06’和耐盐品种‘GF01’为试验材料, 研究0 mmol·L–1、50 mmol·L–1、100 mmol·L–1、150 mmol·L–1、200 mmol·L–1和250 mmol·L–1复合盐(NaCl和Na2SO4按9∶1摩尔比混合)浓度下的种子萌发和离子在萌发幼苗中积累分布情况, 并利用离子流检测技术, 动态监测了复合盐胁迫24 h后植株根系的K+、Na+、Ca2+等离子的流速流向。结果表明, 复合盐胁迫抑制向日葵种子萌发, 导致发芽率下降, 平均发芽时间延长。盐胁迫后向日葵根系K+大量外排, 流速为‘YK18’>‘YK06’>‘GF01’; 随着盐胁迫浓度升高, 根系Na+流速由内吸转为外排, 内吸时‘YK18’速度最大, ‘YK06’次之, ‘GF01’最小, 外排时‘GF01’流速最大, 其“排盐”现象明显。复合盐胁迫后, 整株的Na+积累量增加, K+减少, K+/Na+随着盐浓度升高而下降; 低盐浓度(<150 mmol·L–1)下‘GF01’和‘YK06’茎秆中K+/Na+低于‘YK18’; 高盐胁迫(≥150 mmol·L–1)下, ‘GF01’整株Na+积累最少, 叶片K+/Na+最高。另外, 盐胁迫下向日葵幼苗根系Ca2+的吸收速率加快, ‘GF01’是‘YK18’的2倍。由此可见, 不同耐盐性的油用向日葵植株在盐胁迫下可通过调节Na+、K+和Ca2+的吸收与外排来适应盐胁迫环境, 耐盐性强的品种具有更强的保K+能力, 并通过区域化Na+(低盐胁迫)和拒盐机制(高盐胁迫)来提高其对盐胁迫的耐受性, 维持植株叶片中合理的K+/Na+值。本研究结果可为盐碱地耐盐品种筛选和栽培提供理论依据。
向日葵; 芽苗期; 复合盐胁迫; 离子流; 耐盐性
土地盐碱化已成为世界性的环境问题, 全球可利用耕地日益减少, 提高农作物的耐盐性是发挥盐碱土效益的有效方法之一[1]。油用向日葵(L)具有生育期短、抗逆性强、产量稳定的优点[2], 能够在一定含盐量的盐碱地正常生长、繁育。种植油用向日葵不但可以获得良好的经济效益, 还可逐渐改善盐碱地土壤的理化性质, 是盐碱地的理想农作物。因此研究油用向日葵的耐盐性机理对品种筛选和栽培措施制定具有重要意义。
目前很多学者围绕盐胁迫下向日葵的生长和生理特征做了大量研究, 对揭示向日葵耐盐机理, 明确耐盐性评价指标有巨大贡献。研究发现盐胁迫对不同品种向日葵种子萌发均有抑制作用, 随着盐浓度升高, 抑制作用增大[3]; 另外还会影响向日葵的叶面积、株高、膜透性[4]以及活性氧清除能力[5]等。也有研究者指出盐分胁迫下生物量可作为河套灌区向日葵耐盐性分析的关键指标[6]。盐分对作物造成的离子毒害、渗透胁迫和营养失衡等[7]危害主要与植株对无机离子的吸收、运输、分配等调控能力有直接关系, 从离子吸收、分配角度研究植株的耐盐机理, 对于评价植株的耐盐性更有直接意义。“拒钠”和“钠的区隔化”是植物耐盐的主要生理特征, 不少研究认为油葵和棉花(spp.)的耐盐机理较为相似, 阻止Na+向地上部运输是向日葵具有较强耐盐性的主要原因之一[8]。郑青松等[9]通过检测植株体内不同部位的Na+含量发现, 将Na+主要隔离在植株的茎秆和根部是维持叶片中合理的K/Na比的重要方式, 并且植株在离子吸收和向上运输过程中, 对K+具有较强的选择性。也有学者[10]表明在海水胁迫下, 向日葵幼苗各部位K+/Na+始终是叶部最高, 根部最低, 表明低浓度海水胁迫下向日葵幼苗的根和茎部对Na+有截流作用, 同时幼苗根部对K+的吸收和向地上部运输具有较强的选择性。以上研究均表明将进入植株体内的Na+区域化是向日葵耐盐的重要特征之一, 但对于盐胁迫下向日葵植株是否存在“拒钠”现象鲜见相关报道。
离子流检测技术是一种新型的电生理技术, 其中的非损伤性扫描离子选择电极技术(scanning ion-selective electrode technique, SIET)可以在无损的条件下, 检测出根际的离子运动速率、方向。与离子浓度、离子含量等静态信息相比, 离子流速检测能够更直观地揭示植株对胁迫逆境应答的生理机制[1,11]。本文以复合盐胁迫模拟田间土壤盐分, 研究了盐胁迫下不同耐盐性的油用向日葵品种的种子萌发情况, 结合离子流检测技术研究了复合盐胁迫下油葵幼苗植株对Na+、K+等离子的吸收和积累情况, 以求从离子吸收角度进一步揭示油葵的耐盐机制, 为其耐盐碱品种筛选、推广以及盐碱地区向日葵的生产指导等提供理论依据。
1 材料和方法
1.1 试验材料
供试3个油用向日葵品种分别为强耐盐性品种‘GF01’、中度耐盐性品种‘YK06’和盐敏感型品种‘YK18’, 均来自内蒙古农业大学。
1.2 试验方法
1.2.1 复合盐胁迫下的发芽试验
将NaCl和Na2SO4按9∶1摩尔比混合, 设5个处理浓度(S1~S5), 分别为50 mmol·L–1、100 mmol·L–1、150 mmol·L–1、200 mmol·L–1、250 mmol·L–1, CK为清水。每个处理3次重复。发芽试验的具体方法为: 挑选大小一致且饱满的向日葵种子, 用0.1% HgCl2消毒8 min, 用无菌水漂洗数次至无残留HgCl2后, 取直径为12.0 cm的培养皿, 底部垫2张滤纸做发芽床, 每个培养皿均匀放置50粒种子, 加入不同浓度的盐溶液(以滤纸和种子浸湿为宜), 盖上培养皿盖。置于25 ℃恒温光照培养箱中培养, 每天更换滤纸, 以保持恒定盐分浓度, 试验期间每天调查记录种子发芽数(种子上的真菌要及时清除, 以免受到污染而影响萌发), 种子发芽以胚根达到种子长度的一半为准。根据调查数据统计并计算发芽率及相关指标[12]。
发芽率(%)=最终发芽种子数/
供试发芽总数×100% (1)
发芽势(%)=第3 d时全部发芽的种子粒数/
供试种子粒数×100% (2)
发芽指数=ΣG/D(3)
平均发芽时间=Σ(G×D)/(4)
式中:G为第天发芽种子数,D为相应的发芽天数,为发芽率。
1.2.2 向日葵水培
挑选大小一致且饱满的向日葵种子, 用0.1% HgCl2消8 min, 用无菌水漂洗数次至无残留HgCl2后, 取直径为12.0 cm的培养皿, 底部垫2张滤纸做发芽床, 加入去离子水, 以滤纸和种子浸湿为宜, 待长出子叶且胚根长度达到3~5 cm时, 移入1/2霍格兰营养液水培。待植株长到1对真叶期时, 加入不同盐梯度的复合盐(NaCl+Na2SO4), 盐胁迫24 h后, 分别测定油葵植株根际K+、Na+、Ca2+的离子流速以及向日葵叶片、茎秆和根部的K+、Na+含量。
1.2.3 无机盐离子流检测
Ca2+、Na+、K+离子流的测定采用离子流检测技术(便携式植物微观动态离子流检测系统AI-IFDD-I, 北京农业信息技术研究中心)。取经过硅烷化处理的尖端直径为4~5 µm的玻璃微电极, 首先从后端注入约10~15 mm长度的相应离子的灌充液(Ca2+: 100 mmol·L–1CaCl2; Na+: 250 mmol·L–1NaCl; K+: 100 mmol·L–1KCl), 然后通过选择性离子电极灌装装置, 在微电极的尖端灌充相应的选择性离子交换剂(K+: Potassium ionophore I-cocktail A; Sigma-Aldrich, Louis, MO 63103, USA。Na+: odium ionophore II-cocktail A; Sigma-Aldrich, Louis, MO 63103, USA。Ca2+: Calcium ionophore I-cocktail A; Sigma-Aldrich, Louis, MO 63103, USA)。Ca2+与Na+微电极灌注的离子交换剂的长度约20~40 µm, K+约为180 µm。制作好的电极安装在氯化的Ag/AgCl电极固定架上, 使Ag/AgCl银丝前段浸入到灌充液中, 确保电极电解液与前置放大器相连。参比电极为固体电极。玻璃微电极需要校正后使用, K+和Na+的校正能斯特斜率在58左右, Ca2+在29左右即为合格电极, 方可用于检测。Ca2+校正液为0.05 mmol·L–1和0.5 mmol·L–1CaCl2, K+校正液为0.1 mmol·L–1和1 mmol·L–1KCl, Na+校正液为0.5 mmol·L–1和5 mmol·L–1NaCl。3种离子测试液的成分相同, 即0.1 mmol·L–1KCl, 0.1 mmol·L–1CaCl2, 0.1 mmol·L–1MgCl2, 0.5 mmol·L–1NaCl, 0.2 mmol·L–1Na2SO4, 0.3 mmol·L–1MES, pH 6.0。
测试时, 将向日葵幼苗根系置于测试液中, 用小玻璃块将测试部位固定压好。测量区域是位于距离根尖10 mm左右的根系分生区。由于分生区细胞敏感, 能够快速准确地反映盐胁迫下根系对3种离子的吸收情况。将电极尖端置于距离根表面10mm处作为原点, 电极在垂直于根表面的方向进行两点往复移动, 从而获得两点的电压差, 两点移动距离为30mm (图1), 每个样品稳定测量10 min以上, 每个样品6个重复, 结果取平均值[1]。
1.2.4 复合盐胁迫下植株体内K+、Na+的含量
植物组织内的离子含量检测参考侯建华等[13]的火焰光度法测定。取新鲜向日葵幼苗的叶片、茎秆、根系分别取5.00 g, 经过110.5 ℃杀青30 min后, 置于70~80 ℃烘箱中烘干至恒重, 用粉碎机磨碎, 称取通过420 μm筛的干样1.00 g, 加入30 mL去离子水, 摇匀后置于沸水浴中2 h, 冷却后定容至50 mL测定。3次重复, 结果取平均值。
①玻璃电极; ②LIX; ③向日葵根部; ④电极移动方向。①: Glass electrode; ②: LIX; ③: Sunflower root; ④: Electrode movement direction.
2 结果与分析
2.1 不同浓度复合盐胁迫对向日葵种子发芽率的影响
对照处理下, 3个品种均正常发芽(表1)。盐胁迫后, 发芽率、发芽指数、发芽势均下降, 平均发芽时间延长。低浓度(50 mmol·L–1)复合盐胁迫下, 与对照相比, 各品种发芽率和发芽指数随盐浓度增加而降低; 50 mmol·L–1复合盐胁迫下, ‘YK18’发芽率显著低于‘GF01’; 盐浓度增加到150 mmol·L–1后, ‘YK18’的发芽率下降了22.13%、而‘GF01’下降仅为17.58%。盐浓度达到200 mmol·L–1时, ‘YK18’的发芽率低于50%, 达到250 mmol·L–1时, ‘YK06’和‘YK18’发芽率均低于30%, ‘GF01’仍能维持48.16%的发芽率。相同盐处理条件下, ‘YK18’平均发芽时间最长, ‘GF01’最短, 3个品种的耐盐性差异显著(<0.05)。
2.2 不同浓度复合盐胁迫对向日葵根际K+流速的影响
正常生长条件下, 油葵植株根系吸收K+。品种间相比可看出, 正常生长条件下, 耐盐品种‘GF01’的K+吸收速度最大, 中度耐盐品种‘YK06’次之, 盐敏感品种‘YK18’最小。不同浓度复合盐胁迫24 h后根际K+呈现外排趋势, 外排速度随复合盐浓度增加而增加(图2)。且耐盐品种‘GF01’的K+外流速度最小, ‘YK18’外流速度最大, 品种间差异显著。盐处理浓度为150 mmol·L–1时, ‘GF01’的K+外排速度约为112 pmol·cm–2·s–1, 分别为50 mmol·L–1和100 mmol·L–1浓度下的2.00倍和1.43倍; 盐敏感品种‘YK18’的K+外排流速分别为50 mmol·L–1和100 mmol·L–1浓度下的3.19倍和1.73倍, 流速增加幅度较耐盐品种‘GF01’大。复合盐胁迫后, 200 mmol·L–1时, ‘GF01’和‘YK06’的K+外排速度相近, 均显著小于‘YK18’(<0.05)。另外以150 mmol·L–1复合盐处理浓度胁迫下为例, 可以看到3个品种的K+外排流速变化有小范围波动但总体较为平稳, 反映了不同品种植株的即时生理状态(图3)。
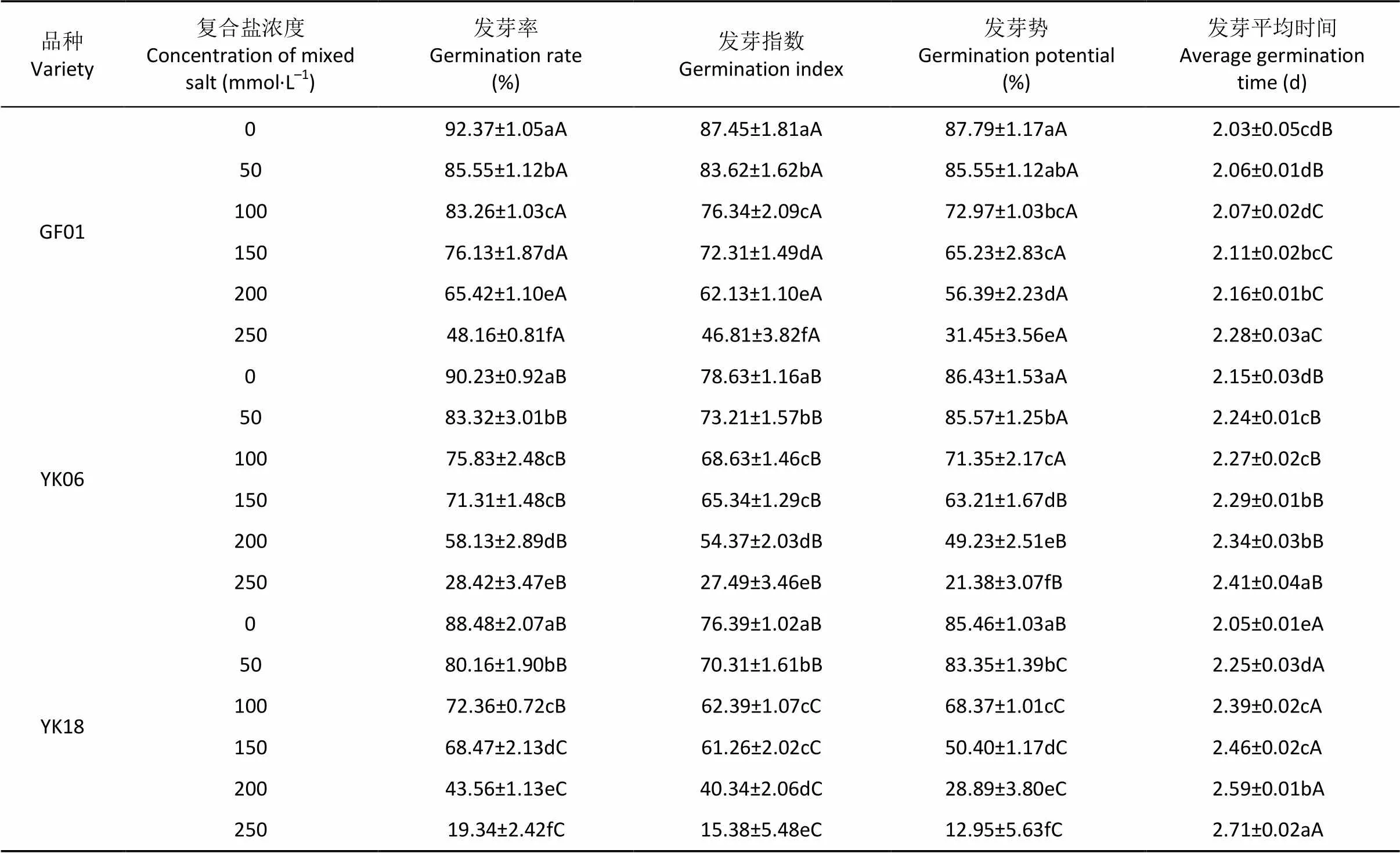
表1 不同浓度复合盐胁迫对不同品种油用向日葵种子萌发的影响
不同小写字母表示浓度间差异显著(<0.05), 不同大写字母表示品种间差异显著(<0.05)。Different lowercase letters indicate significant differences among different salt concentrations at 0.05 level. Different capital letters indicate significant differences among varieties at 0.05 level.
不同大写字母表示浓度间差异显著(<0.05), 不同小写字母表示品种间差异显著(<0.05)。Different capital letters indicate significant differences among different salt concentrations at 0.05 level. Different lowercase letters indicate significant differences among varieties at 0.05 level.
2.3 不同浓度复合盐胁迫对向日葵根际Na+吸收的影响
正常生长条件下, 各品种油葵植株少量吸收Na+。随着复合盐处理浓度增加, 均呈现先内吸后外排的现象(图4)。低盐浓度(50~100 mmol·L–1)时, 油葵植株根系Na+内流, 盐浓度达到150 mmol·L–1时, 3个品种根系Na+均转为外排, 200 mmol·L–1时, 外排流速最高可达7 294 pmol·cm–2·s–1(图5)。品种间相比Na+流速差异显著, 内吸时‘GF01’的流速最小, 50 mmol·L–1盐处理浓度下, ‘GF01’的Na+吸收速率为897 pmol·cm–2·s–1, 是‘YK06’的39%, ‘YK18’的19.9%; 100 mmol·L–1时, 3品种的Na+内吸速度均有所加快, 但‘GF01’的吸收速度仍为最小。外排时‘GF01’的流速最大, 盐浓度达200 mmol·L–1时, ‘GF01’的Na+外排的平均速度是6 512 pmol·cm–2·s–1, 为‘YK06’的3.64倍, ‘YK18’的5.78倍。
不同大写字母表示浓度间差异显著(<0.05), 不同小写字母表示品种间差异显著(<0.05)。Different capital letters indicate significant differences among different salt concentrations at 0.05 level. Different lowercase letters indicate significant differences among varieties at 0.05 level.
2.4 不同浓度复合盐胁迫对向日葵Ca2+的影响
植株在正常生长状态下会少量吸收Ca2+, 内流速度较为缓慢。复合盐胁迫下, 植株吸收Ca2+的速率显著加快, 且与复合盐浓度的增加呈正相关。3个品种间吸收Ca2+的速率差异显著, 表现为‘GF01’>‘YK06’>‘YK18’(图6), 且随盐浓度增加耐盐品种的Ca2+吸收速率增加更快, 在盐处理浓度达150 mmol·L–1时, ‘GF01’ Ca2+吸收速率为‘YK18’的2.00倍(图7)。
2.5 复合盐胁迫后植株体内K+、Na+含量变化
2.5.1 K+积累与分布
与对照相比, 低浓度(50 mmol·L–1)复合盐胁迫后向日葵植株各组织器官中的K+积累量明显下降, 100 mmol·L–1盐处理时植株K+总积累回升, 高浓度盐处理后(≥150 mmol·L–1), 植株的K+总积累量再次显著降低, 3个品种趋势相同(图8)。该结果与在其根际检测到的150 mmol·L–1盐胁迫时, K+外流速度迅速增加相符合(图2)。3个品种中, 耐盐品种‘GF01’的K+总积累最高。高盐浓度(≥150 mmol·L–1)处理后, 不同品种间的K+积累量分布差异明显, ‘GF01’根系和茎的K+积累量显著降低, 但叶片中K+积累量相对稳定。200 mmol·L–1处理时, ‘GF01’根系K+迅速减少为对照的27.63%, 但叶片中K+含量仍能维持在较高水平(4.02 mg·g–1), 甚至高于对照(3.39 mg·g–1), 占植株K+总积累的48%。而‘YK06’和‘YK18’并未表现出类似的特征, 其叶片中的K+积累量分别占植株K+总积累的28.6%和31.6%。
不同大写字母表示浓度间差异显著(<0.05), 不同小写字母表示品种间差异显著(<0.05)。Different capital letters indicate significant differences among different salt concentrations at 0.05 level. Different lowercase letters indicate significant differences among varieties at 0.05 level.
2.5.2 Na+积累与分布
正常生长条件下, 植株体内的Na+总积累量较少, 为0.15 mg·g–1左右。复合盐胁迫后, 向日葵根系、茎和叶片的Na+积累量均高于对照(图9), 且不同向日葵品种Na+含量增加程度不同, 同一向日葵品种不同部位Na+含量增加程度也不相同。低盐浓度下(≤100 mmol·L–1), 所有品种植株根和茎Na+含量均高于叶片。品种间相比, 整株、叶片、根部钠积累量差异较小, 但茎秆中钠积累量差异较大, 耐盐品种‘GF01’为1.628mg·g–1, 显著高于其他两个品种1.215 mg·g–1和1.189mg·g–1。高盐浓度(≥150 mmol·L–1)时, 品种间茎、根Na+积累量差异不大, 但盐敏感品种‘YK18’叶片中的Na+离子积累量迅速增加为2.30 mg·g–1, 是‘GF01’和‘YK06’的1.6倍。盐浓度达200 mmol·L–1时, ‘YK06’和‘YK18’总钠含量迅速增加到11.01 mg·g–1和11.04 mg·g–1, 显著高于‘GF01’的9.41 mg·g–1, 尤其是中度耐盐品种‘YK06’叶片中的Na+含量接近‘YK18’的水平, 约为4.10 mg·g–1, 是‘GF01’的1.75倍。另外, 200 mmol·L–1浓度盐胁迫下, 耐盐品种‘GF01’根部的Na+含量显著高于叶片中的Na+含量, 而其他品种根部与叶片中的Na+含量基本接近。
2.5.3 K+/Na+的变化
复合盐胁迫后, 3个向日葵品种各器官中K+/Na+值均显著低于对照(图10)。随着盐浓度的增加, 各器官的K+/Na+值逐渐下降, 但下降的程度存在差异。耐盐品种‘GF01’植株中的K+/Na+值, 0~50 mmol·L–1时表现为叶>根>茎, 100 mmol·L–1后为叶>茎>根, 在盐胁迫下仍维持叶片中具有最高的K+/Na+值; 中度耐盐品种‘YK06’ 在50~100 mmol·L–1时表现为叶>茎>根, 150 mmol·L–1后为茎>叶>根, 其叶片中的K+/Na+值在150 mmol·L–1时下降明显; 盐敏感品种‘YK18’在50 mmol·L–1时为叶>茎>根, 100 mmol·L–1后基本为茎>叶>根, 其叶片中的K+/Na+值在盐浓度达100 mmol·L–1时下降明显。因此叶片的K+/Na+值可以作为复合盐胁迫对向日葵危害程度的指标。
3 讨论与结论
3.1 复合盐胁迫下不同品种油葵种子萌发和生长的影响
盐胁迫抑制种子吸水膨胀, 造成种子发芽迟缓。王善仙等[14]和刘杰等[15]对盐胁迫下向日葵发芽率的研究表明, 盐胁迫后, 向日葵种子的发芽率及出苗率明显降低, 种子出苗时间推迟。低盐浓度(40~120mmol·L–1)下, 向日葵种子表现为出苗延迟, 但出苗率及成苗率的差异并不明显, 而高盐胁迫后(160~240 mmol·L–1), 不仅出苗延迟, 出苗率及成苗率也均明显下降。桑利敏等[16]发现甜菜(L.)在Na2SO4+NaCl混合盐胁迫下, 两个品种的发芽率表现出下降趋势, 与对照差异明显。本研究中向日葵受到复合盐胁迫(NaCl+Na2SO4)后, 发芽率、发芽指数、发芽势均下降, 平均发芽时间延长。结果与前人的研究结果相似, 究其原因可能是由于盐胁迫下, 水势降低, 种子吸胀吸水困难, 随着盐浓度继续增加, 植物细胞膜结构遭到破坏, 导致种子内大量溶质外渗, 同时毒害离子Na+进入细胞, 造成细胞失水, 影响种子发芽。另外本研究发现复合盐浓度达200mmol·L–1时, 耐盐品种的发芽率接近50%, 而盐敏感型品种‘YK18’几乎不发芽。盐敏感型品种‘YK18’平均发芽时间最长, 耐盐品种‘GF01’最短, 3个品种间的耐盐性差异显著(<0.01)。这种品种间的差异可能是由基因型决定的。
3.2 复合盐胁迫下不同品种油葵对K+、Na+吸收的影响
无机离子是维持植株生长发育必不可少的重要元素。研究表明, 每种植物都不同程度同时存在“吸盐”和“拒盐”两种机制, 这两种机制都直接或者间接地影响植物体对无机离子的吸收、积累以及区域化分[9]。植物受到盐胁迫后, 会吸收更多Na+和Cl–等盐离子, 减少对K+、Ca2+以及Mg2+的吸收, 导致植物体内自身的离子平衡被扰乱。K+是重要的营养元素, 对维持植物正常生长具有重要作用, 许多学者认为, 植物抵御盐胁迫的能力一定程度上依赖于K+的供应或保有水平[1]。本研究利用离子流检测技术实时动态监测复合盐胁迫24 h后的向日葵发现, 其根际K+由少量内流迅速转变为外流, 外流速度随盐处理浓度增加而加快, 同步也检测到植株根系的K+积累量下降, 二者结果相吻合, 表明盐胁迫造成了植株的K+流失。同时发现耐盐品种‘GF01’ K+外流速度最慢, 其根系的K+积累量最高, 进一步证实了耐盐品种在盐胁迫条件下仍具有较好的K+保有能力。
很多研究认为, 控制Na+的吸收和体内分布是植物有效耐盐机制之一[13]。基本途径是将Na+优先积累在根茎中, 阻止Na+在叶片中的积累, 也可以通过细胞质膜排出体外或者通过液泡膜Na+/H+逆向转运蛋白将细胞中过多的Na+区域化在液泡里[17], 减少对植物的伤害。在低盐浓度(100 mmol·L–1)下, 各品种均表现为Na+内流, 耐盐品种‘GF01’内吸速度最慢, 并且整株的Na+积累量最低, 同时发现该浓度盐处理下, ‘GF01’可通过将Na+截留在茎秆, 来维持叶片中相对较低的钠水平。该结果与侯建华等[13]在盐分胁迫对向日葵K+、Na+吸收与分配的影响研究结果一致。向日葵这种将Na+区隔在茎秆中, 限制Na+向叶片运输的现象, 可能是由于茎秆中细胞质的Na+/H+逆向转运蛋白大量表达, 将大量的Na+储存在液泡中, 从而减少Na+向地上部分的运输[18], 以此来维持植株的正常生长。本研究还发现, 当盐浓度达到一定程度(≥150mmol·L–1)时, 植株会出现“排盐”现象, 并且耐盐性越强的品种, 该特征越明显。耐盐品种‘GF01’Na+外排速度最快, 其整株和叶片的Na+积累量也最低, 其耐盐性最强。而另外两个品种Na+外排速度较慢, 整株和叶片中Na+积累量较高, 耐盐性较差。在高盐(200mmol·L–1)浓度下, 耐盐品种‘GF01’根部的Na+积累量显著高于叶片中的Na+积累量, 而其他品种根部与叶片中的Na+积累量基本接近, 这与韩金龙等[19]在对玉米()耐盐性研究的结果相似, 高浓度(>100mmol·L–1)NaCl胁迫耐盐玉米品种根部Na+含量明显高于叶片, 而普通品种根部Na+含量与叶片相近。由此可见, 耐盐品种根系和茎秆对钠的截留能力, 是其具备强耐盐性的主要原因。
Na+因其水合离子半径与K+相似[20], 可与K+竞争跨膜转运位点进入细胞内, 并在植物体内部分代替K+的功能, 提高细胞渗透势。但是过多的Na+则会使相关代谢酶失活而产生毒害, 导致作物生长受到抑制甚至死亡, 所以维持K+/Na+比值在一个合理范围内对植物抗盐性具有重要意义。敖雁等[21]发现盐胁迫明显增加了番茄()体内Na+含量, 同时降低了体内K+含量, 导致3个番茄品种根系、茎秆和叶片K+/Na+下降, 植物生长受到抑制。本研究中, 复合盐胁迫后, 向日葵K+含量减少, Na+含量增加, 各器官中K+/Na+值均显著低于对照, 其中叶片K+/Na+值下降最为显著。杨帆等[22]对构树()幼苗的研究也发现相同的规律, 树苗各器官中的Na+含量随土壤NaCl浓度升高而显著增加, 且叶片中的K+/Na+明显低于根系。事实上叶片中较高的K+/Na+值, 对于维持盐胁迫下正常的光合呼吸等生理过程, 抵御逆境胁迫具有重要作用, 本研究中耐盐品种‘GF01’叶片的K+/Na+明显高于‘YK06’和‘YK18’, 这与其整株对Na+的区隔能力较强并且具有较好的K+保有能力有关。
3.3 复合盐胁迫下不同品种对Ca2+的影响
在植物生长发育中, Ca2+是维持植物细胞正常生理功能的重要物质, 不仅参与了大多数细胞生理代谢, 而且还作为第2信使调控基因表达[23]。在植物受到盐胁迫后, Ca2+能够稳定植物的细胞壁、细胞膜, 激活或抑制细胞膜上各种离子通道, 激活或抑制细胞内特定酶的活性, 诱导抗逆基因转录表达, 从而增强植物对环境的适应能力。赵旭等[24]在研究Ca2+对两种基因型冬小麦()萌发过程中盐胁迫效应中发现, 外源钙可以明显提高盐处理下小麦品种‘陕266’的发芽率和发芽指数, 减轻了盐害作用。刘雪琴等[25]也指出, 外源Ca(NO3)2显著缓解了盐胁迫对玉米种子发芽的抑制作用, 且随Ca(NO3)2浓度的增加缓解作用逐渐增强。由此可见, Ca2+作为一种信号物质参与盐胁迫后细胞的信号转导, 在植株受到胁迫时, 增强 Ca2+的吸收也是提高自身抗性抵御逆境的一个重要途径。在本研究中, 植株受到复合盐胁迫24 h后, 植株根系Ca2+内吸加剧, 盐胁迫浓度越高, 内吸速率越快。而且耐盐品种‘GF01’吸收速度最快, 盐敏感品种‘YK18’最慢, 也表明盐胁迫后, 不同品种植株对Ca2+的吸收差异可能是造成其耐盐性不同的原因之一。
薛延丰等[26]表明, 盐胁迫后, Na+能置换细胞膜上的Ca2+, 导致K+的大量外流, 使得植物体内的离子平衡失调, 生长发育受到抑制, 施加外源钙后, 可以缓解NaCl的胁迫, 促进酶活性升高, 调节无机离子的运输, 增强植物的抗盐能力。李青松等[27]对Ca2+及钙调蛋白(CaM)对不同温度型冬小麦盐分吸收与累积的研究中也发现, Ca2+可以通过CaM作用于盐敏感途径(SOS途径)调节控制小麦中Na+的净吸收和累积, 促进小麦K+吸收。王玉倩等[28]也发现Ca2+对细胞膜上K+专性通道和非选择性阳离子通道(NSCC)都有活化作用, 可以促进K+吸收, 其促进作用随Ca2+的增加而增强。结合本研究中发现的Na+、K+吸收和积累情况来看, 耐盐品种‘GF01’的耐盐机制可能是由于植株在盐胁迫下Ca2+直接激活或者间接通过CaM激活了SOS途径, 诱导细胞质膜上的Na+-H+反向运输蛋白和K+运输蛋白的表达, 进而加速胞内Na+外排和K+吸收, 提高叶片中K+/Na+, 从而调节了植物体细胞内离子平衡, 但具体作用途径和机制仍需更深入的研究。
3.4 结论
本试验利用离子流检测技术对不同耐盐性向日葵受复合盐胁迫后根系的K+、Na+、Ca2+流速情况进行检测, 表明耐盐性强的品种具有强的保K+能力, 同时在低盐浓度下通过区域化Na+增强其耐盐性, 而在高盐胁迫下, 向日葵植株除了有Na+区域化现象, 还具有鲜明的“吐盐”现象。另外植株受到盐胁迫后, Ca2+的加速吸收, 也是植株耐盐的一种表现形式。离子流检测技术作为一种无损检测技术为盐胁迫下植物根系离子吸收机制的研究提供了一种可选择的方法, 可以高效、便捷地应用到以后抗性鉴定和生理机制研究中。
[1] 王晓冬, 王成, 马智宏, 等. 短期NaCl胁迫对不同小麦品种幼苗K+吸收和Na+、K+积累的影响[J]. 生态学报, 2011, 31(10): 2822–2830 Wang X D, Wang C, Ma Z H, et al. Effect of short-term salt stress on the absorption of K+and accumulation of Na+, K+in seedlings of different wheat varieties[J]. Acta Ecologica Sinica, 2011, 31(10): 2822–2830
[2] 李晓丽, 张边江. 油用向日葵的研究进展[J]. 安徽农业科学, 2009, 37(27): 13015–13017 Li X L, Zhang B J. Research progress onL.[J]. Journal of Anhui Agricultural Sciences, 2009, 37(27): 13015–13017
[3] 于志贤, 耿稞, 侯建华, 等. 盐胁迫对不同基因型向日葵种子萌发的影响[J]. 种子, 2013, 32(10): 29–33 Yu Z X, Geng K, Hou J H, et al. Effect of salt stress on seed germination of different sunflower[J]. Seed, 2013, 32(10): 29–33
[4] 王伟, 于海峰, 张永虎, 等. 盐胁迫对向日葵幼苗生长和生理特性的影响[J]. 华北农学报, 2013, 28(1): 176–180 Wang W, Yu H F, Zhang Y H, et al. Effects of salt on the growth and physiological characteristics of sunflower seedlings[J]. Acta Agriculturae Boreali-Sinica, 2013, 28(1): 176–180
[5] 张俊莲, 陈勇胜, 武季玲, 等. 向日葵对盐逆境伤害的生理反应及耐盐性研究[J]. 中国油料作物学报, 2003, 25(1): 45–49 Zhang J L, Chen Y S, Wu J L, et al. Physiological responses and salt-tolerance of sunflower () under salt stress injury[J]. Chinese Journal of Oil Crop Sciences, 2003, 25(1): 45–49
[6] 遆晋松, 童文杰, 周媛媛, 等. 河套灌区向日葵耐盐指标评价[J]. 中国生态农业学报, 2014, 22(2): 177–184 Ti J S, Tong W J, Zhou Y Y, et al. Evaluation of salinity tolerance index of sunflower in Hetao Irrigation District[J]. Chinese Journal of Eco-Agriculture, 2014, 22(2): 177–184
[7] 刘杰, 李云玲, 孙虎, 等. 盐碱胁迫对向日葵子叶渗透调节及离子平衡的影响[J]. 安徽农业学报, 2015, 42(1): 86–91 Liu J, Li Y L, Sun H, et al. Effects of salt and alkali stresses on osmotic adjustment and ionic balance in sunflower cotyledon[J]. Journal of Anhui Agricultural University, 2015, 42(1): 86–91
[8] 谷思玉, 周连仁, 王佳佳. 不同品种玉米萌发期耐盐性的比较[J]. 中国农学通报, 2011, 27(33): 34–39Gu S Y, Zhou L R, Wang J J. Relatives of salt tolerance of different kinds inbred lines of maize in embryoism[J]. Chinese Agricultural Science Bulletin, 2011, 27(33): 34–39
[9] 郑青松, 刘海燕, 隆小华, 等. 盐胁迫对油菜幼苗离子吸收和分配的影响[J]. 中国油料作物学报, 2010, 32(1): 65–70 Zheng Q S, Liu H Y, Long X H, et al. Effects of salt stress on ionic absorption and distribution of rapeseed seedlings[J]. Chinese Journal of Oil Crop Sciences, 2010, 32(1): 65–70
[10] 寇伟锋, 刘兆普, 郑宏伟. 海水胁迫对向日葵苗期生长及矿质营养吸收特性的影响[J]. 生态学杂志, 2006, 25(5): 521–525 Kou W F, Liu Z P, Zheng H W. Effects of seawater stress onL. seedlings growth and mineral nutrition[J]. Chinese Journal of Ecology, 2006, 25(5): 521–525
[11] 赵旭, 王林权, 周春菊, 等. 盐胁迫对四种基因型冬小麦幼苗Na+、K+吸收和积累的影响[J]. 生态学报, 2007, 27(1): 205–213 Zhao X, Wang L Q, Zhou C J, et al. Effects of salt stress on the absorption and accumulation of Na+and K+in seedlings of four winter wheat () genotypes[J]. Acta Ecologica Sinica, 2007, 27(1): 205–213
[12] 杨磊, 奚天雪, 殷婷婷, 等. 水势胁迫对2种菊科种子萌发影响的研究[J]. 种子, 2016, 35(7): 26–30 Yang L, Xi T X, Ying T T, et al. Study on water potential stress on seed germination of two types of Asteraceae[J]. Seed, 2016, 35(7): 26–30
[13] 侯建华, 于海峰, 安玉麟, 等. 盐分胁迫对向日葵K+、Na+吸收与分配的影响[J]. 华北农学报, 2013, 28(2): 139–143 Hou J H, Yu H F, An Y L, et al. Research on changing of K+, Na+of sunflower under salinity stress[J]. Acta Agriculturae Boreali-Sinica, 2013, 28(2): 139–143
[14] 王善仙, 刘宛, 李培军, 等. 生物有机肥调控对盐碱胁迫下向日葵幼苗生长及生理指标的影响[J]. 生态学杂志, 2011, 30(4): 682–688 Wang S X, Liu W, Li P J, et al. Regulation effects of bioorganic fertilizer on sunflower seedlings growth and leaf physiological indices under salt-alkali stress[J]. Chinese Journal of Ecology, 2011, 30(4): 682–688
[15] 刘杰, 张美丽, 张义, 等. 人工模拟盐、碱环境对向日葵种子萌发及幼苗生长的影响[J]. 作物学报, 2008, 34(10): 1818–1825 Liu J, Zhang M L, Zhang Y, et al. Effects of simulated salt and alkali conditions on seed germination and seedling growth of sunflower (L.)[J]. Acta Agronomica Sinica, 2008, 34(10): 1818–1825
[16] 桑利敏, 李彩凤, 王玉波, 等. Na2SO4+NaCl混合盐胁迫对甜菜幼苗生长的影响[J]. 作物杂志, 2016, (4): 137–141 Sang L M, Li C F, Wang Y B, et al. Effects of Na2SO4+NaCl mixed salt stress on the growth of sugar beet seedlings[J]. Crops, 2016, (4): 137–141
[17] 徐璐, 郭善利, 尹海波. Na+/H+逆向转运蛋白与植物耐盐性研究[J]. 湖北农业科学, 2016, 55(11): 2727–2730 Xu L, Guo S L, Yin H B. The Na+/H+antiporter and its relation to salt tolerance in plants[J]. Hubei Agricultural Sciences, 2016, 55(11): 2727–2730
[18] 徐猛, 马巧荣, 张继涛, 等. 盐胁迫下不同基因型冬小麦渗透及离子的毒害效应[J]. 生态学报, 2011, 31(3): 784–792 Xu M, Ma Q R, Zhang J T, et al. Osmotic and ionic stress effects of high NaCl concentration on seedlings of four wheat (L.) genotypes[J]. Acta Ecologica Sinica, 2011, 31(3): 784–792
[19] 韩金龙, 徐立华, 徐相波, 等. 盐胁迫下不同玉米品种在苗期叶片和根中Na+、K+、Ca2+及脯氨酸含量变化的研究[J]. 作物杂志, 2010, (1): 49–52 Han J L, Xu L H, Xu X B, et al. Changes of Na+, K+, Ca2+and praline contents in leaf and root of different maize hybrids under salt stress at seedling stage[J]. Crops, 2010, (1): 49–52
[20] 高英, 同延安, 赵营, 等. 盐胁迫对玉米发芽和苗期生长的影响[J]. 中国土壤与肥料, 2007, (2): 30–34 Gao Y, Tong Y A, Zhao Y, et al. Effect of salt stress on seed germination and seedlings growth of corn[J]. Soil and Fertilizer Sciences in China, 2007, (2): 30–34
[21] 敖雁, 管永祥, 孙云贺, 等. 基于离子稳态的野生与栽培番茄及其杂交F1的耐盐性差异[J]. 土壤学报, 2016, 53(4): 1065–1073 Ao Y, Guan Y X, Sun Y H, et al. A comparative study on salt tolerance of wild cultivated and their hybrid F1tomato seedlings based on the ion homeostasis[J]. Acta Pedologica Sinica, 2016, 53(4): 1065–1073
[22] 杨帆, 丁菲, 杜天真, 等. 盐胁迫下构树幼苗各器官中K+、Ca2+、Na+和Cl–含量分布及吸收特征[J]. 应用生态学报, 2009, 20(4): 767–772 Yang F, Ding F, Du T Z, et al. Absorption and allocation characteristics of K+, Ca2+, Na+and Cl–in different organs of broussonetia papyrifera seedlings under NaCl stress[J]. Chinese Journal of Applied Ecology, 2009, 20(4): 767–772
[23] 龚伟, 王伯初. 钙离子在植物抵抗非生物胁迫中的作用[J]. 生命的化学, 2011, 31(1): 107–111 Gong W, Wang B C. The role of Ca2+in plant response to abiotic stress[J]. Chemistry of Life, 2011, 31(1): 107–111
[24] 赵旭, 王林权, 周春菊, 等. 钙离子对两种基因型冬小麦萌发过程中盐胁迫效应的影响[J]. 土壤通报, 2006, 37(4): 748–752 Zhao X, Wang L Q, Zhou C J, et al. Effects of calcium on seed germination of different winter wheat genotypes under salt stress[J]. Chinese Journal of Soil Science, 2006, 37(4): 748–752
[25] 刘雪琴, 仝瑞建, 施佳妮. 外源Ca2+对盐胁迫下玉米萌发与幼苗生长的影响[J]. 中国农学通报, 2010, 26(17): 197–200 Liu X Q, Tong R J, Shi J N. Effect of calcium on germination and seedling growth of maize under salt stress[J]. Chinese Agricultural Science Bulletin, 2010, 26(17): 197–200
[26] 薛延丰, 刘兆普. 钙离子对盐胁迫下菊芋幼苗的生长、生理反应和光合能力的影响理论[J]. 农业工程学报, 2006, 22(9): 44–47 Xue Y F, Liu Z P. Effects of calcium ion on growth physiological responses and photosynthetic ability in salt-stressed jerusalem artichoke (L.) seedlings[J]. Transactions of the CSAE, 2006, 22(9): 44–47
[27] 李青松, 王林权, 周春菊, 等. 钙离子及钙调蛋白对不同温度型冬小麦盐分吸收与累积的影响[J]. 西北植物学报, 2009, 29(5): 867–873 Li Q S, Wang L Q, Zhou C J, et al. Function of calcium ion and calmodulin on sodium uptake and accumulation of winter wheat with different canopy temperature[J]. Acta Botanica Boreali-Occidentalia Sinica, 2009, 29(5): 867–873
[28] 王玉倩, 汪小丽, 盛海君, 等. 盐胁迫条件下钙离子对不同品种小麦NSCCs转移钾的影响[J]. 扬州大学学报: 农业与生命科学版, 2009, 30(4): 63–66 Wang Y Q, Wang X L, Sheng H J, et al. Effects of calcium on potassium uptake through NSCCs in different wheat cultivars under salt stress[J]. Journal of Yangzhou University: Agricultural and Life Science Edition, 2009, 30(4): 63–66
Ion response of sunflower at sprouting stage to mixed salt stress*
MA Rong1,3, WANG Cheng2,4, MA Qing3, HOU Peichen2, WANG Xiaodong1,4**
(1. Beijing Research Center of Intelligent Equipment for Agriculture, Beijing 100097, China; 2. Beijing Research Center for Information Technology in Agriculture, Beijing 100097, China; 3.College of Agriculture, Inner Mongolia Agricultural University, Hohhot 010019, China; 4. Beijing Key Lab of Digital Plant, Beijing Research Center for Information Technology in Agriculture, Beijing 100097, China)
Research on the mechanism of response of sunflower to salt stress can provide scientific basis for rapid screening of salt resistant varieties, a critical element in the exploitation of saline-alkali lands. In this study, salt-sensitive variety ‘YK18’, moderately salt-tolerant variety ‘YK06’ and highly salt-tolerant variety ‘GF01’ of sunflower were used to analyze seed germination, ion accumulation and distribution in seedlings of different varieties of sunflower under mixed salt (NaCl/Na2SO4of 9/1 mol) concentrations of 0 mmol·L–1, 50 mmol·L–1, 100 mmol·L–1, 150 mmol·L–1, 200 mmol·L–1and 250 mmol·L–1. Scanning ion-selective electrode technique (SIET) was used to determine K+, Na+and Ca2+fluxes in roots after 24 h mixed salt stress. The results showed that seed germination, germination rate and germination index decreased under salt stress and the average germination time of oil sunflower extended. Under salt-stress condition, there was an obvious K+efflux in roots. Compared with high salt-tolerant variety ‘GF01’, the roots of salt-sensitive variety ‘YK18’ and moderate salt-tolerant variety ‘YK06’ had higher K+extrude capacity. Salt stress led to a net Na+influx in the range of 0–100 mmol·L–1in mixed salt concentrations, and was highest for salt-sensitive variety ‘YK18’. The pattern of Na+flux in roots changed significantly under higher mixed salt concentrations (150–200 mmol·L–1) and there was a clear efflux of Na+in seedlings, which was highest for salt-tolerant variety ‘GF01’. After mixed salt stress, Na+content increased while K+content decreased, resulting in a decrease in K+/Na+ratio in the whole plant.Salt-tolerant variety ‘GF01’ had the lowest K+/Na+ratio, had the potential to intercept Na+in stems under low salt concentration (<150 mmol·L–1). The sunflower variety ‘GF01’ had higher capacity to extrude Na+. As a result, ‘GF01’ had the least Na+content (for the whole plant) and had higher K+/Na+ratio in leaves under high salt stress (≥150 mmol·L–1). SIET data also showed that after 24 h exposure to mixed salt stress, a clear Ca2+influx in salt stressed seedlings that was proportional to the mixed salt concentration developed. The Ca2+absorption rate of ‘GF01’ was higher than that of ‘YK18’. In conclusion, different degrees of salt tolerance in different sunflower varieties were regulated by Na+and K+absorption and efflux as a mode of adaption to the salt stress environment. Strong salt tolerant variety had stronger ability to protect K+, but K+can also be protected by regional Na+application (under low salt concentration), salt rejection mechanisms to enhance salt tolerance and then by maintaining reasonable K+/Na+ratio in leaves. In addition, accelerated absorption of Ca2+by plants alleviated salt damage in plants after salt stress. The results of the study provided theoretical basis for the selection and cultivation of salt tolerant varieties. And the established ion flux detection technique was a reliable screening method for salt tolerant varieties selection in plant breeding.
Oil sunflower; Sprouting stage; Mixed salt stress; Ion flux; Salt tolerance
S565.5
A
1671-3990(2017)05-0720-10
10.13930/j.cnki.cjea.160871
* 国家重大科学仪器设备开发专项(2011YQ080052)、北京市农林科学院数字植物科技创新团队(JNKYT201604)和国家自然科学基金项目 (61571443) 资助
**通讯作者: 王晓冬, 主要研究方向为植物生理信号检测。E-mail: wangxd@nercita.org.cn
马荣, 主要研究方向为向日葵种质资源抗逆鉴定及作物育种。E-mail: Heather1116@126.com
2016-09-29
2016-12-26
* This study was funded by the National Major Scientific Instruments and Equipment Development Project of China (2011YQ080052), the Digital Plant Science and Technology Innovation Team of Beijing Academy of Agriculture and Forestry Sciences (JNKYT201604)and the National Natural Science Foundation of China (61571443).
** Corresponding author, E-mail: wangxd@nercita.org.cn
Sep. 29, 2016; accepted Dec. 26, 2016
马荣, 王成, 马庆, 侯佩臣, 王晓冬. 向日葵芽苗期离子对复合盐胁迫的响应[J]. 中国生态农业学报, 2017, 25(5): 720-729
Ma R, Wang C, Ma Q, Hou P C, Wang X D. Ion response of sunflower at sprouting stage to mixed salt stress[J]. Chinese Journal of Eco-Agriculture, 2017, 25(5): 720-729
