2004—2014年尿标本分离粪肠球菌和屎肠球菌药物敏感性变迁
2017-05-09朱赛楠
徐 丹, 李 耘, 朱赛楠, 郑 波
(北京大学第一医院,北京 100034)
·论著·
2004—2014年尿标本分离粪肠球菌和屎肠球菌药物敏感性变迁
徐 丹, 李 耘, 朱赛楠, 郑 波
(北京大学第一医院,北京 100034)
目的 了解临床尿标本分离粪肠球菌和屎肠球菌药物敏感性状况及变迁,为临床抗感染治疗提供实验室依据。方法 分析2004—2014年全国20所三级医院患者尿标本分离的粪肠球菌和屎肠球菌的药物敏感性,采用聚合酶链反应(PCR)检测万古霉素耐药肠球菌(VRE)的耐药基因。结果 2004—2014年共分离菌株788株,其中粪肠球菌371株,屎肠球菌417株。粪肠球菌对氨苄西林、呋喃妥因、磷霉素、万古霉素和替考拉宁的敏感率均>90%,对利福平、米诺环素和红霉素的敏感率均<20%,2011年7月—2012年6月与2009年7月—2010年6月粪肠球菌对磷霉素敏感率比较,差异有统计学意义(P<0.0167)。屎肠球菌对万古霉素和替考拉宁的敏感率分别为96.9%和97.4%,对呋喃妥因、米诺环素和磷霉素的敏感率分别为41.7%、51.8%和78.2%,对氨苄西林、左氧氟沙星、利福平和红霉素的敏感率均<10%;屎肠球菌对呋喃妥因敏感率不同年份有降低趋势(任两组比较均P<0.0167),2011年7月—2012年6月、2013年7月—2014年6月磷霉素敏感率较2009年7月—2010年6月有所降低(均P<0.0167),其他药物不同年份药敏情况无显著变化。14株VRE均携带vanA耐药基因。结论 尿标本分离的粪肠球菌对氨苄西林、呋喃妥因和磷霉素均较敏感,屎肠球菌对大部分抗菌药物敏感性相对较差;粪肠球菌和屎肠球菌对万古霉素和替考拉宁相对敏感,仅少数菌株耐药。
尿标本; 粪肠球菌; 屎肠球菌; 耐药性; 抗药性,微生物; 抗菌药物; 合理用药
[Chin J Infect Control,2017,16(4):322-325]
尿路感染是临床最常见的细菌感染性疾病之一,在引起尿路感染的致病菌中,粪肠球菌和屎肠球菌仅次于大肠埃希菌[1-3]。由于肠球菌对头孢菌素类、低浓度氨基糖苷类和磺胺类抗菌药物天然耐药,临床可供选择的抗菌药物有限,给临床抗感染治疗带来较大困难。近年来,万古霉素耐药肠球菌(vancomycin-resistantEnterococcus, VRE)的增多,尤其是万古霉素耐药屎肠球菌的增多,使得肠球菌引起的尿路感染抗感染治疗面临严峻挑战。张玉等[4]研究显示,尿路感染是VRE医院感染最常见的感染。既往研究主要来自于分散的医疗机构,且缺少跨年份耐药状况变迁的分析比较。本研究分析2004—2014年来自全国20所三级医院的粪肠球菌和屎肠球菌药物敏感性变化情况,为肠球菌尿路感染临床抗感染治疗提供参考依据。
1 对象与方法
1.1 菌株来源 临床菌株和质控菌株粪肠球菌ATCC 29212均由北京大学临床药理研究所提供。临床菌株来源于2004—2014年全国20所医院患者尿标本分离的粪肠球菌(371株)和屎肠球菌(417株),排除同一患者分离的相同菌株。
1.2 药敏试验 采用标准琼脂二倍稀释法测定抗菌药物最低抑菌浓度(minimum inhibitory concentration,MIC)。肠球菌培养及药敏分析采用M-H培养基,培养条件为35 ℃孵育16~20 h(万古霉素药敏测定时间为24 h)。抗菌药物测定浓度范围0.002~256 mg/L,细菌对各种抗菌药物的敏感、中介和耐药判定均按照美国临床实验室标准化协会(CLSI)2016年标准[5]。氨苄西林、红霉素和呋喃妥因均为中国药品生物制品检定所产品,米诺环素和利福平为美国Sigma公司产品,左氧氟沙星为第一三共制药(上海)有限公司产品,万古霉素为美国礼来公司产品,替考拉宁为赛诺菲-安万特公司产品,磷霉素为山西仟源制药有限公司产品。
1.3 耐药基因检测 参照文献[6]报道的方法,采用聚合酶链反应(polymerase chain reaction, PCR)检测万古霉素或替考拉宁耐药菌株vanA、vanB、vanC1、vanC2、vanC3耐药基因。
1.4 统计分析 应用SPSS 14.0软件进行统计学分析,计数资料以百分比表示,组间差异使用卡方检验或Fisher’s精确概率法进行比较,各组间总体比较有统计学意义时再进一步做任意两组间比较。所有的检验均采用双侧检验,各组间总体比较的检验水准定为0.05,任两组进行比较时,采用Bonferroni法调整检验水准=0.05/检验次数。
2 结 果
2.1 粪肠球菌对抗菌药物敏感性 粪肠球菌对氨苄西林、呋喃妥因、磷霉素、万古霉素和替考拉宁的总体敏感率均>90.0%,对左氧氟沙星的敏感率为60.6%,对利福平、米诺环素和红霉素的敏感率均<20%。粪肠球菌对红霉素、磷霉素的敏感率总体比较,差异有统计学意义(均P<0.05),但红霉素任意两组比较差异无统计学意义(任两组比较检验水准调整为0.05/10=0.005,组间比较未达到统计学意义标准);2011年7月—2012年6月与2009年7月—2010年6月粪肠球菌对磷霉素敏感率比较,差异有统计学意义(P<0.0167,磷霉素各年度两两比较,检验水准调整为0.05/3=0.0167);其他药物不同年份敏感率比较,差异无统计学意义。见表1。

表1 2004—2014年全国20所三级医院粪肠球菌的体外药敏结果
-:未检测;a: 呋喃妥因和磷霉素检测菌株为284株;*:采用Fisher’s精确概率法进行各时间段结果的比较,其他采用卡方检验
2.2 屎肠球菌对抗菌药物敏感性 屎肠球菌对万古霉素和替考拉宁的敏感率分别为96.9%和97.4%,对呋喃妥因、米诺环素和磷霉素的敏感率分别为41.7%、51.8%和78.2%,对氨苄西林、左氧氟沙星、利福平和红霉素的敏感率均<10%。呋喃妥因敏感率不同年份有降低趋势(任两组比较均P<0.0167,检验水准调整为0.05/3=0.0167),2011年7月—2012年6月、2013年7月—2014年6月磷霉素敏感率较2009年7月—2010年6月有所降低(均P<0.0167),其他药物不同年份的敏感率比较,差异无统计学意义。见表2。
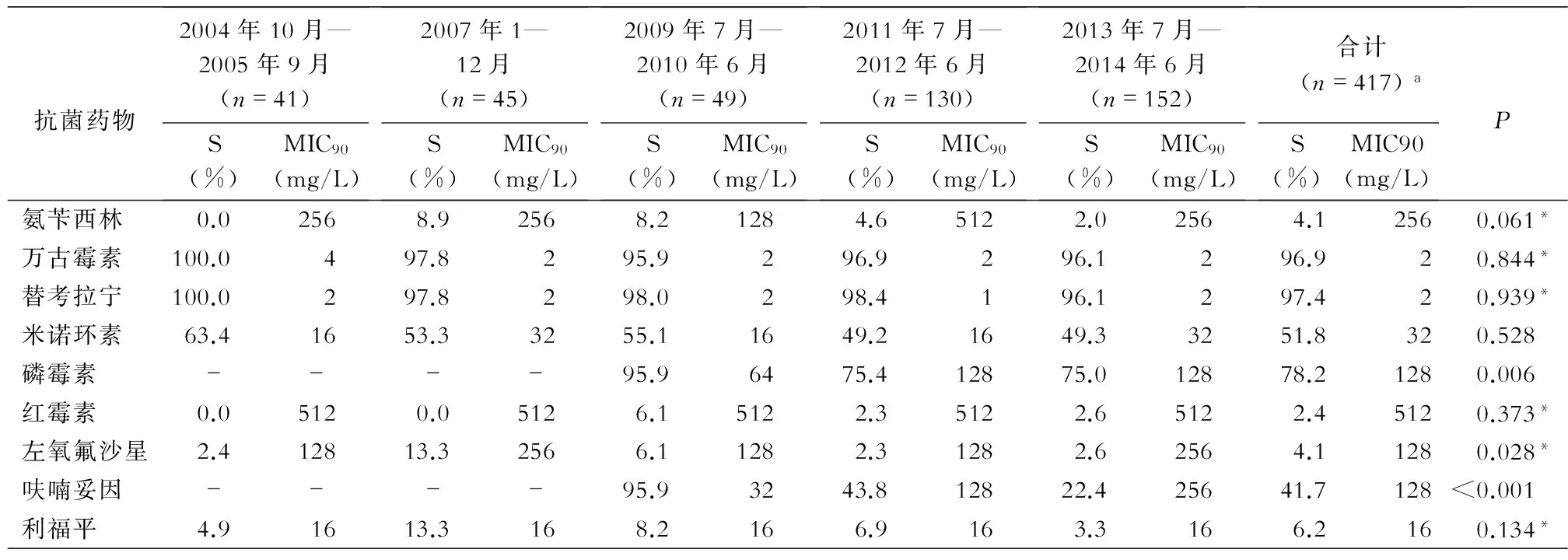
表2 2004—2014年全国20所三级医院屎肠球菌的体外药敏结果
-:未检测;a:呋喃妥因和磷霉素检测菌株为331株;*:采用Fisher’s精确概率法进行各时间段结果的比较,其他采用卡方检验;左氧氟沙星敏感率总体比较差异有统计学意义,但任两组比较检验水准调整为0.05/10=0.005,组间比较未达到统计学意义标准
2.3 肠球菌万古霉素耐药基因型结果 药敏结果显示,共有14株VRE,其中包括1株万古霉素耐药粪肠球菌和13株万古霉素耐药屎肠球菌。PCR耐药基因检测结果显示,14株VRE均携带vanA耐药基因。
3 讨 论
粪肠球菌和屎肠球菌是引起尿路感染的重要病原菌。耐药监测[1-3]结果显示,粪肠球菌和屎肠球菌在男性和女性引起尿路感染的病原菌中分别占第2和第3位。李湘燕等[7]研究显示,留置导尿管患者更容易出现肠球菌尿路感染,留置导尿管尿路感染患者尿标本中肠球菌的分离率为34.9%,远高于无留置导尿管尿路感染患者的分离率(17.3%) 。由于肠球菌对头孢菌素、磺胺类、低浓度氨基糖苷类和克林霉素等抗菌药物天然耐药,可供临床选择的抗菌药物有限,为临床抗感染治疗带来了很大困难。
粪肠球菌对氨苄西林、呋喃妥因、磷霉素和万古霉素的敏感率均>90%,但是口服呋喃妥因和磷霉素氨丁三醇时血药浓度低,因此这两种口服药物仅适用于粪肠球菌所致的下尿路感染[8-10]。此外,由于磷霉素氨丁三醇和呋喃妥因对引起尿路感染最常见的大肠埃希菌具有很好的抗菌活性,且为妊娠B类药物,是孕妇下尿路感染时经验性治疗的首选药物[11-13]。氨苄西林和万古霉素静脉用药能保证足够的血药浓度和尿药浓度,因此,可以用于治疗粪肠球菌感染引起的肾盂肾炎。粪肠球菌对左氧氟沙星的敏感率>60%,且左氧氟沙星在尿液中具有很高的药物浓度[14-15],可以根据药敏结果选择此类药物治疗粪肠球菌引起的尿路感染。
屎肠球菌对氨苄西林、左氧氟沙星、利福平和红霉素的敏感率<10%,不适合用于经验性治疗屎肠球菌尿路感染。屎肠球菌对呋喃妥因、米诺环素和磷霉素的敏感率<80%,可以根据药敏结果的指导选择以上抗菌药物;由于上述三种药物的血药浓度低,不适合用于治疗屎肠球菌感染所致的肾盂肾炎。
万古霉素和替考拉宁是粪肠球菌和屎肠球菌最敏感的抗菌药物,但近年来我国VRE也在逐渐增多,主要由vanA耐药基因介导[16],临床上应加强尿标本分离肠球菌对糖肽类药物的耐药性分析及耐药基因检测。
本组结果显示, 不同年份粪肠球菌和屎肠球菌对大部分抗菌药物的敏感性比较,差异无统计学意义,可能与样本量不足有一定关系,可以扩大样本量进一步研究。
[1] 郑波,吕媛.卫生部全国细菌耐药监测网2011年男性尿标本来源细菌耐药监测[J].中国临床药理学杂志,2012,28(12):893-898.
[2] 齐慧敏,吕媛.卫生部全国细菌耐药监测网2011年女性尿标本来源细菌耐药监测[J].中国临床药理学杂志,2012,28(12):899-904.
[3] 孙淑红,胡晓峰,冯尚彩,等.尿路感染患者肠球菌的分布特征及耐药性分析[J].中华泌尿外科杂志, 2014,35(3):216-221.
[4] 张玉,侯铁英,刘伟江,等.耐万古霉素肠球菌医院感染流行特征与危险因素分析[J].中华医院感染学杂志, 2016,26(3):530-532.
[5] Clinical and Laboratory Standards Institute: Performance standards for antimicrobial susceptibility testing[S]. M100-S26, Wayne, CLSI.
[6] 郑波,王珊,李耘,等.万古霉素耐药肠球菌基因及水平转移研究[J].中国临床药理学杂志,2007,23(2):133-136.
[7] 李湘燕,杨阳,王玉芳.导尿管相关菌尿的病例特点及病原学耐药分析[J].中国临床药理学杂志,2016,32(14):1299-1303.
[8] European Association of Urology, Guidelines on Urological Infections.https://uroweb.org/wp-content/uploads/19-Urological-infections_LR2.pdf[EB/OL].(2015-03)[2016-10].https://uroweb.org/wp-content/uploads/19-Urological-infections_LR2.pdf.
[9] 尿路感染诊断与治疗中国专家共识编写组.尿路感染诊断与治疗中国专家共识(2015版)—复杂性尿路感染[J].中华泌尿外科杂志,2015,36(4):241-244.
[10] 尿路感染诊断与治疗中国专家共识编写组. 尿路感染诊断与治疗中国专家共识(2015版)—尿路感染抗菌药物选择策略及特殊类型尿路感染的治疗建议[J].中华泌尿外科杂志,2015,36(4):245-248.
[11] Keating GM. Fosfomycin trometamol: a review of its use as a single-dose oral treatment for patients with acute lower urinary tract infections and pregnant women with asymptomatic bacteriuria[J]. Drugs, 2013, 73(17): 1951-1966.
[12] Schito GC. Why fosfomycin trometamol as first line therapy for uncomplicated UTI?[J]. Int J Antimicrob Agent, 2003, 22(Suppl 2): 79-83.
[13] Lai B, Zheng B, Li Y, et al. In vitro susceptibility ofEscherichiacolistrains isolated from urine samples obtained in mainland China to fosfomycin trometamol and other antibiotics: a 9-year surveillance study (2004-2012)[J]. BMC Infect Dis, 2014, 14(1): 66-69.
[14] Chen YH, Ko WC, Hsueh PR. The role of fluoroquinolones in the management of urinary tract infections in areas with high rates of fluoroquinolone-resistant uropathogens[J]. Eur J Clin Microbiol Infect Dis, 2012, 31(8): 1699-1704.
[15] Wagenlehner FM, Kinzig-Schippers M, Sörgel F, et al. Concentrations in plasma, urinary excretion and bactericidal activity of levofloxacin (500 mg) versus ciprofloxacin (500 mg) in healthy volunteers receiving a single oral dose[J]. Int J Antimicrob Agents, 2006, 28(6): 551-559.
[16] Zheng B, Tomita H, Xiao YH, et al. Molecular characterization of vancomycin-resistantEnterococcusfaeciumisolates from Mainland-China[J]. J Clin Microbiol, 2007, 45(9): 2813-2818.
(本文编辑:孟秀娟)
Change in antimicrobial susceptibility ofEnterococcusfaecalisandEnterococcusfaeciumisolated from urine in 2004-2014
XUDan,LIYun,ZHUSai-nan,ZHENGBo
(PekingUniversityFirstHospital,Beijing100034,China)
Objective To investigate the change in antimicrobial susceptibility ofEnterococcusfaecalis(E.faecalis) andEnterococcusfaecium(E.faecium) isolated from clinical urine specimens, so as to provide laboratory evidence for clinical anti-infective treatment.Methods Antimicrobial susceptibility ofE.faecalisandE.faeciumisolated from urine specimens from 20 tertiary hosptials in China between 2004 and 2014 were analyzed, drug-resistant genes of vancomycin-resistantEnterococcus(VRE)were detected with polymerase chain reaction (PCR).Results A total of 788Enterococcusstrains were isolated in 2004-2014, 371 strains wereE.faecalisstrains, 417 wereE.faeciumstrains. Susceptibility rates ofE.faecalisto ampicillin, nitrofurantoin, fosfomycin, vancomycin, and teicoplanin were all>90%, susceptibility rates to rifampin, minocycline, and erythromycin were all<20%, there was significant difference in the susceptibility rate ofE.faecalisto fosfomycin betwen July 2011-June 2012 and July 2009-June 2010(P<0.0167). Susceptibility rates ofE.faeciumto vancomycin and teicoplanin were 96.9% and 97.4% respectively, susceptibility rates to nitrofurantoin, minocycline, and fosfomycin were 41.7%, 51.8%, and 78.2% respectively, susceptibility rates to ampicillin, levofloxacin, rifampicin, and erythromycin were all<10%; susceptibility rates ofE.faeciumto nitrofurantoin had decreased tendency in different years (any two group comparison, allP<0.0167), susceptibility rates to fosfomycin in July 2011-June 2012 and July 2013-June 2014 both decreased compared with July 2009-June 2010(bothP<0.0167),there were no significant changes in antimicrobial usceptibility rates in different years. 14 strains of VRE all carriedvanA resistance gene.ConclusionE.faecalisstrains isolated from urine are susceptible to ampicillin, nitrofurantoin, and fosfomycin,E.faeciumare not susceptible to most antimicrobial agents;E.faecalisandE.faeciumare both susceptible to vancomycin and teicoplanin, only a few strains are resistant to antimicrobial agents.
urine specimen;Enterococcusfaecalis;Enterococcusfaecium; drug resistance, microbial; antimicrobial agent; rational antimicrobial use
2017-01-09
国家自然科学基金(81171612);首都临床特色应用研究与推广项目 (Z161100000516040)
徐丹(1988-),女(汉族),湖北省荆门市人,硕士研究生,主要从事细菌耐药机制研究。
郑波 E-mail:doctorzhengbo@163.com
10.3969/j.issn.1671-9638.2017.04.008
R969.3
A
1671-9638(2017)04-0322-04
