三甲基硅基肼的合成
2017-05-07丁可伟李陶琦葛忠学
丁可伟, 李陶琦, 肖 啸, 刘 庆, 朱 勇, 葛忠学
(1. 西安近代化学研究所, 陕西 西安 710065; 2. 氟氮化工资源高效开发与利用国家重点实验室, 陕西 西安 710065)
1 引 言
肼及其衍生物既能直接应用于含能材料领域,也可以作为结构单元进一步构建多氮高能材料[1-6],在有机合成中也有广泛应用[7-9]。肼在较高的温度下极易爆炸生成氨和氮气,给其反应研究带来诸多不便[10]。有机硅基是肼的重要保护基[11],既能在一些反应中保护活泼氢,又能对肼起到稳定作用,在适当的时候又可通过酸解快速脱去[12]。因此,硅基肼既是合成富氮材料的中间体,又是肼的重要的模型化合物[13-14],在多氮高能材料的研究中有重要意义。
硅基肼的合成中常用到易燃易爆的无水肼[15-16],而且产物易氧化、易潮解,分离提纯比较困难。国外对硅基肼类化合物的合成研究较多[17-23], Wannagat等[17]通过三苯基氯硅烷和无水肼反应,合成了单(三苯基硅基)肼; Wannagat和West[17-18]通过三烷基(三甲基、二甲基乙基、二甲基丁基、三乙基、三丙基)卤硅烷和无水肼反应,分别合成了对应的双硅基肼,并通过不同三烷基卤硅烷的混合物和肼反应,合成了不对称的双硅基肼[18-19]; Mitzel等[20]通过二甲基氯硅烷、三乙胺和无水肼反应,合成了三(二甲基硅基)肼; Aylett等[21]通过过量碘硅烷和肼的气相反应,合成了四硅烷基肼。另外,由于肼锂具有较高的反应活性,以其为中间体,可以合成取代基数量更多、位阻更大的硅基肼类化合物[19]。
三甲基硅基在有机硅基中位阻相对较小,是最常用的保护基,但在三甲基硅基肼的合成中易发生副反应,给纯化带来不便,目前对这方面的系统研究很少,国内在这方面的研究报道更少。基于此,本研究以无水肼为起始原料,逐步引入三甲基硅基,并通过高反应活性的肼锂克服位阻效应,合成了二(三甲基硅基)肼、三(三甲基硅基)肼和四(三甲基硅基)肼,对合成实验过程中发现的单(三甲基硅基)肼的自缩合反应、双(三甲基硅基)肼的异构化反应及机理进行了分析,以期为三甲基硅基肼类化合物的合成提供参考。
2 实验部分
2.1 试剂与仪器
原料和试剂: 氢氧化钾、氢氧化钠、无水氯化钙、金属钠,分析纯,成都市科龙化工试剂厂; 水合肼(80%)、无水乙醚,分析纯,天津化学试剂三厂; 三甲基氯硅烷、正丁基锂,分析纯,美国百灵威科技科技有限公司; 无水乙醚经无水氯化钙干燥过夜,加钠丝回流,惰性气体保护下蒸出待用; 三甲基氯硅烷重蒸后使用。
主要仪器: JA 5003B型分析天平,上海精密科学仪器有限公司; AV500型(500MHz)超导核磁共振仪,瑞士Bruker公司; QP-2010 Plus型气质联用仪,日本岛津公司; 5700 FT-IR型傅里叶变换红外光谱仪,美国热电尼高力公司; Vario EL-Ⅲ型元素分析仪,德国EXEMENTAR公司。
2.2 合成路线
以无水肼为起始原料,和三甲基氯硅烷反应,合成出1,2-二(三甲基硅基)肼,再经丁基锂活化,合成了三(三甲基硅基)肼,最后通过三(三甲基硅基)肼锂的溶剂热反应得到四(三甲基硅基)肼。合成路线如Scheme 1所示。
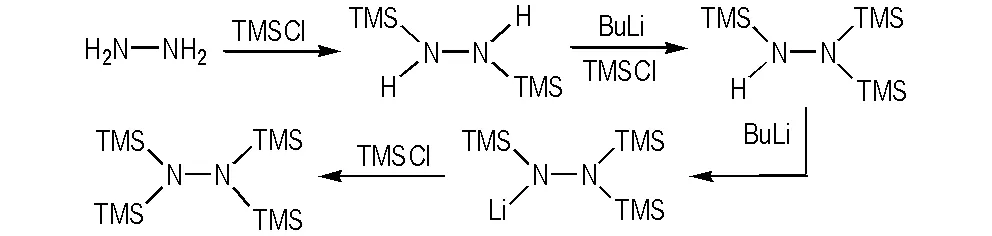
Scheme 1 Synthetic routes of bis, tris and tetra-(trimethylsilyl)hydrazine
2.3 实验过程
2.3.1 无水肼的合成
将80%的水合肼(25 g,0.40 mol)加入到250 mL圆底烧瓶中,然后加入氢氧化钾(10 g,0.17 mol),在0 ℃下放置过夜,将上层清液转入另一个圆底烧瓶中,并加入氢氧化钠(21 g,0.53 mol),用氩气吹扫,在隔绝空气的条件下回流2 h,降温,常压蒸馏,收集114~116 ℃的馏分,得有胺臭味的无色发烟液体9.6 g,收率75 %。
2.3.2 1,2-二(三甲基硅基)肼的合成
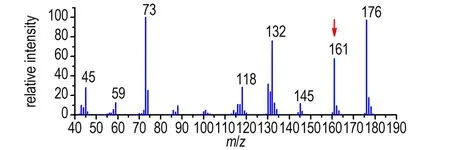
氩气保护下,将无水肼(9.6 g, 300 mmol)加入250 mL三口烧瓶中,冰浴冷却,加入新蒸的三甲基氯硅烷(21.6 g, 200 mmol),搅拌1 h后室温搅拌过夜,静置,在氩气氛中快速过滤,将滤液在无氧条件下减压精馏,收集55~57 ℃的馏分(250 Pa),得无色透明液体14.6 g,收率83%,于无水无氧条件下保存。FT-IR(KBr,ν/cm-1): 2953(C—H), 1245(C—H), 1058(N—N), 871(Si—N), 831, 740(C—H), 684, 609(Si—C);1H NMR (500 MHz, CDCl3)δ: 2.43 (s, 2H, NH),0.17 (s, 18H, CH3); MS(m/z): 176(M+, 76), 161(21), 145(24), 132(100), 118(67), 88(19), 73(82), 59(35), 45(39)。
2.3.3 1,1,2-三(三甲基硅基)肼的合成
氩气保护下,将1,2-二(三甲基硅基)肼(12.3 g, 140 mmol)和25 mL无水乙醚加入250 mL三口烧瓶中,搅拌,用冰水浴冷却,缓慢滴入0.65 mol·L-1的正丁基锂戊烷溶液(60 mL,78 mmol),反应0.5 h,然后冷却至-78 ℃,逐滴加入新蒸三甲基氯硅烷(8.1 g,75 mmol),加毕,自由升至室温并继续反应2 h。静置,在氩气氛中过滤,将滤液在无氧条件下先常压蒸馏,除去低沸点溶剂,然后再减压精馏,收集100~102 ℃的馏分(350 Pa),得无色透明液体15.1 g,收率90%,于无水无氧条件下保存。FT-IR(KBr,ν/cm-1): 2955(C—H), 1246(C—H), 962(N—N), 833, 815(Si—N), 764, 750(C—H), 676, 617(Si—C);1H NMR (500 MHz, CDCl3)δ: 2.03 (s, 1H, NH),0.08 (s, 27H, CH3); 元素分析C9H28N2Si3(%): 计算值 C 43.55, H 11.30, N 11.30; 实测值 C 43.51, H 11.33, N 11.32。
2.3.4 1,1,2-三(三甲基硅基)肼锂的合成
氩气保护下,将1,1,2-三(三甲基硅基)肼(12.4 g,50 mmol)加入250 mL圆底烧瓶中,冰浴冷却,搅拌下滴加0.65 mol·L-1的正丁基锂戊烷溶液(42.5 mL,55 mmol),反应1 h,然后冷却至-40 ℃,在氩气手套箱中快速趁冷过滤,得白色固体11.7 g,收率92%,于无水无氧条件下保存。1H NMR (500 MHz, C2D5OC2D5)δ: 0.07 (s, 27H, CH3)。
2.3.5 四(三甲基硅基)肼的合成
氩气保护下,将1,1,2-三(三甲基硅基)肼锂(10.1 g,40 mmol)和100 mL无水苯加入150 mL Pyrex管中,加入新蒸三甲基氯硅烷(4.3 g,40 mmol),密封,振荡,加热至120 ℃,反应48 h。然后降至室温,过滤,常压蒸馏除去溶剂,将所得固体用油泵减压升华,得固体6.4 g,收率50%。FT-IR(KBr,ν/cm-1): 2953(C—H), 1243(C—H), 833(N—N), 815, 764(C—H), 617(Si—C);1H NMR (500 MHz, CDCl3)δ:0.06 (s, 36H, CH3); 元素分析C12H36N2Si4(%): 计算值 C 44.93, H 11.31, N 8.73; 实测值 C 45.01, H 11.39, N 8.68。
3 结果与讨论
通过三甲基氯硅烷和肼上的活泼氢反应来制备多硅基肼,反应中伴生的酸被过量的肼吸收生成盐酸肼。三甲基氯硅烷的使用决定了该反应不能用水合肼替代无水肼,而且还需要防止吸潮,否则三甲基氯硅烷水解生成大量酸,反过来影响生成的多硅基肼。无水肼的制备按照经典的加强碱回流的方法,整个过程都要隔绝空气,并在严格防护下进行。
3.1 单(三甲基硅基)肼的自缩合反应
首先通过投料比的变化探索了单(三甲基硅基)肼的合成,发现三甲基氯硅烷即使与大过量的肼反应,最后也很难得到单(三甲基硅基)肼,获得的都是二(三甲基硅基)肼。这和文献报道一致[22-23],可能是由于其极易发生自缩合反应,两分子单(三甲基硅基)肼转化为一分子1,2-二(三甲基硅基)肼,并释放出一分子肼。这种缩合反应的机理是三甲基硅基在肼上的分子间迁移,如Scheme 2所示。
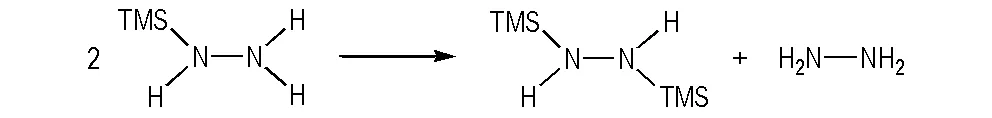
Scheme 2 Self-condensation reaction of mono(trimethylsilyl)hydrazine
3.2 二(三甲基硅基)肼的合成及异构化反应
三甲基氯硅烷与无水肼在室温下反应得到1,2-二(三甲基硅基)肼。精馏是比较合适的分离方法,但要保持在较低的温度下进行。1,2-二(三甲基硅基)肼上的两个活泼氢极易被空气氧化,使硅基肼变为粉色,因此整个制备过程都需要在惰性气氛中进行。
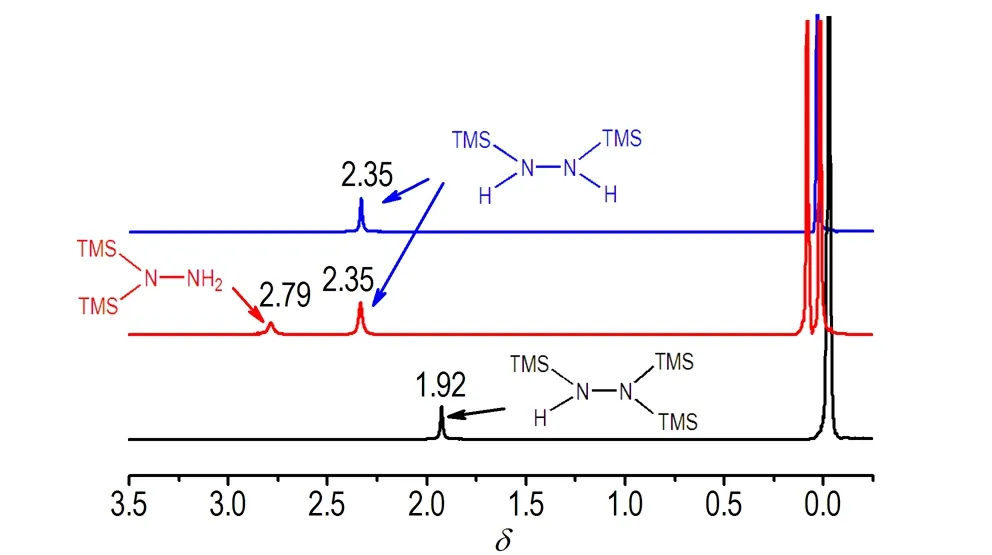
图1 二(三甲基硅基)肼和三(三甲基硅基)肼的1H NMR谱
Fig.11H NMR spectra of bis- and tris-(trimethylsilyl)hydrazines
1,2-二(三甲基硅基)肼的核磁共振谱如图1(蓝线)所示,有两组氢信号,积分面积1∶9,肼基上活泼H的化学位移为2.35。1,2-二(三甲基硅基)肼的质谱如图2a所示,其分子离子峰为m/z176,同位素峰比例为[M]∶[M+1]∶[M+2]=100∶18∶8,这和硅的同位素丰度[M]∶[M+1]∶[M+2]=100∶5.1∶3.4是一致的。主要碎片峰m/z161,m/z132,m/z118和m/z73分别为双(三甲基)硅胺基、三甲基硅基-二甲基硅烷基、三甲基氮烯基和三甲基硅基碎片。

a. 1,2-bis(trimethylsilyl)hydrazine
b. 1,1-bis(trimethylsilyl)hydrazine
图2 双(三甲基硅基)肼的质谱
Fig.2 Mass spectra of bis(trimethylsilyl)hydrazine
直接加热1,2-二(三甲基硅基)肼到75 ℃以上或者在其精馏纯化过程中温度过高,得到的都是一组结构类似的混合物,相对含量基本保持恒定,通过精馏难以将二者分离。混合物的核磁共振谱如图1(红线)所示,在1,2-二硅基肼谱图的基础上,新出现一组类似的信号峰,化学位移左移,积分面积仍为1∶9。GC-MS也显示该混合物含两个组分,其一为1,2-二(三甲基硅基)肼,另一化合物质谱如图2b所示,和1,2-二(三甲基硅基)肼的质谱极其相似,由分子离子峰m/z=176和同位素峰确定其也为二(三甲基硅基)肼的异构体。与1,2-二(三甲基硅基)肼相比,该异构体的碎片峰m/z=161的信号强度明显提高,说明该异构体更容易形成双(三甲基)硅胺基碎片,确定该异构体为1,1-二(三甲基硅基)肼。该异构体中,1位N上的硅基对2位N上氢的屏蔽作用减弱,因此活泼氢的化学位移向低场方向移动至2.79。碎片峰m/z161的相对强度和活泼氢的化学位移可为二(三甲基硅基)肼异构体的鉴别提供重要依据。
Robert West 等[24]曾报道1-甲基-1,2-二(三烷基)硅基-肼在丁基锂的催化下能快速转化为1-甲基-2,2-二(三烷基)硅基-肼,并建立平衡,该反应被认为经历了阴离子重排,而且硅基从N→N迁移比其它取代基从N→C、O→C和C→C迁移更快。本研究发现在热作用下,1,2-二(三甲基硅基)肼也可以发生异构化反应,生成1,1-二(三甲基硅基)肼,二者之间存在一定的平衡,使相对含量基本恒定。这一重排反应可能同样经历了文献报道[24]的N—Si—N三元环过渡态,如Scheme 3所示,该过渡态之所以容易形成,是由于Si原子具有3d轨道,能比较容易的从四配位扩展为五配位状态。这也决定了硅基在氮原子上易发生分子内或分子间迁移反应。
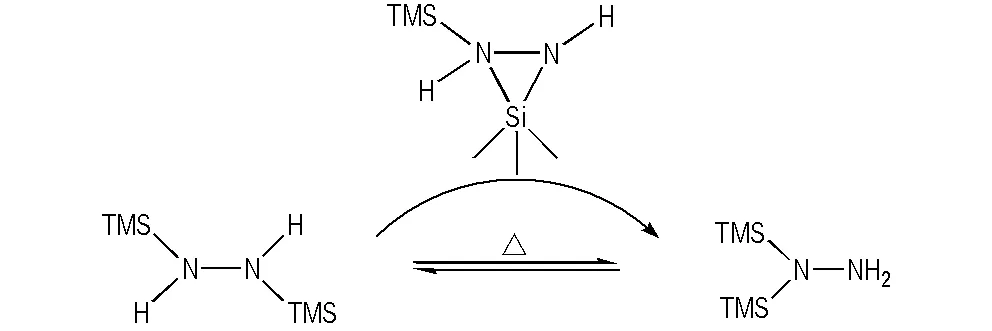
Scheme 3 Rearrangement reaction between 1,2- and 1,1- bis(trimethylsilyl)hydrazine
3.3 三(三甲基硅基)肼和四(三甲基硅基)肼
三硅基肼以三个硅基作为保护基,留出一个活泼氢作为定向反应位点,是多氮材料构建中常用的中间体。即使选用有机硅基中体积最小的三甲基硅基,由于位阻效应,三(三甲基硅基)肼还是难以通过肼和氯硅烷直接反应获得,需要以具有更高活性的二(三甲基硅基)肼锂为前体,通过分步反应来制备。
三(三甲基硅基)肼的核磁共振谱如图1所示,有两组氢信号,积分面积1∶27,由于三个硅基对活泼氢的屏蔽作用更强,相较于二(三甲基硅基)肼,活泼氢的化学位移向高场方向移动至1.92。三(三甲基硅基)肼的质谱如图3所示,其分子离子峰为m/z248,同位素峰比例为[M]∶[M+1]∶[M+2]∶[M+3]=100∶26∶13.5∶2.5,和硅的同位素丰度一致。
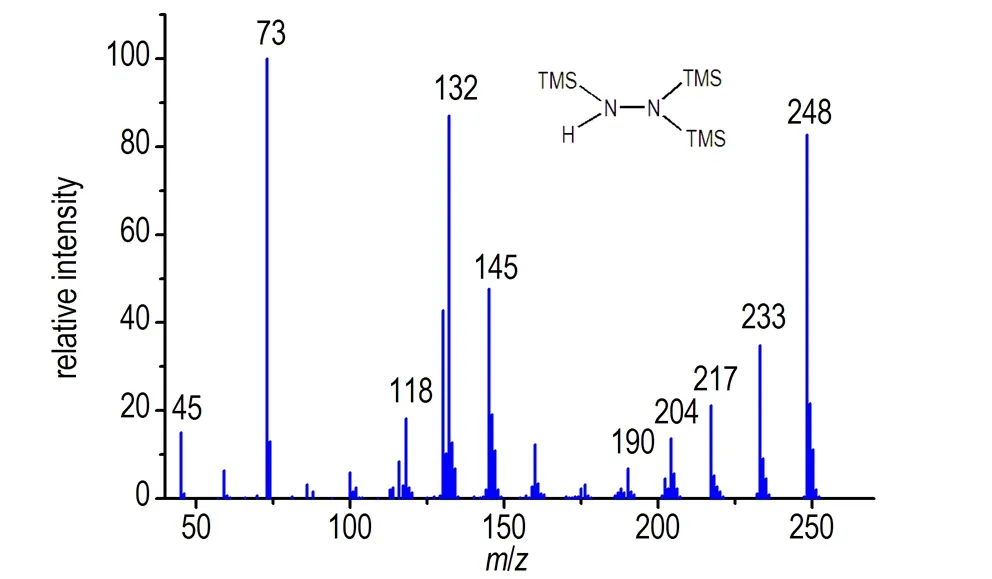
图3 三(三甲基硅基)肼的质谱
Fig.3 Mass spectrum of tris(trimethylsilyl)hydrazine
四(三甲基硅基)肼由于取代基的位阻更大,即便以较高反应活性的肼锂为底物,也需要在溶剂热反应的高温高压条件下才能生成。四(三甲基硅基)肼由于肼上活泼氢都被取代,缺少反应位点,在多氮材料研究中一般不常用。
4 结 论
(1) 以无水肼为起始原料,与三甲基氯硅烷反应,合成了1,2-二(三甲基硅基)肼,进一步以高反应活性的肼锂为前体,合成了具有较高位阻的三(三甲基硅基)肼和四(三甲基硅基)肼,总收率依次为83%、75%、34%。
(2) 探讨了单(三甲基硅基)肼的自缩合反应、双(三甲基硅基)肼的重排反应,表明这些反应的机理都是三甲基硅基在肼基上的分子间或分子内迁移,并发现75 ℃以上双(三甲基硅基)肼就能发生异构体间的转化与平衡。
参考文献:
[1] 汪惠英, 文亮, 杨红伟, 等. 硝仿肼的合成工艺与晶体结构[J]. 火炸药学报, 2013, 36(6): 43-59.
WANG Hui-ying, WEN Liang, YANG Hong-wei, et al. Synthesis technique and crystal structure of HNF[J].ChineseJournalofExplosivesandPropellants, 2013, 36(6): 43-59.
[2] ZHOU Cheng, WANG Bo-zhou, HUO Huan, et al. A novel energetic material hydrazinium 3,5-dinitroamino-1,2,4-triazole: synthesis and properties[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2014, 22(4): 576-578.
[3] 许诚, 毕福强, 张敏, 等. 3,3′-二硝胺基-4,4′-偶氮呋咱二肼盐的合成、表征及性能研究[J]. 固体火箭技术, 2015, 38(1):98-101.
XU Cheng, BI Fu-qiang, ZHANG Min, et al. Synthesis, characterization and properties of dihydrazinun salt of 3,3′-bis(nitramino)-4,4′-azofurazan[J].JournalofSolidRocketTechnology, 2015, 38(1): 98-101.
[4] Hammerl A, Klapötke T M, Nöth H. [N2H5]+2[N4C—NN—CN4]2-: A new high-nitrogen high-energetic material[J].InorganicChemistry, 2001, 40(14): 3570-3575.
[5] 乔小晶, 郝志坚, 樊帆, 等. 高氯酸碳酰肼类配合物的比热容研究[J]. 含能材料, 2009, 17(1): 103-106.
QIAO Xiao-jin, HAO Zhi-jian, FAN Fan, et al. Specific heat capacities of carbohydrazide perchloric acid coordination compounds[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2009, 17(1): 103-106.
[6] 王为强, 薛云娜, 梅苏宁, 等. 双肼基均四嗪十氢十硼酸盐的合成[J]. 含能材料, 2014, 22(3): 428-429.
WANG Wei-qiang, XUE Yun-na, MEl Su-ning, et al. Synthesis of dihydrazine-1,2,4,5-tetrazine decahydrodecaborate[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2014, 22(3): 428-429.
[7] Furst A, Berlo R C, Hooton S, et al. Hydrazine as a reducing agent for organic compounds (catalytic hydrazine reductions)[J].ChemicalReviews, 1965, 65(1): 51-68.
[8] Tian M, He Y, Zhang X, et al. Synthesis of pyrazolo[5,1-a]isoindoles and pyrazolo[5,1-a]isoindole-3-carboxamides through one-pot cascade reactions of 1-(2-bromophenyl)buta-2,3-dien-1-ones with isocyanide and hydrazine or acetohydrazide[J].TheJournalofOrganicChemistry, 2015, 80(15): 7447-7455.
[9] Buscemi S, Pace A, Piccionello A P, et al. Fluorinated heterocyclic compounds. An effective strategy for the synthesis of fluorinatedZ-oximes of 3-perfluoroalkyl-6-phenyl-2H-1,2,4-triazin-5-ones via a ring-enlargement reaction of 3-benzoyl-5-perfluoroalkyl-1,2,4-oxadiazoles and hydrazine[J].TheJournalofOrganicChemistry, 2005, 70(8): 3288-3291.
[10] 禹天福, 吴志坚. 空间环境下无水肼和甲基肼的爆炸危险性[J]. 火箭推进, 2001(6): 1-5.
YU Tian-fu, WU Zhi-jian. Explosive potential of hydrazine and MMH in the space environment[J].JournalofRocketPropulsion, 2001(6): 1-5.
[11] Eaborn, C. Organosilicon compounds[M]. London: Butterworths, 1960.
[12] Ebsworth, E A V. Volatile silicon compounds[M]. New York: Pergamon, 1963.
[13] Kataria J, Vasisht S K, Sharma A,et al. Silyl stabilized azanes: reactions of lithiumbis (trimethylsilyl)hydrazine with trialkyltin halides[J].JournalofOrganometallicChemistry, 2005, 690: 1507-1510.
[14] Zdilla M J, Verma A K, Lee S C. Iron-mediated hydrazine reduction and the formation of iron-arylimide heterocubanes[J].InorganicChemistry, 2011, 50(4): 1551-1562.
[15] 胡长诚. 国外水合肼无水肼制备及提纯方法研发进展[J]. 化学推进剂与高分子材料,2005, 3(4): 1-5.
HU Chang-cheng. Foreign research and development progress of preparation and purification methods for hydrazine hydrate and anhydrous hydrazine[J].ChemicalPropellants&PolymericMaterials,2005, 3(4): 1-5.
[16] Welsh T W B, Broderson H J. Anhydrous hydrazine. Ⅳ. Chemical reactions in anhydrous hydrazine[J].JournaloftheAmericanChemicalSociety, 1915, 37(4): 825-832.
[17] Wannagat U, Liehr W. Hydrazin-silicium-verbindungen[J].AngewandteChemie, 1957, 69(24): 783-783.
[18] West R. 1, 2-Anionic rearrangements of organosilicon and germanium compounds[J].AdvancesinOrganometallicChemistry, 1977, 16: 1-31.
[19] Wannagat U, Niederprum H. Darstellung mehrfach silyl-substituierter stickstoff-verbindungen mit hilfe von lithiumphenyl[J].AngewandteChemie. 1959, 71(18): 574-574.
[20] Mitzel N W, Bissinger P, Schrnidbaur H. Synthesis and structure of (hydridosilyl)hydrazines[J].ChemischeBerichte, 1993, 126(2): 345-350.
[21] Aylett B J. The silyl group as an electron acceptor[J].JournalofInorganicandNuclearChemistry, 1956, 2(5-6): 325-329.
[22] Wannagat U. The chemistry of silicon-nitrogen compounds[J].AdvancesinInorganicChemistryandRadiochemistry, 1964, 6: 225-278.
[23] Wannagat U, Liehr W. Hydrazin-silicium-verbindungen. Ⅰ. Mono- und bis-(triorganosilyl)-hydrazine[J].ZeitschriftfürAnorganischeundAllgemeineChemie, 1958, 297: 129-136.
[24] West R, Ishikawa M, Bailey R E. New anionic rearrangements. Ⅳ. Kinetics of catalyzed anionic rearrangement of bis(organosilyl)methylhydrazines[J].JournaloftheAmericanChemicalSociety, 1967, 89(16): 4072-4076.
