形稳阳极Ti/IrO2-Ta2O5电Fenton法催化降解含酚废水
2017-05-07闫俊娟刘有智郭志远管张斌
高 璟, 闫俊娟, 刘有智, 郭志远, 管张斌
(1. 中北大学超重力化工过程山西省重点实验室,山西 太原 030051; 2. 中北大学化工与环境学院, 山西 太原 030051)
1 引 言
苯酚等酚类物质作为制备火炸药的原料,在生成过程中所形成的含酚废水,若不经处理直接排放会对环境产生严重污染[1]。目前处理含酚废水的方法很多[2-6]。其中,电芬顿(Fenton)法利用电解产生Fe2+、H2O2或者同时电解生成这两种物质,使之构成Fenton试剂,进而生成强氧化性的·OH以氧化降解有机物,处理废水效果较好。目前,电Fenton法多采用可溶性材料如铁Fe作阳极为Fenton反应过程提供Fe2+。该过程需经常更换电极,从而造成电Fenton反应过程不稳定,废水处理效率受到影响[7-8]。Ti/IrO2-Ta2O5电极属于具有良好电催化活性和稳定性的形稳阳极(Dimensionally Stable Anodes,DSA),将其作为电催化反应所用阳极时,可利用催化电极反应产生·OH等氧化物以降解废水中的污染物[9-10],并且本身不会溶解和造成二次污染,属于“绿色阳极材料”,近年来得到研究者的关注[11-13],但相关研究主要集中在电极的制备方面,在废水处理方面的应用研究较少。
因此,本研究使用不溶性的Ti/IrO2-Ta2O5电极代替可溶性Fe电极,作为电Fenton反应体系所用阳极以降解含酚废水,可实现一个反应体系内同时进行电催化反应和电Fenton反应,利用二者形成的协同效应产生更多的·OH等氧化物,进而提高废水中污染物的降解效率,以解决由于可溶性阳极Fe的溶解而影响废水降解效率的问题。目前在此方面的研究鲜见报道,本研究以期为电Fenton降解废水过程阳极材料的选取和废水处理提供新的方法。
2 实验部分
2.1 实验材料
苯酚,分析纯,天津市永大化学试剂有限公司; 七水硫酸亚铁,分析纯,天津市福晨化学试剂厂; 浓硫酸,分析纯,西陇化工股份有限公司; 氢氧化钠,分析纯,天津市大茂化学试剂厂; 30%过氧化氢,分析纯,天津市富宇精细化工有限公司; 甲醇,色谱纯,天津市科密欧化学试剂有限公司。
2.2 实验仪器
Ultimate3000高效液相色谱仪,美国戴安公司; 多光谱化学需氧量分析仪,河北上清科技有限公司; PHS-3C型精密酸度计,上海垒固仪器有限公司; 直流稳压电源,绍兴市承天电器有限公司。
2.3 实验方法
选取苯酚作为含酚废水中的典型污染物进行实验,配制苯酚溶液模拟含酚废水,用10%(mass/volume,m/v)硫酸和10%(m/v)氢氧化钠溶液调节废水pH值。水样在取样后立即加入0.1 mol·L-1叔丁醇终止电Fenton反应,进而进行检测。苯酚浓度采用Ultimate3000高效液相色谱仪测定,检测波长270 nm,C-18色谱柱(250 mm×4.6 mm×5 μm),流动相: 甲醇/水(60/40),流速: 1 mL/min,柱温25 ℃,进样量20 μL[14]。采用重铬酸钾法(GB11914-89)测实验水样的化学需氧量(chemical oxygen demand,COD)[15]。废水的处理效果以苯酚去除率和COD去除率来衡量。苯酚和COD去除率的计算公式为:
(1)
式中,C0和Ct分别为废水降解前后的苯酚或COD浓度,mg·L-1。
2.4 实验装置及流程
电Fenton法降解废水的实验装置图如图1所示,由电Fenton反应器、电极板、直流稳压电源装置组成。电Fenton反应器尺寸为160 mm×70 mm×150 mm,Ti/IrO2-Ta2O5和Fe作为阳极,Ti作为阴极,电极板规格为100 mm×100 mm×1 mm。
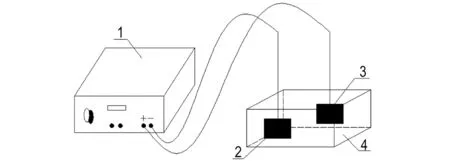
1—直流稳压电源, 2—Ti阴极, 3—Ti/IrO2-Ta2O5阳极或Fe阳极, 4—电Fenton反应器
1—DC regulated power supply, 2—titanium cathode, 3—Ti/IrO2-Ta2O5or Fe anode, 4—Electro-Fenton reactor
图1电Fenton催化反应装置示意图
Fig.1Schematic diagram of Electro-Fenton reaction quipment
取1000 mL模拟含酚废水置于电Fenton反应器中,插入电极,根据需要加入FeSO4·7H2O和30%H2O2(m/v),接通直流稳压电源,调节电压为设定值,进行电Fenton反应研究。
3 结果与讨论
3.1 FeSO4·7H2O投加量对废水降解效果的影响
使用Ti/IrO2-Ta2O5作阳极电Fenton处理100 mg·L-1含酚废水,当pH值为3.5、电压为5 V、按H2O2投加量分别为0.98,1.96,2.94 mmol·L-1计算后加入FeSO4·7H2O, 降解时间为2 min时,研究FeSO4·7H2O投加量对废水降解效果的影响,结果如图2所示。
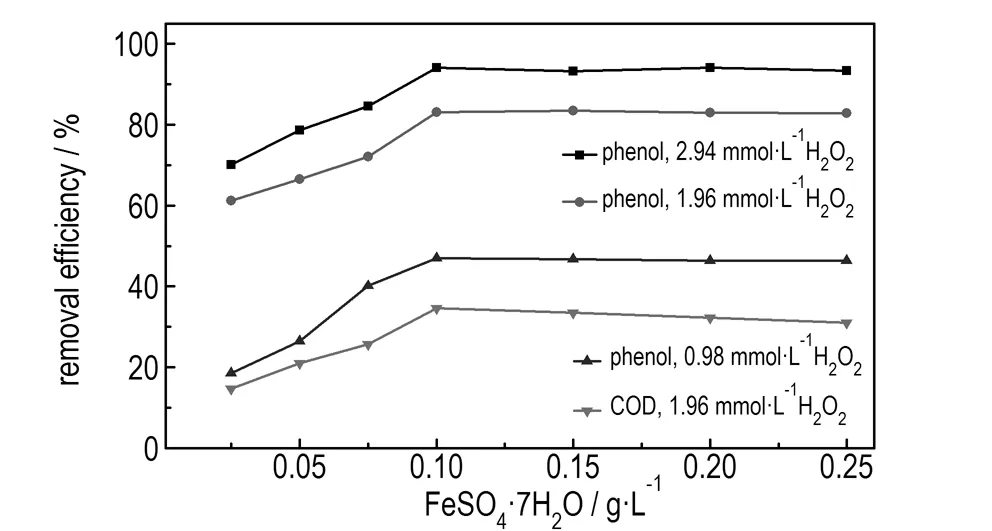
图2FeSO4·7H2O投加量对废水降解效果的影响
Fig.2Effect of dosage of FeSO4·7H2O on the degradation efficiency of wastewater
由图2可知,随着FeSO4·7H2O投加量的增加,苯酚和COD的去除率均随之增大。这是因为当H2O2投加量一定时,Fe2+的浓度过低时,电Fenton反应很慢,产生的·OH很少,去除率降低; 随着Fe2+离子含量的增加,·OH的生成量也逐渐增多,被·OH分解的有机物含量也逐渐增多,从而使苯酚和COD的去除率逐渐增大,这可用式(2)[16]解释:
Fe2++H2O2→·OH +OH-+Fe3+
(2)
当FeSO4·7H2O投加量增加到0.1 g·L-1时,苯酚和COD的去除率变化趋于平缓,其增加到0.15 g·L-1时,苯酚的去除率变化趋于不变,COD的去除率略有下降。这是因为加入过多的Fe2+会消耗溶液中的·OH,与·OH降解废水中有机物的反应产生竞争,并且易生成Fe(OH)2和Fe(OH)3沉淀,不仅消耗Fenton试剂,同时增加废水色度,从而减缓苯酚去除并使COD去除率略有下降。这可用式(3)~(5)进行解释[17-18]。此时,随着FeSO4·7H2O投加量的增加,即使H2O2投加量较大时,苯酚和COD的去除率变化不大,即FeSO4·7H2O的投加量为0.1 g·L-1时,基本满足处理该浓度废水所需的Fe2+投加量。因此,适宜的FeSO4·7H2O的投加量为0.1 g·L-1。
Fe2++·OH→OH-+Fe3+
(3)
Fe2++2OH-→Fe(OH)2
(4)
Fe3++3OH-→Fe(OH)3
(5)
3.2 H2O2投加量对废水降解效果的影响
用Ti/IrO2-Ta2O5作阳极电Fenton处理100 mg·L-1含酚废水,研究当电解电压为5 V、反应时间为2 min、pH值为3.5,FeSO4·7H2O投加量为0.1 g·L-1时, H2O2投加量对废水降解效果的影响。同时与相同条件下不投加FeSO4·7H2O时的Fe阳极对废水降解效果进行对比,结果如图3所示。
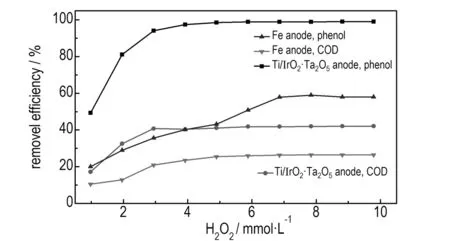
图3H2O2投加量对废水降解效果的影响
Fig.3Effect of dosage of H2O2on the degradation efficiency of wastewater
由图3可知,无论使用Ti/IrO2-Ta2O5阳极还是Fe阳极,当H2O2的投加量增加时,苯酚和COD的去除率均随之先增大后趋于平缓。这是因为当H2O2的投加量较低时,·OH的生成量较少; 当H2O2的投加量增加时,产生的·OH的量随之增加,对苯酚和中间产物的去除率随之增加。因此,苯酚和COD的去除率也随之增加; 但当H2O2投加量过高时,产生大量·OH的同时,大量的Fe2+被氧化成为Fe3+,此时Fe2+的含量减少,则氧化态物质(主要是·OH和Fe3+)和还原态物质(主要是Fe2+)的比值增大。由能斯特方程[9]可知,此比值的增大会导致氧化还原电位值的增大,能耗升高。同时过量的H2O2也会作为·OH的捕捉剂从而造成新生成的·OH淬灭,见式(6)。随着反应不断进行,反应逐渐达到动态平衡。因此,苯酚和COD的去除率不再增加,而是趋于不变。
·OH+H2O2→H2O+HO2·
(6)
但在相同的H2O2的投加量时,使用Ti/IrO2-Ta2O5作阳极相比Fe作阳极可获得较高的苯酚和COD去除率。如当H2O2的投加量为2.94 mmol·L-1时,使用Ti/IrO2-Ta2O5作阳极时的苯酚和COD去除率分别为94.1%和40.7%,比使用Fe作阳极时的35.6%和20.8%分别可提高164%和96%; 在相同的去除率情况下,Ti/IrO2-Ta2O5作阳极时的H2O2投加量较少。如使用Fe作阳极,当苯酚的最大去除率为59.0%时,H2O2投加量为7.84 mmol·L-1。在相同苯酚去除率59.0%时,若使用Ti/IrO2-Ta2O5作阳极,H2O2投加量为1.33 mmol·L-1,仅需Fe作阳极时H2O2投加量的1/6。这是因为电催化反应与电Fenton反应形成协同效应,协同降解废水的能力大于Fe作阳极时单独仅靠电Fenton反应产生的·OH来降解废水的能力,从而可在获得较高的去除率情况下减少H2O2用量,降低处理成本。由图3可知,使用Ti/IrO2-Ta2O5作阳极,H2O2投加量为2.94 mmol·L-1时,苯酚和COD的去除率较高且增大变缓。因此,适宜的H2O2投加量为2.94 mmol·L-1。
3.3 pH值对废水降解效果的影响
当含酚废水浓度100 mg·L-1、电解电压为5 V、反应时间为2 min,Ti/IrO2-Ta2O5作阳极电Fenton反应时,H2O2投加量为2.94 mmol·L-1、FeSO4·7H2O投加量为0.1 g·L-1,Fe电极作阳极时的H2O2投加量为7.84 mmol·L-1时,考察Ti/IrO2-Ta2O5阳极和Fe阳极电Fenton降解废水过程中,初始pH值对废水降解效果的影响,结果如图4所示。

图4初始pH值对废水降解效果的影响
Fig.4Effect of initial pH on the degradation efficiency of wastewater
由图4可知,无论使用Ti/IrO2-Ta2O5作阳极还是Fe作阳极,酸性条件下的废水处理效果较好。这是因为酸性条件下有利于电Fenton反应进行并生成H2O2和·OH,从而有利于有机物的降解,如式(7)和(8)所示[19-20]; 但pH值过小时,Fe2+难以再生,Fenton链反应受到影响,见式(9)[20],·OH的生成量减少,导致苯酚和COD的去除率较低。当使用Ti/IrO2-Ta2O5作阳极,pH值为3.5时,苯酚和COD的去除率较高,分别为94.14%和40.74%。因此,适宜的pH值为3.5。当使用Fe作阳极,pH值为2时,苯酚和COD的去除率较高,分别为85.04%和39.78%。由此可知,Ti/IrO2-Ta2O5作阳极对苯酚和COD的去除率相比Fe作阳极分别提高10.71%和2.41%,并且H2O2投加量仅为Fe阳极的3/8,所需的pH值较高,调节pH值所耗酸性试剂较少,并且无需频繁更换电极,体现出运行费用较低的优势。而Fe作阳极时,溶液中的Fe2+是通过牺牲阳极电解反应产生的,产生Fe2+的速率和数量受限于电极反应速率和pH值。较低的pH值可促进Fe2+的溶解,增加Fenton试剂的产生数量,但同时酸耗量增加,电极溶解快,更换次数增多,影响着废水降解效率。
O2+2H++2e-=H2O2
(7)
2H2O-2e-→2·OH+2H+
(8)
Fe3++H2O2→Fe2++HO2·+H+
(9)
3.4 电压对废水降解效果的影响
用Ti/IrO2-Ta2O5阳极电Fenton处理100 mg·L-1含酚废水。当初始pH值为3.5、反应时间为2 min、H2O2投加量为2.94 mmol·L-1、FeSO4·7H2O投加量为0.1 g·L-1时,和相同pH值和反应时间条件下,使用Fe阳极在H2O2投加量为7.84 mmol·L-1时进行对比,考察电压对废水降解效果的影响,结果如图5所示。
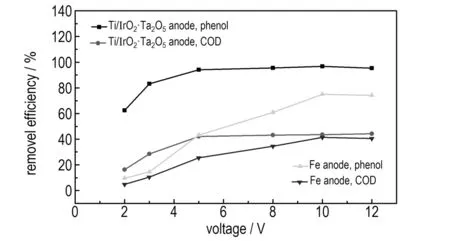
图5电压对废水降解效果的影响
Fig.5Effect of voltage on the degradation efficiency of wastewater
由图5可知,无论使用Ti/IrO2-Ta2O5作阳极还是Fe作阳极,当随着电压值的升高,苯酚和COD的去除率均随之先增大后趋于平缓。由法拉第定律[9]可知,随着电压的升高,电流密度会随之增大,阴极输出的电量和阳极得到的电量也随之增加,产生·OH和H2O2物质的量也随之增多。因此,废水中的有机物的去除率也随之增大。
当使用Ti/IrO2-Ta2O5作阳极,电解电压为5 V时,苯酚和COD的去除率较高且分别为94.14%和40.74%; 而使用Fe电极,电解电压为10 V时,苯酚和COD的去除率较高分别为75%和41.35%。当Ti/IrO2-Ta2O5阳极对苯酚去除率相比Fe阳极提高25.52%时,所需电解电压仅为铁电极的1/2。原因是当使用Fe阳极电解废水时,析氧副反应会产生超电势,需提高电解电压才能保证反应的顺利进行,从而使得电解能耗增加。而Ti/IrO2-Ta2O5阳极具有相对较高的析氧电位和催化分解污染物的能力,可在一定程度上抑制和减少阳极析氧副反应的发生,维持电极的有效活性面积和·OH的生成速率,无需过多的提高电解电压便可获得较高的苯酚和COD去除率。综合电耗和废水降解效果两方面考虑,Ti/IrO2-Ta2O5阳极电Fenton法处理含酚废水适宜的电解电压为5 V,相比铁电极而言,体现出废水降解效果良好和节能的优势。
3.5 苯酚初始浓度对废水降解效果的影响
当含酚废水初始pH值为3.5、反应时间为2 min,处理100 mg·L-1含酚废水。使用Ti/IrO2-Ta2O5电极作阳极,电解电压为5 V、H2O2投加量为2.94 mmol·L-1、FeSO4·7H2O投加量为0.1 g·L-1。使用Fe电极作阳极,电解电压为10 V、H2O2投加量为7.84 mmol·L-1时,考察使用Ti/IrO2-Ta2O5阳极和Fe阳极时,苯酚初始浓度对废水降解效果的影响,结果如图6所示。
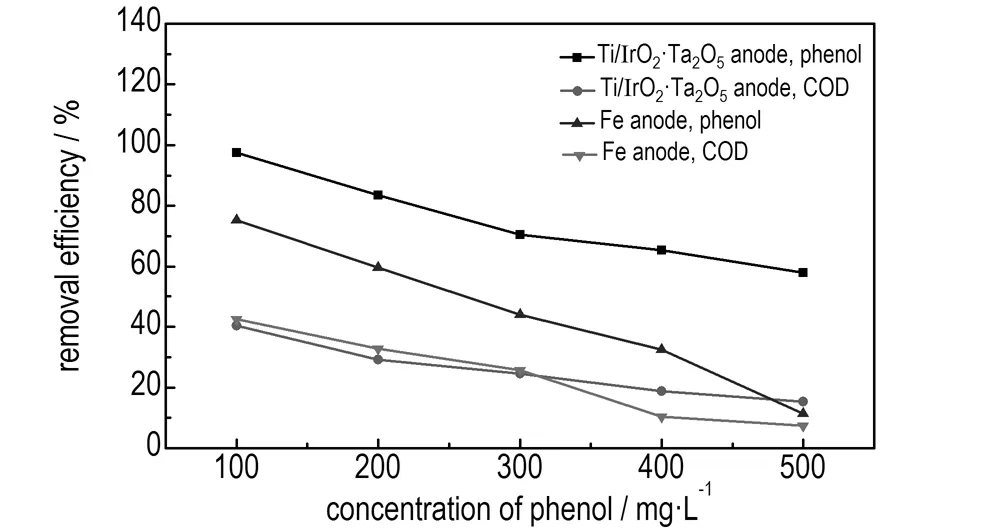
图6苯酚初始浓度对废水降解效果的影响
Fig.6Effect of phenol initial concentration on the degradation efficiency of wastewater
由图6可知,无论使用Ti/IrO2-Ta2O5电极还是Fe电极,当H2O2投加量不变时,随着苯酚初始浓度的增大,苯酚和COD的去除率逐渐减小。这是因为系统中电Fenton反应产生的·OH不足以降解逐渐增多的苯酚。相同苯酚初始浓度时,使用Ti/IrO2-Ta2O5阳极在较低电压和较少H2O2投加量的情况下,苯酚和COD去除率高于铁阳极,即在相近苯酚和COD去除率时,Ti/IrO2-Ta2O5阳极相比Fe阳极可在较低电压和较少H2O2投加量的情况下降解较高初始浓度的含酚废水。这是因为Ti/IrO2-Ta2O5阳极电催化反应过程中产生的IrO2(·OH)和过氧化物IrOX,与电Fenton反应产生的·OH协同降解有机物的能力大于Fe阳极电Fenton反应产生的·OH降解有机物的能力,所以可在较低电压和较少H2O2投加量的情况下降解较多量的苯酚和中间产物。而对于Fe阳极而言,当苯酚初始浓度增加时,则需增加Fenton试剂的投加量或提高电解电压方可达到理想的废水降解效果。
3.6 降解时间对废水降解效果的影响
在电解电压为5 V、初始pH值为3.5、废水初始浓度为100 mg·L-1的条件下,当使用Ti/IrO2-Ta2O5阳极电Fenton降解废水时,FeSO4·7H2O投加量为0.1 g·L-1、H2O2投加量为2.94 mmol·L-1; 当使用Fe阳极电Fenton降解废水时,H2O2投加量为7.84 mmol·L-1; 当使用Ti/IrO2-Ta2O5阳极不投加试剂电催化降解废水时,降解时间对苯酚和COD的去除率影响如图7和图8所示。
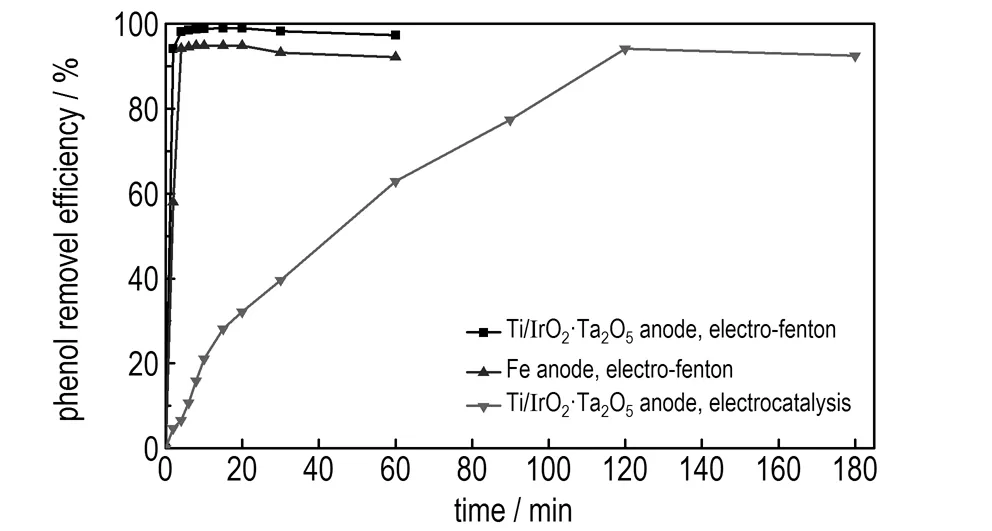
图7降解时间对苯酚去除率的影响
Fig.7Effect of degradation time on the removal efficiency of phenol
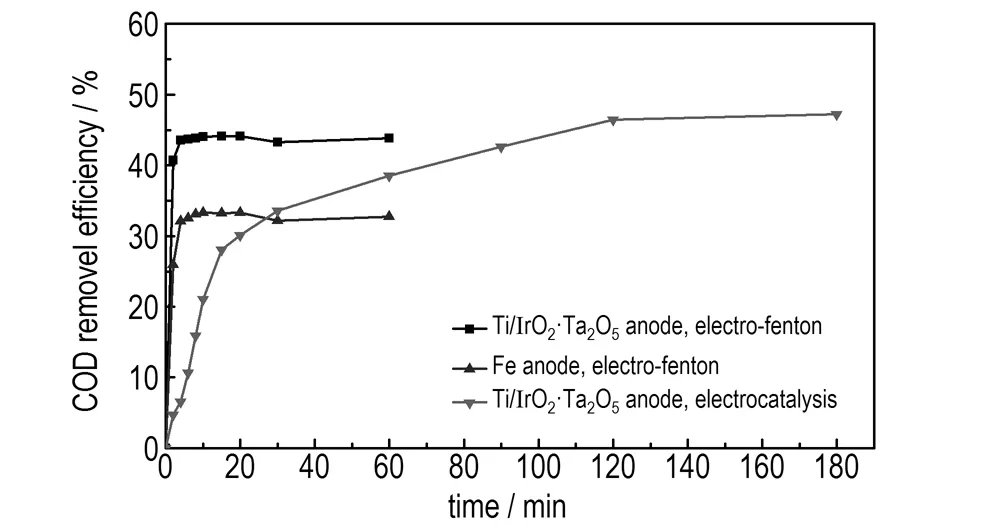
图8降解时间对COD去除率的影响
Fig.8Effect of degradation time on removal efficiency of COD
由图7和图8可知,在降解废水的起始阶段,三种方法的苯酚和COD去除率均快速增加。这是因为起始阶段,体系中苯酚浓度较高,反应产生的·OH的量也较多,从反应动力学角度分析,反应速率较快,有机物去除速率较快,去除率较高。降解2 min时,Ti/IrO2-Ta2O5阳极电Fenton和Fe阳极电Fenton对苯酚的去除率分别为94.14%和59%,对COD的去除率分别为40.74%和26.41%,之后去除率增加变缓。降解4 min时,Ti/IrO2-Ta2O5阳极电Fenton和Fe阳极电Fenton对苯酚的去除率分别为99.1%和94.15%,对COD的去除率分别为45.54%和32.12%。Ti/IrO2-Ta2O5阳极对废水的处理效率高于Fe阳极。降解4 min后,去除率变化不显著。此时苯酚浓度降低,H2O2浓度减小,产生的·OH的量减少,反应达到动态平衡。因此,适宜的降解时间为2 min,达到最高去除率的降解时间为4 min。若继续延长降解时间,则能耗和处理费用增多。
在本研究条件下,要取得94%以上的苯酚去除效果,使用Fe阳极电Fenton需用4 min,H2O2投加量为7.84 mmol·L-1; 使用Ti/IrO2-Ta2O5阳极电Fenton需用2 min,FeSO4·7H2O投加量为0.1 g·L-1、H2O2投加量为2.94 mmol·L-1,时间仅为Fe阳极的1/2,并且试剂投加量少; 使用Ti/IrO2-Ta2O5阳极电催化则需用120 min。因此,在苯酚去除率相近情况下,Ti/IrO2-Ta2O5作阳极电Fenton降解废水时由于时间的缩短所带来的电耗的减少,以及试剂消耗量的减少所带来的试剂费用的降低使其处理废水的费用较少。使用Ti/IrO2-Ta2O5阳极电Fenton降解废水2 min的苯酚和COD去除率均大于Fe阳极电Fenton和Ti/IrO2-Ta2O5阳极电催化的去除率,这是因为Ti/IrO2-Ta2O5阳极电Fenton过程中的Ti/IrO2-Ta2O5阳极电催化反应与电Fenton反应产生协同效应,反应产生的·OH协同降解有机物的能力大于单独Fe阳极电Fenton反应和Ti/IrO2-Ta2O5阳极电催化反应降解有机物的能力。因此,使用Ti/IrO2-Ta2O5阳极电Fenton处理含酚废水相比Fe阳极电Fenton,可在较少试剂耗量情况下,缩短废水处理时间和获得较好的废水处理效果。
3.7 污染物降解过程分析
在3.6节的研究条件下,通过高效液相色谱分析Ti/IrO2-Ta2O5阳极和Fe阳极电Fenton降解苯酚生成的中间产物,研究苯酚的降解过程。Ti/IrO2-Ta2O5阳极电Fenton和Fe阳极电Fenton降解苯酚不同时间的高效液相色谱图如图9和图10所示。
通过图9和图10中高效液相色谱图出峰的保留时间与已知标准物质的保留时间对比可知,相同降解时间时,Ti/IrO2-Ta2O5阳极与Fe阳极电Fenton降解苯酚的中间产物种类一致,均出现了中间产物邻苯二酚(保留时间3.762 min)、对苯二酚(保留时间2.965 min)、间苯二酚(保留时间2.240 min)、对苯醌(保留时间3.668 min)、顺丁烯二酸(保留时间2.310 min)、丁二酸(保留时间2.680 min)和丙二酸(保留时间2.540 min)的色谱峰,说明二者废水的降解途径和过程相同,即首先反应产生的·OH与苯环发生亲电加成反应,攻击苯环的不同位置,使苯酚在邻位、对位、间位发生了羟基化,生成邻苯二酚、对苯二酚、间苯二酚和对苯醌; 其次苯环共轭结构被破坏,苯环被继续氧化生成脂肪族物质顺丁烯二酸、丁二酸和丙二酸; 最后苯酚和中间产物持续被氧化成CO2和H2O。代表顺丁烯二酸的色谱峰面积减少的较慢,说明苯环开环后氧化成脂肪族物质比较容易,但完全矿化成CO2和H2O比较困难。即苯酚的去除效果较好,但COD的去除效果不及苯酚,这与实验结果相一致。同时由图9和图10可知,在相同降解时间内,Ti/IrO2-Ta2O5作阳极相比Fe作阳极时,代表苯酚和中间产物的色谱峰面积减小的要快,即Ti/IrO2-Ta2O5作阳极电Fenton对苯酚和中间产物的去除率高于Fe作阳极电Fenton的去除率。Ti/IrO2-Ta2O5阳极电Fenton降解含酚废水的效率较高。
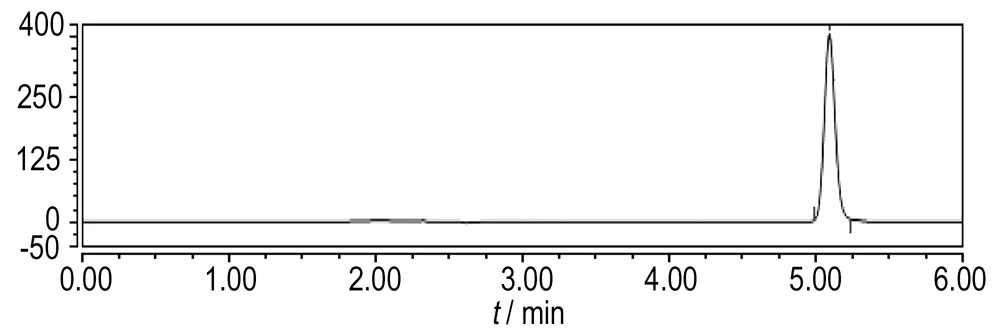
a. 0 min

b. 2 min
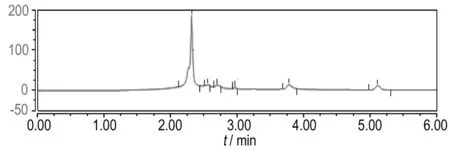
c. 4 min
图9Ti/IrO2-Ta2O5阳极电Fenton降解苯酚不同时间的高效液相色谱图
Fig.9HPLC chromatograms of the Electro-Fenton degradation of phenot with Ti/IrO2-Ta2O5anode at different reaction time
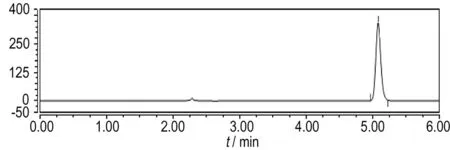
a. 0 min

b. 2 min
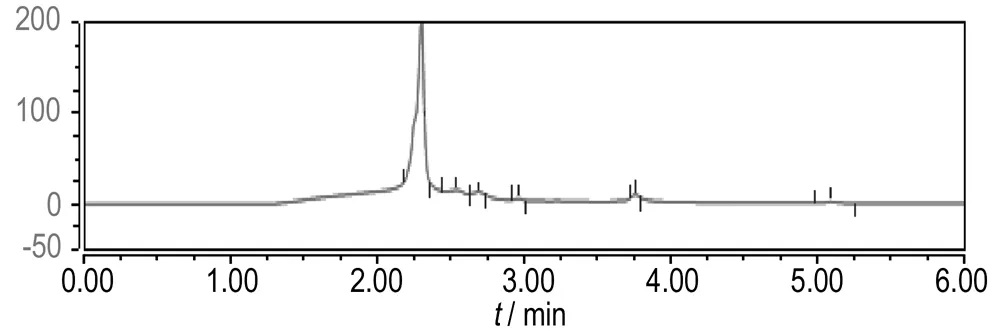
c. 4 min
图10Fe阳极电Fenton降解苯酚不同时间的高效液相色谱图
Fig.10The HPLC chromatograms of different reaction times with Fe anode Electro-Fenton method
4 结 论
(1)Ti/IrO2-Ta2O5阳极电Fenton法降解含酚废水适宜的操作条件为: pH值3.5、电解电压5 V、FeSO4·7H2O投加量0.1 g·L-1、H2O2投加量2.94 mmol·L-1、反应时间2 min,此时苯酚去除率为94.14%,COD去除率为40.74%; 反应时间4 min时,苯酚去除率为99.1%,COD去除率为45.54%。
(2)当Ti/IrO2-Ta2O5阳极电Fenton对苯酚和COD的去除率高于Fe阳极电Fenton和Ti/IrO2-Ta2O5阳极电催化反应去除率时,H2O2投加量、电解电压和需用时间分别仅为Fe阳极的3/8、1/2和1/2,耗电费和试剂消耗费用少。原因是Ti/IrO2-Ta2O5阳极电Fenton过程中的Ti/IrO2-Ta2O5阳极电催化反应与电Fenton反应产生协同效应,协同降解有机物的能力大于单独Fe阳极电Fenton和Ti/IrO2-Ta2O5阳极电催化反应降解有机物的能力。
(3)HPLC分析显示,Ti/IrO2-Ta2O5阳极电Fenton和Fe阳极电Fenton催化降解苯酚的过程一致,均是反应第一阶段羟基自由基与苯环发生亲电加成反应,生成邻苯二酚、对苯二酚、间苯二酚、对苯醌; 第二阶段苯环氧化开环,生成脂肪族物质; 第三阶段脂肪族物质氧化成CO2和H2O。但在相同降解时间内,Ti/IrO2-Ta2O5阳极电Fenton催化降解含酚废水的效率较高。
参考文献:
[1]BUSCA G, BERARDINELLI S, RESINI C, et al. Technologies for the removal of phenol form fluid streams: A short review of recent development[J].JournalofHazardousMaterials, 2008, 160(2-3): 265-288.
[2]RUI C M, ANDRE F R, ROSA M. Fenton′s oxidation process for phenolic wastewater remediation and biodegradability enhancement[J].JournalofHazardousMaterials, 2010, 180(1-3): 716-180.
[3]Sprynskyy M, Ligor T, Lebedynets M, et al. Kinetic and equilibrium studies of phenol adsorption by natural and modified forms of the clinoptiolite[J].JournalofHazardousMaterials, 2009, 169(1-3): 847-854.
[4]GAO J, LIU Y Z, CHANG L F. Treatment of phenol wastewater using high gravity electrochemical reactor with multi-concentric cylindrical electrodes[J].ChinaPetroleumProcessingandPetrochemicalTechnology, 2012, 14(2): 71-75.
[5]GAO J, YAN J J, LIU Y Z, ZHANG J C, GUO Z Y. A novel electro-catalytic degradation method of phenol wastewater with Ti/IrO2-Ta2O5anodes in high-gravity fields[J].WaterScienceandTechnology, 2017, 76(3): 662-670.
[6]刘引娣, 刘有智, 高璟, 等. 超重力-电催化耦合法降解含酚废水[J]. 化工进展, 2015, 34(7): 2070-2074.
LIU Yin-di, LIU You-zhi, GAO Jing, et al. Degradation of phenol in wastewater using high gravity coupled with catalytic method[J].ChemicalIndustryandEngineeringProgress, 2015, 34(7): 2070-2074.
[7]Ghoneim M M, EI-Desoky H S, Zidan N M, et al. Electro-Fenton oxidation of Sunset Yellow FCF azo-dye in aqueous solutions[J].Desalination, 2011, 274(1-3): 22-30.
[8]徐小妹, 潘顺龙, 李健生, 等. 多孔载体负载型Fenton催化剂降解酚类污染物的研究进展[J]. 化工进展, 2014, 33(6): 1465-1474.
XU Xiao-mei, PAN Shun-long, LI Jian-sheng, et al. Reserch progress of phenols degradation with Fenton catalyst supported on porous materials[J].ChemicalIndustryandEngineeringProgress, 2014, 33(6): 1465-1474.
[9]张招贤. 钛电极工学(第二版)[M]. 北京: 冶金工业出版社, 2003.
ZHANG Zhao-xian. Titanium electrode technology[M]. Beijing: Metallurgical industry press, 2003.
[10]DUAN X Y, MA F, YUAN Z X, et al. Electrochemical degradation of phenol in aqueous solution using PbO2anode[J].JournaloftheTaiwanInstituteofChemicalEngineers, 2013, 44(1): 95-102.
[11]HUANG C A, YANG S W, CHEN C Z, et al. Electrochemical behavior of IrO2-Ta2O5/Ti anodes prepared with different surface pretreatments of Ti substrate[J].SurfaceandCoatingsTechnology, 2017, 320(25): 270-278.
[12]HERRADA R A, MEDEL A, MANRQUEZ F, et al. Preparation of IrO2-Ta2O5vertical bar Ti electrodes by immersion, painting and electrophoretic depositon for the electrochemical removal of hydrocarbons from water[J].JournalofHazardousMaterials, 2016, 319(5): 102-110.
[13]XIN Y L, XU L K, WANG J T, et al. Effect of sintering temperature on microstructure and electrocatalytic properties of Ti/IrO2-Ta2O5anodes by pechini method[J].RareMetalMaterialsandEngineering, 2010, 39(11): 1903-1907.
[14]马旭丽.EF法降解苯酚及中间产物的高效液相色谱分析[D].太原: 太原理工大学,2003.
MA Xu-li. EF method of degradation of phenol and intermediate products of high performance liquid chromatography (HPLC) analysis[D]. Taiyuan: Taiyuan University of Technology, 2003.
[15]GB11914-89. 水质化学需氧量的测定重铬酸盐法[S]. 北京: 中国标准出版社, 1991.GB11914-89.
Water quality-Determination of the chemical oxygen demand-Dichromate method[S]. Beijing: China Standards Press, 2003.
[16]Neyens E, Baeyens J. A review of classic Fenton′s peroxidation as an advanced oxidation technique[J].JournalofHazardousMaterials, 2003, 98(1-3): 33-50.
[17]MA J, SONG W, CHEN C, et al. Fenton degradation of organic compounds promoted by dyes under visible irradiation[J].EnvironSciTechnol, 2005, 39(15): 5810-5815.
[18]Mollah M Y, Schennach R, Parga J R, et al. Electrocoagulation(EC)-science and applications[J].JournalofHazardousMaterials, 2001, 84(1): 29-41.
[19]Ghoneim M M, EI-Desoky H S, Zidan N M. Electro-Fenton oxidation of sunset yellow FCF azo-dye in aqueous solutions[J].Desalination, 2011, 274(1-3): 22-30.
[20]WANG C T, CHOU W L, CHUNG M H, et al. COD removal from real dyeing wastewater by electro-Fenton technology using an activated carbon fiber cathode[J].Desalination, 2010, 253(1-3): 129-134.
