水温和盐度对长牡蛎“海大1号”早期生长发育的影响
2017-05-04张景晓
孟 乾, 李 琪, 张景晓
水温和盐度对长牡蛎“海大1号”早期生长发育的影响
孟 乾, 李 琪, 张景晓
(中国海洋大学 海水养殖教育部重点实验室, 山东 青岛 266003)
为确定长牡蛎新品种“海大1号”苗种繁育的最适环境条件, 研究了盐度对其胚胎发育的影响以及盐度、水温对其幼虫生长、存活率和附着率的影响。结果表明: 长牡蛎“海大1号”受精卵孵化的最适盐度为30~35, 孵化率最高可达90%。幼虫生长的适宜盐度为20~35, 最适盐度为20~30; 存活的适宜盐度为20~35, 最适盐度为20~25; 幼虫附着的适宜盐度为20~35, 最适盐度为25~30; 对长牡蛎“海大1号”幼虫生长、存活、附着的适宜水温分别为为20~30℃、20~25℃、20~30℃, 最适水温分别为30、25、30℃, 高温35℃时幼虫全部死亡。综上, 长牡蛎“海大1号”苗种培育的适宜盐度为20~35, 适宜水温为20~25℃。上述结果为长牡蛎“海大1号”规模化苗种繁育提供了重要的基础资料。
长牡蛎(); 水温; 盐度; 胚胎; 幼虫; 海大1号
长牡蛎()是重要的海水养殖贝类之一, 具有较高的营养价值和良好的环境适应性, 其养殖产业已遍布世界各地。长牡蛎在中国主要分布在北方沿海, 由于人工育苗技术的发展和筏式养殖的兴起, 长牡蛎养殖给中国带来了巨大的经济和社会效益[1]。但目前中国牡蛎养殖业良种缺乏, 对产业健康可持续发展造成了不利的影响。长牡蛎“海大一号”为近年培育出的长牡蛎新品种, 具有品质好、生长快等优点, 开展长牡蛎“海大一号”苗种繁殖技术的研究, 对制定合理的育种规划、推广该新品种具有重要意义。
海水盐度影响贝类的渗透压调节, 一旦盐度的变化超过了自身的调节能力, 就会造成贝类的死亡[2]。相关研究表明, 盐度不仅对海洋贝类幼虫的生长、存活等性状有重要的影响, 还对固着性贝类幼虫的固着有较大的影响; 此外, 水温也被认为是决定贝类配子发育和产卵的重要环境因素[3-6]。有关水温、盐度对贝类胚胎及幼虫的影响已有很多相关报道, 譬如不同温、盐条件下栉孔扇贝()[7]和脉红螺()[8]的胚胎及幼虫生长发育, 为生产提供了最适的培育条件。迄今, 有关水温和盐度对长牡蛎“海大1号”胚胎及幼虫的影响尚未见报道。因此, 本研究探讨了不同水温和盐度对长牡蛎“海大1号”胚胎发育及幼虫的生长、存活和附着的影响, 以期为长牡蛎 “海大1号”的应用推广提供基础资料。
1 材料与方法
1.1 材料来源
实验在烟台市海益苗业有限公司莱州基地进行, 所用种贝为本实验室培育的“海大1号”。2015年5月挑选平均壳高8.51 cm±0.69 cm, 外表无损伤的2龄贝100个作为亲贝, 进行暂养。在亲贝蓄养过程中, 定期取样观测肥满度, 并镜检精卵发育情况。6月1日挑选性腺发育良好的亲贝, 人工解剖授精, 使用孔径50 µm的筛绢选优, 收集D形幼虫实验材料。
1.2 实验设计
胚胎实验共分为8个盐度梯度: 5、10、15、20、25、30、35和40, 实验时水温为24~27.5℃。实验容器为5 L的塑料桶, 每桶加入4 L不同盐度的海水。将受精卵放入其中, 微充气, 适宜时间观察一次, 每次每组取样30个, 记录其发育时期、发育时间、孵化率、孵化时间等。幼虫实验设计5个盐度梯度: 20、25、30、35和40, 实验水温24~26℃; 4个水温梯度: 20、25、30和35℃, 海水盐度为30。各个水温和盐度均设置3个重复组, 实验容器为15 L的塑料桶。
实验用海水均经过砂滤池和滤水袋过滤。低盐海水由加入曝气后的淡水配得, 高盐海水加入海盐配得。
1.3 幼虫培育
幼虫培育前期投喂球等鞭金藻(), 后期补充扁藻(sp.), 日投饵3次。幼虫初始密度为5个/mL, 培育过程定期取样, 在显微镜下用目微尺测量壳高, 统计密度。当幼虫有30%出现眼点时投放附着基, 附着基采用栉孔扇贝壳, 统计附着数量。
1.4 数据处理
胚胎实验中, 统计每个实验组发育到不同时期的时间、孵化率、孵化时间和畸形率。以D形幼虫率达到30%的时间为孵化时间, 孵化率是指观察的30个体中孵化个数占总数的比例; 畸形率是指胚胎发育过程中未孵化个体所占百分比。幼虫实验中, 统计各个实验组幼虫的壳高、壳长、存活率和附着率。存活率是指活个体数占初始总个体数的百分比; 附着率是指附着个体数占投放附着基之前总个体数的百分比。
实验数据采用SPSS(v 20.0)软件进行单因子方差分析, 结合最小显著差数法(LSD)多重比较分析组间差异, 显著性水平设为<0.05。
2 结果
2.1 不同盐度对长牡蛎“海大1号”胚胎发育的影响
不同盐度组受精卵的发生时间如表1。盐度5、10组, 最终都不能发育到D形幼虫; 盐度15、20、25、30、35、40组孵化时间分别为29、24、22、17、20、21 h。盐度30组孵化时间最短。
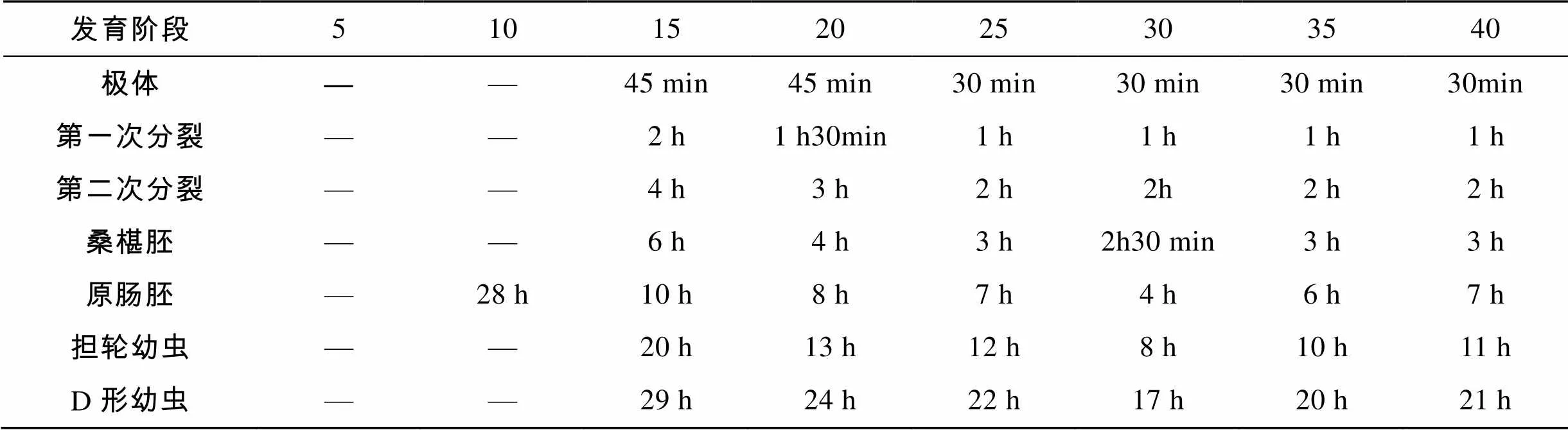
表1 不同盐度下长牡蛎“海大1号”胚胎的发育时间
不同盐度组胚胎孵化率及畸形率见图1。36 h盐度15、20、25、30、35、40组胚胎孵化率分别为30%、80%、80%、90%、90%、85%。盐度30和35组孵化率显著高于其他盐度组(<0.05)。除盐度5、10和15组外, 其他实验组孵化率均不低于80%。
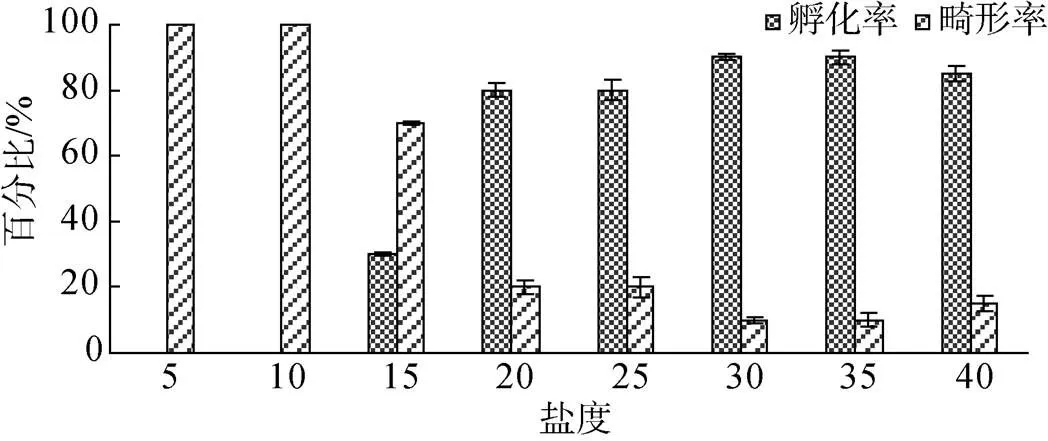
图1 不同盐度下长牡蛎“海大1号”胚胎孵化率和畸形率
2.2 不同盐度和水温对长牡蛎“海大1号”幼虫生长、存活率和附着率的影响
2.2.1 不同盐度对长牡蛎“海大1号”幼虫的影响
实验结果表明, 盐度可显著影响长牡蛎“海大1号”幼虫的生长(图2)。单因子方差分析显示, 第4天, 40盐度组生长最慢, 平均壳高140mm与35盐度组无明显差异, 与20、25、30盐度组均存在显著性差异(<0.05); 20盐度组生长最快, 平均壳高为169mm, 但与25、30盐度组之间无明显差异; 第6天40盐度组生长最慢, 平均壳高159mm与其他各个盐度组之间均存在显著性差异(< 0.05); 20盐度组生长最快, 平均壳高206mm, 与25、30盐度组之间没有明显差异(> 0.05)。40盐度组日生长率为6%, 其余各组日生长率为9%~11%。由图2还可看出, 最终40盐度组壳高生长明显慢于其他组, 20盐度组生长最快, 但与25、30盐度组无明显差异。
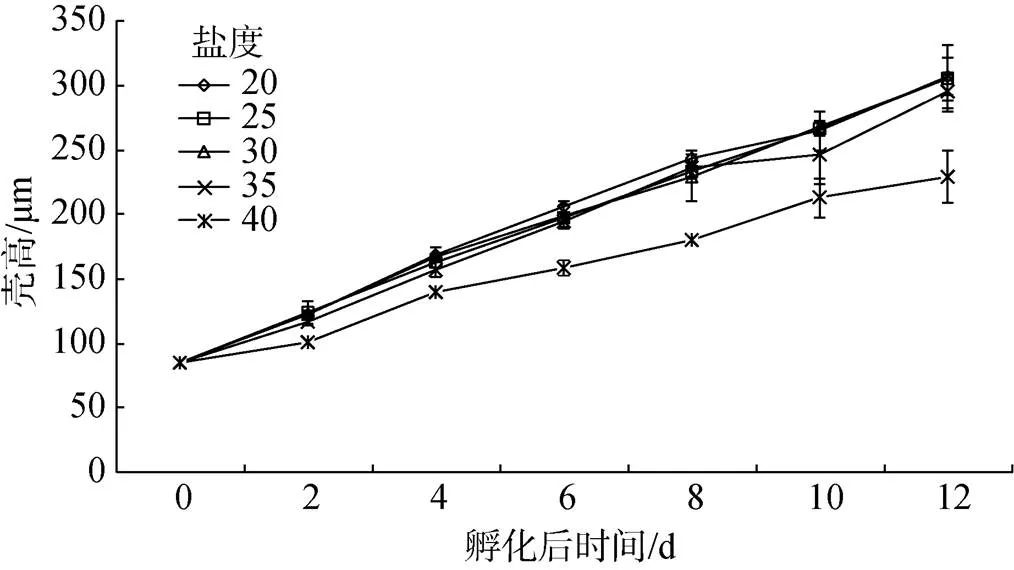
图2 不同盐度下长牡蛎“海大1号”幼虫的生长
整个实验过程中, 存活率最高为25盐度组, 其次为20盐度组, 最低为40盐度组。第2天开始, 40盐度组存活率为54%, 显著低于其他各个实验组(< 0.05); 25盐度组存活率最高为83%, 但与20、30、35盐度组无显著差异。第6天, 20~40盐度组存活率均大于25%, 20~35盐度组存活率均大于50%; 盐度25组存活率最高为61.3%, 显著高于其他盐度组(< 0.05)。由图3可看出, 第10天开始, 25盐度组存活率为48.3%, 显著高于30~40盐度组, 但是与20盐度组(存活率45.3%)间不具明显差异; 40盐度组存活率最低为11.7%, 显著低于其他组(< 0.05)。
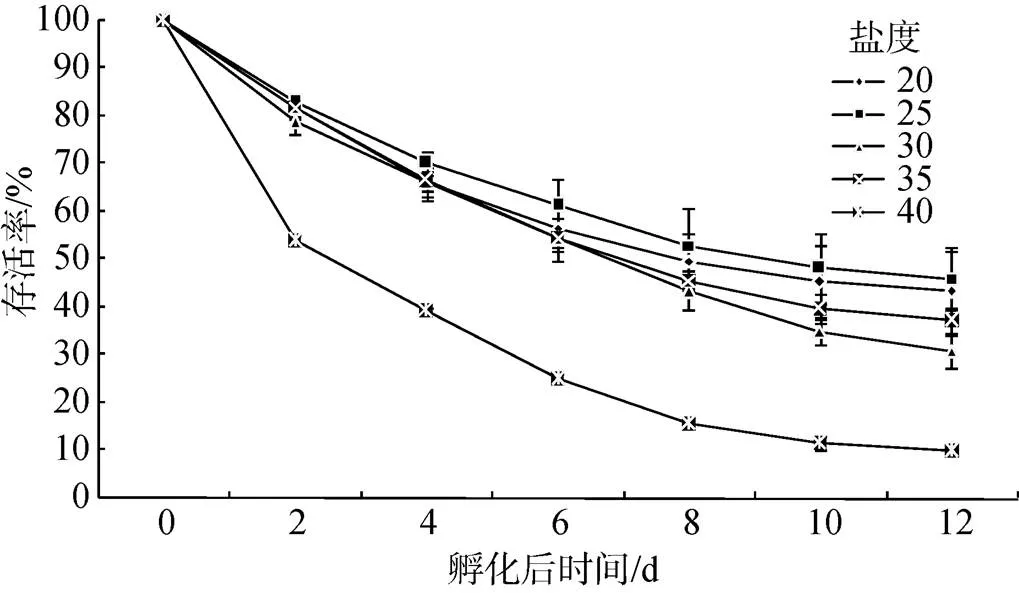
图3 不同盐度下长牡蛎“海大1号”幼虫的存活率
由图4可看出, 30、25盐度组附着率最高, 分别为35%、33%, 无显著性差异, 但是显著高于其他各组(<0.05); 附着率最低为40盐度组, 附着率为16%, 显著低于其他各组(<0.05)。其他各组间也都存在显著差异。
2.2.2 不同水温对长牡蛎“海大1号”幼虫的影响
单因子方差分析显示, 前期各个水温组无明显差异, 第4天, 水温30℃组的幼虫生长最慢, 平均壳高为133mm, 与20℃与25℃组存在明显差异; 25℃组生长最快平均壳高为152mm, 与30℃、35℃组有显著差异(< 0.05)。第6天, 35℃组已全部死亡, 20℃组平均壳高168mm, 与其他两组存在显著差异(< 0.05)。由图5可看出: 第8天开始, 30℃组平均壳高为228mm, 显著高于其他两组(< 0.05)。
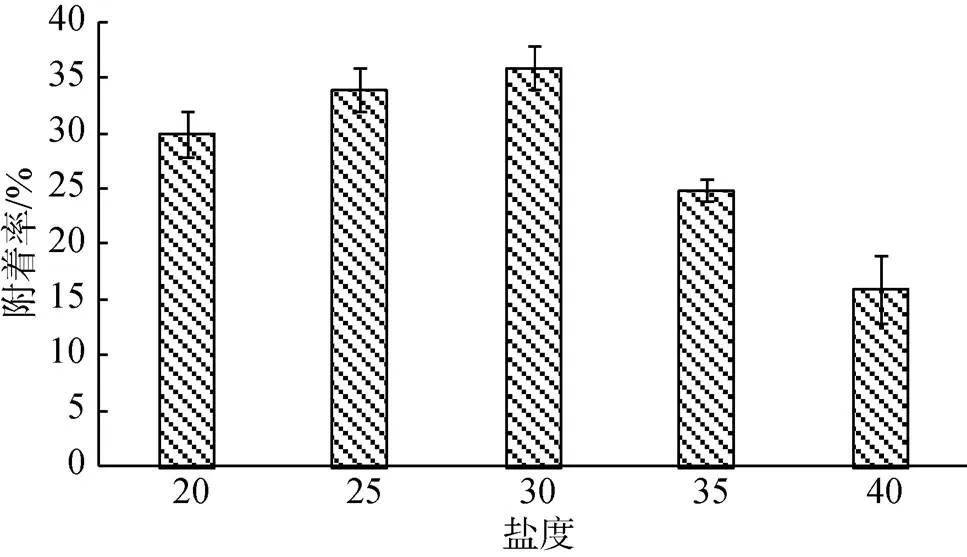
图4 不同盐度下长牡蛎“海大1号”幼虫的附着率
幼虫存活率如图6所示, 整个实验过程中, 水温25℃组存活率最高, 其次是20℃组, 而35℃组幼虫在孵化后第6天全部死亡。单因子方差分析显示各个实验组存活率均存在显著差异(< 0.05)。

图5 不同水温下长牡蛎“海大1号”幼虫的生长
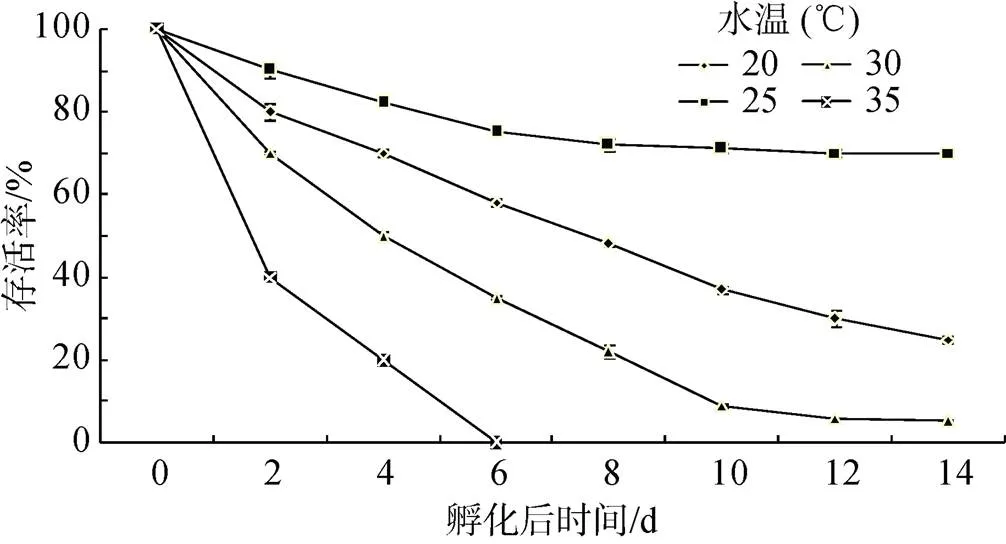
图6 不同水温下长牡蛎“海大1号”幼虫的存活率
水温30℃组附着率最高为16%, 显著高于其他两组(< 0.05)。20℃组与25℃组附着率无显著性差异(> 0.05), 详见图7。
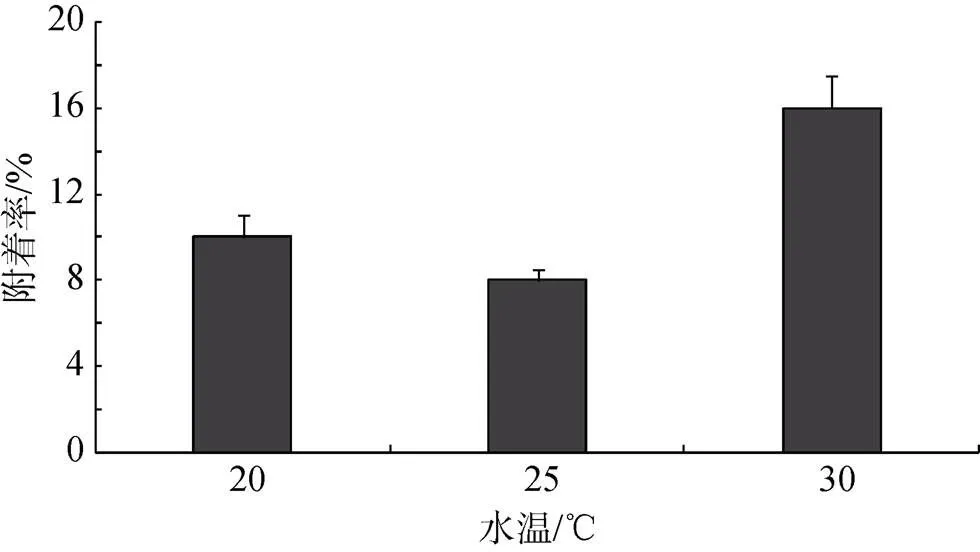
图7 不同水温下长牡蛎“海大1号”幼虫的附着率
3 讨论
本文的实验结果表明, 长牡蛎“海大1号”受精卵孵化的适宜盐度为20~40(孵化率≥80%); 最适盐度为30~35(孵化率≥90%)。其胚胎发育速度与盐度密切相关, 在本实验条件下, 盐度30组孵化时间最短为17 h, 盐度低于10, 受精卵最终不能发育到D形幼虫。有研究认为长牡蛎胚胎发育的最适宜盐度17~26, 盐度低于5.96时不能发育, 盐度34时也不能发育[9]; 刘海涛等[10]认为大连湾牡蛎(Crosse)胚胎的发育速度较快时的盐度为22~23。本文结果与上述研究存在差异, 其原因可能是: (1)两个研究中亲贝生活环境的盐度可能不同, 而亲贝生活环境会影响后代的适应性[11]; (2)两个研究中水温的不同也会造成孵化率差异, 因为受精卵的孵化受水温和盐度影响较大; (3)选择的作用, 长牡蛎“海大1号”在对生长性状选择的同时, 可能间接对盐度适应性进行了选择。本实验探究了长牡蛎“海大1号”的最适孵化盐度及其发育到D形幼虫的时间, 有利于育苗生产中及时进行选优。
水温和盐度是影响海洋生物生长发育的重要的环境因子。海洋贝类多生活在潮间带和河口等地, 环境盐度波动较为频繁, 海水盐度直接影响贝类的渗透压调节及其存活。苗种生产中, 盐度不仅对海洋贝类幼虫的生长、存活等性状有重要的影响, 还对幼虫的附着有较大的影响; 水温变化也会对海洋贝类幼虫生长发育及成活造成重要影响[9]。因此, 为建立贝类人工育苗技术, 需要研究幼虫的适宜盐度和水温范围。本实验中, 长牡蛎“海大1号”幼虫生长的适宜盐度为20~35, 经多重比较最适生长盐度为20~30; 适宜生存盐度为20~35, 最适生存盐度为20~25; 幼虫附着的适宜盐度为20~35, 最适盐度为25~30; 同时可以看出长牡蛎“海大1号”幼虫对盐度有较强的适应性, 但是40盐度下, 其生长、存活及附着率迅速下降, 说明其对高盐40盐度适应性较差, 与胚胎发育相比, 其盐度适宜范围基本相同。幼虫适宜生存盐度20~35, 胚胎适宜盐度为20~40。姚托等[12]通过研究发现长牡蛎稚贝生长的最适盐度为25~35, 生存的最适盐度为15~35。对比发现, 稚贝的生存盐度范围比幼虫要广, 这与海湾扇贝()、彩虹樱蛤() 、泥蚶()对盐度耐受力的规律一致[13-14]; 长牡蛎稚贝适宜生长盐度比幼虫高, 并对高盐有更好的适应性[15]。
有学者指出, 同一贝类在不同海区最适宜其幼虫发育的盐度是有所差别的。本研究结果与刘海涛和姚托等[10, 12]的结果存在一定差异。造成结果存在一定差异的原因可能是受到了亲贝性腺发育时所在海区盐度的影响; 也可能是因为实验条件的不同, 海水中矿物质和微量元素的含量、藻类、微生物等综合因素会对配子的质量和幼虫的生长、存活产生影响。贝类的盐度耐受力对其人工育苗有重要影响, 贝类育苗场所在地是易受到气候影响的沿岸或海湾, 盐度受气候变化而变动较大, 容易造成贝类幼虫或者稚贝的死亡。
水温是影响幼虫生长、存活和附着的重要因素之一。本实验条件下, 长牡蛎“海大1号”适宜生长水温为20~30℃, 最适生长水温为30℃; 适宜的存活水温范围20~25℃, 最适存活水温为25℃, 水温35℃第6天全部死亡; 附着的最适水温为30℃。尽管本实验中长牡蛎“海大1号”幼虫30℃的时候生长速度最快, 但是此时存活率较低为10%左右, 类似的结果也出现在波罗的海蛤()、脉红螺()等其他贝类[8, 16]。这表明, 在苗种生产过程中, 一定范围内幼虫培育水温的升高可以促进幼虫的生长, 但当水温超过一定界限后, 就会显著影响幼虫的存活, 使其存活率显著降低。有学者认为, 高温可加速水中细菌及微生物的生长繁殖, 进而增加了耗氧, 同时高温还可能造成幼虫摄食量下降, 导致存活率降低[17-18]。在人工育苗时, 由于密度较高, 高温还易导致水质、饵料的败坏, 影响饵料供应, 进而影响其存活和附着[14]。另外, 在长牡蛎“海大1号”生长发育的观测过程中发现, 水温20℃组的幼虫形状较狭长, 其附着率较低的原因可能是低温导致了幼虫的发育畸形。综合考虑, 人工育苗生产时, 长牡蛎“海大1号”幼虫培育最适水温为25℃。
4 结论
综上所述, 本研究阐明了水温和盐度对长牡蛎“海大1号”胚胎发育及幼虫生长存活和附着的影响, 确定了其幼虫生长、存活以及附着的适宜盐度为20~35, 适宜水温为20~25℃, 为长牡蛎“海大1号”规模化人工繁育提供了重要的科学依据。
[1] 孔宁, 李琪, 丛日浩, 等. 长牡蛎 F3代快速生长选育群体生长特性的研究[J]. 海洋科学, 2015, 39(3): 7-11.
Kong Ning, Li Qi, Cong Rihao, et al. Study on growth characteristics of the selected third generation of Pacific oysterwith rapid growth[J]. Marine Sciences, 2015, 39(3): 7-11.
[2] 刘志刚, 刘建勇, 王辉, 等. 墨西哥湾扇贝稚贝盐度适应性的研究[J]. 湛江海洋大学学报, 2006, 26(6): 12-16.
Liu Zhigang, Liu Jianyong, Wang Hui, et al. Study on adaptability of juveniles ofsay to salinity[J]. Journal of Zhanjiang Ocean University, 2006, 26(6): 12-16.
[3] Gribben P, Helson J, Jeffs A. Reproductive cycle of the New Zealand geoduck,, in two North Island populations[J]. The Veliger, 2004, 47(1): 53-65.
[4] Cantillanez M, Avendaño M, Thouzeau G, et al. Reproductive cycle of(Bivalvia: Pectinidae) in La Rinconada marine reserve (Antofagasta, Chile): response to environmental effects of El Niño and La Niña[J]. Aquaculture, 2005, 246(1): 181-195.
[5] Uddin M J, Park K I, Kang D H, et al. Comparative reproductive biology of Yezo scallop,, under two different culture systems on the east coast of Korea[J]. Aquaculture, 2007, 265(1): 139-147.
[6] Qiu T, Zhang T, Bai Y, et al. Gonad development of the pen shellfrom Shandong Province, China[J]. Journal of Shellfish Research, 2014, 33(2): 465-471.
[7] 梁玉波, 张福绥. 温度, 盐度对栉孔扇贝 () 胚胎和幼虫的影响[J]. 海洋与湖沼, 2008, 39(4): 334-340.
Liang Yubo, Zhang Fusui. Effects of temperature/salinity on development of embryos and larvae of scallop[J]. Oceanologia and Limnologia Sinica, 2008, 39(4): 334-340.
[8] 杨智鹏, 于红, 于瑞海, 等. 不同水温, 盐度和培育密度对脉红螺浮游幼虫生长存活的影响[J]. 中国海洋大学学报(自然科学版), 2015, 45(11): 15-19.
Yang Zhipeng, Yu Hong, Yu Ruihai, et al. Effects of temperature, salinity and stocking density on the growth and survival of Veined Rapa Whelk () pelagic larvae[J]. Periodical of Ocean University of China, 2015, 45(11): 15-19.
[9] 王如才, 王昭萍. 海水贝类养殖学[M]. 青岛: 中国海洋大学出版社, 2008: 137.
Wang Rucai, Wang Zhaoping. Science of marine shellfish culture[M]. Qingdao: Ocean University of China Press, 2008: 137.
[10] 刘海涛, 董占武, 徐志明. 盐度对大连湾牡蛎胚胎发育及幼虫生长的影响[J]. 水产学报, 1992, 16(1): 32-39.
Liu Haitao, Dong Zhanwu, Xu Zhiming. The effects of salinity on embryonic development and growth of veliger of oyster[J]. Journal of Fisheries of China, 1992, 16(1): 32-39.
[11] Giomi F, Mandaglio C, Ganmanee M, et al. The importance of thermal history: costs and benefits of heat exposure in a tropical, rocky shore oyster[J]. The Journal of Experimental Biology, 2016, 219(5): 686-694.
[12] 姚托, 王昭萍, 闫喜武, 等. 盐度对长牡蛎和近江牡蛎及其杂交稚贝生长和存活的影响[J]. 生态学报, 2015, 35(5): 1581-1586.
Yao To, Wang Zhaoping, Yan Xiwu, et al. Effects of salinity on growth an survival of,and juvenile hybrids[J]. Acta Ecologica Sinica, 2015, 35(5): 1581-1586.
[13] 顾晓英, 尤仲杰, 王一农. 几种环境因子对彩虹明樱蛤不同发育阶段的影响[J]. 东海海洋, 1998, 16(3): 40-47.
Gu Xiaoting, You Zhongjie, Wang Yinong. Some environmental factor,s effects on thein the different growth stages[J]. Donghai Marine Science, 1998, 16(3): 40-47.
[14] 尤仲杰, 徐善良, 边平江, 等. 海水温度和盐度对泥蚶幼虫和稚贝生长及存活的影响[J]. 海洋学报 (中文版), 2001, 23(6): 108-113. You Zhongjie, Xu Shanliang, Bian Pingjiang, et al. The effects of sea water temperature an salinity on the growth and survival oflarvae and juveniles[J]. Acta Oceanologica Sinica, 2001, 23(6): 108-113.
[15] 张跃环, 王昭萍, 闫喜武, 等. 香港巨牡蛎和长牡蛎幼虫及稚贝的表型性状[J]. 生态学报, 2012, 32(4): 1105-1114.
Zhang Yuehuan, Wang Zhaoping, Yan Xiwu, et al. Phenotypic traits of both larvae and juvenileand[J]. Acta Ecologica Sinica, 2012, 32(4): 1105-1114.
[16] Drent J. Temperature responses in larvae offrom a northerly and southerly population of the European distribution range[J]. Journal of Experimental Marine Biology and Ecology, 2002, 275(2): 117-129.
[17] Gruffydd L D, Beaumont A. A method for rearing Pecten maximus larvae in the laboratory[J]. Marine Biology, 1972, 15(4): 350-355.
[18] Velasco L A, Barros J. Experimental larval culture of the Caribbean scallops Argopecten nucleus and Nodipecten nodosus[J]. Aquaculture Research, 2008, 39(6): 603-618.
Effect of temperature and salinity on embryonic development, growth, survival, and setting of the Pacific oyster “Haida No.1” larvae
MENG Qian, LI Qi, ZHANG Jing-xiao
(The Key Laboratory of Mariculture Ministry of Education, Ocean University of China, Qingdao 266003, China)
This study examined the effect of temperature/salinity on embryos and larvae to verify the favorable and optimal temperature and salinity for the Pacific oyster “Haida No.1.” The highest hatchability of fertilized eggs was 90% under the salinity 30–35. The salinity ranges 20–35, 20–35, and 20–35 were suitable and 20–30, 20–25, and 25–30 were optimal for the growth, survival, and setting of larvae, respectively. The temperature ranges 20–30°C, 20–25°C, and 20–30°C were suitable and the temperatures 30, 25, and 30°C were optimal for the growth, survival, and setting of larvae, respectively. When the temperature reached 35°C, all larvae were dead. The results obtained in this study will contribute to the improvement of the efficiency of mass aquaculture of the Pacific oyster “Haida No.1” larvae.
; temperature; salinity; embryos; larvae; “Haida No.1”
(本文编辑: 梁德海)
[The specialized research fund for the doctoral program of higher education project, No. 20130132110009]
Feb. 26, 2017
孟乾(1992-), 男, 山东济南人, 硕士研究生, 主要研究方向为贝类遗传育种学, E-mail: 1508574120@qq.com; 李琪,通信作者, 教授, 主要研究方向为贝类遗传育种学, E-mail: qili66@ouc.edu.cn
S968.3
A
1000-3096(2017)12-0032-06
10.11759/hykx20170524004
2017-02-26;
2017-05-20
高等学校博士学科点专项科研基金资助项目(20130132110009)
