夏季黄海海水碳酸盐体系特征
2017-05-04RichardBellerby
朱 栾, Richard Bellerby, 2
夏季黄海海水碳酸盐体系特征
朱 栾1, Richard Bellerby1, 2
(1. 华东师范大学 河口海岸学国家重点实验室, 上海 200062; 2. 挪威水资源研究所, 挪威卑尔根 N-5006)
根据2016年7月对黄海海域碳酸盐体系参数pH和总碱度(T)开展的调查, 结合温度、盐度、营养盐及叶绿素等同步观测数据, 分析了夏季黄海海水碳酸盐体系的特征并讨论了其控制机制。结果表明, 碳酸盐体系特征在不同水团间差异很大。表层与底层pH分别在7.915~8.307和7.849~8.074之间, 高值位于长江冲淡水和黄海沿岸流中。表层与底层T分别为2063~2358 μmol/kg和2205~2372 μmol/kg,总体表现为由南往北递增。长江冲淡水T较低, 黄海沿岸流T较高。海水总溶解无机碳(T)在黄海北部山东半岛附近含量较高, 底层明显高于表层。表层海水二氧化碳分压(CO2)与表层T变化趋势相似。霰石饱和度(Ar)在底层较低, 最低值仅为1.28。Pearson相关分析结果显示, 水团中T与盐度的相关性较大(>0.7), pH与营养盐的相关性较大。说明碳酸盐体系特征主要受水团混合和生物活动的影响。水团混合是影响T分布的主导因素。表层营养盐浓度过低导致浮游植物生长受限, 受限区域pH变化不大, 底层再矿化过程释放大量CO2导致底层pH降低。
黄海; 碳酸盐体系; 水团; 影响因素; 生物活动
陆架边缘海初级生产力占全球总初级生产力的18%~33%, 在全球碳循环中起着重要作用[1]。受陆源有机质高分解速率和近岸高CO2水体水平输送的影响, 陆架边缘海通常表现为大气CO2的源区[2, 3]。然而, 近年来人类活动导致近岸水体营养盐浓度增加, 加强了海洋生物泵强度, 促进了海水对大气CO2的吸收[4], 使陆架边缘海碳源汇机制发生变化, 影响海水碳酸盐体系平衡。海水碳酸盐体系是控制海水中多种化学平衡的重要体系, 其变化将改变海水化学环境, 影响海洋生态系统的健康[5], 威胁海洋生物尤其是钙化生物的生存[6]。由于近岸海域水动力条件复杂且观测点覆盖范围有限, 目前对陆架边缘海碳酸盐体系的研究仍面临许多挑战[7]。中国陆架边缘海碳酸盐体系的研究主要集中在东海, 研究已逐渐深入到大尺度时空监测及海水酸化趋势预测。已有的成果表明, 东海碳酸盐体系的变化在受河流径流与上升流影响的区域最为明显[8-10]。在东海大陆坡, 海水pH以每年0.001 6的速度降低, 其中表观耗氧量增加对pH降低的贡献高达51%[11], 说明该海域水体正在逐渐酸化, 且酸化程度受生物活动影响显著。
黄海是我国典型的陆架边缘海, 衔接东海和渤海, 海洋资源丰富, 研究黄海海水碳酸盐体系的特征对该海域海洋环境的保护与渔业资源的发展有重要意义。目前对黄海海水碳酸盐体系的研究相对较少。Qu等[12]对南黄海夏季表层海水CO2进行了观测, 发现其具有明显的空间变化, 且该变化受长江径流的影响较大。Zhai等[13]通过分析北黄海底层海水碳酸盐体系的季节变化, 发现其从春季CO2不饱和状态转变为秋季过饱和状态, 并认为该变化与底层水体的需氧再矿化作用有关。然而, 已有的研究大多集中于某一水层或小范围海域, 对黄海碳酸盐体系缺少整体观测。鉴于此, 本研究依据海上现场调查数据, 对黄海海域不同水层及不同水团的碳酸盐体系特征进行整体分析, 并探究水团混合行为及生物活动等过程对黄海海水碳酸盐体系的控制机制。
1 材料与方法
1.1 研究区域概况及站位布设
黄海是中国北部典型的半封闭浅海, 海陆相互作用强烈, 平均水深44 m, 有长江、淮河、鸭绿江等多条河流汇入。黄海由山东半岛成山角与朝鲜半岛长山串之间的连线分为北黄海与南黄海。南黄海与东海相连, 水体交换比北黄海更为充分。受东亚季风影响, 该海域水团活动强烈, 受来自东海的黑潮(KC)、台湾暖流(TWC)、对马暖流(TWW), 及长江冲淡水(CDW)、黄海沿岸流(YSCoW)、朝鲜沿岸流(WKCoW)和渤海沿岸流(BSCoW)等的综合作用(图1)。夏季, 黄海海水层化, 底层为稳定冷水团, 西侧沿岸流南下, 长江冲淡水往西北方向扩展, 形成围绕黄海海盆的逆时针环流。
站位布设如图1所示。本研究依托国家基金委渤黄海夏季共享航次, 随“东方红二号”科考船, 对黄海海域开展调查。航次历时13 d, 自2016年6月29日—7月11日, 调查范围为121°~124°E, 32°~39°N, 共73个站位, 各站位3~4层水。通过航次期间现场原位测量, 样品收集、过滤, 以及实验室样品测定, 获得了此次研究所需的碳酸盐体系参数pH、总碱度(T)与辅助环境参数的数据集。
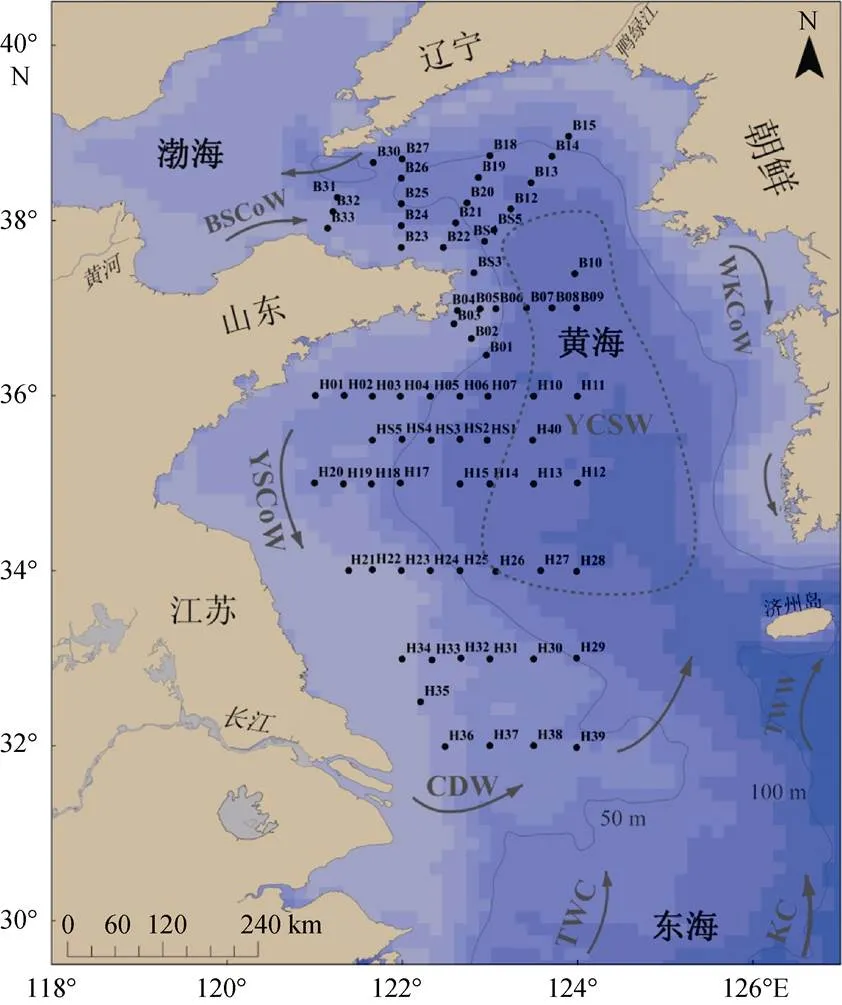
图1 研究区域水团分布图与站位布设图
字母缩写分别代表: 黑潮(KC)、台湾暖流(TWC)、对马暖流(TWW)、朝鲜沿岸流(WKCoW)、黄海冷水团(YSCW)、渤海沿岸流(BSCoW)、黄海沿岸流(YSCoW)、长江冲淡水(CDW)
Currents in Fig. 1 are: the Kuroshio Current (KC), the Taiwan Warm Current (TWC), the Tsushima Warm Water (TWW), the Western Korea Coastal Water (WKCoW), the Yellow Sea Cold Water (YSCW), theBohai Sea Coastal Water (BSCoW), the Yellow Sea Coastal Water (YSCoW), and the Changjiang Diluted Water (CDW)
1.2 样品采集与测定方法
利用船载CTD的Niskin莲座型采水器, 依照先pH、T, 后营养盐、叶绿素的顺序现场采集水样。pH与T的采样和分析方法严格按照Dickson等[14]提出的标准操作程序。pH(总氢离子浓度标度)样品用500mL高质量硼硅酸盐玻璃瓶采集, 采样结束后返回船载实验室进行测定, 近岸及底层浑浊样品需静置2 h。pH测定采用分光光度法, 使用仪器为挪威水资源研究所(NIVA)的pH自动进样仪(AFtes), 仪器精度为pH 0.0005, 测量结果不确定度小于pH0.003。该仪器通过测量样品背景吸光度及多次加入指示剂分别去除了浊度及指示剂添加对测样结果的影响, 具体原理及步骤参照Reggiani等[15]。T样品用250mL高密度聚乙烯(HDPE)瓶采集[16], 加入100 μL饱和HgCl2溶液后于25℃环境中保存。T测定采用格兰电位滴定法, 使用仪器为美国AS-ALK1+碱度滴定仪, 该仪器配备高精度pH计和Orion®8102BN Ross电极。测量结果使用美国Scripps研究所提供的标准物质(CRM; Batch 151)进行校准, 精度控制在±2 μmol/kg。
温度()和盐度()剖面数据由船载CTD的SBE911+剖面仪获得。营养盐水样用0.4 5μm醋酸纤维膜过滤后置于250 mLHDPE瓶中, 保存于–20℃环境下[17-18]。样品中的硝酸盐(NO3–-N)、磷酸盐(PO43–-P)与硅酸盐(SiO32–-Si)采用荷兰SKALAR Sanplus分段流分析仪进行测定, 测量精度高于0.03%[19]。叶绿素(Chl)样品使用0. 7 μmWhatman GF/F玻璃纤维膜对200~2 000 mL水样进行低压抽滤, 完成后取滤膜迅速对折并用铝箔包好置于2 mL冻存管中, 于液氮中保存。Chl使用日本Shimadzu LC-20A高效液相色谱仪(HPLC)测定, 该色谱仪配备Eclipse XDB C8色谱柱, 测量方法参照Zapata等[20]。
1.3 碳酸盐体系参数计算
根据测定温度下得到的pH和T数据, 使用CO2SYS.XLS 程序(版本16)[21]计算原位温度下的海水碳酸盐体系参数, 包括pH、T、总溶解无机碳(T)、表层海水二氧化碳分压(CO2)和霰石饱和度(Ar)。计算时将各采样点原位温度、盐度、磷酸盐及硅酸盐浓度作为参数输入。碳酸、硼酸及HSO4−离子的电离常数分别根据Lueker等[22]、Lee等[23]及Dickson[24]的方法得到。
2 结果与分析
2.1 水团划分
根据调查区域海水-特征, 参照Chen[25]提出的黄海水团分类与命名方法, 将研究区域的水团分为四类: (1)长江冲淡水(CDW), (2)黄海沿岸流(YSCoW), (3)黄海表层暖水(YSWW)及(4)黄海冷水团(YSCW)。各水团的-特征如图2所示, 温度与盐度的变化范围及均值列于表1中。根据图3c、3d和图4c、4d显示的平面特征, 水团空间分布与图1所示的黄海夏季环流情况基本一致。长江冲淡水以盐度32为分界线[26], 位于研究区域的东南角, 主要占据深度小于50 m的海域。黄海沿岸流盐度低于31, 位于研究区域西侧35°N 附近, 影响范围最小。黄海冷水团最低温度为5.97℃, 占据中部及北部底层大面积区域, 两个低温中心分别位于南黄海中部盆地及北黄海。黄海表层暖水位于黄海冷水团上部, 与冷水团的平均盐度差仅为0.4。值得注意的是, 本文中的黄海表层暖水不同于冬季由对马暖流分支嵌入黄海形成的暖流[27], 而是为了区别于底层冷水团, 将上层高温高盐水体归为黄海表层暖水, 其本质上源于台湾暖流与近岸水体的混合[28]。
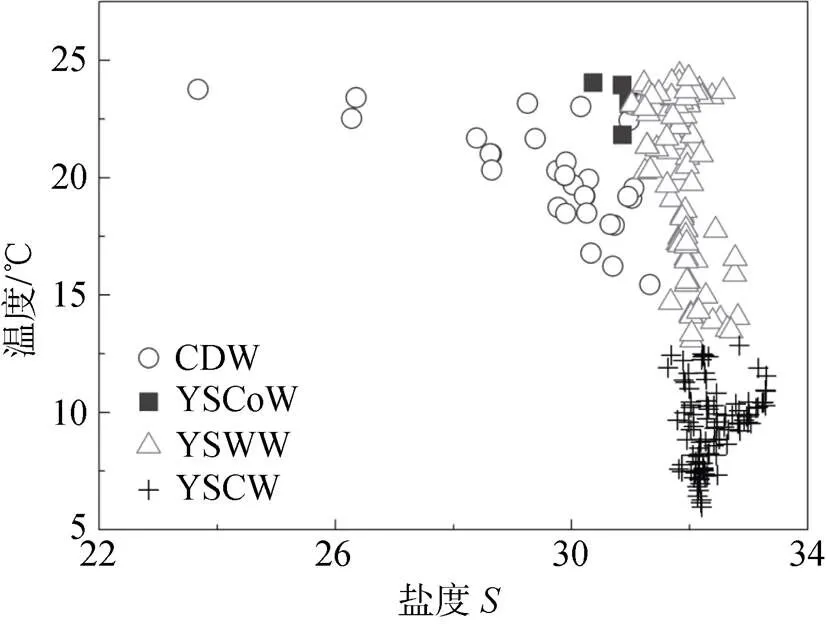
图2 研究区域水团T-S图
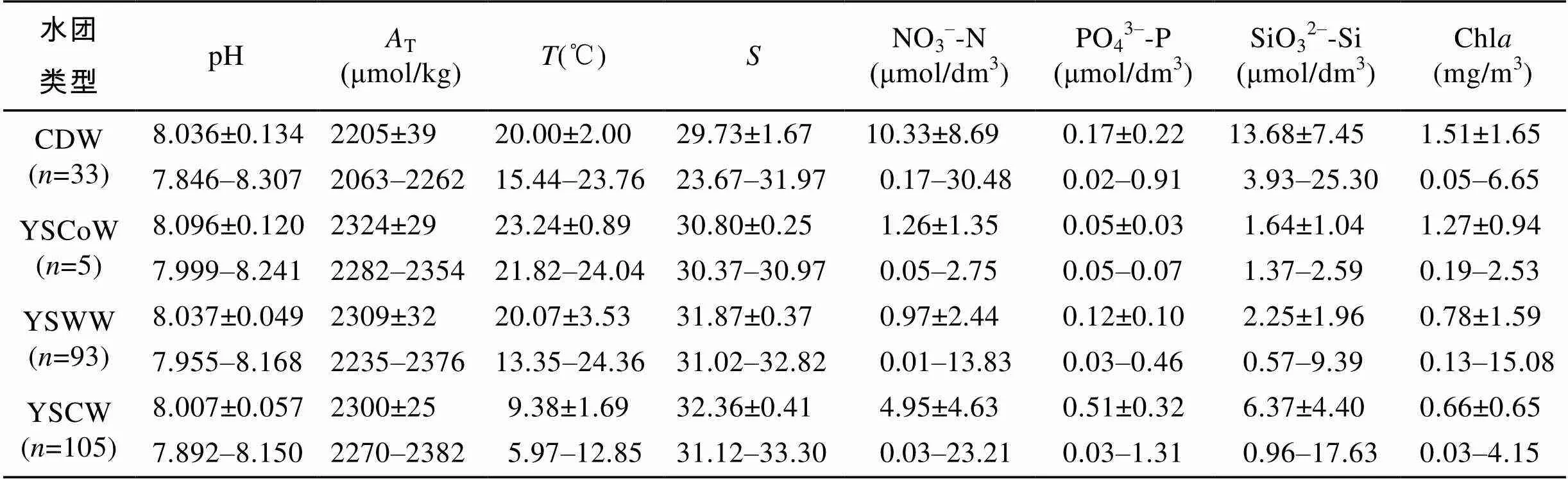
表1 各水团碳酸盐体系参数与其他水文、化学参数的均值及变化范围
注: 表中表示各水团中采样点数量
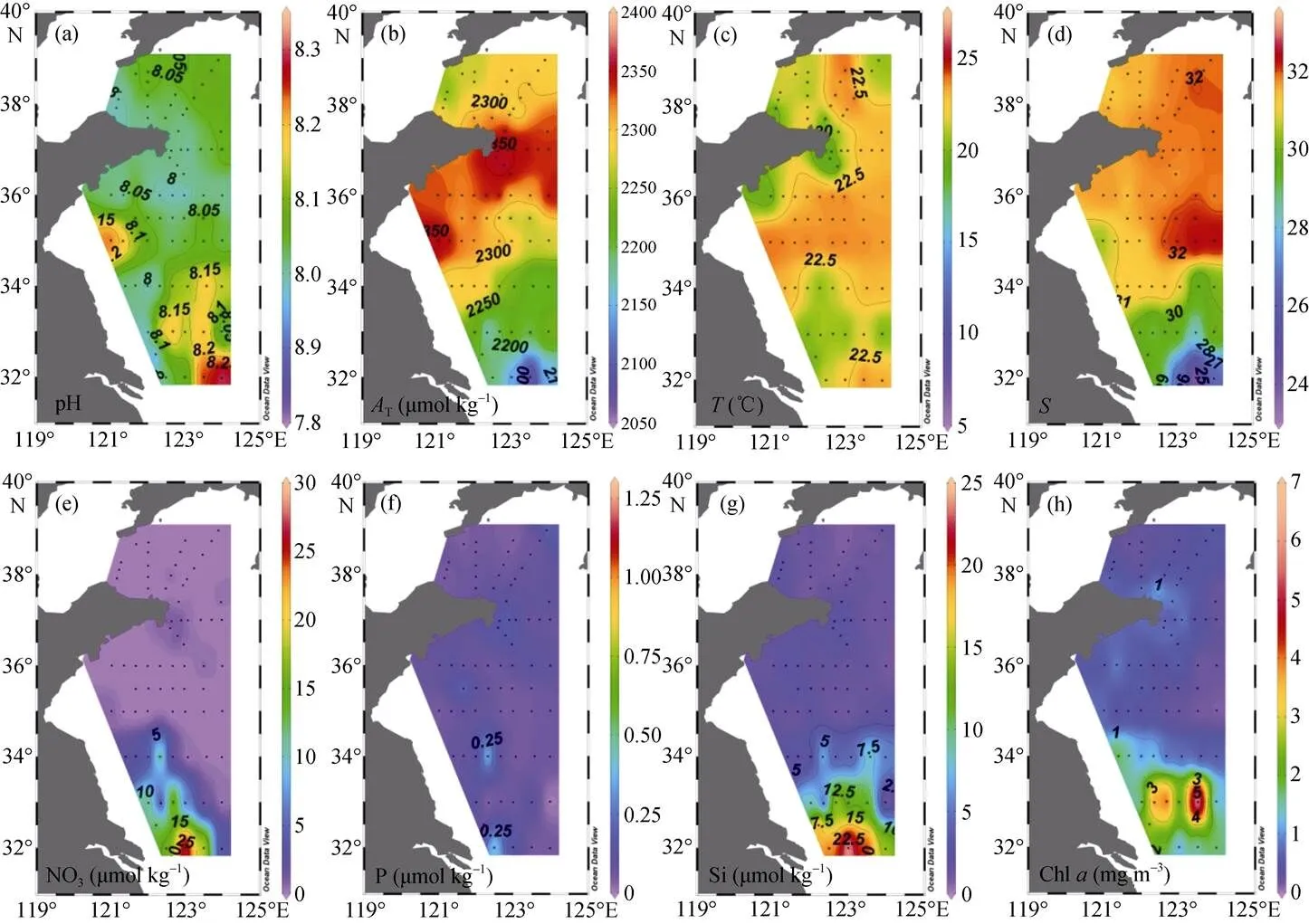
图3 黄海表层(a)pH、(b)AT、(c)T、(d)S、(e)NO3–-N、(f)PO43–-P、(g)SiO32–-Si和(h)Chla的分布
2.2 碳酸盐体系参数与其他实测参数分布特征
研究区域各水团pH与T变化区间如表1所示, 水平分布特征如图3a、3b、4a、4b所示。表层pH在7.915~8.307, 两个高值区均位于南黄海, 最高值在[124°E, 32°N]处盐度为26.35的长江冲淡水中。底层pH明显低于表层, 在7.849~8.074, 空间差异不大。表层T在2063~2358 μmol/kg, 黄海西部与北部较高, 大体上呈现由南往北递增的趋势。底层T在2205~ 2372 μmol/kg, 变化趋势与表层相似。CO2SYS.XLS 程序计算结果显示, 表、底层T变化范围分别为1 766~2 163 μmol/kg和1 995~ 2 233 μmol/kg, 黄海北部尤其是山东半岛附近T较高。表层海水CO2在194~566 μatm, 平均值为407 μatm±74μatm, 分布趋势与表层T分布趋势近似。Ar变化范围为1.28~ 4.44, 底层水体Ar较低。两个低值中心分别位于黄海中部盆地 [123°E, 35°N] (Ar=1.39)及北黄海西部低洼[123°E, 38°N](Ar=1.28)。Zhai等[13]认为该值(Ar<1.5)可能低于本地贝类生长所需的理想环境Ar值。
调查期间, 黄海中部及北部出现明显海水层化。温跃层位于水下约15 m处, 近岸表层出现冷水斑块, 底层水温由近岸往离岸方向递减。表层盐度略低于底层, 变化趋势相似, [122.66°E~123°E, 35°N]处底部观察到明显上升流。营养盐表、底层差异明显。长江冲淡水硝酸盐和硅酸盐含量最高(分别为30.48 μmol/dm3和25.30 μmol/dm3), 其影响范围北至34°N附近。黄海中部表层海水营养盐含量极低。底层盆地营养盐聚集, 硝酸盐、磷酸盐与硅酸盐的浓度分别高达23.21 μmol/dm3、1.31 μmol/dm3和 17.63 μmol/dm3。叶绿素在受长江冲淡水影响的海域浓度较高, 最高值15.1 mg/m3位于长江冲淡水与黄海表层暖水交汇区域。
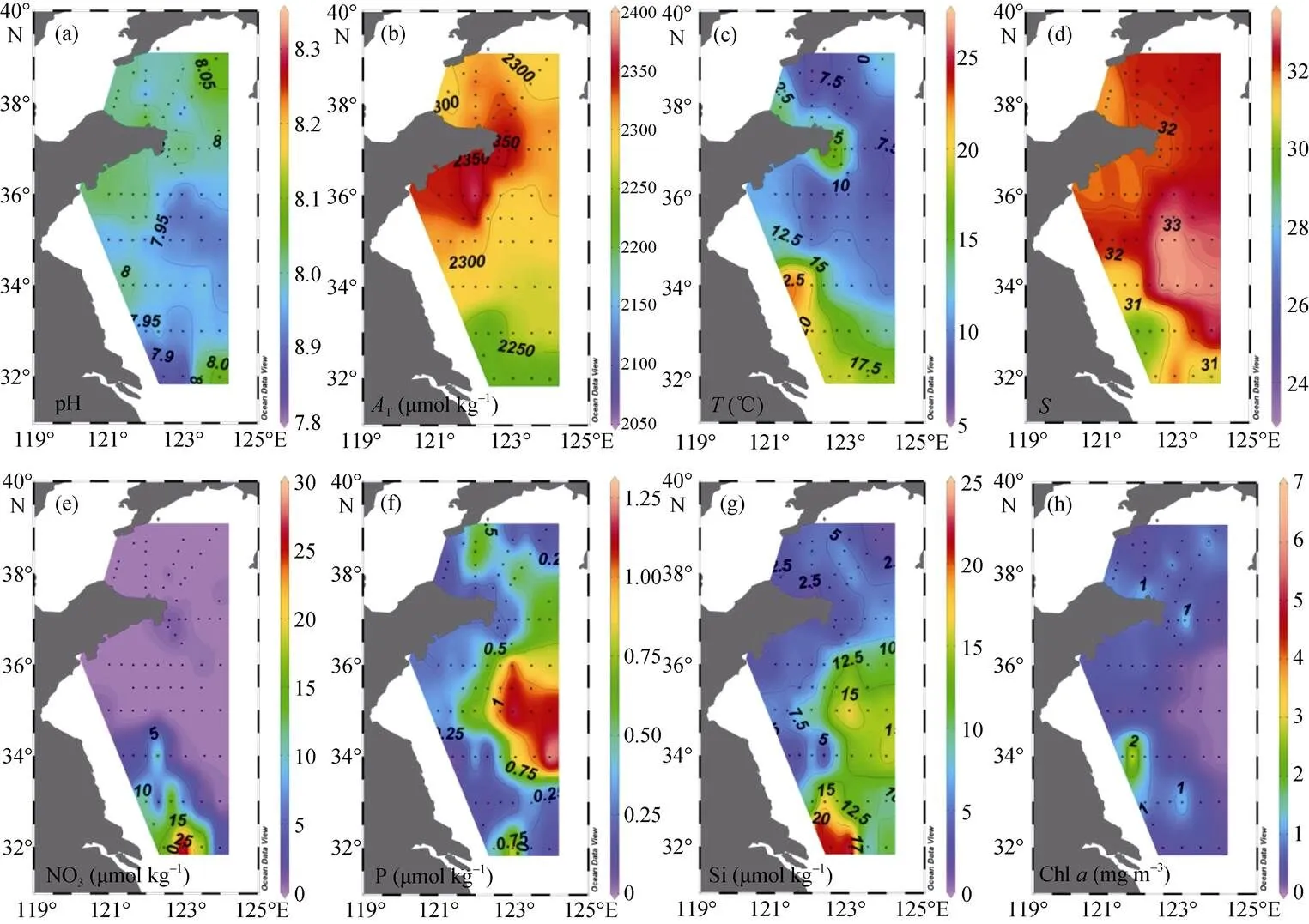
图4 黄海底层(a)pH、(b)AT、(c)T、(d)S、(e)NO3–-N、(f)PO43–-P、(g)SiO32–-Si和(h)Chla的分布
3 讨论
2.2结果显示, 研究区域海水碳酸盐体系空间变化复杂, 不同水团差别很大。为研究其控制因素, 使用Pearson相关分析法计算各水团碳酸盐体系参数(pH、T)与环境参数(、、NO3–-N、PO43–-P、SiO32–-Si、Chl)之间的相关性, 并检测其显著性,<0.05表示显著,<0.01表示极显著。结果显示(表2), pH、T与盐度、营养盐的相关性最高, 说明水团混合和生物活动对碳酸盐体系有主导作用。本文分别讨论水团运动与生物活动对碳酸盐体系的影响。
3.1 水团混合行为及其影响
T原则上是保守型参数[29], 在陆架边缘海主要受到河流冲淡水的影响。研究T与盐度的关系可以用于追踪水团并显示水团的混合行为[30]。当海洋观测中只能获取水文参数时, 该关系还可用于碳酸盐体系参数预测[31]。结果显示(表2), 除黄海表层暖水外, 其他水团的T与盐度有较强相关性。T-特征及回归直线如图5所示。长江冲淡水的T-线性关系为:
TCDW= 21.399+ 1571.0 (=0.874,=33) (1)
该公式截距与前人观测到的长江径流T结果(1 582~1 743 μmol/kg)[32]近似, 说明长江冲淡水主体来源于长江径流。在夏季, 受风场变化及台湾暖流、浙闽沿岸流驱使, 长江冲淡水转向北上[26]。台湾暖流表层T为2 300~2 310 μmol/kg(=35)[33], 与公式(1)外推结果(T≈2 320 μmol/kg,=35)相近, 根据端元混合原理, 该冲淡水北上的过程中与台湾暖流发生混合, 使其表现为河流径流与外海水体的混合水团。本研究中长江冲淡水盐度最高值31.97 出现在[123°E, 32°N]深度36.20 m处, 正是与北向移动的高盐度台湾暖流混合后的结果[34]。长江冲淡水往西北方向扩展时遇到黄海沿岸流南下。黄海沿岸流的T-呈负相关, 其线性关系为:
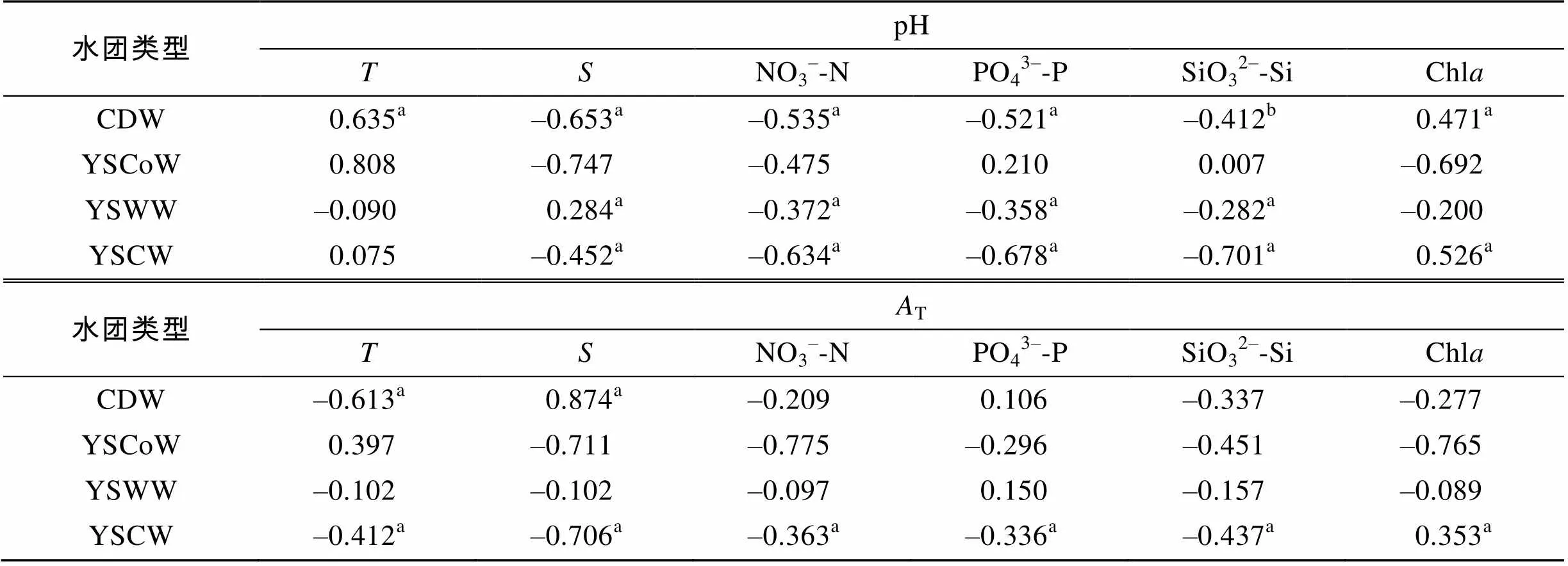
表2 碳酸盐体系参数(pH、AT)与环境参数之间的相关系数
注: 表中相关系数的上标a和b分别表示相关性极显著(<0.01)和相关性显著(<0.05)。
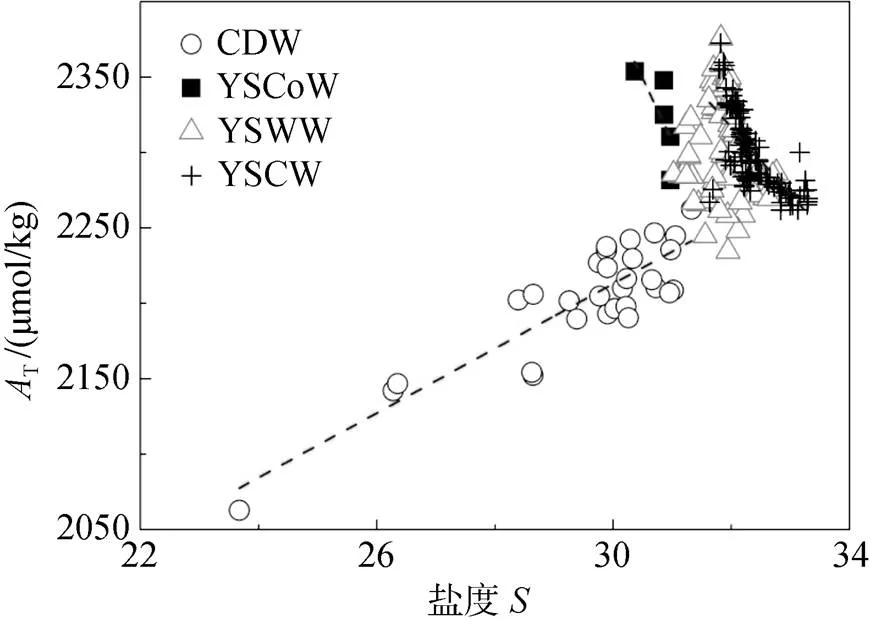
图5 研究区域各水团AT-S图及回归直线
TYSCoW= –82.772+ 4873.5 (=0.711,=5) (2)
长江冲淡水与黄海沿岸流的回归直线在=31.70,T=2 249 μmol/kg处相交, 该盐度值普遍高于两个水团实际盐度值, 表明这两种水团的混合过程有高盐度水体参与(即黄海表层暖水)。黄海表层暖水的T-相关性不显著, 推测是因为其本质上是来源复杂的混合水团。黄海冷水团T-的线性关系为:
TYSCW= –44.381+ 3 737.0 (=0.706,=105) (3)
在开阔大洋, 高盐度水体通常对应高T值[30]。但是本研究中黄海沿岸流的T值高于盐度最高的黄海冷水团(>33)(表1)。根据Chen[25]的研究, 黄海沿岸流本质上是由渤海沿岸流沿山东半岛南下, 混合近岸水体形成的。因此推测该水团T值较高的原因是其具备了渤海沿岸流的部分性质。而渤海沿岸流由于混合了T值在1 470~6 300 μmol/kg的多条河流径流而具有较高T[13]。这一结论与图3b、4b显示的分布趋势一致, 说明渤海水体可能是黄海北部高T值的来源。在4个水团的T-关系中, 仅有长江冲淡水表现为显著正相关, 说明研究区域复杂的水团混合及生物化学过程改变了T-的线性关系。
3.2 生物活动的影响
生物过程如光合作用、呼吸作用、钙化作用等通过消耗和释放CO2对海水碳酸盐体系产生显著影响[35]。Chl是判断浮游植物生物量的重要指标。然而根据表2的结果, 碳酸盐体系参数与Chl之间并无直接线性关系。原因可能是水体中浮游动物对浮游植物尤其是微型藻的摄食作用[12, 36]。但在一些特殊区域, 如研究区域南部, 碳酸盐体系参数分布与Chl之间有很好的耦合关系。调查期间, 在[123~124°E, 33°N]断面H30站位11.8 m检测到最大Chl值15.08 mg/m3,说明该处发生严重赤潮(Chl>10 mg/m3)[37-39]。赤潮位置与该站位表层水的高pH (8.203)对应, 证明赤潮导致了局部海水pH升高。在黄海海域, 藻类赤潮一般发生于春季, 于6月逐渐消失。图4a显示, 在[123°E, 35°N]H14站位, pH高值出现在表层水中, 而Chl最高值(1.15 mg/m3)位于该站位水深35 m处, 说明早期爆发的藻类在逐渐下沉, 且对水体pH存在后续影响。
黄海冷水团pH与营养盐呈明显负相关。这是由于表层藻类生长形成的有机颗粒沉降到底部后, 在底部微生物作用下进行再矿化, 有机化合物重新转化为无机化合物, 消耗水中溶解氧的同时释放大量CO2。该再矿化过程可以由Redfield方程粗略表示[40]:
(CH2O)106(NH3)16H3PO4+ 138O2→106CO2+16HNO3+H3PO4+122H2O(4)
这也是黄海底部营养盐自春季开始再生[25], 并在中部低洼聚集的原因(图4)。大量CO2的释放导致底层pH降低,T增加。这一结论与Zhai等[13]对北黄海底部pH月变化的观测结果一致。在上升流出现的区域, 该现象会更为明显。调查期间, 在[122.66~123°E, 35°N]处观察到明显上升流, 底部CO2随上升流往上, 导致断面中部T及营养盐浓度明显升高。
作为浮游植物生源要素, 营养盐还通过改变光合作用强弱影响表层pH。春季浮游植物生长消耗表层大量营养盐。由于夏季黄海海水层化明显, 而长江径流带来的营养盐不能补给黄海中部[41], 因此无法维持其继续大量生长。再加上研究区域本身为氮过量状态, 磷酸盐限制非常明显[39](调查区域磷酸盐最高值仅为1.31 µmol/dm3), 所以浮游植物生长受限, 表层低叶绿素含量证实了这一点(图3h)。因此表层pH除长江冲淡水和黄海沿岸流两个高值区外其他区域变化不大(图3a)。长江口外是典型的富营养化海区, 初级生产力强[42], 因而常出现pH高值[12, 32]。
其他因素如降水、台风、悬浮泥沙、人类活动等也会对海水碳酸盐体系造成影响。如采样期间(7月1日)在黄海海域出现小范围降雨, 可能导致表层海水pH和T降低。超强台风尼伯特(Nepartak)在7月8—11日期间影响南黄海海域(http: //news.sdchina. com/show/3840870.html), 加强了海水垂向交换, 引发上升流。另外, 海水中沉积物含量过高会影响浮游植物生长。如图3a[122°E, 32.5°N]处的pH低值可能是由于河口区泥沙再悬浮导致浮游植物生长受到光限制[39]。
4 结论
夏季黄海海水碳酸盐体系空间差异很大, 分布特征受该海域水团性质的影响。表层pH在7.915~ 8.307之间, 高值位于长江冲淡水和黄海沿岸流中。底层pH低于表层, 在7.849~8.074之间, 水平分布差异不大。表、底层海水T值分别为2 063~2 358 μmol/kg和2 205~2 372 μmol/kg。表层与底层变化趋势一致, 总体表现为由南往北逐渐递增。长江冲淡水T较低, 黄海沿岸流T较高。表层海水CO2与T变化趋势相似, 黄海北部山东半岛附近数值最高。北黄海西部低洼处Ar最低值仅为1.28, 该值可能低于贝类生物正常生长所需环境Ar值。
不同水团中碳酸盐体系参数与环境参数的相关性差异很大。总体而言, 碳酸盐体系参数与盐度、营养盐的关系最为密切。T受水团混合影响较大, 在长江冲淡水、黄海沿岸流与黄海冷水团中与盐度的相关性(>0.7)大于与营养盐的相关性。黄海西北部海水高T值的来源可能是渤海沿岸流。pH与生物活动密切相关。表层营养盐浓度过低使浮游植物生长受限, 受限区域pH变化较小。底层pH较低是由于再矿化作用释放大量CO2导致。其他因素如上升流、降雨、悬浮泥沙等都会对海水碳酸盐体系产生短期局部影响。
[1] Bauer J E, Cai W J, Raymond P A, et alThe changing carbon cycle of the coastal ocean[J]. Nature, 2013, 504(7478): 61-70.
[2] Huang W J, Cai, W J, Castelao R M, et alEffects of a wind-driven cross-shelf large river plume on biological production and CO2uptake on the Gulf of Mexico during spring[J]. Limnology and Oceanography, 2013, 58(5): 1727-1735.
[3] Walsh J J, Premuzic E T, Gaffney J S, et alOrganic storage of CO2on the continental slope off the mid-Atlantic bight, the southeastern Bering Sea, and the Peru coast[J].Deep Sea Research Part A, Oceanographic Research Papers, 1985, 32(7): 853-883.
[4] Chen C T A, Huang T H, Chen Y C, et al. Air-sea exchanges of CO2in the world’s coastal seas[J]. Biogeosciences, 2013, 10(10): 6509-6544.
[5] 贺仕昌, 张远辉, 陈立奇, 等. 海洋酸化研究进展[J]. 海洋科学, 2014, 38(6): 85-93.
He Shichang, Zhang Yuanhui, Chen Liqi, et al. Advances in Studies of Ocean Acidification[J]. Marine Sciences, 2014, 38(6): 85-93.
[6] 董冰冰, 黄荣莲, 王庆恒, 等. 海洋酸化对马氏珠母贝珍珠层形成的影响[J]. 海洋科学, 2015, 39(8): 39-46.
Dong Bingbing, Huang Ronglian, Wang Qingheng, et al. Effects of ocean acidification on nacre formation and expressionof related genes in[J]. Marine Sciences, 2015, 39(8): 39-46.
[7] Shim J, Kim D , Kang Y C, et alSeasonal variations inCO2and its controlling factors in surface seawater of the northern East China Sea[J]. Continental Shelf Research, 2007, 27(20): 2623-2636.
[8] Zhai W D, Dai M H, Guo X. Carbonate system and CO2degassing fluxes in the inner estuary of Changjiang (Yangtze) River, China[J]. Marine Chemistry, 2007, 107(3): 342-356.
[9] Zhai W D, Dai M H. On the seasonal variation of air-sea CO2fluxes in the outer Changjiang (Yangtze River) Estuary, East China Sea[J].Marine Chemistry, 2009, 117(1-4): 2-10.
[10] Lui H K, Chen C T A, Lee J, et al.Acidifying intermediate water accelerates the acidification of seawater on shelves: An example of the East China Sea[J]. Continental Shelf Research, 2015, 111: 223-233.
[11] Qu B, Song J, Yuan H, et al. Summer carbonate chemistry dynamics in the Southern Yellow Sea and the East China Sea: Regional variations and controls[J]. Continental Shelf Research, 2015, 111: 250-261.
[12] Zhai W D, Zheng N, Huo C, et al. Subsurface pH and carbonate saturation state of aragonite on the Chinese side of the North Yellow Sea: Seasonal variations and controls[J]. Biogeosciences, 2014, 11(4): 1103-1123.
[13] Dickson A G, Sabine C L, Christian J R. Guide to best practices for ocean CO2measurements[M]. PICES Special Publication 3. British Columbia: North Pacific Marine Science Organization, 2007.
[14] Reggiani E R, King A L, Norli M, et al. FerryBox-assisted monitoring of mixed layer pH in the Norwegian Coastal Current[J]. Journal of Marine Systems, 2016, 162: 29-36.
[15] Huang W J, Wang Y, Cai W J. Assessment of sample storage techniques for total alkalinity and dissolved inorganic carbon in seawater[J]. Limnology and Oceanography Methods, 2012, 10(9): 711-717.
[16] Clementson L A, Wayte S E. The effect of frozen storage of open-ocean seawater samples on the concentration of dissolved phosphate and nitrate[J]. Water Research, 1992, 26(9): 1171-1176.
[17] Zhang J, Chen S Z, Yu Z G, et al. Factors influencing changes in rainwater composition from urban versus remote regions of the Yellow Sea[J]. Journal of Geophysical Research, 1999, 104(D1): 1631-1644.
[18] Zhang G, Zhang J, Liu S. Characterization of nutrients in the atmospheric wet and dry deposition observed at the two monitoring sites over Yellow Sea and East China Sea[J]. Journal of Atmospheric Chemistry, 2007, 57(1): 41-57.
[19] Zapata M, Rodriguez F, Garrido J L. Separation of chlorophylls and carotenoids from marine phytoplankton: a new HPLC method using a reversed phase C8 column and pyridine-containing mobile phases[J]. Marine Ecology Progress, 2000, 195(3): 29-45.
[20] Pelletier G J, Lewis E, Wallace D W R. CO2SYS.XLS: A Calculator for the CO2System in Seawater for Microsoft Excel/VBA, Version 16[CP/DK].Washington, Olympia: Washington State Department of Ecology, 2011.
[21] Lueker T J, Dickson A G, Keeling C D. OceanCO2calculated from dissolved inorganic carbon, alkalinity, and equations for K1 and K2: Validation based on laboratory measurements of CO2in gas and seawater at equilibrium[J]. Marine Chemistry, 2000, 70(1): 105-119.
[22] Lee K, Kim T W, Byrne R H, et al.The universal ratio of boron to chlorinity for the North Pacific and North Atlantic oceans[J]. Geochimica Et Cosmochimica Acta, 2010, 74(6): 1801-1811.
[23] Dickson A G. Standard potential of the reaction: AgCl(s) +12H2(g) = Ag(s) + HCl(aq), and and the standard acidity constant of the ion HSO4−in synthetic sea water from 273.15 to 318.15 K[J]. The Journal of Chemical Thermodynamics, 1990, 22(2): 113-127.
[24] Chen C T A. Chemical and physical fronts in the Bohai, Yellow and East China seas[J]. Journal of Marine Systems, 2009, 78(3): 394-410.
[25] Chang P H, Isobe A, Kang K R, et al.Summer behavior of the Changjiang diluted water to the East/Japan Sea: A modeling study in 2003[J]. Continental Shelf Research, 2014, 81(3): 7-18.
[26] 胡放, 于非, 王建丰, 等.黄海暖流源区附近温盐结构及其季节变化[J].海洋科学, 2016, 40(7): 160-169.
Hu Fang, Yu Fei, Wang Jianfeng, et al.Thermohaline structure and seasonal variation near the Yellow Sea Warm Current source region[J]. Marine Sciences, 2016, 40(7): 160-169.
[27] Lie H J, Cho C H, Lee J H, et al. Does the Yellow Sea Warm Current really exist as a persistent mean flow?[J]. Journal of Geophysical Research Oceans, 2001, 106(C10): 22199-22210.
[28] Bates N R, Michaels A F, Knap A H. Alkalinity changes in the Sargasso Sea: geochemical evidence of calcification?[J]. Marine Chemistry, 1996, 51(4): 347-358.
[29] Cross J N, Mathis J T, Bates N R, et al. Conservative and non-conservative variations of total alkalinity on the southeastern Bering Sea shelf[J]. Marine Chemistry, 2013, 154(5): 100-112.
[30] Land P E, Shutler J D, Findlay H, et alSalinity from space unlocks satellite-based assessment of ocean acidification.[J]. Environmental Science and Technology, 2015, 49(4): 1987-1994.
[31] Chou W C, Gong G C, Sheu D D, et al. Surface distributions of carbon chemistry parameters in the East China Sea in summer 2007[J]. Journal of Geophysical Research, 2009, 114(C7): 1748-1755.
[32] 吴晓丹, 宋金明, 李学刚. 长江口邻近海域水团特征与影响范围的季节变化[J]. 海洋科学, 2014, 38(12): 110-119.
Wu Xiaodan, Song Jinming, Li Xuegang. Seasonal variation of water mass characteristic and influence area in the Yangtze Estuary and its adjacent waters[J]. Marine Sciences, 2014, 38(12): 110-119.
[33] Chen C T A, Wang S L. Carbon, alkalinity and nutrient budgets on the East China Sea continental shelf[J]. Journal of Geophysical Research Oceans, 1999, 104(C9): 20675-20686.
[34] Zeebe R, Wolf-Gladrow D. CO2in Seawater: Equilibrium, Kinetics, Isotopes[M]. Amsterdam: Elsevier, 2001: 340.
[35] Fu M, Wang Z, Li Y, et al. Phytoplankton biomass size structure and its regulation in the Southern Yellow Sea (China): Seasonal variability[J]. Continental Shelf Research, 2009, 29(18): 2178-2194.
[36] Reinart A, Kutser T. Comparison of different satellite sensors in detecting cyanobacterial bloom events in the Baltic Sea[J]. Remote Sensing of Environment, 2006, 102(1): 74-85.
[37] Zhai W D, Chen J F, Jin H Y, et al. Spring carbonate chemistry dynamics of surface waters in the northern East China Sea: Water mixing, biological uptake of CO2, and chemical buffering capacity[J]. Journal of Geophysical Research Oceans, 2014, 119(9): 5638-5653.
[38] Zhu Z Y, Ng W M, Liu S M, et alEstuarine phytoplankton dynamics and shift of limiting factors: A study in the Changjiang (Yangtze River) Estuary and adjacent area[J]. Estuarine Coastal and Shelf Science, 2009, 84(3): 393-401.
[39] Zhai W D, Zhao H D, Zheng N, et alCoastal acidification in summer bottom oxygen-depleted waters in northwestern-northern Bohai Sea from June to August in 2011[J]. Science Bulletin, 2012, 57(9): 1062-1068.
[40] Lin C, Ning X, Su J, et al. Environmental changes and the responses of the ecosystems of the Yellow Sea during 1976-2000[J]. Journal of Marine Systems, 2005, 55(3-4): 223-234.
[41] Wang B. Cultural eutrophication in the Changjiang (Yangtze River) plume: History and perspective[J]. Estuarine Coastal and Shelf Science, 2006, 69(3-4): 471- 477.
Summer characteristics of carbonate system in the Yellow Sea
ZHU Luan1, Richard Bellerby1, 2
(1. State Key Laboratory of Estuarine and Coastal Research, East China Normal University, Shanghai 200062, China; 2.Norwegian Institute for Water Research, Bergen N-5006, Norway)
Summer carbonate characteristics and their controlling factors in the Yellow Sea were studied through a survey in July 2016. pH, total alkalinity (T) and pertinent data (temperature, salinity, nutrients, and chlorophyll) were investigated during the cruise. The carbonate characteristics were significantly different between the waters. The results show that the pH varied between 7.915 and 8.307 in the surface and between 7.849 and 8.074 in the bottom. High pH values were detected in the Changjiang Diluted Water (CDW) and the Yellow Sea Coastal Water (YSCoW).Tranged between 2063 and 2358 μmol/kg in the surface and between 2205 and2372 μmol/kg in the bottom, with a same increasing trend from the south to the north.Tin the CDW was low, whileTin the YSCoW was high. The partial pressure of CO2(CO2) in the surface also had a similar distribution as the total dissolved inorganic carbon (T), and this was higher in the North Yellow Sea (NYS), especially near the Shandong Peninsula. The aragonite saturation state (Ar) decreased from surface to bottom and had a lowest value of 1.28 in the basin of NYS. Relationships between carbonate parameters and environmental factors were studied through the Pearson correlation analysis. Better relationships were generally found betweenTand salinity, pH, and nutrients, confirming the large effects of water mixing behaviors and biological processes. Water mixing was the dominated factor ofTdistributions. Phytoplankton growth was restricted in the surface of the central Yellow Sea because of nutrients limitation, ultimately resulting in smaller pH variation. In the bottom, the local remineralization of the biogenic particles released CO2and decreased pH.
Yellow Sea; carbonate system; water type; controlling factor; biological process
(本文编辑: 康亦兼)
[National Thousand Talents Program for Foreign Experts (to Richard Bellerby), No.WQ20133100150; Research Project of the State Key Laboratory of Estuarine and Coastal Research, No. SKLEC-2016RCDW01]
May 27, 2017
朱栾(1992-), 女, 四川乐山人, 硕士研究生, 主要从事海水碳酸盐体系与海洋酸化研究, 电话: 18801903478, E-mail: julie.ecnu. china@hotmail.com; Richard Bellerby,通信作者, E-mail: Richard. Bellerby@niva.no
P734.4+2
A
1000-3096(2017)12-0066-09
10.11759/hykx20170527002
2017-05-27;
2017-10-08
国家外专千人计划项目及华东师范大学配套建设经费(WQ20133100150); 河口海岸学国家重点实验室科研业务经费(SKLEC-2016RCDW01)
