尼古丁调控人牙周膜细胞自噬水平的实验研究
2017-05-04杜样袁帅周志斐邬礼政汪璐璐吴兴安王小竞
杜样 袁帅 周志斐 邬礼政 汪璐璐 吴兴安 王小竞
1.军事口腔医学国家重点实验室,国家口腔疾病临床医学研究中心,陕西省口腔疾病临床医学研究中心,第四军医大学口腔医院儿童口腔科,西安 710032;2.武警后勤学院附属医院口腔科,天津 300300;3.第四军医大学微生物学教研室,西安 710032
尼古丁调控人牙周膜细胞自噬水平的实验研究
杜样1袁帅1周志斐1邬礼政2汪璐璐1吴兴安3王小竞1
1.军事口腔医学国家重点实验室,国家口腔疾病临床医学研究中心,陕西省口腔疾病临床医学研究中心,第四军医大学口腔医院儿童口腔科,西安 710032;2.武警后勤学院附属医院口腔科,天津 300300;3.第四军医大学微生物学教研室,西安 710032
目的 探讨尼古丁对人牙周膜细胞(hPDLCs)自噬水平的影响。方法选取因正畸治疗而拔除的前磨牙,采用组织块法分离培养hPDLCs。通过Western blot法筛选尼古丁影响hPDLCs自噬的最佳作用时间及浓度,使用透射电子显微镜(TEM)和免疫荧光染色法检测该作用时间及浓度下hPDLCs自噬体形成情况和自噬标志蛋白LC3的表达情况。结果LC3Ⅱ蛋白表达在尼古丁作用的12 h内持续升高,从而确定12 h为最佳作用时间;LC3Ⅱ蛋白表达上调具有尼古丁浓度依赖性,1×10-5mol·L-1为尼古丁最佳作用浓度。TEM和免疫荧光染色证实尼古丁在此浓度及作用时间下hPDLCs细胞质内自噬体的数量增加,自噬标志蛋白LC3表达升高。结论在一定条件下,尼古丁能够上调hPDLCs自噬水平,为进一步研究细胞自噬与吸烟相关牙周炎的关系奠定了基础。
人牙周膜细胞; 尼古丁; 自噬
近年来,流行病学调查和临床病例研究[1-2]均证实,吸烟是牙周炎发生发展的重要危险因素。吸烟者牙周炎患病率高、病情重,且治疗效果和预后均较差。尼古丁作为烟草中的主要毒性物质,除能影响牙周膜细胞的增殖分化能力外[3],还可调控细胞因子的释放,发挥间接性组织破坏作用[4]。
自噬是真核细胞的一种高度保守的生物学行为,是细胞自体吞噬、消化的过程。自噬过程中,细胞通过双层膜结构包裹受损的蛋白质和细胞器,运送到溶酶体中进行代谢,缓解应激压力,维持代谢平衡。在低氧、营养匮乏等不利微环境下,细胞通过激活、上调自噬水平来降解细胞内蛋白聚集体、氧化脂质、受损细胞器等物质以维持活性[5-6]。
尼古丁可以通过调控多种细胞自噬水平参与机体的病理生理过程。研究[7]证实,尼古丁可以激活神经母细胞瘤细胞SH-SY-5Y的自噬水平,在脐静脉内皮细胞中可以激活内皮细胞自噬[8]。目前关于尼古丁与人牙周膜细胞(human periodontal ligament cells,hPDLCs)自噬的关系尚不明确,但有研究[9]发现,与细胞自噬有关的机制参与了牙周炎症的损伤过程。在有关细胞自噬的研究中,常通过检测自噬体数量及自噬标志蛋白等手段评价自噬水平。自噬体是双层膜包被的圆形或椭圆形结构,内含细胞质、蛋白质、损伤细胞器等[10]。LC3是常见的哺乳动物自噬体分子标志物,存在两种可互相转化的形式,即LC3-Ⅱ和LC3-Ⅰ,LC3-Ⅱ位于自噬体囊泡的膜表面[11],随自噬体膜的增多而增多。本研究通过观察尼古丁对hPDLCs自噬体形成情况和自噬标志蛋白LC3表达情况的影响,探索吸烟与牙周炎在发病机制方面的关系,为临床治疗提供理论依据。
1 材料和方法
1.1 主要试剂和仪器
DMEM培养基、PBS(Coning公司,美国),胎牛血清(Hyclone公司,美国),0.25%胰蛋白酶、青霉素和链霉素、预染蛋白Marker(上海生工生物工程有限公司),兔抗人LC3抗体(Cell Signaling Technology公司,美国),山羊抗兔抗体(Odyssey公司,美国),异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记山羊抗兔抗体(北京康为世纪生物科技有限公司)。BCA蛋白浓度检测试剂盒(Thermo公司,美国),十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)电泳及转移系统(Bio-Rad公司,美国),Odyssey扫描仪(LiCor公司,美国),分光光度计(Jenway公司,英国),荧光显微镜(Olympus公司,日本)。
1.2 方法
1.2.1 hPDLCs培养 收集第四军医大学口腔医院颌面外科门诊因正畸减数而新鲜拔除的健康前磨牙(患者年龄12~18岁),要求牙齿无龋坏以及牙周疾患,供者无全身系统性疾病。PBS和低糖DMEM反复多次冲洗牙齿后,无菌手术刀片刮取根中1/3牙周膜组织,收集并离心,用含15%胎牛血清的DMEM重悬牙周膜组织沉淀接种于六孔板,无菌盖玻片覆盖。加入1.5~2.0 mL含15%胎牛血清的DMEM,置于37 ℃恒温孵箱培养,每3 d常规换液,待细胞增殖至板底面积90%时胰酶消化传代,第4代hPDLCs用于后续实验,培养基为含10%胎牛血清的DMEM。
1.2.2 Western-blot检测LC3Ⅱ蛋白的表达 取生长状态良好的第4代hPDLCs,以每孔2×105个细胞的密度接种于六孔板中,待细胞生长至80%后分别给予1× 10-5mol·L-1的尼古丁作用0、3、6、12、24 h,PBS洗涤后每孔加入120 μL含1 mmol·L-1蛋白酶抑制剂的细胞裂解液(ridio-immunoprecipition assay,RIPA),在冰上充分裂解后刮取细胞,将RIPA移至EP管中,4 ℃、12 000 r·min-1离心15 min。取所得上清采用BCA法测定蛋白质浓度,计算每孔总蛋白30 μg的上样量。制备15%SDS-PAGE蛋白电泳凝胶,恒压电泳结束后将蛋白恒流200 mA转移至聚偏二氟乙烯膜,3%脱脂牛奶封闭1 h后孵育一抗,4 ℃过夜,二抗室温避光孵育2 h后,避光扫膜。以磷酸甘油醛脱氢酶(glyceraldehyde-phosphate dehydrogenase,GAPDH)或β-actin为内参,计算LC3Ⅱ与内参的灰度值的比值[12],得出LC3Ⅱ蛋白的相对表达量。另取生长状态良好的第4代hPDLCs接种至六孔板,分别给予各孔0、1×10-7、1×10-6、1×10-5、1×10-4mol·L-1尼古丁作用12 h,其余步骤同前。以GAPDH或β-actin为内参,计算LC3Ⅱ与内参的灰度值的比值,得出LC3Ⅱ蛋白的相对表达量。
1.2.3 透射电子显微镜(transmission electron microscope,TEM)观察hPDLCs内自噬体的形成情况 取生长状态良好的第4代hPDLCs,制备成密度为2× 105·mL-1细胞悬液,取2 mL接种于25 cm2培养瓶中,待细胞生长至80%后,实验组给予1×10-5mol·L-1尼古丁作用12 h,胰蛋白酶消化后制成密度为1×106·mL-1细胞悬液,4 ℃、1 200 r·min-1离心5 min后弃上清,加入1 mL预冷2.5%戊二醛固定,4 ℃过夜,根据文献[13]的操作步骤进行后续实验操作。
1.2.4 免疫荧光染色观察LC3蛋白的表达 取生长状态良好的第4代hPDLCs,以每孔2×104个细胞的密度接种于24孔板,待细胞生长至80%时给予1×10-5mol·L-1尼古丁作用12 h,4%预冷多聚甲醛固定20 min,0.5% TritonX-100通透10 min,3%BSA封闭30 min后加入一抗(1∶100)4 ℃过夜,二抗(1∶500)室温避光孵育2 h,细胞用4,6-二脒基-2-苯基吲哚(4,6-diamidino-2-phenylindole, DAPI)染核5 min,甘油封片后荧光显微镜观察。
1.2.5 统计学分析 使用SPSS 16.0软件对数据进行分析,采用单因素方差分析检验组间差异,检验水准为双侧α=0.05。
2 结果
2.1 细胞培养与鉴定
组织块接种3~7 d以后可见细胞自边缘爬出。hPDLCs呈长梭形,体积较大,胞体丰满,核卵圆形,位于细胞质中央,具有成纤维样细胞形态特征(图1左),传代后细胞排列成放射状(图1右)。2.2 尼古丁对hPDLCs LC3Ⅱ蛋白表达影响的时间及
浓度依赖性
Western blot结果提示,1×10-5mol·L-1尼古丁作用3 h后,与空白对照组相比,LC3Ⅱ表达水平明显升高,差异有统计学意义(P<0.05),且这一升高趋势在12 h达到高峰(P<0.01),LC3Ⅱ蛋白表达水平在尼古丁作用12 h后基本趋于稳定,24 h组蛋白质表达情况与12 h组相比差异无统计学意义(P>0.05)(图2左),由此可以确定尼古丁的最佳作用时间为12 h。当作用时间为12 h时,随着尼古丁浓度增加,hPDLCs中LC3Ⅱ的表达随之增加,1×10-4mol·L-1组自噬现象最明显(图2右,P<0.05),与1×10-5mol·L-1组相比差异无统计学意义(P>0.05)。考虑到尼古丁具有一定的细胞毒性[14],从而确定1×10-5mol·L-1为尼古丁的最佳作用浓度。
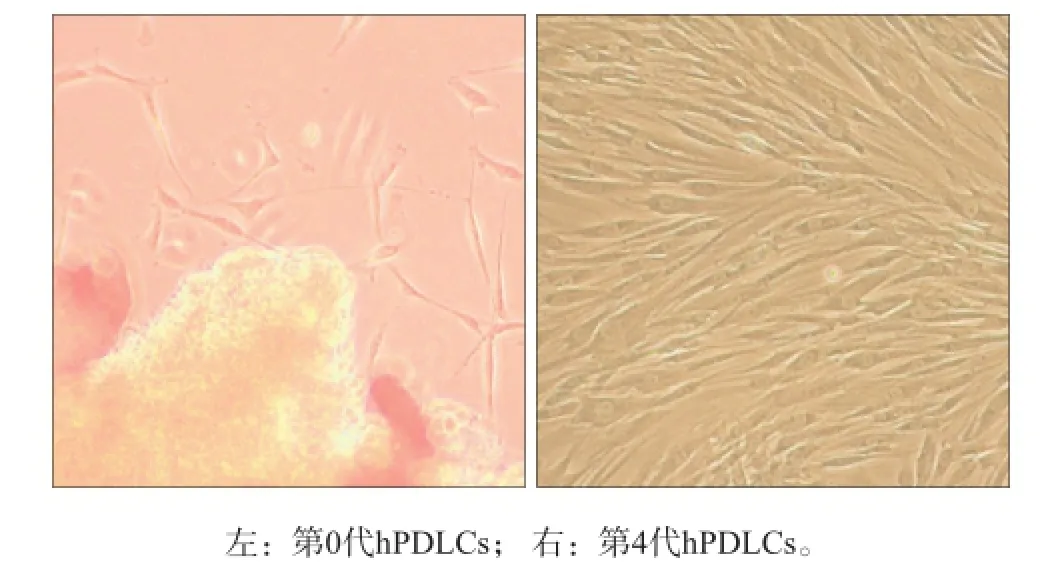
图1 培养的hPDLCs细胞形态 光学显微镜 × 100Fig1 The cell morphology of hPDLCs optical microscope × 100
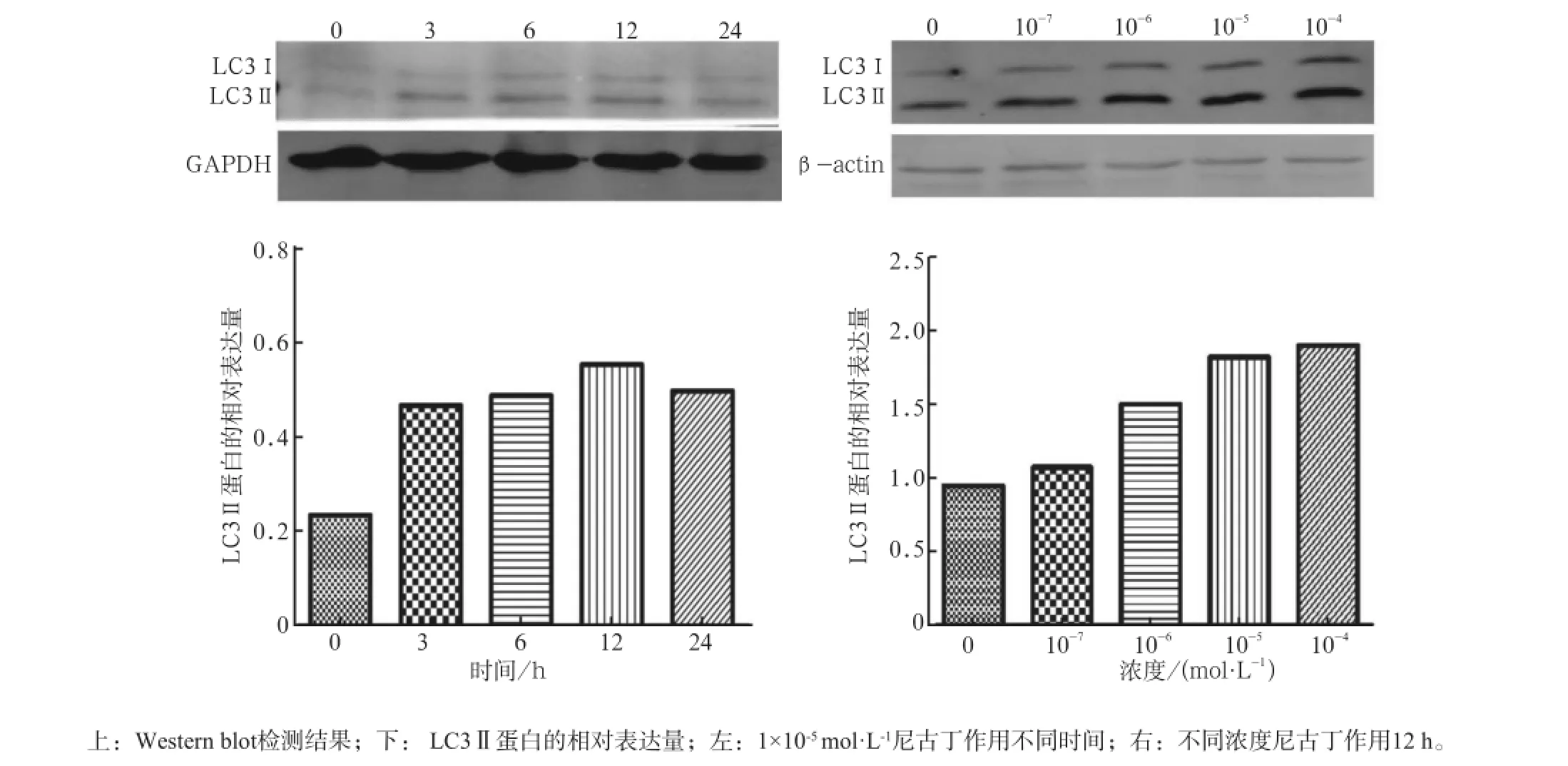
图2 Western blot检测尼古丁诱导hPDLCs中LC3Ⅱ蛋白的表达情况Fig2 The expression of LC3Ⅱ protein of hPDLCs treated with nicotine or in control group was detected by Western blot
2.3 尼古丁作用后hPDLCs内自噬体的形成以及数量变化
1×10-5mol·L-1尼古丁作用hPDLCs 12 h后行TEM观察,低倍镜下可见,与对照组(图3A)相比,实验组(图3C)hPDLCs细胞质内细胞器增多;高倍镜下可见,对照组自噬体(图3B红色箭头示)的数量明显少于实验组(图3D红色箭头示)。
2.4 免疫荧光染色检测尼古丁作用hPDLCs后LC3蛋白的表达变化
荧光显微镜观察可见,1×10-5mol·L-1尼古丁作用12 h后,实验组的细胞核周围出现LC3荧光亮点(图4红色箭头所示),荧光强度高且亮点多,提示细胞内有大量的自噬体形成;而对照组亮点分布少而弥散,提示细胞内自噬体较少。
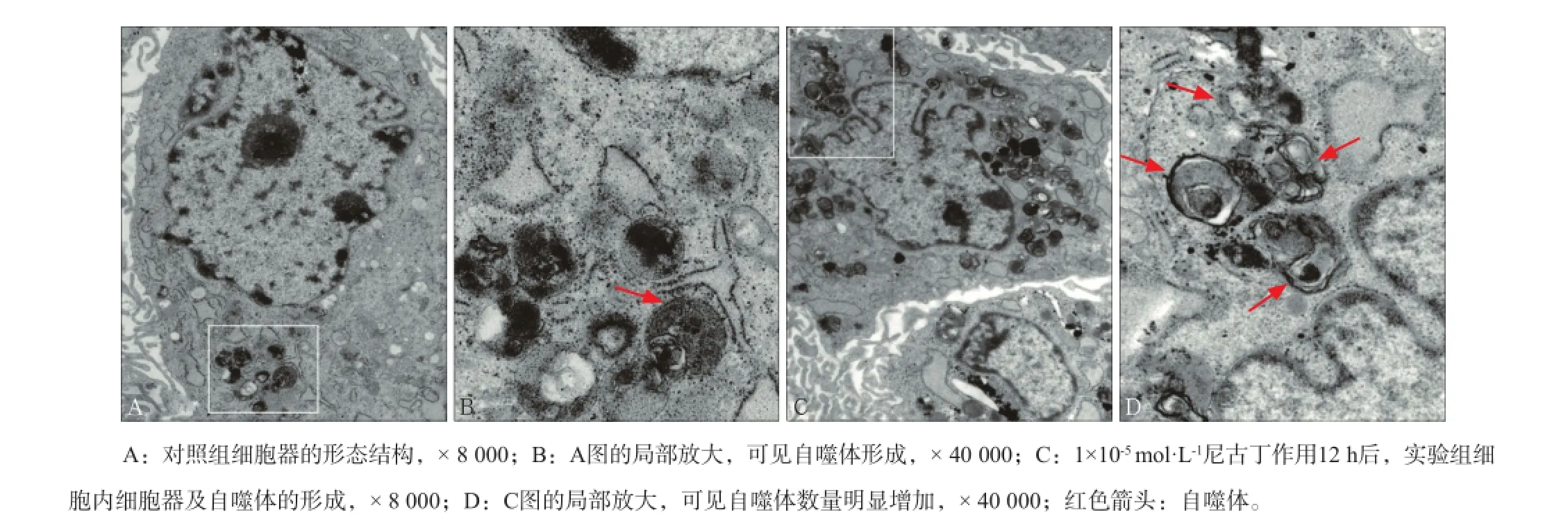
图3 对照组和实验组hPDLCs的细胞质内细胞器和自噬体的数量及形态结构 TEMFig3 The quantity and form of autophagosomes of hPDLCs treated with nicotine or in control group TEM

图4 尼古丁作用后hPDLCs内LC3蛋白的表达变化 荧光显微镜 × 400Fig4 Nicotine-induced the expression of LC3 in hPDLCs fluorescence microscope × 400
3 讨论
hPDLCs是牙周膜中数量最多、功能最重要的细胞,其功能损伤可能导致牙周支持组织破坏。尼古丁是一种存在于茄科植物中的生物碱,为强致命毒物。本课题组前期研究[15-16]证实,尼古丁可特异性上调大鼠牙周组织和hPDLCs膜表面α7亚型烟碱型乙酰胆碱受体表达水平,从而激活下游多条炎症和骨代谢相关信号通路,参与吸烟相关性牙周炎的发生发展过程。进一步研究[4]发现,尼古丁可激活hPDLCs中核因子-κB信号通路,调控下游炎症因子白细胞介素(interleukin,IL)-1β和IL-8的表达,进而参与吸烟促牙周炎发生发展的过程。这些前期研究结果均提示尼古丁能够加重吸烟相关性牙周炎牙周组织炎症损伤的过程。
研究[9]发现,细胞自噬在炎症相关性疾病中扮演着重要的角色,例如口腔临床中常见的牙周炎。牙周炎患者常发生hPDLCs缺氧,导致hPDLCs自噬水平升高,使细胞发生自噬性死亡,同时伴随大量细胞因子IL-1β、基质金属蛋白酶-8(matrix metallo preteinases-8,MMP-8)的分泌,从而加重牙周炎症反应[17]。An等[18]通过体外成功培养牙周炎患者的牙周膜干细胞,发现炎症微环境下牙周膜干细胞的自噬标志物(LC3)和基因(Atg12/7)表达都显著高于正常牙周膜组织来源的牙周膜干细胞。另有研究[9]发现,牙周炎患者外周血单核细胞中的LC3、IL-1β、IL-18 mRNA表达水平都显著高于正常人群。这些研究结果均提示,细胞自噬可能参与牙周炎的发生发展过程。结合本实验结果和本课题组前期研究[4]的结果可以发现,尼古丁作用后细胞炎症因子表达上调与自噬水平上调结果较为一致,同样提示细胞自噬可能参与了局部微环境炎症反应进程。
尼古丁与细胞自噬的关系已有研究予以证实。研究[19]发现,香烟提取物(主要成分为尼古丁)能显著上调牙龈成纤维细胞的自噬水平。其他组织中同样发现,尼古丁可作用于脐静脉内皮细胞,通过上调内皮细胞的自噬水平影响细胞黏附[8]。本研究发现,在尼古丁的作用下,hPDLCs的细胞自噬标志物LC3蛋白表达显著升高,与上述研究结果较为一致;此外本研究还通过TEM从组织学水平证实细胞质内自噬体的形态及数量变化同样受尼古丁作用的影响。
从本研究可以看出,尼古丁能够上调hPDLCs自噬水平,这为进一步探讨吸烟相关牙周炎的发病机制和治疗方法提供了依据。
[1] Wyganowska-Swiatkowska M, Nohawica MM. Effect of tobacco smoking on human gingival and periodontal fibroblasts. A systematic review of literature[J]. Prz Lek, 2015, 72(3):158-160.
[2] Chatzopoulos G. Smoking, smokeless tobacco, and alcohol consumption as contributing factors to periodontal disease [J]. Northwest Dent, 2016, 95(1):37-41.
[3] Zhou Z, Li B, Dong Z, et al. Nicotine deteriorates the osteogenic differentiation of periodontal ligament stem cells through α7 nicotinic acetylcholine receptor regulating Wnt pathway [J]. PLoS ONE, 2013, 8(12):e83102.
[4] Wu L, Zhou Y, Zhou Z, et al. Nicotine induces the production of IL-1β and IL-8 via the α7 nAChR/NF-κB pathway in human periodontal ligament cells: anin vitrostudy[J]. Cell Physiol Biochem, 2014, 34(2):423-431.
[5] Yang Z, Goronzy JJ, Weyand CM. Autophagy in autoimmune disease[J]. J Mol Med, 2015, 93(7):707-717.
[6] Wu Y, Zhang Y, Wang L, et al. The role of autophagy in kidney inflammatory injury via the NF-κB route induced by LPS[J]. Int J Med Sci, 2015, 12(8):655-667.
[7] Hung SY, Huang WP, Liou HC, et al. Autophagy protects neuron from Abeta-induced cytotoxicity[J]. Autophagy, 2009, 5(4):502-510.
[8] Duerrschmidt N, Hagen A, Gaertner C, et al. Nicotine effects on human endothelial intercellular communication via α4β2and α3β2nicotinic acetylcholine receptor subtypes[J]. Naunyn Schmiedebergs Arch Pharmacol, 2012, 385(6):621-632.
[9] Bullon P, Cordero MD, Quiles JL, et al. Autophagy in periodontitis patients and gingival fibroblasts: unraveling the link between chronic diseases and inflammation[J]. BMC Med, 2012, 10:122.
[10] Suzuki H, Osawa T, Fujioka Y, et al. Structural biology of the core autophagy machinery[J]. Curr Opin Struct Biol, 2016, 43:10-17.
[11] Tanida I, Ueno T, Kominami E. LC3 conjugation system in mammalian autophagy[J]. Int J Biochem Cell Biol, 2004, 36(12):2503-2518.
[12] Hao Y, Lu Q, Yang G, et al. Lin28a protects against postinfarction myocardial remodeling and dysfunction through Sirt1 activation and autophagy enhancement[J]. Biochem Biophys Res Commun, 2016, 479(4):833-840.
[13] Lu J, Sun D, Gao S, et al. Cyclovirobuxine D induces autophagy-associated cell death via the Akt/mTOR pathway in MCF-7 human breast cancer cells[J]. J Pharmacol Sci, 2014, 125(1):74-82.
[14] Kim SY, Kang KL, Lee JC, et al. Nicotinic acetylcholine receptor α7 and β4 subunits contribute nicotine-induced apoptosis in periodontal ligament stem cells[J]. Mol Cells, 2012, 33(4):343-350.
[15] Wang XJ, Liu YF, Wang QY, et al. Functional expression of alpha 7 nicotinic acetylcholine receptors in human periodontal ligament fibroblasts and rat periodontal tissues[J]. Cell Tissue Res, 2010, 340(2):347-355.
[16] Liu YF, Wu LA, Wang J, et al. Micro-computerized tomography analysis of alveolar bone loss in ligature- and nicotineinduced experimental periodontitis in rats[J]. J Periodont Res, 2010, 45(6):714-719.
[17] Song ZC, Zhou W, Shu R, et al. Hypoxia induces apoptosis and autophagic cell death in human periodontal ligament cells through HIF-1α pathway[J]. Cell Prolif, 2012, 45(3): 239-248.
[18] An Y, Liu W, Xue P, et al. Increased autophagy is required to protect periodontal ligament stem cells from apoptosis in inflammatory microenvironment[J]. J Clin Periodontol, 2016, 43(7):618-625.
[19] Kim MS, Yun JW, Park JH, et al. Autophagy has a beneficial role in relieving cigarette smoke-induced apoptotic death in human gingival fibroblasts[J]. Int J Med Sci, 2016, 13(5): 357-364.
(本文编辑 吴爱华)
A preliminary study on the autophagy level of human periodontal ligament cells regulated by nicotine
Du Yang1, Yuan Shuai1, Zhou Zhifei1, Wu Lizheng2, Wang Lulu1, Wu Xing’an3, Wang Xiaojing1. (1. State Key Laboratory of Military Stomatology, National Clinical Research Center for Oral Diseases, Shanxi Clinical Research Center for Oral Diseases, Dept. of Pediatric Dentistry, School of Stomatology, The Fourth Military Medical University, Xi’an 710032, China; 2. Dept. of Stomatology, Affiliated Hospital of Logistics University of People’s Armed Police Force, Tianjin 300300, China; 3. Dept. of Microbiology, The Fourth Military Medical University, Xi’an 710032, China)
Objective To explore the effect of nicotine on the autophagy level of human periodontal ligament cells (hPDLCs).MethodsPeriodontal tissues collected from premolars for orthodontic treatment reasons were used to culture hPDLCs. Western blot analysis was performed to test the most optimal time and concentration of nicotine on the autophagy level of the hPDLCs. Transmission electron microscope and immunofluorescence observation were carried out to detect the form of autophagosomes and expression of autophagy related protein LC3 in hPDLCs under this optimal condition.ResultsProtein expression of LC3Ⅱ was up regulated with the 12 h nicotine stimulating. Besides that, the up regulation of the protein expression of LC3Ⅱ was concentration dependent and nicotine with a concentration of 1×10-5mol·L-1was the most optimal condition. Transmission electron microscope and immunofluorescence observations indicated that nicotine would activate the autophagy level of hPDLCs by increasing the number of autophagosomes and up regulating the expression of autophagy related protein LC3.ConclusionNicotine could increase autophagy level of hPDLCs, thus affecting the occurrence and development of smoking related periodontitis.
human periodontal ligament cells; nicotine; autophagy
R 780.2
A
10.7518/hxkq.2017.02.017
Supported by: The General Program of National Nature Science Foundation of China (81470743). Correspondence: Wang Xiaojing, E-mail: wxjing@fmmu.edu.cn.
2016-11-05;
2017-01-02
国家自然科学基金面上项目(81470743,81670988)
杜样,硕士,E-mail:duyangzizi@126.com
王小竞,教授,博士,E-mail:wxjing@fmmu.edu.cn
