降钙素基因相关肽对血清饥饿作用下MC3T3-E1成骨细胞凋亡和自噬的影响
2017-05-04安洋张慧宇郭俊峰李鑫杨阳张纲谭颖徽
安洋 张慧宇 郭俊峰 李鑫 杨阳 张纲 谭颖徽
第三军医大学新桥医院口腔颌面外科,重庆 400037
降钙素基因相关肽对血清饥饿作用下MC3T3-E1成骨细胞凋亡和自噬的影响
安洋 张慧宇 郭俊峰 李鑫 杨阳 张纲 谭颖徽
第三军医大学新桥医院口腔颌面外科,重庆 400037
目的 研究血清饥饿条件下降钙素基因相关肽(CGRP)对小鼠MC3T3-E1成骨细胞凋亡、自噬的影响以及二者之间的关系,以进一步明确CGRP对成骨细胞的保护机制。方法体外培养小鼠MC3T3-E1成骨细胞。采用流式细胞术和蛋白质印迹检测正常血清、无血清(血清饥饿)、3-MA预处理+血清饥饿培养的成骨细胞的凋亡和微管相关蛋白1轻链3(LC3)蛋白的表达。采用蛋白质印迹检测正常血清、血清饥饿、血清饥饿+不同浓度(10-10、10-9、10-8、10-7mol·L-1)CGRP培养的成骨细胞的LC3和P62蛋白表达;采用蛋白质印迹检测正常血清、血清饥饿、血清饥饿+10-8mol·L-1CGRP培养不同时间(2、6、12、24、48、72 h)的成骨细胞的LC3蛋白表达,流式细胞数检测细胞凋亡,MDC染色检测细胞自噬泡。采用流式细胞术检测正常血清、血清饥饿、血清饥饿+10-8mol·L-1CGRP、3-MA预处理+血清饥饿、3-MA预处理+血清饥饿+10-8mol·L-1CGRP培养24 h的成骨细胞的凋亡。结果血清饥饿培养时成骨细胞的LC3Ⅱ蛋白表达及细胞凋亡较正常血清时增加,3-MA预处理+血清饥饿培养时成骨细胞的凋亡较血清饥饿时增加(P<0.01)。与正常血清相比,血清饥饿、血清饥饿+CGRP培养时LC3Ⅱ蛋白表达增加,P62蛋白表达降低,以血清饥饿+10-8mol·L-1CGRP培养24 h时LC3Ⅱ/Ⅰ比值最高;血清饥饿+10-8mol·L-1CGRP培养能抑制成骨细胞的凋亡,促进自噬泡的合成。3-MA预处理后MC3T3-E1成骨细胞凋亡增加,CGRP部分逆转3-MA预处理所增加的成骨细胞凋亡。结论CGRP能够增强血清饥饿下MC3T3-E1成骨细胞的自噬活性,并可能通过促进自噬抑制成骨细胞的凋亡。
降钙素基因相关肽; 成骨细胞; 自噬; 凋亡
成骨细胞作为参与骨修复的重要细胞之一,主要依赖于微环境中源源不断的促生存信号才能维持其正常的生理功能;当存在疾病或损伤导致营养因子供应受到限制时,细胞将会发生过度的凋亡,从而严重影响到骨的修复。目前已有大量的生长因子被证明在骨修复中具有重要的作用,但骨修复本身是一个高度精密复杂的调控过程,临床上仍然不断地研究和寻找更高效的骨活化剂[1]。
降钙素基因相关肽(calcitonin gene-related peptide,CGRP)是一种由末梢神经分泌的神经递质,在骨修复、骨形成和骨吸收中的积极作用表明其在骨折愈合中扮演重要的角色[2]。本课题组在前期研究[3]中已证实,CGRP在颌骨骨折的愈合过程中具有重要的促进作用。最近,CGRP还被证明对成骨细胞具有潜在的保护作用,能够通过抑制成骨细胞的凋亡从而抑制骨丢失[4]。
自噬(autophagy)是一种广泛存在于细胞内的膜转运方式,主要用于递送不必要的或者不正常的蛋白质和细胞器至溶酶体以降解和再利用[5]。自噬能防止细胞损伤的聚集,并确保细胞内的平衡。凋亡是依赖于半胱氨酸天冬氨酸特异性蛋白酶(cysteinecontaining aspartate-specific proteases,caspase)的自主有序的细胞死亡方式,形态学上主要表现为核固缩、染色质浓聚、核破裂及凋亡小体形成[6]。凋亡与自噬的平衡是维持细胞稳态必不可少的,在骨折愈合过程中常伴随着凋亡与自噬的发生。在此过程中二者如何互相作用尚不清楚。本课题组在前期研究[3,7]中已证实,CGRP在颌骨骨折的愈合过程中具有重要的促进作用,在前期研究的基础上,本课题组将研究在饥饿条件下CGRP对成骨细胞凋亡的影响,并首次从自噬入手,试图进一步揭示CGRP对成骨细胞的保护作用所涉及的机制。
1 材料和方法
1.1 主要试剂和仪器
小鼠MC3T3-E1成骨细胞(购自于中国科学院上海细胞库),α-MEM培养基、青链霉素混合液、胎牛血清(Gibco公司,美国),CGRP、单丹磺酰尸胺(monodansylcadaverin,MDC)、3-甲基腺嘌呤(3-methyladenine,3-MA)(Sigma公司,美国);微管相关蛋白1轻链3(microtubule associated protein 1 light chain 3,LC3)、P62蛋白(CST公司,美国),小鼠抗β-actin单抗(北京中杉金桥生物技术有限公司),辣根过氧化物酶标记羊抗兔IgG、辣根过氧化物酶标记羊抗鼠IgG(ABGENT公司,美国),Image Quant LAS 4000数字成像系统(GE公司,美国),MoFlo XDF流式细胞仪(Beckman公司,美国),TCS SP5激光共聚焦显微镜(Leica公司,德国)。
1.2 细胞培养
小鼠MC3T3-E1成骨细胞株在含10%胎牛血清和1%青链霉素混合液的α-MEM培养基中5%CO2、37 ℃条件下培养,每3 d换液一次,镜下观察细胞生长至密度约80%时0.25%胰蛋白酶消化传代培养。本实验使用第三代MC3T3-E1成骨细胞。
1.3.1 血清饥饿对MC3T3-E1成骨细胞凋亡和自噬的影响 1)将MC3T3-E1成骨细胞在含血清培养液(空白对照组)、无血清培养液(血清饥饿组)中分别培养12 h和24 h,采用蛋白质印迹(Western blot)检测LC3蛋白的表达,流式细胞术检测细胞凋亡。2)将MC3T3-E1成骨细胞分别在含血清培养液(空白对照组)、无血清培养液(血清饥饿组)、5 mmol·L-13-MA预处理1 h+无血清培养液(血清饥饿+3-MA组)中培养24 h,采用流式细胞术检测细胞凋亡。
1.3.2 血清饥饿下CGRP对MC3T3-E1成骨细胞自噬和凋亡的影响 1)将MC3T3-E1成骨细胞分别在含血清培养液(空白对照组)、无血清培养液(血清饥饿组)、无血清+不同浓度(10-10、10-9、10-8、10-7mol·L-1)CGRP培养液(血清饥饿+CGRP组)中培养24 h,采用Western blot检测LC3和P62蛋白的表达。2)将MC3T3-E1成骨细胞分别在含血清培养液(空白对照组)、无血清培养液(血清饥饿组)、无血清+10-8mol·L-1CGRP培养液(血清饥饿+CGRP组)培养2、6、12、24、48、72 h,采用Western blot检测LC3蛋白的表达,流式细胞术检测培养24 h时的细胞凋亡,MDC染色检测培养24 h时细胞自噬泡的表达。3)将MC3T3-E1成骨细胞分别在含血清培养液(空白对照组)、无血清培养液(血清饥饿组)、无血清+10-8mol·L-1CGRP培养液(血清饥饿+ CGRP组)、5 mmol·L-13-MA预处理1 h+无血清培养液(血清饥饿+3-MA组)、3-MA预处理1 h+无血清+10-8mol·L-1CGRP培养液(血清饥饿+CGRP+3-MA组)培养24 h,采用流式细胞术检测细胞凋亡。
1.4 检测方法
1.4.1 Western blot检测LC3和P62蛋白的表达 将培养的MC3T3-E1成骨细胞按常规方法裂解,提取细胞总蛋白。BCA法测定蛋白浓度后,十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分离,将目的蛋白转至0.20 μm的PVDG膜,LC3抗体(1︰1 000)、P62抗体(1︰1 000)和β-actin(1︰1 000)4 ℃孵育过夜;辣根过氧化物酶标记二抗(1︰5 000),用电化学发光法发光显影,Image Quant LAS4000数字成像系统采集影像。
1.4.2 流式细胞术检测细胞凋亡 将培养的MC3T3-E1成骨细胞以每孔1×106个接种于六孔板中,PBS液重悬细胞后加入1 μg·mL-1Annexin V-PI双染,采用流式细胞术检测细胞凋亡,计算凋亡细胞所占百分比。
1.4.3 MDC染色观察自噬泡 将培养的MC3T3-E1成骨细胞进行爬片处理后,弃培养基,PBS冲洗3遍,4%多聚甲醛固定15 min,PBS洗2次,加入0.05 mmol·L-1MDC染料200 μL,37 ℃孵育10 min,PBS冲洗4遍,共聚焦激光显微镜下(激发波长380 nm,发射波长525 nm)观察细胞自噬泡的变化。
1.5 统计学分析
卡锤头的原因也比较多,常见的有以下几种:一是冲孔操作中在经过两种强度差别明显的岩层时没有对行程进行相应调整;二是地层中存在的硬度较大的探头石将锤头卡住;三是冲孔过程中由于操作不当使锤头偏斜顶住孔壁导致锤头无法顺利移动。
采用SPSS 17.0软件进行统计,数据以均数±标准差表示,Student t检验或单因素方差进行分析。
2 结果
2.1 血清饥饿对MC3T3-E1成骨细胞凋亡和自噬的影响
Western blot及流式细胞术检测结果显示,无论在12 h还是在24 h,与空白对照组相比,血清饥饿组LC3Ⅱ蛋白表达及细胞凋亡均增加(P<0.01),且随着时间延长,LC3Ⅱ/Ⅰ比值差异加大(图1~3)。
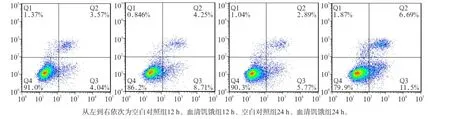
图1 2组MC3T3-E1成骨细胞培养12、24 h的细胞凋亡水平Fig1 Apoptosis of MC3T3-E1 osteoblasts of two groups in the time point of 12 h and 24 h
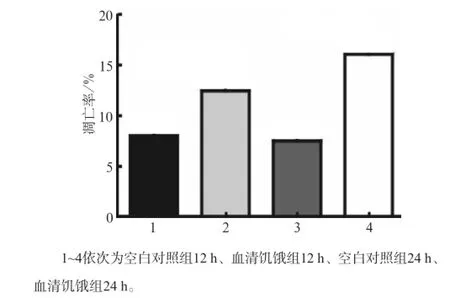
图2 2组MC3T3-E1成骨细胞培养12、24 h的细胞凋亡率Fig2 Apoptosis rate of MC3T3-E1 osteoblasts of two groups in the time point of 12 h and 24 h
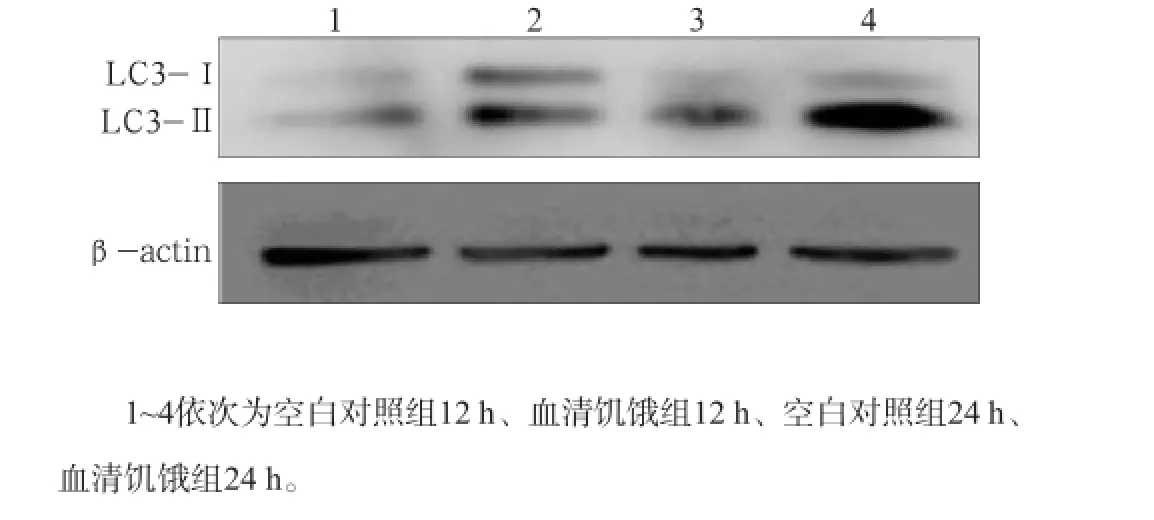
图3 2组MC3T3-E1成骨细胞培养12、24 h的LC3蛋白表达水平Fig3 Expression of LC3 of MC3T3-E1 osteoblasts of two groups in the time point of 12 h and 24 h
这提示,血清饥饿可以诱导MC3T3-E1成骨细胞的凋亡和自噬。
3-MA预处理后无血清培养液培养24 h,流式细胞术结果显示MC3T3-E1成骨细胞的凋亡较血清饥饿组明显增加(P<0.01,图4、5)。这提示血清饥饿条件下,自噬的抑制会导致MC3T3-E1成骨细胞的凋亡增强。
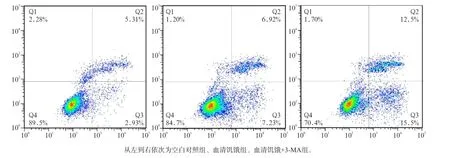
图4 3组MC3T3-E1成骨细胞培养24 h的细胞凋亡水平Fig4 Apoptosis of MC3T3-E1 osteoblasts of three groups in the time point of 24 h
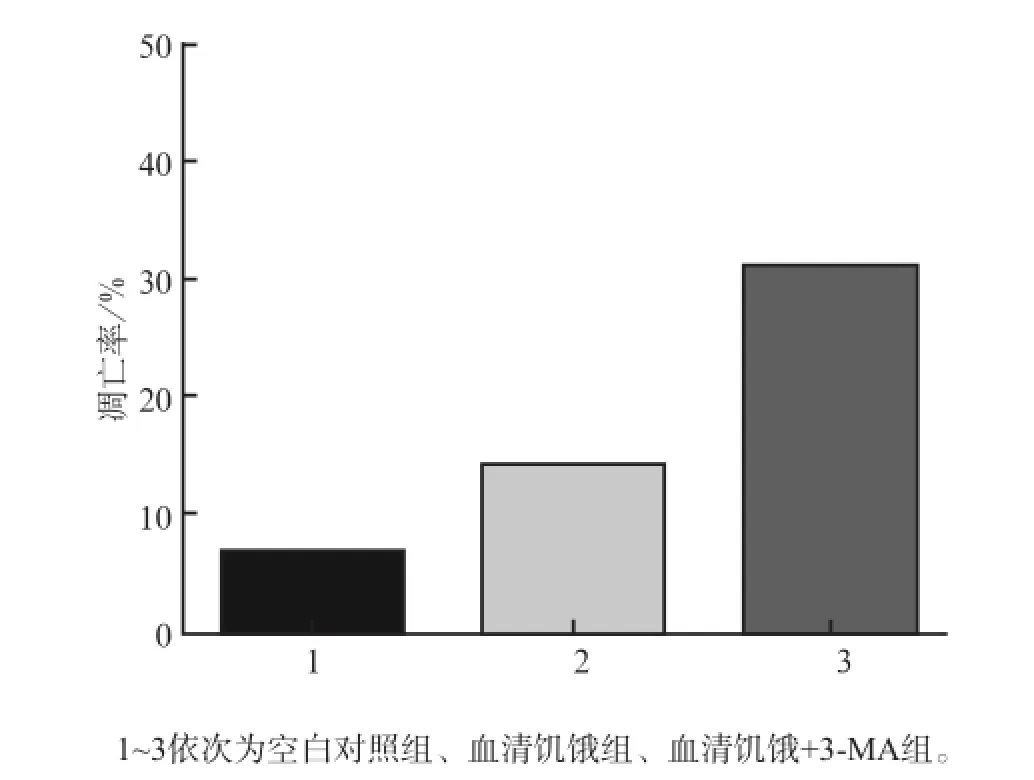
图5 3组MC3T3-E1成骨细胞培养24 h的细胞凋亡率Fig5 Apoptosis rate of MC3T3-E1 osteoblasts of three groups in the time point of 24 h
2.2 血清饥饿下CGRP对MC3T3-E1成骨细胞自噬的影响
Western blot检测结果表明,与空白对照组相比,血清饥饿组和不同浓度的血清饥饿+CGRP组MC3T3-E1成骨细胞培养24 h后LC3Ⅱ蛋白的表达均增加,在CGRP浓度为10-8mol·L-1时LC3Ⅱ/Ⅰ比值最高;P62蛋白的表达均降低,CGRP浓度为10-8mol·L-1为最大刺激浓度(图6)。这表明,在血清饥饿的条件下,CGRP能促进MC3T3-E1成骨细胞的自噬,10-8mol·L-1为最适浓度。
相同浓度(10-8mol·L-1)CGRP作用MC3T3-E1成骨细胞不同时间(2,6,12,24,48,72 h)之间相比较,24 h时LC3Ⅱ/Ⅰ比值最高(图7),提示在作用24 h时CGRP能显著诱导MC3T3-E1成骨细胞的自噬。
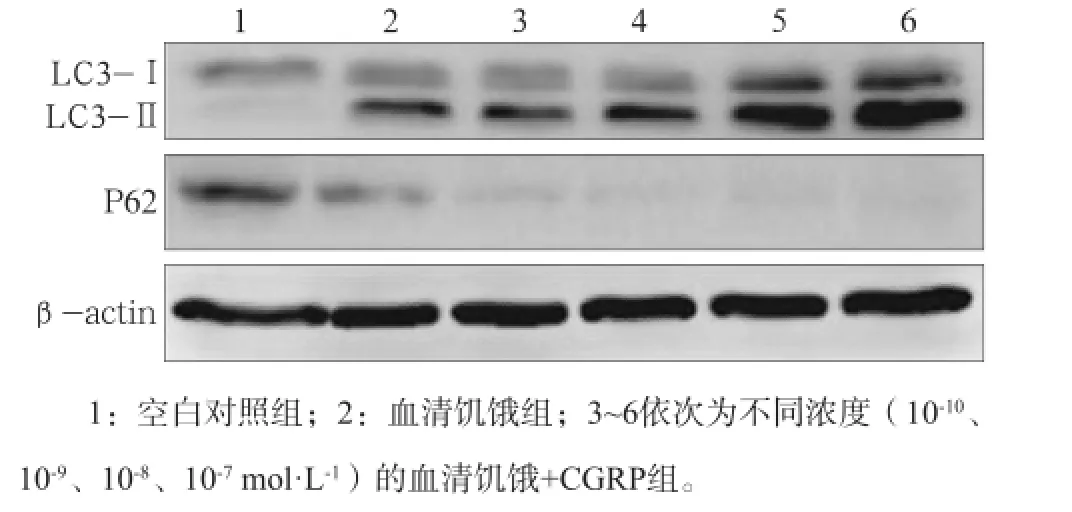
图6 各组MC3T3-E1成骨细胞培养24 h的LC3、P62蛋白表达水平Fig6 Expression of LC3 and P62 of MC3T3-E1 osteoblasts of each group in the time point of 24 h

图7 各组MC3T3-E1成骨细胞培养不同时间的LC3蛋白表达水平Fig7 Expression of LC3 of MC3T3-E1 osteoblasts of each group at different time
2.3 血清饥饿下CGRP对MC3T3-E1成骨细胞凋亡的影响
流式细胞术检测结果表明,血清饥饿+CGRP组能抑制MC3T3-E1成骨细胞的凋亡(P<0.05)(图8);MDC染色检测结果显示,血清饥饿组的自噬囊泡荧光强度较空白对照组强,血清饥饿+CGRP组较血清饥饿组强(图9)。
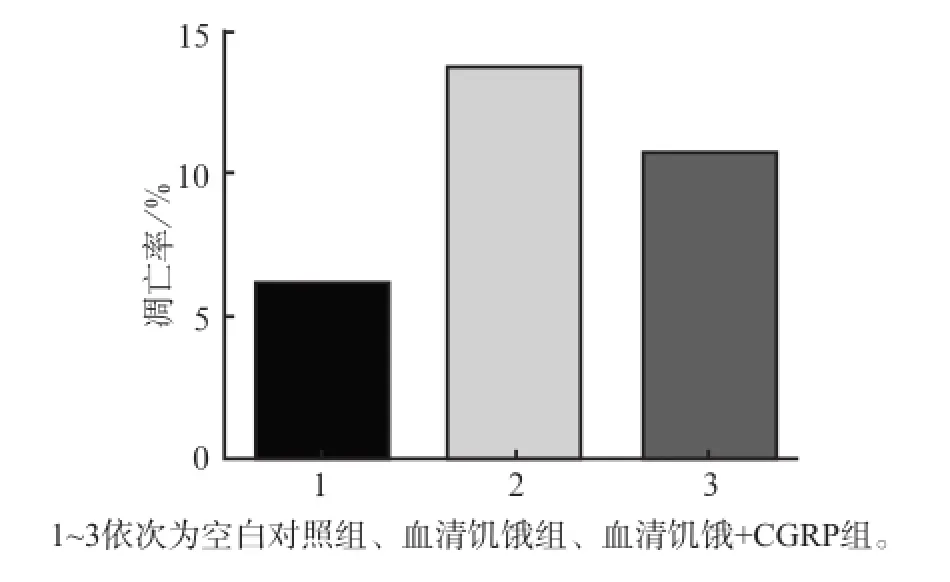
图8 3组MC3T3-E1成骨细胞培养24 h的细胞凋亡率Fig8 Apoptosis rate of MC3T3-E1 osteoblasts of three groups in the time point of 24 h
这说明,在饥饿条件下,CGRP不仅能够抑制MC3T3-E1成骨细胞的凋亡,同时也能够促进MC3T3-E1成骨细胞自噬泡的合成。
2.4 血清饥饿下3-MA预处理后CGRP对MC3T3-E1成骨细胞自噬和凋亡的影响
流式细胞术检测的结果表明,3-MA预处理后MC3T3-E1成骨细胞凋亡增加,CGRP部分逆转3-MA预处理所增加的血清饥饿条件下MC3T3-E1成骨细胞凋亡的水平(图10)。该结果提示CGRP可能通过促进MC3T3-E1成骨细胞的自噬从而抑制细胞的凋亡。

图9 3组MC3T3-E1成骨细胞培养24 h的细胞自噬泡 MDC × 400Fig9 Autophagosome of MC3T3-E1 osteoblasts of three groups in the time point of 24 h MDC × 400

图10 5组MC3T3-E1成骨细胞培养24 h的细胞凋亡率Fig10 Apoptosis rate of MC3T3-E1 osteoblasts of five groups in the time point of 24 h
3 讨论
CGRP主要来源于感觉神经肽,是骨组织中分泌最广泛的一种神经递质。本课题组前期研究[8-9]发现,CGRP能够促进骨折的愈合,也证实CGRP能促进成骨细胞的活性。作为骨修复与骨重建的活化剂,CGRP的功能引起越来越多的关注。新近的研究发现CGRP能够抑制成骨细胞的凋亡,但这种抗凋亡的保护作用的具体机制少有报道。
自噬是一个循环的过程,通过降解受损的大分子物质及细胞器实现细胞本身的代谢需求和细胞器的更新,是细胞的一种生存机制[10]。同时,自噬也参与细胞的各种生理功能,Nollet等[11]研究发现,自噬参与成骨细胞的矿化过程,特异性成骨细胞自噬缺陷的小鼠的骨量会发生明显的减少,提示成骨细胞的自噬同时涉及到骨矿化和骨平衡。在骨折愈合和自噬的研究[12-13]中发现,在手术致大鼠骨折的损伤初期阶段LC3-Ⅱ与增殖细胞核抗体蛋白的表达都有明显的升高,并且两者之间存在相互关系;自噬增强剂雷帕霉素处理大鼠所构造的股骨骨折模型时能增加血管内皮生长因子和增殖细胞核抗体的表达水平,并且能显著增加成骨细胞数量和矿化结痂,提示自噬对骨折愈合可能具有潜在的积极作用。
细胞凋亡是细胞程序性死亡的过程,过度的细胞凋亡会引起组织的坏死或修复的减少,在许多疾病和损伤的机制中具有重要的生物学作用。凋亡和自噬这二者之间在功能上既存在广泛的联系,又有着明显的不同。自噬为凋亡所需,自噬通常发生在凋亡之前,进而启动凋亡;自噬也可抑制凋亡,保护细胞免于发生凋亡和坏死;自噬可以向凋亡转化,共同促进细胞死亡[6,14]。
本实验首先研究了血清饥饿对MC3T3-E1成骨细胞凋亡和自噬的影响,并初步探索了二者之间的相互关系。实验结果表明,血清饥饿会诱导MC3T3-E1成骨细胞的凋亡,同时也促进了MC3T3-E1成骨细胞的自噬。此外,通过自噬抑制剂3-MA的应用,本研究发现当抑制MC3T3-E1成骨细胞的自噬时,细胞的凋亡会明显增加,这说明自噬的存在可能会抑制MC3T3-E1成骨细胞凋亡的发生。接下来,本实验又研究了CGRP对MC3T3-E1成骨细胞自噬/凋亡的影响,结果表明,血清饥饿条件下,CGRP增强了细胞自噬并且抑制了MC3T3-E1成骨细胞的凋亡。进一步联用自噬抑制剂研究发现,CGRP对血清饥饿条件下MC3T3-E1成骨细胞凋亡的抑制作用被明显降低;这也反向说明了细胞自噬活性在CGRP对MC3T3-E1成骨细胞的保护中的重要性,这为CGRP在骨修复中的应用前景提供了新的证据,也为进一步揭示CGRP对成骨细胞的保护作用所涉及的机制提供了新的思路。
[1] Lamprou M, Kaspiris A, Panagiotopoulos E, et al. The role of pleiotrophin in bone repair[J]. Injury, 2014, 45(12):1816-1823.
[2] He H, Chai J, Zhang S, et al. CGRP May regulate bone metabolism through stimulating osteoblast differentiation and inhibiting osteoclast formation[J]. Mol Med Rep, 2016, 13 (5):3977-3984.
[3] Yan L, Yinghui T, Bo Y, et al. Effect of calcitonin generelated peptide on nitric oxide production in osteoblasts: an experimental study[J]. Cell Biol Int, 2011, 35(8):757-765.
[4] Mrak E, Guidobono F, Moro G, et al. Calcitonin gene-related peptide (CGRP) inhibits apoptosis in human osteoblasts by β-catenin stabilization[J]. J Cell Physiol, 2010, 225(3):701-708.
[5] Kang C, You YJ, Avery L. Dual roles of autophagy in the survival of Caenorhabditis elegans during starvation[J]. Genes Dev, 2007, 21(17):2161-2171.
[6] 朱文胤, 陈倩倩, 刘祁, 等. 饥饿诱导下小鼠成骨细胞自噬与凋亡相互作用研究[J]. 川北医学院学报, 2015, 30(2): 206-211. Zhu WY, Chen QQ, Liu Q, et al. Study on the interaction between autophagy and apoptosis of MC3 T3-E1 at starvation state[J]. J North Sichuan Med Col, 2015, 30(2):206-211.
[7] Zhao Z, Fu X, Zhang G, et al. The influence of RAMP1 overexpression on CGRP-induced osteogenic differentiation in MG-63 cells in vitro: an experimental study[J]. J Cell Biochem, 2013, 114(2):314-322.
[8] 王飞, 张慧宇, 窦予昕, 等. 降钙素基因相关肽通过Hippo通路调控小鼠骨髓间充质干细胞成骨分化的实验研究[J]. 华西口腔医学杂志, 2016, 34(3):286-290.
Wang F, Zhang HY, Dou YX, et al. Calcitonin gene-related peptide-induced osteogenic differentiation of mouse bone marrow stromal cells through Hippo pathway in vitro[J]. West Chin J Stomatol, 2016, 34(3):286-290.
[9] 蔡俊, 吕俊, 李适庭, 等. 降钙素基因相关肽通过抑制Nod样受体蛋白3表达促进小鼠成骨细胞分化的研究[J]. 华西口腔医学杂志, 2016, 34(1):12-16.
Cai J, Lü J, Li ST, et al. Calcitonin gene-related peptide inhibits the expression of Nod-like receptor protein 3 to promote osteoblast differen-tiation in mouse osteoblasts in vitro [J]. West Chin J Stomatol, 2016, 34(1):12-16.
[10] Mizushima N, Komatsu M. Autophagy: renovation of cells and tissues[J]. Cell, 2011, 147(4):728-741.
[11] Nollet M, Santucci-Darmanin S, Breuil V, et al. Autophagy in osteoblasts is involved in mineralization and bone homeostasis[J]. Autophagy, 2014, 10(11):1965-1977.
[12] Zhou Q, Luo D, Li T, et al. Bone fracture in a rat femoral fracture model is associated with the activation of autophagy [J]. Exp Ther Med, 2015, 10(5):1675-1680.
[13] Yang GE, Duan X, Lin D, et al. Rapamycin-induced autophagy activity promotes bone fracture healing in rats[J]. Exp Ther Med, 2015, 10(4):1327-1333.
[14] Yang YH, Chen K, Li B, et al. Estradiol inhibits osteoblast apoptosis via promotion of autophagy through the ER-ERK-mTOR pathway[J]. Apoptosis, 2013, 18(11):1363-1375.
(本文采编 李彩)
Effect of calcitonin gene-related peptide on MC3T3-E1 osteoblast apoptosis and autophagy induced by serum starvation
An Yang, Zhang Huiyu, Guo Junfeng, Li Xin, Yang Yang, Zhang Gang,Tan Yinghui. (Dept. of Oral and Maxillofacial Surgery, Xinqiao Hospital, The Third Military Medical University, Chongqing 400037, China)
Objective To study the effect of calcitonin gene-related peptide (CGRP) on apoptosis and autophagy of mouse MC3T3-E1 osteoblast and their interaction and to further clarify protective mechanism of CGRP on osteoblasts. Methods MC3T3-E1 osteoblasts of mouse were cultured in vitro. Western blot and flow cytometry were used to detect expressions of microtubule-associated protein 1 light chain 3 (LC3) and P62 protein of MC3T3-E1 osteoblasts cultured with serum culture and serum-free (serum starvation) culture. Western blot was also used to detect expressions of LC3 and P62 protein of MC3T3-E1 osteoblast cultured at different concentrations (10-10, 10-9, 10-8, and 10-7mol·L-1) or without added CGRP. MC3T3-E1 osteoblasts were treated with 10-8mol·L-1CGRP at different times (2, 6, 12, 24, 48, and 72 h), protein expression levels of LC3 were assessed by Western blot and flow cytometry, and changes in autophagosome in cells were detected by monodansylcadaverin staining. Autophagy inhibitor 3-methyladenine (3-MA) was used to pretreat MC3T3-E1 osteoblasts. Cells were then treated with or without CGRP for 24 h. Flow cytometry was used to detect apoptosis level.ResultsUnder serum starvation conditions, LC3Ⅱ expression and apoptosis of osteoblasts increased compared with that of serum culture. Under 3-MApretreatment and serum starvation conditions, LC3Ⅱ expression of osteoblasts increased compared with that of serum culture (P<0.01). Compared with serum culture, serum starvation culture with or without CGRP significantly increased expression level of LC3 and reduced expression level of P62. LC3Ⅱ/Ⅰ of osteoblasts was the highest under serum starvation and 10-8mol·L-1CGRP conditions. Serum starvation and 10-8mol·L-1CGRP culture inhibited apoptosis of osteoblasts and promoted synthesis of autophagosome. Apoptosis of osteoblasts increased after 3-MA pretreatment, and CGRP reversed inhibitory effects of 3-MA CGRP on apoptosis.ConclusionCGRP can increase autophagy of MC3T3-E1 osteoblasts under serum starvation conditions. CGRP may also inhibit apoptosis of MC3T3-E1 osteoblasts by promoting autophagy.
calcitonin gene-related peptide; osteoblast; autophagy; apoptosis
Q 25
A
10.7518/hxkq.2017.02.005
Supported by: The National Natural Science Foundation of China (81371110). Correspondence: Tan Yinghui, E-mail: tanyhxqkq@163.com.
2016-08-16;
2016-10-10
国家自然科学基金(81371110)
安洋,硕士,E-mail:anyangqq@163.com
谭颖徽,教授,博士,E-mail:tanyhxqkq@163.com
