不同咀嚼负荷对幼兔髁突软骨内印度豪猪蛋白-人甲状旁腺激素相关蛋白通路表达的影响
2017-05-04阎帆冯剑颖刘晨燕王盼孙哲施昌劲
阎帆 冯剑颖 刘晨燕 王盼 孙哲 施昌劲
浙江中医药大学口腔医学院,杭州 310053
·基础研究·
不同咀嚼负荷对幼兔髁突软骨内印度豪猪蛋白-人甲状旁腺激素相关蛋白通路表达的影响
阎帆 冯剑颖 刘晨燕 王盼 孙哲 施昌劲
浙江中医药大学口腔医学院,杭州 310053
目的 分析不同咀嚼负荷作用下,幼兔髁突软骨内印度豪猪蛋白(Ihh)-人甲状旁腺激素相关蛋白(PThrP)通路表达的差异性,探讨咀嚼应力负荷对髁突软骨Ihh-PThrP信号通路的影响。方法选取10 d龄幼兔48只,随机分为硬食组和软食组,分别喂以同种颗粒状(硬食)和粉状(软食),于饲养的第2、4、6、8周处死。采用苏木精-伊红(HE)染色、免疫组织化学、免疫印迹、实时定量荧光聚合酶链反应检测Ihh和PThrP mRNA和蛋白的动态变化。结果HE染色显示硬食组髁突软骨厚度高于软食组的厚度;第2、4、6、8周,Ihh蛋白、PThrP蛋白和mRNA表达量在两组中呈递减趋势;软食组中Ihh和PThrP蛋白以及mRNA表达量显著低于硬食组。结论较低的咀嚼负荷会造成髁突软骨生长因子Ihh和PThrP分泌减少,Ihh-PThrP通路表达迟缓,软骨发育受阻碍;适当的咀嚼负荷对髁突的正常发育有至关重要的作用。
髁突软骨; 咀嚼力; 印度豪猪蛋白; 甲状旁腺激素相关蛋白
髁突软骨作为髁突生长区,其形成与髁突发育和改建有着直接联系[1-2]。髁突软骨是一种继发性软骨,在形成过程中受到内部生长因子调控和局部周围环境影响的共同作用[3-5]。咀嚼压力作为局部环境影响因素,对髁突软骨形态结构发育具有重要的作用[6-7]。Kato等[8]研究证实,流质食物造成幼鼠髁突发育迟缓。本课题组前期研究[9]证明,咀嚼压力不足可能导致髁突软骨发育迟缓。咀嚼压力不仅导致髁突软骨发育迟缓,同时亦会影响软骨内重要生长因子及其相关信号通路的表达[3]。
印度豪猪蛋白(Indian hedgehog,Ihh)和人甲状旁腺激素相关蛋白(parathyroid hormone-like related protein,PThrP)已被证实是髁突软骨发育过程中调节髁突软骨细胞增殖分化的重要因子[10-11]。哺乳动物胚胎时期,Ihh和PThrP被观察到在软骨内大量分泌[11],但随着生长发育高峰到来,二者表达量逐步降低[12]。Jahan等[13]已证实胚胎期的下颌制动能够改变Ihh蛋白分泌,从而影响髁突发育。Huang等[14]的实验表明,Ihh和PThrP对于压力改变十分敏感。
本研究通过改变髁突咀嚼压力,观察Ihh和PThrP在髁突软骨内基因表达量及蛋白分泌和分布的差异性,分析Ihh-PThrP通路与咀嚼负荷间的关系,为进一步研究咀嚼压力对髁突生长发育的影响提供参考。
1 材料和方法
1.1 动物分组与模型建立
选取10 d龄健康未断奶幼兔48只,随机分为硬食组和软食组,分别喂以硬食颗粒饲料和由同种颗粒饲料碾磨而成的粉末状饲料。实验第1~14天,幼兔以母乳和饲料混合喂食,在实验第2周(幼兔28 d龄)断奶。幼兔每周称重,生病及健康状况不良的幼兔剔除实验。幼兔分别于实验第2、4、6、8周处死。
1.2 标本制备及染色
取幼兔双侧颞下颌关节标本,右侧关节样本在显微镜下剥离髁突软骨,放入液氮保存备用;左侧关节标本浸于4%多聚甲醛中24 h,浸于10%乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)溶液脱钙,然后修去多余组织,暴露髁突及关节盘,石蜡包埋,沿正中矢状面切成3 μm厚的连续切片,进行苏木精-伊红(hematoxylin-eosin,HE)染色。
1.3 软骨厚度比较
以骨和软骨的交界线的长度作为髁突周径,分为三等分,即前部、中部和后部,再将各部三等分,等分点作为测量点,用Leica Qwin测量软件测量髁突软骨厚度,取平均值作为该部位的软骨厚度(图1)。
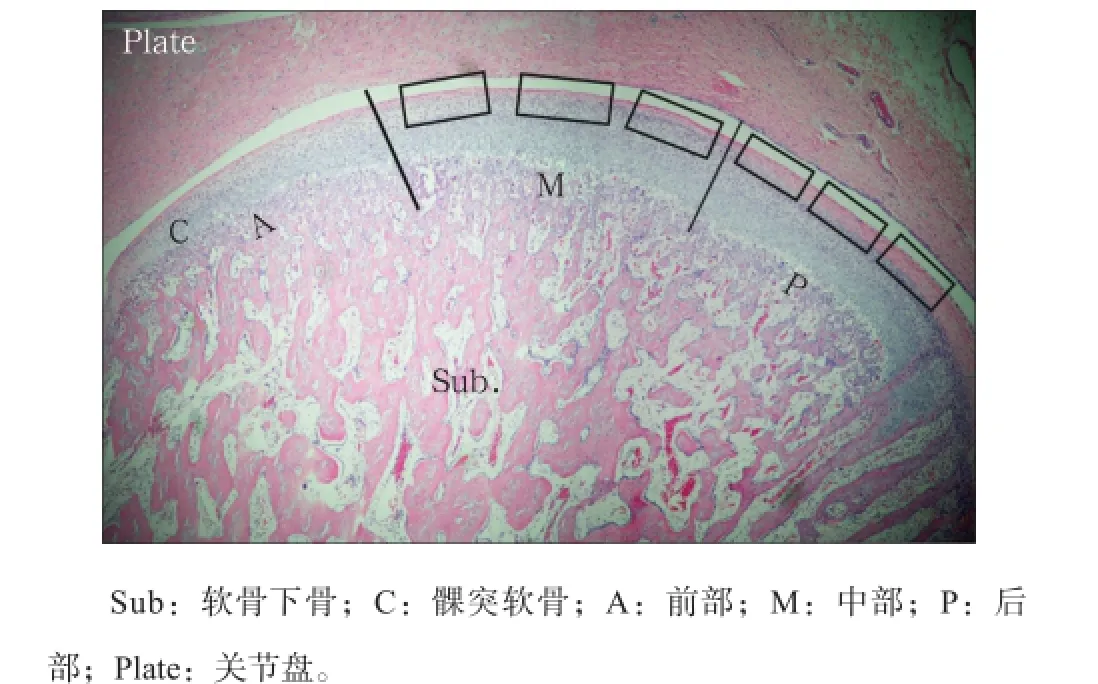
图1 髁突软骨划分示意图 HE × 100Fig1 Schematic diagram of the divided condylar cartilage HE × 100
1.4 Ihh蛋白免疫组织化学检测
样本切成厚3 μm连续切片,烤片。二甲苯脱蜡,梯度乙醇水化。蒸馏水洗,抗原修复。3%过氧化氢消除内源性过氧化物酶活性,加一抗(Santa Cruz:SC-13088)。4 ℃孵育过夜,加二抗室温孵育60 min,DAB显色,苏木精衬染,盐酸乙醇分化,封片。Band-Scan 5.0软件分析软骨前部光密度平均值。
1.5 实时定量荧光聚合酶链反应(polymerase chainreaction,PCR)
提取总RNA。采用Primer Premier 6.0和Beacon designer 7.8软件进行PCR引物设计,由上海生工生物工程股份有限公司合成,引物序列及内参序列见表1。各管中加含染料2×PCR TaqMix10 μL;加正反向引物各0.5 μL,向管中加入混合的cDNA各1 μL,各管补加水至20 μL。混匀,CFX384多重实时荧光定量PCR仪中进行95 ℃ 1 min;95 ℃ 15 s,63 ℃ 25 s,40个循环。

表1 引物序列和条件Tab1 Primers and conditions
1.6 免疫印迹
总蛋白提取试剂盒(Thermo Pierce:78510)提取总蛋白,采用BCA定量试剂盒进行总蛋白定量。十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gelelectrophoresis,SDSPAGE)电泳分析,转膜,放入T-TBS,室温封闭1 h。加一抗杂交,4 ℃孵育过夜。加二抗,室温孵育1 h。室温孵育转印膜,X-ray film曝光,显影和定影。BandScan 5.0软件分析条带的光密度值。
1.7 统计学方法
采用SPSS 19.0 统计软件对实验数据进行分析,配对t检验分析软硬食组间差异,检验水准α=0.05。非参数检验分析不同年龄组间差异。
2 结果
2.1 髁突软骨厚度
髁突软骨层前部最薄,逐渐增厚,后部最厚。软食组髁突前部软骨在第 2、4、6、8周时较硬食组薄,差异有统计学意义(P<0.05)。髁突中部软骨厚度在不同周龄软硬食组间差异均无统计学意义。软食组髁突后部软骨厚度在第2、4、6周时较硬食组厚,差异有统计学意义(P<0.05);第8周时软硬食两组后部软骨厚度接近,差异无统计学意义(表2)。
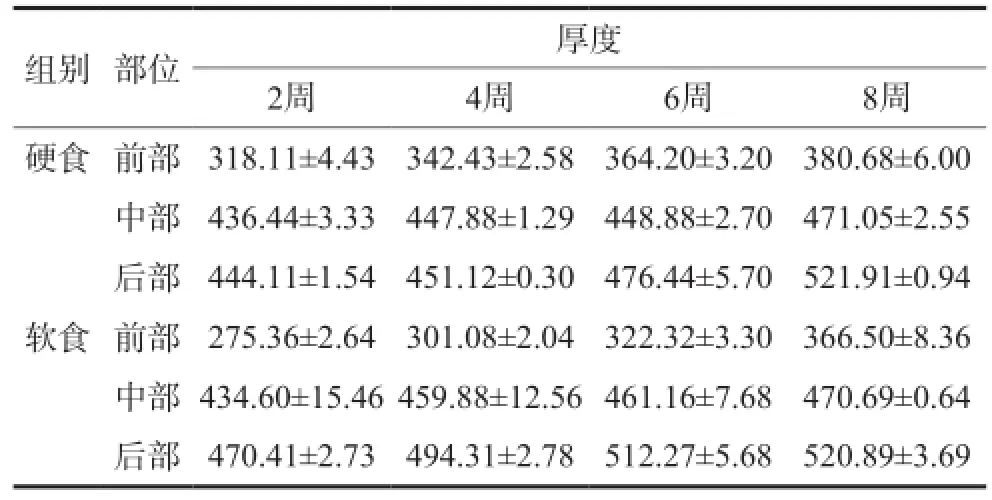
表2 髁突软骨前部、中部以及后部厚度比较Tab2 The difference of thickness of anterior, middle and posterior parts in condylar cartilage μm
2.2 Ihh蛋白免疫组织化学检测结果
Ihh蛋白表达位于髁突软骨肥大层浅层至纤维层的细胞外基质,肥大层浅层较集中。以时间轴观察,软硬食组髁突Ihh蛋白在2周为低表达,4周表达量达到高峰,6周后逐渐下降,8周少量表达(图2)。
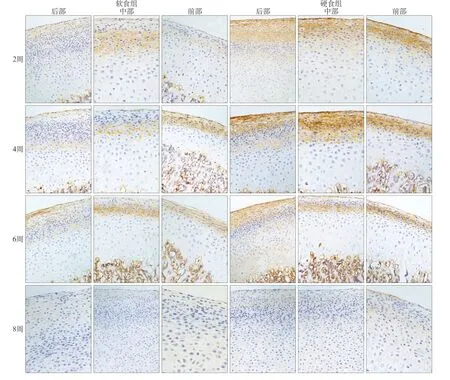
图2 第2、4、6、8周,不同咀嚼负荷下髁突内Ihh蛋白表达 免疫组织化学染色 × 200Fig2 The expression of Ihh in the condylar cartilage with altered mastication at 2, 4, 6, 8 weeks immunohistochemistry staining × 200
以髁突前中后部位比较分析,各周龄的硬食组Ihh蛋白表达量均较软食组高,其中前部、中部和后部在4、6、8周硬食组的表达显著高于软食组(P<0.05),其余组间无显著性差异(表3)。
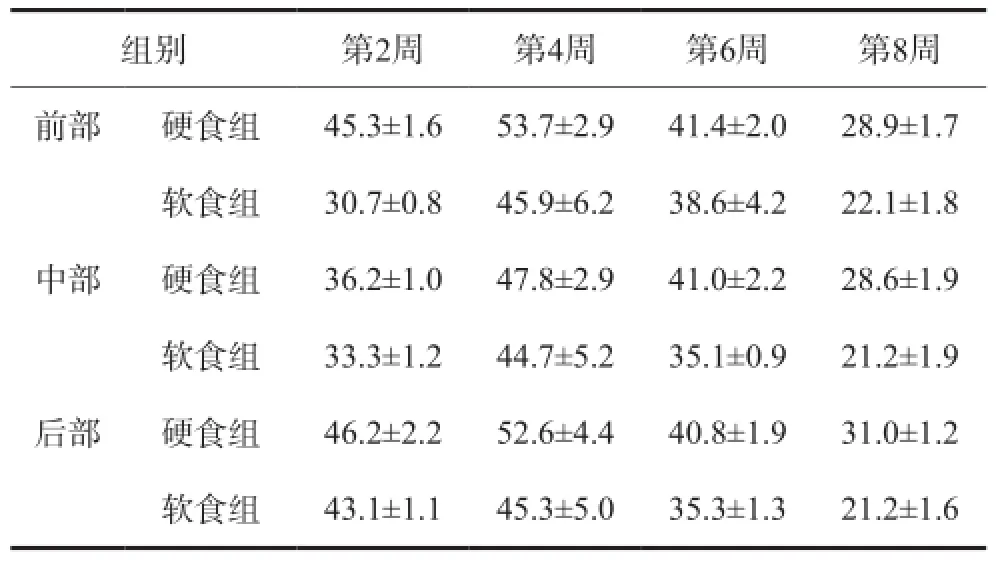
表3 不同咀嚼负荷下Ihh蛋白在髁突软骨内的表达量Tab3 The expression of Ihh in the condylar cartilage with altered mastication
2.3 Ihh和PThrP免疫印迹
Ihh和PThrP蛋白表达量硬食组明显高于软食组(图3),实验第2、4、6、8周表达量逐步减少,不同年龄组间具有差异。经统计学分析,Ihh和PThrP蛋白在第4、6周两组间差异有统计学意义(P<0.05),其他同年龄组间差异无统计学意义。第8周,软硬食组间各蛋白表达量相近(图4)。
2.4 Ihh和PThrP实时定量PCR
第2周至第4周Ihh和PThrP mRNA表达量升高,第4周达到顶峰,然后逐渐回落,各年龄硬食组的mRNA表达量均高于软食组。经统计分析,第6周两组间Ihh mRNA差异具有统计学意义(P<0.05),PThrP mRNA在第2周和第6周软硬食组间差异具有统计学意义(P<0.05),其他同年龄组间差异无统计学意义。第8周,软硬食组间各mRNA表达量相近(图4)。
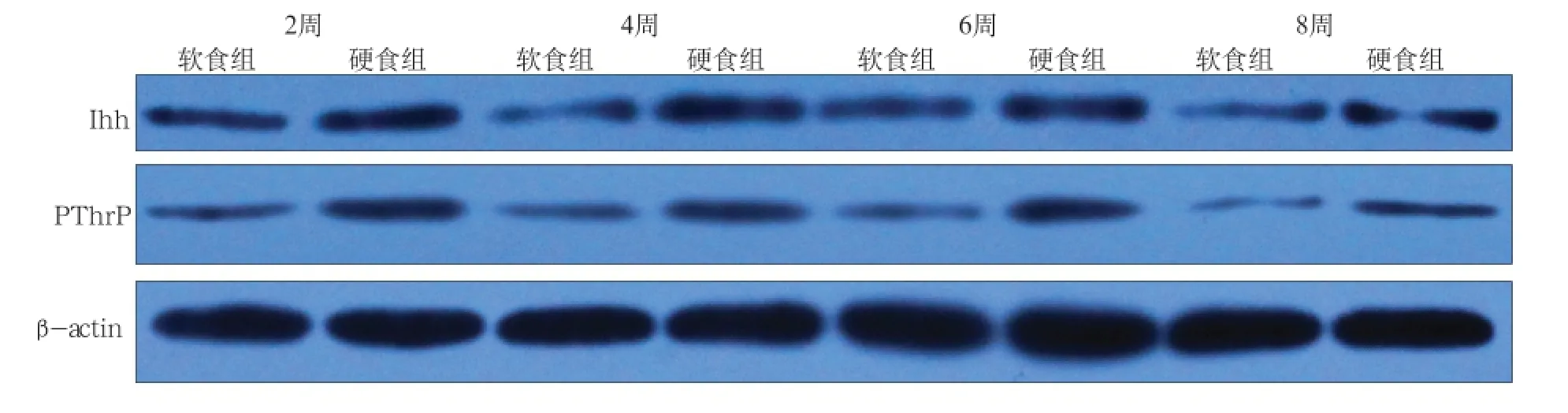
图3 第2、4、6、8周,不同咀嚼负荷下髁突内Ihh和PThrP蛋白免疫印迹表达Fig3 The expression of Ihh and PThrP proteins in the condylar cartilage with altered mastication at 2, 4, 6, 8 weeks through Western blot

图4 不同咀嚼负荷下Ihh、PThrP蛋白和mRNA在髁突软骨内的表达Fig4 The expression of Ihh and PThrP proteins and mRNA in the condylar cartilage with altered mastication
3 讨论
髁突软骨是髁突发育的基础。Orajärvi等[15]证实髁突软骨对咀嚼负荷压力的改变非常敏感。适当的咀嚼负荷有助于髁突软骨细胞增殖,髁突软骨的正常发育。本研究发现,第2、4、6、8周,硬食组髁突软骨前部的厚度明显高于软食组中软骨的厚度,尤以前斜面最显著。Utreja等[16]研究结果显示,改变幼鼠髁突的机械负荷,会造成幼鼠髁突软骨细胞增殖分化以及细胞外基质蛋白表达异常,同样也是在前斜面最明显。提示了适当的咀嚼压力有助于促进髁突软骨细胞,特别是前斜面区软骨细胞的增殖分化。而咀嚼压力刺激不足的软食组,前期髁突软骨明显发育滞后。8周后髁突软骨厚度与硬食组厚度相差无几。推测可能是由于髁突软骨细胞增殖活性除受到咀嚼负荷刺激影响外,也受机体生长发育内因素调控,后者在发育后期占主导地位。
Ihh和PThrP是调控髁突软骨细胞增殖分化的关键生长因子[4,10],促进软骨细胞的增殖,延缓分化作用,其调控机制直接影响到髁突软骨细胞的终末分化,二者形成负反馈的表达机制,共同影响髁突发育[17]。近年来研究[3]显示,不同的咀嚼压力会导致髁突软骨内各蛋白和基因的表达量改变,从而影响髁突软骨发育。根据Deng等[18]的研究,PThrP在胚胎发育期主要分布于肥大细胞层,而PThrP的缺乏会造成髁突形态发育不足[19],证明PThrP的分泌表达对于髁突发育至关重要。第2、4、6、8周,幼兔进入生长发育高峰,虽然PThrP蛋白和mRNA的表达量总体趋势降低,但mRNA的表达量在第2~4周先进入高峰,再降低,与之前的研究结果[12,20]均不同,需要实验进一步验证。由于PThrP对压力的敏感性高,本研究中,在不同咀嚼负荷作用下,硬食组中PThrP蛋白和mRNA的表达量明显高于软食组。在Jahan等[13]的研究中,下颌骨制动造成髁突咀嚼压力减小,发现PThrP分泌减少。暗示当咀嚼压力降低,PThrP分泌受到抑制,进一步得出咀嚼负荷对PThrP的重要性。
Ihh是一个活跃的机械信号传导因子,能够将机械信号转化成生物信号,在调节细胞增殖分化中起着重要作用[13-14]。适当的机械压力刺激能使Ihh促进软骨细胞增殖,从而影响髁突软骨的发育与改建[21]。本研究中可以观察到Ihh蛋白主要分布于髁突软骨肥大层浅层至纤维层,与前期的研究结果一致。本实验观察到Ihh蛋白在前中后3个部分表达与软骨生长厚度是相适应的。咀嚼压力升高,不但刺激Ihh蛋白分泌量升高,进一步促进髁突软骨快速生长;压力不足,则使Ihh蛋白分泌减少,软骨生长缓慢。这一结果提示Ihh与调节髁突软骨形成代谢有密切联系。Chau等[11]对出生后幼鼠软骨内Ihh蛋白主要分布的研究,也证明Ihh蛋白对于软骨发育具有重要意义。但研究中Ihh免疫组织化学和免疫印迹结果不完全一致,可能是由于免疫组织化学分髁突区段来比较蛋白表达,而免疫印迹则检测整个髁突软骨蛋白表达。随着幼兔进入生长发育高峰期,Ihh蛋白和mRNA的表达量总体为逐步降低,这一总体趋势与Semevolos等[12]关于软骨和年龄相关性的研究结果类似。Ihh mRNA的表达量在2~4周进入顶峰,再回落,同Watahiki等[20]研究结果类似,峰值出现的原因需要进一步实验探究。另外,即使由于发育期咀嚼压力不同造成Ihh蛋白表达差异,却并没有造成生长因子的异常分泌过度或不足。造成这一现象的原因可能是,软食刺激所产生的弱负荷不足以使髁突产生病理性改变,而较强的咀嚼负荷更容易使髁突产生病变。第2~8周,在不同咀嚼负荷的作用下,硬食组中Ihh蛋白和mRNA的表达量明显高于软食组。Chen等[6]通过改变髁突软骨的压力,同样得出当降低咀嚼压力,Ihh蛋白的表达会降低,表明适当的咀嚼压力,能够刺激髁突软骨内生长因子分泌表达,髁突软骨细胞增殖加快,从而促进髁突形态结构发育。第8周软硬食组中Ihh、PThrP的蛋白和mRNA的表达量趋于一致,原因同样可能与机体内因素调控有关。研究结果提示适当的咀嚼压力作用有利于Ihh-PThrP通路中蛋白分子的表达,刺激髁突软骨细胞分化和发育。
综上所述,髁突软骨内Ihh-PThrP通路的表达受到不同咀嚼负荷的影响,而弱的咀嚼压力会阻滞相关生长因子分泌表达,从而延缓髁突软骨发育。因此,适当的咀嚼负荷对Ihh-PThrP通路表达和髁突发育起到至关重要的作用。
[1] Blackwood HJ. Growth of the mandibular condyle of the rat studied with tritiated thymidine[J]. Arch Oral Biol, 1966, 11(5):493-500.
[2] Carlson DS, McNamara JA Jr, Jaul DH. Histological analysis of the growth of the mandibular condyle in the Rhesus monkey (Macaca mulatta)[J]. Am J Anat, 1978, 151(1): 103-117.
[3] Enomoto A, Watahiki J, Nampo T, et al. Mastication markedly affects mandibular condylar cartilage growth, gene expression, and morphology[J]. Am J Orthod DentofacialOrthop, 2014, 146(3):355-363.
[4] Hinton RJ, Jing J, Feng JQ. Genetic influences on temporomandibular joint development and growth[J]. Curr Top Dev Biol, 2015, 115:85-109.
[5] Hinton RJ. Genes that regulate morphogenesis and growth of the temporomandibular joint: a review[J]. Dev Dyn, 2014, 243(7):864-874.
[6] Chen J, Sorensen KP, Gupta T, et al. Altered functional loading causes differential effects in the subchondral bone and condylar cartilage in the temporomandibular joint from young mice[J]. Osteoarthritis Cartilage, 2009, 17(3):354-361.
[7] Miyazaki M, Yonemitsu I, Takei M, et al. The imbalance of masticatory muscle activity affects the asymmetric growth of condylar cartilage and subchondral bone in rats[J]. Arch Oral Biol, 2016, 63:22-31.
[8] Kato T, Takahashi S, Domon T. Effects of a liquid diet on the temporomandibular joint of growing rats[J]. Med Princ Pract, 2015, 24(3):257-262.
[9] 刘晨燕, 冯剑颖, 谷志远. 咀嚼负荷对幼兔髁突软骨细胞BrdU标记影响的研究[J]. 口腔医学, 2015, 35(4):250-253, 286.
Liu CY, Feng JY, Gu ZY. Effect of masticatory force on cell proliferation of the condylar cartilage in growing rabbits using Bromodeoxyuridine labeling[J]. Stomatology, 2015, 35(4):250-253, 286.
[10] Sugito H, Shibukawa Y, Kinumatsu T, et al. Ihh signaling regulates mandibular symphysis development and growth [J]. J Dent Res, 2011, 90(5):625-631.
[11] Chau M, Forcinito P, Andrade AC, et al. Organization of the Indian hedgehog-parathyroid hormone-related protein system in the postnatal growth plate[J]. J Mol Endocrinol, 2011, 47(1):99-107.
[12] Semevolos SA, Nixon AJ, Fortier LA, et al. Age-related expression of molecular regulators of hypertrophy and maturation in articular cartilage[J]. J Orthop Res, 2006, 24(8): 1773-1781.
[13] Jahan E, Matsumoto A, Rafiq AM, et al. Fetal jaw movement affects Ihh signaling in mandibular condylar cartilage development: the possible role of Ihh as mechanotransduction mediator[J]. Archives of Oral Biology, 2014, 59(10): 1108-1118.
[14] Huang L, Cai X, Li H, et al. The effects of static pressure on chondrogenic and osteogenic differentiation in condylar chondrocytes from temporomandibular joint[J]. Arch Oral Biol, 2015, 60(4):622-630.
[15] Orajärvi M, Puijola E, Yu SB, et al. Effect of estrogen and dietary loading on condylar cartilage[J]. J Orofac Pain, 2012, 26(4):328-336.
[16] Utreja A, Dyment NA, Yadav S, et al. Cell and matrix response of temporomandibular cartilage to mechanical loading [J]. Osteoarthr Cartil, 2016, 24(2):335-344.
[17] Long F, Ornitz DM. Development of the endochondral skeleton[J]. Cold Spring Harb Perspect Biol, 2013, 5(1): a008334.
[18] Deng Z, Liu Y, Wang C, et al. Involvement of PI3K/Akt pathway in rat condylar chondrocytes regulated by PTHrP treatment[J]. Arch Oral Biol, 2014, 59(10):1032-1041.
[19] Ishii-Suzuki M, Suda N, Yamazaki K, et al. Differential responses to parathyroid hormone-related protein (PTHrP) deficiency in the various craniofacial cartilages[J]. Anat Rec, 1999, 255(4):452-457.
[20] Watahiki J, Yamaguchi T, Irie T, et al. Gene expression profiling of mouse condylar cartilage during mastication by means of laser microdissection and cDNA array[J]. J Dent Res, 2004, 83(3):245-249.
[21] Ng TC, Chiu KW, Rabie AB, et al. Repeated mechanical loading enhances the expression of Indian hedgehog in condylar cartilage[J]. Front Biosci, 2006, 11: 943-948.
(本文编辑 杜冰)
Influence on Indian hedgehog-parathyroid hormone-like related protein pathway induced by altered masticatory loading in the condylar cartilage of growing rabbits
Yan Fan, Feng Jianying, Liu Chenyan, Wang Pan, Sun Zhe, Shi Changjing. (College of Stomatology, Zhejiang Chinese Medical University, Hangzhou 310053, China)
Objective To determine the influence of altered masticatory loading on Indian hedgehog (Ihh)-parathyroid hormone-like related protein (PThrP) pathway in the condylar cartilage of growing rabbits.MethodsA total of 48 10-dayold rabbits were randomly divided into two groups and fed different kinds of food, such as solid diet and soft diet. The animals were sacrificed after 2, 4, 6, and 8 weeks. Difference of Ihh and PThrP expression levels induced by altered masticatory loading was tested by hematoxylin-eosin (HE), immunohistochemistry, Western blot, and real-time polymerase chain reaction (PCR).ResultsThe thickness of condylar cartilage and expression levels of Ihh and PThrP proteins and mRNA of the solid diet groups exceeded those of the soft diet groups. The decreasing tendencies of the expression levels of Ihh and PThrP proteins and mRNA were observed at 2, 4, 6, 8 weeks.ConclusionLow masticatory loading may delay or inhibit the development of condylar cartilage and its growing factors Ihh and PThrP. Therefore, masticatory loading plays an important role in the development of condylar cartilage.
condylar cartilage; mastication; Indian hedgehog; parathyroid hormone-like related protein
Q 257
A
10.7518/hxkq.2017.02.004Supported by: The National Natural Science Foundation of China(81200802); Zhejiang Provincial Natural Science Foundation (Y2111273). Correspondence: Feng Jianying, E-mail: twohorsejy@163.com.
2016-06-13;
2016-11-13
国家自然科学基金(81200802);浙江省自然科学基金(Y2111273)
阎帆,住院医师,硕士,E-mail:648467706@qq.com
冯剑颖,副教授,博士,E-mail:twohorsejy@163.com
