赖氨酸芽孢杆菌产氨基甲酸乙酯水解酶的发酵条件优化
2017-05-03王伟高周景文
王伟高, 陈 坚,3, 周景文*
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;2.江南大学 食品安全与营养协同创新中心,江苏 无锡214122;3.江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡214122)
赖氨酸芽孢杆菌产氨基甲酸乙酯水解酶的发酵条件优化
王伟高1,2, 陈 坚1,2,3, 周景文*1,2
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;2.江南大学 食品安全与营养协同创新中心,江苏 无锡214122;3.江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡214122)
氨基甲酸乙酯是发酵酒精饮料及发酵食品中一种广泛存在的致癌物,酶法降解是解决氨基甲酸乙酯污染的重要途径之一。作者以一株来源于小鼠胃部具有水解氨基甲酸乙酯活性的菌株Lysinibacillus fusiformis SC02为出发菌株,通过摇瓶水平单因素实验对其产酶条件进行了优化。优化后的培养基组成为:半乳糖25 g/L,大豆蛋白胨20 g/L,尿素4 g/L,硫酸铜0.02 g/L,pH 6.0。最佳产酶的发酵条件为:发酵温度37℃,接种体积分数3%,装液量20 mL/250 mL。在上述优化的培养基和培养条件下,产酶水平由900 U/L提高到4 500 U/L,提高了350%。在3 L发酵罐水平上初步探究了不同搅拌转速对菌株产酶的影响。当搅拌转速达到800 r/min,菌株最高酶活水平由4 500 U/L提高到7 066 U/L,提高了57%。
氨基甲酸乙酯水解酶;发酵条件优化;芽孢杆菌;发酵食品
氨基甲酸乙酯(Ethyl carbamate,EC)是一种2A级致癌物[1-2],在黄酒等酒精饮料及酱油等发酵食品中广泛存在[3-8]。氨基甲酸乙酯主要是在食品的发酵和长期储存过程中自发产生[9-10]。
目前对氨基甲酸乙酯的控制策略一般有物理法、化学法和生物法三种,其中物理法容易造成风味物质的损失,化学法容易造成环境污染和食品安全问题[11]。生物法主要分为对生产菌株的代谢改造、酶法降解其前体物质及酶法直接降解氨基甲酸乙酯[11]。关于酶法降解目前的研究主要集中在利用酸性脲酶[10,12]降解氨基甲酸乙酯前体物尿素。然而氨基甲酸乙酯化学性质稳定,一旦形成很难消除,因此酶法降解氨基甲酸乙酯对于解决发酵食品中氨基甲酸乙酯所造成的食品安全问题具有十分重要的意义[13]。目前针对氨基甲酸乙酯水解酶的报道大部分集中在对其产酶菌株的筛选[14-18],仅有少量关于来自粘质红酵母的氨基甲酸乙酯水解酶的优化报道[19]。
作者针对前期实验室从小鼠胃肠道分离得到菌株Lysinibacillus fusiformis SC02,从发酵培养基组分和发酵条件等方面考察这些因素对该菌发酵生产氨基甲酸乙酯水解酶的影响,以获得该菌发酵生产氨基甲酸乙酯水解酶的最优条件。
1 材料与方法
1.1 菌种与材料
1.1.1 菌种 作者所在研究室保藏的赖氨酸芽孢杆菌SC02,-80℃甘油管保藏。
1.1.2 主要试剂 半乳糖、硫酸铜、尿素、大豆蛋白胨等:均为国产分析纯,购自国药有限公司;酵母粉、蛋白胨等:购自OXOID公司;其他试剂:均为分析纯,购自国药有限公司。
1.1.3 主要设备与仪器 H-B1-420BS电热恒温培养箱:上海跃进医疗器械有限公司;DGX9053B-1电热鼓风干燥箱:上海福玛实验设备有限公司;DKI-Ⅱ恒温调速回转式摇床:上海杜科自动化设备有限公司;UVmini-1240紫外可见分光光度计:Shimadzu公司;DKZ系列电热恒温振荡水槽:上海一恒科技有限公司;5840 R型高速低温离心机:Eppendorf公司;EL204电子天平:Mettler Toledo公司;3 L发酵罐:New Brunswick Scientific Co.,NJ,USA。
1.1.4 培养基
1)活化培养基:酵母粉5 g/L,蛋白胨10 g/L,氯化钠10 g/L,琼脂2.5 g/dL。
2)种子培养基:酵母粉5 g/L,蛋白胨10 g/L,氯化钠10 g/L。
3)发酵初始培养基:蛋白胨 16 g/L,NaCl 5 g/L,酵母提取物10 g/L。
1.1.5 显色试剂
1)显色剂Ⅰ:称取15 g苯酚和0.625 g亚硝基铁氰化钠,用超纯水定容至250 mL。
2)显色剂Ⅱ:称取13.125 g NaOH和7.5 mL NaClO,用超纯水定容至250 mL。
3)终止剂:称取10 g三氯乙酸,用超纯水定容至100 mL。
1.2 试验方法
1.2.1 种子培养 将用甘油保存的菌株接种于活化培养基上,划线培养,挑取单菌落接种于种子培养基中,种子培养基条件为装液量20 mL/250 mL,温度37℃,摇床转速200 r/min,培养时间12 h。
1.2.2 摇床发酵培养 将种子培养基中的菌液以1%的接种体积分数接种于发酵培养基中,培养条件为装液量20 mL/250 mL,温度37℃,摇床转速200 r/min,培养时间15 h。
1.2.3 Berthelot reaction比色法测定氨基甲酸乙酯水解酶酶活 取酶液1 mL,加入1 mL 3%EC溶液,37℃反应30 min,再加入1 mL终止剂,混匀后加入1 mL的显色剂Ⅰ和1 mL显色剂Ⅱ,强烈振荡,37℃保温20 min后取出,用超纯水稀释到10 mL,625 nm处比色,并记录OD值,根据铵离子标准曲线计算酶活[20]。空白对照为先加反应终止剂,再加反应底物。酶活单位(U):在常压、37℃、pH7.0条件下,每分钟分解EC产生1μmol氨为一个酶活力单位(U)。
1.2.4 发酵培养基优化 对碳源、氮源、金属离子Mn2+、Cu2+、Zn2+、Fe2+、Fe3+、Co2+、Mg2+、Ni2+等培养基成分进行设计培养,15 h取样测定氨基甲酸乙酯水解酶活力。
1.2.5 培养条件优化 选用温度、pH、接种体积分数和装液量等发酵条件进行设计,研究其对该芽孢杆菌产氨基甲酸乙酯水解酶活力的影响。
1.2.6 添加底物对产酶的影响 在培养基中添加不同浓度的氨基甲酸乙酯,研究其对该菌产氨基甲酸乙酯水解酶活力的影响。
2 结果与分析
2.1 摇瓶水平优化
2.1.1 最适碳源及最佳添加量 分别选用乳糖、蔗糖、果糖、半乳糖、葡萄糖、麦芽糖、甘油7种碳源作为惟一碳源,添加到发酵初始培养基中,使每种碳源的碳质量浓度都为8 g/L,考察其对氨基甲酸乙酯水解酶产量的影响,结果见图1。可以看出,在相同碳源添加量的情况下,最佳碳源为半乳糖,产酶活力为1 068 U/L;以半乳糖为最佳碳源,考察不同质量浓度半乳糖对酶产量的影响,结果见图2。最佳质量浓度为25 g/L,产酶活力为1 200 U/L。

图1 不同碳源对菌体产酶的影响Fig.1 Effects of various carbon sources on urethanase production
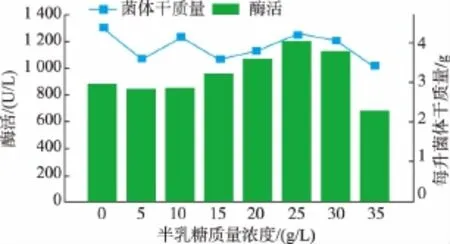
图2 半乳糖质量浓度对菌体产酶的影响Fig.2 Effects of different galactose addition on urethanase production
2.1.2 最适氮源及最佳添加量 在最佳碳源的基础上,选用氯化铵、硫酸铵、尿素、大豆蛋白胨、酵母粉、蛋白胨、玉米浆,分别以3 g/L的含氮质量浓度替换初始培养基中的蛋白胨,考察它们对产酶的影响。从图3可以看出,以大豆蛋白胨为氮源的酶活最高,尿素仅次于大豆蛋白胨。因而选择大豆蛋白胨为有机氮源,以尿素为无机氮源,分别研究大豆蛋白胨的最适质量浓度以及尿素的最适质量浓度,结果见图4-5。可以看出,大豆蛋白胨的最佳质量浓度为20 g/L,尿素最佳质量浓度为4 g/L,产酶活力提高至2 000 U/L。
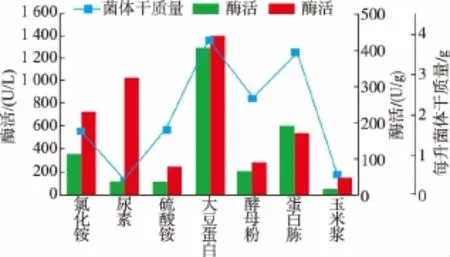
图3 不同氮源对菌体产酶的影响Fig.3 Effects of various nitrogen sources on urethanase production
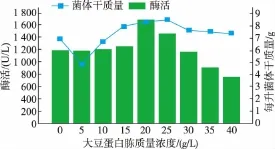
图4 不同大豆蛋白胨添加量对菌体产酶的影响Fig.4 Effects of different soy peptone addition on urethanase production

图5 尿素质量浓度对菌体产酶的影响Fig.5 Effects of different urea concentration on urethanase production
2.1.3 金属离子的优化 选用8种常见金属离子Mn2+、Cu2+、Zn2+、Fe2+、Fe3+、Co2+、Mg2+、Ni2+,考察了不同质量浓度金属离子对赖氨酸芽孢杆菌产氨基甲酸乙酯水解酶的影响,结果见表1。不同质量浓度和种类的金属离子对产酶有不同影响,其中Ni2+、Fe3+、Cu2+对酶活提高较明显。选择此三种金属离子,探究其最佳质量浓度,比较各自最佳质量浓度下单独和同时添加对酶活力的影响,结果见图6。可以看出,单独添加Cu2+至终质量浓度为0.02 g/L时,酶活提高至4 534 U/L,而同时添加三种离子的酶产量低于单独添加铜离子的产量,因而选择铜离子质量浓度为0.02 g/L。

表1 8种金属离子不同浓度对酶活的影响Table1 Effects of different concentration of eight metal ions on urethanase production 酶活(U/L)

图6 不同金属离子添加对菌体产酶的影响Fig.6 Effects of addition of different metal ions on urethanase production
2.1.4 发酵温度优化 选择28、30、37、40℃研究发酵温度对产酶的影响。结果见图7。当培养温度为37℃时,酶活力最高,菌体生长最好。

图7 不同温度对菌体产酶的影响Fig.7 Effects of different temperatures on urethanase production
2.1.5 初始 pH优化 选择初始 pH 5.0、6.0、7.0、8.0、9.0研究对Lysinibacillus fusiformis SC02产酶的影响,结果见图8。可知最佳初始pH为6.0。pH过高或过低酶活都下降,其原因可能为该芽孢杆菌表达氨基甲酸乙酯水解酶需要在弱酸的环境下进行,pH过低或过高都不利于该酶的表达。
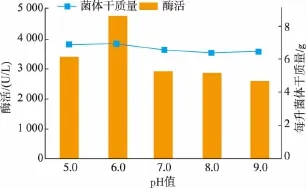
图8 不同初始pH对菌体产酶的影响Fig.8 EffectsofvariousinitialpH on urethanase production
2.1.6 接种体积分数优化 选取1%、3%、5%、7%和9%5个接种体积分数。研究对产酶的影响,结果见图9。可以看出,当接种体积分数为3%时,酶活力达到最高值。
2.1.7 装液量优化 选择20、30、40 mL三个装液量研究对产酶的影响,结果见图10。可以看出,最佳装液量为20 mL/250 mL,此时最高酶活为4 500 U/L。随着装液量的增加,酶活急剧下降。
2.2 发酵罐水平转速优化
选择400、600、800、1 000 r/min 4个发酵转速来研究其对产酶的影响,结果见图11。4种转速条件下产酶趋势相同,然而当转速从400 r/min增加到600 r/min时,最高酶活出现时间由10 h缩短为8 h,提前了2 h。当搅拌转速增加至800 r/min时,最高酶活达到7 000 U/L,最高酶活随着搅拌转速的增加又降低至5 000 U/L,说明过高的搅拌转速不利于菌体产酶。

图9 不同接种体积分数对菌体产酶的影响Fig.9 Effects of various inoculum volume on urethanase production

图10 不同装液量对菌体产酶的影响Fig.10 Effects of various liquid volume in flask on urethanase production
从菌体干质量曲线可以看出,当搅拌转速控制在400 r/min时,菌体干质量为7 g/L,然而当搅拌转速增加至1 000 r/min时,菌体干质量降低至6.25 g/ L,这说明剪切力较高的确不利于菌体生长。
从残糖曲线可以看出,从接种后开始2 h内,残糖质量浓度下降较大,这是由于菌体生长需要消耗碳源提供能量。当发酵进行至第6小时后,残糖质量浓度趋于稳定,这说明菌体不再利用碳源。对比各批次残糖曲线可以看出,发酵结束后的残糖质量浓度随着转速的增加而降低,当转速增加至1 000 r/min时,发酵结束后的残糖质量浓度降低至18 g/L,然而此时菌体干质量却最低,说明耗掉的葡萄糖并没有完全用于菌体生长,原因可能是较高的转速可能引起还原糖的氧化。
对比各批次产酶曲线和残糖曲线发现,葡萄糖的利用效果较差,整个发酵过程糖耗不足10 g/L。葡萄糖质量浓度过高会增加培养基的渗透压,不利于菌体生长,因此可以尝试降低发酵培养基中葡萄糖质量浓度。
对比各个批次发酵过程的pH变化曲线和产酶曲线可以看出,随着发酵过程的进行,发酵液的pH逐渐增加。在发酵的前6小时,发酵液的pH从6.5急剧增加至9.0。原因是该过程菌体产酶需要消耗大量的氮源,从而导致pH增加。当发酵液pH在7~8.5之间时,菌体生长和产酶急剧上升。因此,下一步可以尝试在pH 7~8.5选择最适pH,通过控制恒定pH的方法来促进菌体生长产酶。
对比各批次溶解氧变化曲线和产酶曲线可以看出,在接种后的4 h内,溶解氧急剧下降,此时是因为菌体生长需要消耗掉过多的氧气。随着发酵时间的延长,溶解氧在第四个小时之后呈现反弹趋势,这说明菌体耗氧速率逐渐降低。当酶活达到最高时,溶解氧浓度趋于100%,说明此时菌体停止生长。对比各批次溶解氧曲线可以发现,随着溶解氧的增加,产酶速率和最高酶活都呈现下降趋势,当转速增加至1 000 r/min时,最低溶解氧浓度为80%,此时菌体的最高酶活仅为5 000 U/L,这说明过高的溶解氧对菌体生长不利。因此,下一步可以尝试将溶解氧浓度控制在80%以下来探究溶解氧浓度对菌体生长的影响,选择最适溶解氧浓度。
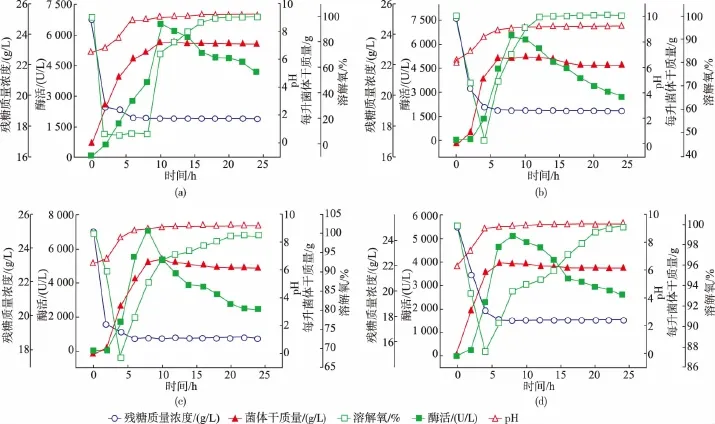
图11 不同搅拌转速对菌体产酶的影响Fig.11 Different agitation speeds on urethanase production
3 结语
通过单因素优化实验对赖氨酸芽孢杆菌产氨基甲酸乙酯水解酶培养基成分及培养条件进行优化。优化后的培养基为:酵母提取物10 g/L,NaCl 5 g/L,半乳糖 25 g/L,大豆蛋白胨 20 g/L,尿素4 g/L。 CuSO40.02 g/L,初始pH 6.0。培养条件:37℃,接种体积分数3%,装液量20 mL/250 mL。与原始培养条件下酶活力900 U/L相比,酶活提高了350%。通过在3 L发酵罐水平探究不同转速对产酶影响,发现当转速控制在800 r/min时,发酵10 h酶活由4 500 U/L提高到7 066 U/L,提高了57%。
参考文献:
[1]Nettleship A,Henshaw P S,Meyer H L.Induction of pulmonary tumors in mice with ethyl carbamate (urethane)[J].Journal of the National Cancer Institute,1943,52(3):290-295.
[2]Weber J,Sharypov V.Ethyl Carbamate in Foods and Beverages[M].Netherlands:Springer,2009:429-452.
[3]Lofroth G,Gejvall T.Diethyl pyrocarbonate:Formation of urethane in treated beverages[J].Science,1971,174(4015):1248-1250.
[4]Shi W,Liu X,Zhao Y,et al.Residue level of ethyl carbamate in fermented foods[J].China Brewing,2009,212(11):124-126.(in Chinese)
[5]Lee K G.Analysis and risk assessment of ethyl carbamate in various fermented foods[J].European Food Research and Technology,2013,236(5):891-898.
[6]Jagerdeo E,Dugar S,Foster G D,et al.Analysis of ethyl carbamate in wines using solid-phase extraction and multidimensional gas chromatography/mass spectrometry[J].Journal of Agricultural and Food Chemistry,2002,50(21):5797-5802.
[7]Schmeltz I,Chiong K G,Hoffmann D.Formation and determination of ethyl carbamate in tobacco and tobacco smoke[J]. Journal of Analytical Toxicology,1978,2(6):265-268.
[8]WU S j,WANG H X.Research advancement of ethyl carbamate in fermented food[J].Chemistry&Bioengineering,2009,9:5. [9]Riffkin H L,Wilson R,Howie D,et al.Ethyl carbamate formation in the production of pot still whisky[J].Journal of the Institute of Brewing,1989,95(2):115-119.
[10]Monteiro F F,Trousdale E K,Bisson L F.Ethyl carbamate formation in wine:use of radioactively labeled precursors to demonstrate the involvement of urea[J].American Journal of Enology and Viticulture,1989,40(1):1-8.
[11]Zhao X,Du G,Zou H,et al.Progress in preventing the accumulation of ethyl carbamate in alcoholic beverages[J].Trends in Food Science&Technology,2013,32(2):97-107.
[12]Kobashi K,Takebe S,Sakai T.Removal of urea from alcoholic beverages with an acid urease[J].Journal of Applied Toxicology,1988,8(1):73-74.
[13]BU Panpan,CHEN Jian,DU Guocheng,et al.Purification and charalterization of a halophilic urethanase from Klebiella pneumoniae[J].Chinese Journal of Biotechnology,2014,30(3):404-411.(in Chinese)
[14]Zha X H,Gu X L,Zhou N D,et al.Purification and Characterization of a urethanase from Penicillium variabile[J].Applied Biochemistry and Biotechnology,2014,172(1):351-36.
[15]Zhao C J,Imamura L,Kobashi K.Urethanase of Bacillus licheniformis sp.isolated from mouse gastrointestine[J].Chemical& Pharmaceutical Bulletin,1991,39(12):3303-3306.
[16]Zhou N D,Gu X L,Tian Y P.Isolation and characterization of urethanase from Penicillium variabile and its application to reduce ethyl carbamate contamination in Chinese rice wine[J].Applied Biochemistry and Biotechnology,2013,170(3):718-728.
[17]Mohapatra B,Bapuji M.Characterization of urethanase from Micrococcus species associated with the marine sponge(Spirasfrella species)[J].Letters in Applied Microbiology,1997,25(6):393-396.
[18]KobashiK,Takebe S,Sakai T.Urethane-hydrolyzing enzyme from Citrobacter sp[J].Chemical&Pharmaceutical Bulletin,1990,38(5):1326-1328.
[19]Wu Q,Zhao Y,Wang D,et al.Immobilized Rhodotorula mucilaginosa:a novel urethanase-producing strain for degrading ethyl carbamate[J].Applied Biochemistry and Biotechnology,2013,171(8):2220-2232.
[20]Scheiner D.Determination of ammonia and Kjeldahl nitrogen by indophenol method[J].Water Research,1976,10(1):31-36.
Optimization of the Fermentation Conditions for Producing Urethanase by Lysinibacillus fusiformis
WANG Weigao1,2, CHEN Jian1,2,3, ZHOU Jingwen*1,2
(1.Key Laboratory of Industrial Biotechnology of the Ministry of Education,Jiangnan University,Wuxi 214122,China;2.Collaborative Innovation Center of Food Safety and Nutrition,Jiangnan University,Wuxi 214122,China;3.National Engineering Laboratory of Grain Fermentation Process and Technology,Jiangnan University,Wuxi 214122,China)
Ethyl carbamate (EC)is a potential carcinogen which widely exists in alcohol beverage and fermented food.Enzyme degradation is one of the important routes to deal with the EC contamination.In this study,a bacteria Lysinibacillus fusiformis SC02 which was able to degrade EC was isolated from mice stomach as the starting strain.The condition of enzyme production was optimized by using single-factor test.The optimal fermentation medium components were asfollows:galactose 25 g/L,soy peptone 20 g/L,urea 4 g/L,CuSO40.02 g/L,initial pH 6.0.The optimal conditions for enzyme-producing were as below:temperature 37℃,inoculum volume 3%and liquid volume in flask 20 mL/250 mL.Urethanase production level of the strain was improved from 900 U/L to 4 500 U/L after being cultured for 15 h under the conditions mentioned above,which was 350%higher than the one under the original conditions.After investigating the influences of different agitation speeds on the urethanase production at the fermentation tank level,800 r/min was chosen as the optimal agitation speed,and the urethanase activity can reach to 7066 U/L at this speed,which was 57%higher than before.
ethyl carbamate,single-factor optimization,Bacillus,fermented food
Q 814
A
1673—1689(2017)03—0259—07
2015-01-20
国家973计划项目(2012CB720802)。
*通信作者:周景文(1982—),男,安徽巢湖人,工学博士,教授,博士研究生导师,主要从事利用微生物生产植物来源天然产物的代谢工程和合成生物学方面的研究。E-mail:zhoujw1982@jiangnan.edu.cn
王伟高,陈坚,周景文.赖氨酸芽孢杆菌产氨基甲酸乙酯水解酶的发酵条件优化[J].食品与生物技术学报,2017,36(03):259-265.
