围生期窒息患儿早期脑组织结构及 血流动力学改变的床旁颅脑超声检查
2017-05-03徐海燕张忠新陈燕娥赵进娥
徐海燕,高 勇,张忠新,陈燕娥,赵进娥
(南通市第一人民医院超声科,江苏 南通 226001)
[临床研究]
围生期窒息患儿早期脑组织结构及 血流动力学改变的床旁颅脑超声检查
徐海燕,高 勇,张忠新,陈燕娥,赵进娥
(南通市第一人民医院超声科,江苏 南通 226001)
目的 探讨床旁颅脑超声检查对围生期窒息患儿早期脑组织结构及血流动力学改变的诊断价值。方法 选取南通市第一人民医院于2015年1月至2016年1月期间收治或接生的72例有围生期窒息病史的新生儿,在患儿出生后72h内,对其行首次颅脑超声检查,大脑中动脉、前动脉血流动力学变化采用多普勒技术监测,阻力指数(RI)、收缩期峰值血流速度(Vs)、舒张末期血流速度(Vd)为检测的主要参数。结果 新生儿出生后72h内行首次颅脑超声检测的72例患儿中表现颅脑损伤阳性率达75.0%(54/75)。患儿脑血流动力学发生改变20例,其中10例Vd增加,RI减少(≤0.55);6例Vd、Vs均减少,RI正常;频谱高尖3例,且RI增加(≥8.00);仅有1例患儿大脑一侧中动脉Vd、Vs增加,RI正常。早产儿脑组织损伤类型中最多见的两种为脑白质损伤12例(46.2%),χ2=11.466,P=0.001,颅内出血16例(61.5%),χ2=4.043,P=0.044;足月儿脑组织损伤类型中最多见的两种为脑水肿15例(32.6%),χ2=1.852,P=0.396,颅内出血17例(37.0%),χ2=4.135,P=0.026;早产儿颅内出血率、脑白质损伤率均高于足月儿,足月儿的脑水肿发生率高于早产儿(χ2值分别为4.043、11.466、5.437,均P<0.05)。两组患儿的丘脑基底核损伤率、血流动力学改变率之间差异无统计学意义(χ2值分别为0.573、0.015,均P>0.05)。结论 缺氧缺血性颅脑损伤在围生期窒息患儿中常见,患儿早期脑组织结构及血流动力学的改变可被颅脑超声发现,其检查时间在72h内阳性率较高,对于新生儿重症监护室(NICU)的患儿而言,床旁检查是超声的优势。
围生期;窒息;血流动力学;超声;
围生期是一个特定时期,指产前、产时和产后,围生期窒息在这一时期是常见的[1-2]。围生儿死亡首要因素之一即围生期窒息[3-4]。部分新生儿伴有神经系统损伤后遗症,这也是新生儿围生期脑损伤的主要原因[5-6]。为早期发现该类患儿常见的脑损伤类型,探讨并分析床旁颅脑超声检查对围生期窒息患儿早期脑组织结构及血流动力学改变的诊断价值,在患儿出生后72h内,采用多普勒超声技术对其行首次颅脑检查,监测大脑中动脉、前动脉血流动力学变化,为临床诊治提供影像学依据。
1资料与方法
1.1患儿一般资料
选取南通市第一人民医院2015年1月至2016年1月期间收治或接生的72例有围生期窒息病史的新生儿,胎龄28~41+(1~6)周,平均胎龄37.4±3.1周,平均体重(3.3±1.7)kg。其中26例早产儿中14例胎龄<34周,12例34~36+6周,平均体重(0.9±0.5)kg;46例足月儿,胎龄37~41+6周,平均体重(3.7±1.4)kg。轻度窒息患儿49例,重度窒息患儿23例。
1.2患儿纳入标准
所有纳入患儿父母均完全知情,并经本院医学伦理委员会同意后,自愿签署知情同意书并让患儿参与调研。患儿纳入标准:①围生期有宫内胎儿窒息和(或)新生儿窒息的患儿;②新生儿窒息,均根据Apgar评分,1min评分,重度窒息为0~3分,轻度窒息为4~7分;③宫内胎儿窒息,胎动晚期减少,甚至消失,胎心率<100次/分钟,胎动早期增加,胎心率≥160次/分钟。
1.3超声检测方法
诊断仪采用GE LOGIQ7彩色多普勒超声诊断仪,频率为6~10M Hz,腹部超声探头。在出生72h内,对新生儿行首次颅脑超声检查。患儿均保持睡眠或者安静状态,采取仰卧位,采用多普勒技术监测颅脑组织结构,大脑中动脉、前动脉血流动力学变化,阻力指数(resistant index,RI)、收缩期峰值血流速度(peaksystolicvelocity,Vs)、舒张末期血流速度(end-diastolicvelocity,Vd)为检测的主要参数。
1.4统计学方法
将采集的72例围生期窒息患儿临床资料用SPSS 19.0软件进行统计分析,计数资料用例数(百分比)表示,并采用χ2检验分析,以P<0.05为差异有统计学意义。
2结果
2.1超声检查患儿阳性率
新生儿出生后72h内,行首次颅脑超声检测,正常新生儿RI在0.55~0.8。72例患儿中有54例有不同程度的颅脑损伤,阳性率达75.0%。患儿脑血流动力学发生改变20例,其中,10例Vd增加,RI减少(≤0.55);6例Vd、Vs均减少,RI正常;频谱高尖3例,且RI增加(≥0.80);仅有1例患儿大脑一侧中动脉Vd、Vs增加,RI正常。
2.2早产儿与足月儿各参数比较
早产儿脑组织损伤类型,最多见的两种类型为脑白质损伤12例(46.2%),颅内出血16例(61.5%);足月儿脑组织损伤类型,最多见的两种类型为脑水肿15例(32.6%)、颅内出血17例(37.0%),两组患儿的丘基底核损伤率、血流动力学改变率比较差异均无统计学意义(均P>0.05),早产儿颅内出血率、脑白质损伤率均显著高于足月儿(均P<0.05),见表1。

表1 围生期窒息早产儿和足月儿脑损伤类型[n(%)]
2.3不同胎龄脑损伤比较
不同胎龄新生儿颅内出血、脑白质损伤发生率比较差异有统计学意义(χ2值分别为4.135、11.419,均P<0.05),早产儿和足月儿脑血流动力学改变发生率之间比较差异无统计学意义(均P>0.05),见表2。
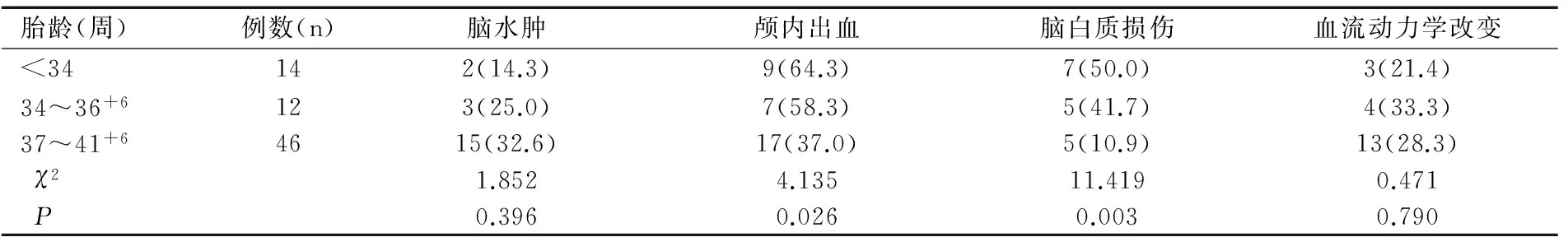
表2 围生期窒息不同胎龄新生儿脑损伤类型[n(%)]
2.4患儿一般资料比较
早产儿与足月儿的性别、窒息程度等资料之间比较均无显著性差异(均P>0.05),见表3。
表3 患儿一般资料比较[n(%)]
Table 3 Comparison of general data of cases[n(%)]

分组例数(n) 性别 1minApgar评分 男女0~3分4~7分早产儿2619(73.1)7(26.9)17(65.4)9(34.6)足月儿4628(60.9)18(39.1)32(69.6)14(30.4)χ23.7322.334P1.3251.224
3讨论
3.1围生期窒息损害机制
围生期窒息对胎儿的健康及生命有极大威胁。围生期窒息会导致胎儿或新生儿缺氧、缺血,脑组织对缺氧最为敏感,患儿体内无氧酵解增多,从而大量堆积乳酸,体内酸碱缓冲失调,血液二氧化碳分压升高,血液pH下降,引发酸中毒,严重者可死于新生儿早期[7-8]。郭秀春等[9]研究表明,颅内出血、脑白质损伤、脑水肿为超声常见脑损伤类型,早产儿与足月儿之间差异有明显意义。围生期窒息是缺氧缺血性脑病的主要诱因。
3.2本次研究成果分析
足月儿颅内出血发生率显著低于早产儿,但其出血部位及出血程度两者间差异不明显。在本次研究中,脑水肿更常见于足月儿,婴儿在围生期发生缺氧时,脑组织发生一系列病理过程,多种相互因素间的作用致使其早期病理改变为脑水肿。轻度窒息儿Vd、Vs均高于重度窒息儿,差异具有统计学意义(P<0.05)。重度窒息患儿RI异常增高。这说明在对判断缺血缺氧性脑病及发病程度时,围生期窒息新生儿脑血流动力学改变可以提供重要参考信息,这与冯薇的研究相类似[10]。因此对于新生儿窒息的早期预防显得更加重要和有效,可进一步减少新生儿病死率。另外,为了预防新生儿围生期窒息,孕妇应该做到定期产检,医护人员对发现的高危妊娠应及时采取处理,提高产科整体医疗技术,尽量避免手术产和早产。以改善脑损伤的发生过程,对提高围生儿的健康及生命具有重要意义[11-12]。明确诊断仅靠超声仍缺乏足够证据,故在本次研究中仍有5例患儿MRI示顶叶、额叶脑水肿。大脑结构与形态改变大多是通过CT和MRI检查确诊,但由于需要新生儿移位,对重症早期新生儿护理不利,为了临床早期筛查,床旁超声头颅检查是一个不错的选择。对于围生期窒息患儿而言,在脱离危险后仍需要进一步CT和MRI进行确诊,以避免临床漏诊、错诊,这与李静波等人的研究相似[13]。
综上所述,缺氧缺血性颅脑损伤在围生期窒息患儿中常见,患儿早期脑组织结构及血流动力学的改变可被颅脑超声发现,其检查72h内阳性率高,对于新生儿重症监护室(NICU)的重症患儿床旁检查是超声的优势。
[1]Aduloju O P, Akintayo A A, Ade-Ojo I P,etal. Gestational age at initiation of antenatal care in a tertiary hospital, Southwestern Nigeria[J]. Niger J ClinPract, 2016,19:772-777.
[2]Glantz J C. Completed Sonographic Anatomic Surveys:The Exception Rather Than the Rule[J]. J Ultrasound Med,2016,35:2441-2447.
[3]杨玉婷,范丽丽,李婷婷,等.围生期窒息新生儿护理体会的初步探讨[J].中国医药指南,2012,(36):639-640.
[4]Mlacker S, Shafa G, Aldahan A S,etal. Origin of the Zika virus revealed: a historical journey across the world[J]. Int J Dermatol, 2016,55:1369-1372.
[5]Wright T E, Terplan M, Ondersma S J,etal. The role of screening, brief intervention, and referral to treatment in the perinatal period[J]. Am J Obstet Gynecol, 2016,215:539-547.
[6]郑丽敏.早产儿常见并发症及其治疗综述[J].临床医学,2014,34(2):115-117.
[7] Cakmak C F, Aygun C, Kucukoduk S,etal. Maternal and neonatal outcomes in advanced maternal age:a retrospective cohort study[J]. J Matern Fetal Neonatal Med, 2016:11(22):1-5.
[8] Paranjpe SM, Sarkate PP, Ingole NA,etal. Profiles of HIV-infected anti-retroviral therapy naive children from Mumbai, India[J]. World J Pediatr, 2016,12:430-435.
[9] 郭秀春,赵世刚.缺血缺氧性脑病治疗研究进展[J].内蒙古医学杂志,2015,47(7):813-815.
[10] 冯薇.彩色多普勒超声在围生期窒息所致的新生儿颅脑损伤中的应用[J].中国实用医药,2015,(16):78-79.
[11]Zuccolotto E B, Pagnussatt N E, Nogueira G C,etal. Anesthesia in pregnant women with HELLP syndrome: case report[J]. Braz J Anesthesiol, 2016,66:657-660.
[12]仇杰,臧丽娇,庄根苗,等.不同胎龄围生期窒息与多器官功能损伤的相关性[J].山东大学学报(医学版),2016,54(9):64-68.
[13]李静波,王建荣,张海峰,等.围生期窒息新生儿脑损伤早期超声的临床诊断价值[J].医学影像学杂志,2015,32(4):600-603.
[专业责任编辑:韩 蓁]
Bedside cranial ultrasound examination on structure and hemodynamic changes of brain tissue in early stage of perinatal asphyxia
XU Hai-yan, GAO Yong, ZHANG Zhong-xin, CHEN Yan-e,ZHAO Jin-e
(DepartmentofUltrasonography,FirstPeople’sHospitalofNantong,JiangsuNantong226001,China)
Objective To investigate the diagnostic value of bedside cranial ultrasound examination on structure and hemodynamic changes of brain tissue in early stage of perinatal asphyxia. Methods Altogether 72 neonates with perinatal asphyxia history delivered or hospitalized in First People’s Hospital of Nantong from January 2015 to January 2016 were selected, and they underwent first cranial ultrasound examination at 72h after birth. Hemodynamic changes of middle cerebral artery and anterior cerebral artery were monitored by Doppler technique, and resistance index (RI), peak systolic velocity (Vs) and end diastolic velocity (Vd) were main detection parameters. Results Positive rate of brain injury of 72 patients undergoing first cranial ultrasound examination within 72h after birth reached 75.0% (54/72). Twenty patients had cerebral hemodynamic changes, including 10 cases with Vd increase and RI decrease (≤0.55), 6 cases with decreased Vd and Vs and normal RI, 3 cases with high spectrum and increased RI (≥8.00), and only 1 case with increased brain artery Vd and Vs and normal RI. The most common types of brain injury in preterm infants were cerebral white matter damage occurring in 12 cases (46.2%) (χ2=11.466,P=0.001) and intracranial hemorrhage in 16 cases (61.5%) (χ2=4.043,P=0.044). The most common types of brain injury in full-term infants were cerebral edema occurring in 15 cases (32.6%) (χ2=1.852,P=0.396) and intracranial hemorrhage in 17 cases (37.0%) (χ2=4.135,P=0.026). Incidences of intracranial hemorrhage and white matter injury in preterm infants were both higher than in full-term infants, and the incidence of cerebral edema in full-term infants was higher than in preterm infants (χ2value was 4.043, 11.466 and 5.437, respectively, allP<0.05). The differences in basal ganglia injury incidence and hemodynamic change of cases between two groups were not statistically significant (χ2value was 0.573 and 0.015, respectively, bothP>0.05). Conclusion Hypoxic ischemic brain injury is common in children with perinatal asphyxia. Changes of brain tissue structure and hemodynamics in early stage of asphyxia can be found by brain ultrasound exam. Positive rate is highest within 72h after birth. For patients in neonatal intensive care unit (NICU), bedside examination is an advantage of ultrasound.
Perinatal period; asphyxia; hemodynamics; ultrasonic
2016-11-19
徐海燕(1975-),女,副主任医师,主要从事超声医学工作。
赵进娥,副主任医师。
10.3969/j.issn.1673-5293.2017.03.018
R714.7
A
1673-5293(2017)03-0276-03
