兔脊髓缺血再灌注后小胶质细胞活化及炎性细胞因子变化的研究
2017-05-02王昀璐田蕾刘诗瑶马志高侯思雨杨彦伟李慧先金沐董秀华卢家凯程卫平
王昀璐,田蕾,刘诗瑶,马志高,侯思雨,杨彦伟,李慧先,金沐,董秀华,卢家凯,程卫平
兔脊髓缺血再灌注后小胶质细胞活化及炎性细胞因子变化的研究
王昀璐,田蕾,刘诗瑶,马志高,侯思雨,杨彦伟,李慧先,金沐,董秀华,卢家凯,程卫平
目的:观察兔脊髓缺血再灌注后小胶质细胞活化及炎性细胞因子白细胞介素(IL)-6、IL-10、核转录因子(NF)-κB的变化规律,为后处理干预时机提供理论依据。
方法:采用胸主动脉球囊阻断法建立兔脊髓缺血再灌注损伤模型。36周健康成年雄性新西兰大白兔54只,假手术组(n=6只)只置入球囊不阻断;48只脊髓缺血再灌注家兔按再灌注时间点分为8组:再灌注0 h组、再灌注1 h组、再灌注2 h组、再灌注3 h组、再灌注8 h组、再灌注24 h组、再灌注48 h组、再灌注72 h组,每组6只。分别于再灌注后0 h、1 h、2 h、3 h、8 h、24 h、48 h和72 h检测缺血段脊髓组织中正常神经元、凋亡神经元以及离子钙结合接头分子-1(Iba-1)、IL-6、IL-10、NF-κB的表达水平。
结果:正常神经元数量随再灌注时间延长而减少;脊髓缺血再灌注损伤后8 h原位末端转移酶标记(TUNEL)阳性神经元开始增多,再灌注24 h组的TUNEL阳性神经元达高峰。再灌注2 h组的Iba-1表达开始增多,再灌注8 h组Iba-1表达达高峰;NF-κB于再灌注3 h组开始增高,再灌注8 h组NF-κB表达高峰;IL-6和IL-10表达均在再灌注24 h组达高峰。脊髓缺血再灌注后NF-κB、IL-6、IL-10的表达水平与Iba-1呈相近的变化趋势。
结论:脊髓缺血再灌注后小胶质细胞激活呈动态变化。NF-κB、IL-6、IL-10的表达水平与小胶质细胞激活显著正相关,在小胶质细胞激活前给予后处理可降低神经元损伤。
再灌注损伤;小神经胶质细胞;炎症趋化因子类
脊 髓 缺 血 再 灌 注(spinal cord ischemia reperfusion,SCIR)损伤后的炎症反应是导致大血管术后脊髓继发性损伤的重要原因之一[1,2]。小神经胶质细胞(microglia cell,MC)是神经系统中主要的炎症细胞之一,激活后释放促炎因子可导致组织损伤[3]。抑制小胶质细胞激活可缓解SCIR损伤[4]。但有关SCIR损伤后MC激活和炎症因子动态变化规律的研究较少。本研究将建立兔SCIR模型,多时点观察兔SCIR损伤后MC的动态变化过程以及炎症因子白细胞介素-6(IL-6)、白细胞介素-10(IL-10)和核转录因子-κB(NF-κB)的动态变化,为选择合理的干预治疗时机提供理论依据。
1 材料与方法
实验动物、主要仪器:本实验已获得首都医科大学动物实验伦理委员会批准,实验动物的福利遵照美国国家卫生研究院(NIH)相关指南实施。健康成年新西兰大白兔54只,体重2.5~3.0 kg,雄性,由首都医科大学附属北京安贞医院动物中心提供[许可证编号:SYXK(京)2015-0023]。PHILIPS多道生理监护仪(德国)。
建立兔SCIR损伤模型[5]:实验动物行3%戊巴比妥耳缘静脉注射麻醉(30 mg/kg),仰卧位固定,保留自主呼吸。耳缘中动脉置管测量近端动脉血压,股动脉置管测量远端血压。直肠内置入温度传感器监测体温,应用电热毯维持核心温度38 ℃左右。分别在阻断前、阻断后5 min及再灌注后15 min记录近端、远端血压和肛温。在兔大腿内侧注射利多卡因局部浸润麻醉,切开皮肤,分离左右侧股动脉,耳缘静脉注射肝素钠125 U/kg,2 min后,经右侧股动脉置入2F Fogarty球囊导管(上海爱德华生命科学有限公司)约15 cm,前端到达兔左侧肾动脉下0.5~1 cm腹主动脉处,左侧股动脉明视下置入18号套管针监测远端血压。阻断时充起球囊,主动脉远端血压立即下降并维持在8 mmHg(1 mmHg=0.133 kPa)左右,血压波形消失证明造模成功,开放时以股动脉波形迅速恢复为准。22 min后,抽空球囊恢复水平体位,耳缘静脉注入鱼精蛋白(1 mg鱼精蛋白中和100 U肝素钠),缝合股动脉穿刺处。分别于阻断前10 min和阻断后15 min做动脉血气分析。术毕肌注庆大霉素40000 IU预防感染,送回笼中饲养。
动物分组及处理方案:采用计算机随机数法将实验动物分为9组:假手术组(n=6)只置入球囊不阻断;脊髓缺血再灌注家兔48只,缺血时间22 min,再灌注时间分为8个时间点,分为再灌注0 h组、再灌注1 h组、再灌注2 h组、再灌注3 h组、再灌注8 h组、再灌注24 h组、再灌注48 h组和再灌注72 h组,每组6只。分别在再灌注后0 h、1 h、2 h、3 h、8 h、24 h、48 h、72 h处死动物检测相应指标。
神经功能评分:所有动物于再灌注后4 h、8 h、24 h、48 h、72 h由不了解分组情况的观察者进行神经功能评分,兔后肢运动功能评分采用Jacobs法[6]:0分:后肢完全瘫痪;1分:后肢严重瘫痪,针刺有反应;2分:后肢可支撑行走但无法跳跃;3分:可齐足跳但伴共济失调;4分:可奔跑但有轻微共济失调;5分:完全正常。由于术后麻醉作用基本在3 h后消除,48只脊髓缺血再灌注家兔在再灌注后0 h、1 h、2 h、3 h不做评分。
标本取材[7]:经左心室注入冰盐水灌洗后取出脊髓,L3-4节段脊髓置于4℃,4%多聚甲醛中固定,备行石蜡包埋后切片做HE染色及免疫组化。L4-5节段脊髓放于-80℃冰箱中保存,进行蛋白免疫印迹法(western blot)检测。
脊髓组织病理学观察及前角运动神经元计数:HE染色并采用盲法由不了解分组情况的观察者在200倍光镜下观察脊髓组织病理学改变。光镜下正常脊髓神经元清晰,多极性,细胞质中可见尼氏小体。损伤及坏死神经元表现为细胞核固缩、碎裂、溶解,尼氏体消失。每个脊髓节段随机抽取3张切片,沿中央导水管水平线以前计数前角正常神经元数目并取3张切片平均值。
脊髓组织原位末端转移酶标记技术(TUNEL)检测细胞凋亡程度:采用TUNEL检测试剂盒(Roche,德国)进行染色,显微镜下观察细胞核中有棕褐色颗粒者为阳性细胞。由不了解分组情况的观察者在200倍光镜下观察,每个脊髓节段随机抽取3张切片计数凋亡神经元,每组6只动物。
免疫组化法观察小胶质细胞形态变化:采用SP法染色,一抗为离子钙结合接头分子1(ionized calcium-binding adaptor molecule 1,Iba-1)羊多抗(abcam,英国),以试剂公司提供的免疫组化图片为阳性对照,呈棕黄色的小胶质细胞为阳性细胞,每只家兔选一张切片在高倍镜下(×400)随机选取5个不同视野计算阳性积分光密度值。
Western blot 检测蛋白表达:剪碎标本,裂解,冰上匀浆,离心取上清液,测定蛋白质浓度,按每个电泳孔道加入50 μg蛋白混合样品进行聚丙烯酰氨凝胶电泳,转膜。先后加入一抗IL-6、IL-10、Iba-1(abcam,英国,稀释度1:1000)及NF-κB[天德悦(北京)生物科技公司,中国,稀释度1:2000]和羊抗兔或羊抗鼠二抗(稀释度1:10000)进行杂交。应用图像分析软件Total lab quant分析各电泳条带的蛋白含量。
统计学方法:样本量运用NCSS-PASSv11.0.7进行估算,结果为每组6只(各组监测指标差异20%,power=90%,P<0.05);采用SPSS 23.0统计软件进行统计学分析,计量资料以均数±标准差表示,运动功能评分采用中位数(P25,P75)表示。参数检验采用完全随机设计的单因素方差分析统计;非参数检验采用非参数秩和Kruskal-Wallis法。P<0.05为差异有统计学意义。脊髓缺血再灌注后Iba-1表达水平分别与IL-6,IL-10,NF-κB进行Spearman相关性分析,P<0.01为差异显著性标准。
2 结果
2.1各组兔的生理参数及动脉血气分析结果比较(表1、2)
除假手术组外的各组阻断后5 min远端血压与同组阻断前比较明显降低(P<0.05)。各组兔阻断前、后的其他生理参数值在组内、组间比较,差异均无统计学意义;各组兔阻断前10 min和再灌注后15 min的血气分析结果组内、组间比较差异均无统计学意义。
表1 各组兔的生理参数值比较

表1 各组兔的生理参数值比较
注:与同组阻断前比*P< 0.05。1 mmHg=0.133 kPa
?
表2 各组兔在阻断前10 min和再灌注后15 min的动脉血气分析结果比较(

表2 各组兔在阻断前10 min和再灌注后15 min的动脉血气分析结果比较(
注: 1 mmHg=0.133 kPa
再灌注72 h组(n=6)血酸碱度阻断前10 min 7.38±0.04 7.37±0.06 7.40±0.03 7.40±0.08 7.38±0.02 7.39±0.04 7.41±0.03 7.36±0.02 7.37±0.04再灌注后15 min 7.38±0.04 7.39±0.06 7.40±0.03 7.40±0.05 7.41±0.07 7.41±0.08 7.43±0.09 7.39±0.05 7.37±0.04动脉血氧分压 (mmHg)阻断前10 min 87±3.6 84±3.9 86±2.1 86±4.5 88±3.4 89±6.1 85±4.3 84±2.2 85±3.1再灌注后15 min 87±4.0 83±4.6 86±1.6 87±5.2 87±6.2 87±5.5 83±4.4 84±2.1 83±3.2动脉血二氧化碳分压 (mmHg)阻断前10 min 38±2.6 40±4.3 35±3.1 34±2.1 41±5.7 36±2.2 39±5.7 41±4.9 40±5.1再灌注后15 min 38±3.2 39±6.0 35±3.1 35±2.4 40±5.3 35±2.1 40±5.8 43±5.1 40±5.3项目 假手术组(n=6)再灌注0 h组(n=6)再灌注1 h组(n=6)再灌注2 h组(n=6)再灌注3 h组(n=6)再灌注8 h组(n=6)再灌注24 h组(n=6)再灌注48 h组(n=6)
2.2不同再灌注时间点的兔后肢运动功能评分(表3)
采用Jacobs法,假手术组均为5分,脊髓缺血再灌注后,随着时间的推移评分越来越低,各时间点的评分与假手术组比差异均有统计学意义(P<0.05),再灌注后24 h、48 h、72 h评分分别与再灌注后4 h相比,差异均有统计学意义(P<0.05)。

表3 不同再灌注时间点的兔后肢运动功能评分(分)
2.3各组兔神经元及胶质细胞组织学变化及凋亡情况比较(图1)
假手术组脊髓前角神经元及胶质细胞结构完整,神经元胞质可见尼氏小体,核仁清楚。随着再灌注时间延长,正常神经元数量逐渐减少,体积缩小,细胞外空泡增多,胶质细胞向损伤区聚集。再灌注72 h组正常神经元数目与其他各组比均明显减少(P<0.05)。假手术组不存在TUNEL阳性细胞,其他8组均存在TUNEL阳性细胞,再灌注3 h组脊髓前角开始出现散在凋亡神经元和胶质细胞,再灌注8 h组凋亡神经元和胶质细胞增多,再灌注24 h组凋亡神经元和胶质细胞最多,之后逐渐减少。
2.4各组兔损伤节段脊髓切片Iba-1免疫组化结果(图2)
假手术组Iba-1阳性细胞少,包体细小呈椭圆形,多分支;再灌注2 h组的Iba-1阳性细胞开始增多,形态改变不明显,再灌注8 h组Iba-1阳性细胞增生达到高峰,胞体变大变圆,突起减少或消失,呈阿米巴样,染色加深并聚集在神经元周围,再灌注72 h组的Iba-1阳性细胞数量下降。
2.5Western blot检测结果(图3)
假手术组Iba-1蛋白低表达,再灌注2 h组Iba-1表达开始增多,再灌注8 h组达到高峰,再灌注72 h组明显减少。假手术组NF-κB蛋白几乎无表达,再灌注3 h组NF-kB表达量明显上升,再灌注8 h组NF-κB蛋白表达达高峰,之后下降,但仍明显高于假手术组。假手术组IL-6蛋白表达低,再灌注3 h组IL-6表达开始增多,再灌注24 h组IL-6表达达高峰,之后下降。假手术组IL-10蛋白表达低,再灌注后IL-10呈上升趋势,再灌注24 h组IL-10蛋白表达量最多,显著高于假手术组(P<0.05)。

图1 兔损伤节段脊髓切片HE、TUNEL染色结果(×200)及神经元计数结果
2.6兔脊髓缺血再灌注后Iba-1与NF-κB、IL-6、IL-10蛋白表达随再灌注时间变化的关系(图4)
脊髓缺血再灌注后Iba-1与NF-κB、IL-6及IL-10呈相近的变化趋势。Iba-1与NF-κB从再灌注后2 h开始明显升高,8 h达到高峰。IL-6从再灌注后1h开始明显升高,IL-10于再灌注后1 h开始缓慢上升,最后均于24 h达到高峰。
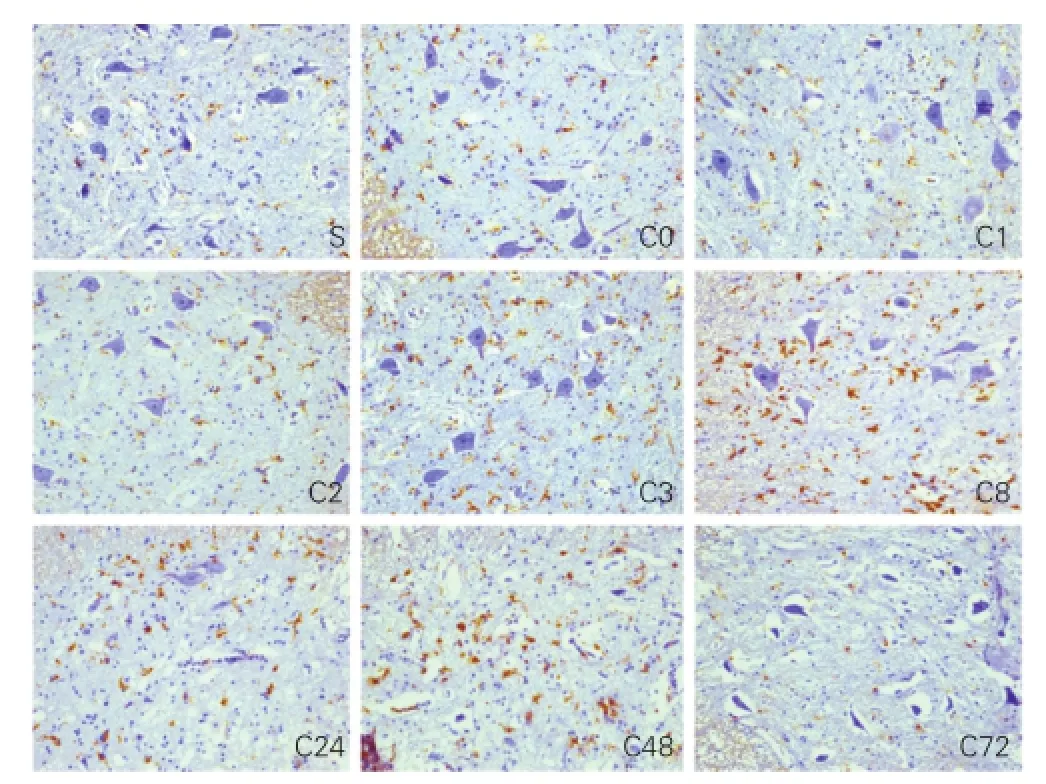
图2 兔损伤节段脊髓切片Iba-1染色结果(×200)

图3 兔脊髓缺血再灌注后Iba-1、NF-κB、IL-6、IL-10的表达水平

图4 兔脊髓缺血再灌注后Iba-1与NF-κB、IL-6、IL-10蛋白表达随再灌注时间变化的关系
3 讨论
脑缺血再灌注后即刻后处理可以减少神经功能损伤和神经元死亡[8],而延迟后处理同样有神经保护作用[9]。本研究前期发现再灌注1 h行氙气后处理能降低大鼠脊髓神经元的凋亡数量[10],说明神经元存在延迟性死亡的现象,可能有多种因素在不同时间段分别介导神经元的死亡。小胶质细胞是神经系统固有的炎性细胞,MC的增殖和活化会产生细胞毒性[11],可能是促使神经元死亡的因素之一。观察SCIR后MC及炎症因子的变化对了解延迟后处理的脊髓保护机制及把握干预时机有重要意义。
脊髓损伤可使小胶质细胞激活[12],MC参与损伤后的炎症反应。本研究发现,再灌注3 h后MC明显增生,8 h达到高峰,细胞变圆变大,呈阿米巴样,染色加深,24~48 h仍呈激活态。激活后的MC可能产生IL-6、IL-1、TNF-α等有害因子造成组织损伤,抑制MC将明显降低脊髓缺血再灌注损伤[4,13]。
脊髓缺血再灌注损伤可使炎症因子水平升高,如IL-6在小鼠脊髓缺血再灌注后表达明显增高并于36 h到达顶峰[14],IL-10也有所上升。本研究中IL-6从2 h开始显著升高,24 h达到高峰,IL-10同样在24 h达到高峰。目前,多数学者认为促炎症因子IL-6的释放对脊髓组织有不利影响。Hasturk等[15]指出脊髓缺血后促炎因子如IL-6的升高与组织损伤有关,其实验中炎性细胞因子的升高与脊髓出血、神经元减少等病理损害并行出现。而IL-10的升高可能由于缺血激活了机体的内源性保护反应所致[16]。
MC的炎症反应过程与细胞内多种调节通路有关,目前认为NF-κB是该过程中最为重要的介导分子。非激活状态下,NF-κB与抑制蛋白IκB结合存在于细胞质中,当存在损伤因素时,IκB磷酸化并脱离复合物,活化的NF-κB借助暴露出来的核定位信号转入细胞核,与相应靶序列结合,调节相关靶基因的转录活性。有研究表示,NF-κB可能调控着MC中IL-6的表达[17],本研究发现,SCIR损伤后NF-κB于再灌注后3 h开始上升,8 h达到高峰,而IL-6、IL-10表达整体稍晚。将Iba-1分别与IL-6,IL-10及NF-κB进行Spearman相关性分析发现三者在脊髓缺血再灌注后的表达规律均与MC有相关性,其中NF-κB(r=0.71)和IL-6(r=0.72)的表达趋势与MC相关性很高,说明SCIR损伤后MC的确可能通过NF-κB介导了IL-6、IL-10等炎症因子的释放。
活化MC介导炎症因子释放可能促进了神经元的凋亡。本研究中,Iba-1于再灌注8 h达到高峰,8 h后我们观察到兔后肢运动功能评分逐渐下降,脊髓前角正常神经元数量比假手术组明显减少,凋亡神经元比假手术组明显增多,并与炎性因子均在24 h达到高峰,这可能是MC激活对神经元产生损害作用的原因之一。因此,MC可能参与了脊髓组织损伤后神经元凋亡的过程,如果在MC激活前进行后处理干预,抑制MC激活则能够减少神经元凋亡的数量,对脊髓形成保护作用。
[1] Li Y, Si R, Feng Y, et al. Myocardial ischemia activates an injurious innate immune signaling via cardiac heat shock protein 60 and Tolllike receptor 4. J Biol Chem, 2011, 286: 31308-31319.
[2] 彭静, 杨贵芳, 彭文, 等. 主动脉夹层免疫炎症机制研究进展. 中国循环杂志, 2015, 30: 924-925.
[3] Pineau I, Lacroix S. Proinflammatory cytokine synthesis in the injured mouse spinal cord: multiphasic expression pattern and identification of the cell types involved. J Comp Neurol, 2007, 500:267-285.
[4] Smith PD, Bell MT, Puskas F, et al. Preservation of motor function after spinal cord ischemia and reperfusion injury through microglial inhibition. Ann Thorac Surg, 2013, 95: 1647-1653.
[5] Watanabe K, Kawaguchi M, Kitagawa K, et al. Evaluation of the neuroprotective effect of minocycline in a rabbit spinal cord ischemia model. J Cardiothorac Vasc Anesth, 2012, 26: 1034-1038.
[6] Jacobs TP, Shohami E, Baze W, et al. Deteriorating stroke model: histopathology, edema, and eicosanoid changes following spinal cord ischemia in rabbits. Stroke, 1987, 18: 741-750.
[7] 刘诗瑶, 侯思雨, 杨彦伟, 等. 氙气延迟后处理诱导蛋白激酶B信号通路活化对大鼠脊髓缺血再灌注损伤的保护作用. 中国循环杂志, 2015, 30: 498-502.
[8] Rehni AK, Singh N. Role of phosphoinositide 3-kinase in ischemic postconditioning-induced attenuation of cerebral ischemia-evoked behavioral deficits in mice. Pharmacol Rep, 2007, 59: 192-198.
[9] Burda J, Danielisova V, Nemethova M, et al. Delayed postconditionig initiates additive mechanism necessary for survival of selectively vulnerable neurons after transient ischemia in rat brain. Cell Mol Neurobiol, 2006, 26: 1141-1151.
[10] Yang YW, Cheng WP, Lu JK, et al. Timing of xenon-induced delayed postconditioning to protect against spinal cord ischaemia-reperfusion injury in rats. Br J Anaesth, 2014, 113: 168-176.
[11] Tikka T, Fiebich BL, Goldsteins G, et al. Minocycline, a tetracycline derivative, is neuroprotective against excitotoxicity by inhibiting activation and proliferation of microglia. J Neurosci, 2001, 21: 2580-2588.
[12] Matsumoto S, Matsumoto M, Yamashita A, et al. The temporal profile of the reaction of microglia, astrocytes, and macrophages in the delayed onset paraplegia after transient spinal cord ischemia in rabbits. Anesth Analg, 2003, 96: 1777-1784.
[13] Cho DC, Cheong JH, Yang MS, et al. The effect of minocycline on motor neuron recovery and neuropathic pain in a rat model of spinal cord injury. J Korean Neurosurg Soc, 2011, 49: 83-91.
[14] Smith PD, Puskas F, Meng X, et al. The evolution of chemokine release supports a bimodal mechanism of spinal cord ischemia and reperfusion injury. Circulation, 2012, 126(11 Suppl): S110-S117.
[15] Hasturk A, Atalay B, Calisaneller T, et al. Analysis of serum proinflammatory cytokine levels after rat spinal cord ischemia/reperfusion injury and correlation with tissue damage. Turk Neurosurg, 2009, 19:353-359.
[16] Fan L, Wang K, Shi Z, et al. Tetramethylpyrazine protects spinal cord and reduces inflammation in a rat model of spinal cord ischemiareperfusion injury. J Vasc Surg, 2011, 54: 192-200.
[17] Lu DY, Tang CH, Yeh WL, et al. SDF-1alpha up-regulates interleukin-6 through CXCR4, PI3K/Akt, ERK, and NF-kappaB-dependent pathway in microglia. Eur J Pharmacol, 2009, 613: 146-154.
Investigation of Microglia Activation and Inflammatory Cytokine Changes in Experimental Rabbits After Spinal Cord Ischemia Reperfusion
WANG Yun-lu, TIAN Lei, LIU Shi-yao, MA Zhi-gao, HOU Si-yu, YANG Yan-wei, LI Hui-xian, JIN Mu, DONG Xiu-hua, LU Jia-kai, CHENG Wei-ping.
Department of Anesthesiology, Beijing Anzhen Hospital and Beijing Institute of Heart, Lung and Blood Vessel Diseases, Capital Medical University, Beijing (100029), China
CHENG Wei-ping, Email: ch_eng9735@sina.com
Objective: To observe the activation of microglia and the changing rule of inflammatory cytokine as IL-6, IL-10 and nuclear factor-κB (NF-κB) in experimental rabbits after spinal cord ischemia reperfusion (SCIR) injury in order to provide theoretical basis for post-conditioning time.
Methods: Rabbit SCIR injury model was established by thoracic aorta balloon occlusion. 54 New Zealand male adult white rabbits were divided into 9 groups: Sham group (the animals received balloon implantation without occlusion), SCIR-0h group (reperfusion was conducted at 0 hour of spinal cord ischemia), SCIR-1h, -2h, -3h, -8h, -24h, -48h and -72h groups. n=6 in each group. The number of normal and apoptosis neurons, the levels of Iba-1, IL-6, IL-10 and NF-κB in spinal tissue were examined and compared among different groups respectively.
Results: The number of normal neuron was decreasing with the extended reperfusion time, TUNEL-positive neuron began to increasing in SCIR-8h group and the peak was reached in SCIR-24h group. The expression of Iba-1 began toelevating in SCIR-2h group and the peak was obtained in SCIR-8h group; NF-κB began to rising in SCIR-3h group and the peak was observed in SCIR-8h group; both IL-6 and IL-10 arrived the peak in SCIR-24h group. The expressions of NF-κB, IL-6 and IL-10 were positively related to Iba-1 level.
Conclusion: Microglia activation had dynamic changes in experimental SCIR rabbits and the expression levels of NF-κB, IL-6 and IL-10 were positively to microglia activation; post-conditioning time at front and back to microglia activation may reduce neuron injury.
Reperfusion injury; Microglia cell; Inflammatory Chemokine
(Chinese Circulation Journal, 2017,32:395.)
2016-10-13)
(编辑:许菁)
国家自然科学基金(面上项目81271387);国家卫生和计划生育委员会:公益性行业科研专项项目(201402009)
100029 北京市,首都医科大学附属北京安贞医院 北京市心肺血管疾病研究所 麻醉科
王昀璐 硕士研究生 研究方向:心血管麻醉及围术期脏器功能保护 Email:Wang_YL073@163.com 通讯作者:程卫平Email: ch_eng9735 @sina.com
R54
A
1000-3614(2017)04-0395-06
10.3969/j.issn.1000-3614.2017.04.020
