心血管神经症患者自主神经功能的变化及综合运动干预对其的影响
2017-05-02李萃董蕾刘遂心张文亮刘元李凝
李萃,董蕾,刘遂心,张文亮,刘元,李凝
心血管神经症患者自主神经功能的变化及综合运动干预对其的影响
李萃,董蕾,刘遂心,张文亮,刘元,李凝
目的:观察心血管神经症(CN)患者自主神经功能的变化及探讨综合运动干预对其的影响。
方法:纳入48例CN患者(CN组),与30例正常人(对照组)比较,观察静息心率(RHR)及运动后1 min心率恢复(HRR1)的变化,采用心肺运动试验的方法测定;从CN患者中选取30例患者随机分为两个亚组,即药物组(n=14)和运动组(n=16)。药物组给予β受体阻滞剂和(或)地西泮治疗,运动组在药物组的基础上予以有氧联合抗阻的综合运动,共干预3个月,两组干预前后均采用症状自评量表(SCL-90)进行评分,并进一步观察RHR及HRR1的变化。
结果:与对照组受试者比较,CN组患者RHR明显增快,HRR1明显下降(P均<0.01)。与干预前比较,干预后两个亚组CN患者的RHR、HRR1、SCL-90评分均明显改善(P均<0.05);与药物组患者比较,运动组患者的SCL-90各项评分和HRR1均明显改善(P均<0.05)。
结论:CN患者存在自主神经功能紊乱;有氧联合抗阻训练的综合运动能有效地改善CN患者的临床症状,其机制可能与综合运动改善其自主神经功能有关。
神经症性障碍;运动疗法;自主神经系统
心血管神经症(CN)是临床常见病、多发病。CN患者往往因治疗效果不佳反复就诊,给患者日常生活和工作带来极大困扰。目前针对CN的治疗方法主要有药物治疗、心理治疗及运动治疗。药物治疗及心理治疗均存在一定的局限性。本课题组前期研究已证实,有氧运动能改善CN患者的临床症状[1],其机理不明。本研究拟在前期研究的基础上,探讨有氧联合抗阻训练的综合运动对CN患者临床症状的改善,并进一步观察运动对患者自主神经功能的影响。
1 资料与方法
研究对象:选取我院2014-05至2015-02心血管康复中心的CN患者,共纳入48例CN患者(CN组),平均年龄(39.73±9.84)岁。另选取年龄、性别相匹配的我院体检正常人30例作为对照组。纳入标准[2]:(1)以心悸、呼吸困难、心前区痛为主要表现;(2)体格检查除心音增强、心率增快外,无其他阳性体征;(3)心电图无ST-T改变或心得安试验阳性;运动心电图正常或运动心得安试验阳性;(4)X线胸片、超声心动图检查无异常;(5)甲状腺功能正常;(6)排除其他器质性心脏病、精神障碍;(7)近两周未使用过β受体阻滞剂、镇静及抗抑郁焦虑类药物。排除标准:有活动性肺结核、癌症等或合并有运动系统疾病、神经系统疾病而影响运动者。
干预方法:干预前CN组及对照组均行静息心率(RHR)、运动后1 min心率恢复(HRR1)检测。从CN组患者中选取30例按随机数字表法分为两个亚组即药物组(n=14)和运动组(n=16)。药物组给予β受体阻滞剂治疗(美托洛尔缓释片23.75 mg/47.5 mg或比索洛尔 2.5 mg/5 mg, 1次/d;本文按比索洛尔5 mg换算成美托洛尔缓释片47.5 mg),必要时加用镇静催眠药(地西泮5 mg,每晚睡前一次)。运动组在药物治疗的基础上加用有氧联合抗阻训练干预,共干预3个月。干预前后,药物组和运动组均行症状自评量表(SCL-90)评分及RHR、HRR1的检测。
RHR及HRR1测定:采用心肺运动试验的方法。HRR1即运动试验中峰值心率与试验停止1 min心率的差值[3]。
综合运动方案:(1)有氧训练:根据心肺运动试验(CPET)测得的无氧阈确定运动强度,训练过程中结合Borg评分调整运动强度,患者在13~16分范围内运动。运动形式:院内主要采用固定踏车、平板跑步机、上肢液阻;家庭运动主要为快走。时间为30~60 min,3~5次/周。(2)抗阻训练:同样结合Borg评分来调整运动强度,控制在11~13 分之间。CN患者均选择适宜强度的弹力带行抗阻训练,每个动作2~3组,每组重复8~12次动作,组间间隔1~2 min,3次/周。治疗头2周患者在心电及血压的监护下,进一步确定运动量并进行适当调整,教会患者运动的方法及注意事项。两周后患者在医生的指导下制定个体化的家庭运动方案,运动量同医院内水平。运动情况以表格的形式进行记录,内容主要包括运动方式、运动时间及运动前、运动中和运动后的感觉,运动前后的心律和血压情况。两组患者均2~4周来医院复诊1次。运动组每周电话随访并记录其运动坚持情况,来医院复诊同时在院内行运动治疗1次,根据患者运动能力及运动过程中的反应酌情调整运动方案。
统计学方法:采用SPSS 18.0软件进行统计学分析。计量资料比较采用t检验,计数资料比较采用χ2检验,等级资料比较采用秩和检验。P<0.05认为差异有统计学意义。
2 结果
本研究入选的运动组16例CN患者接受运动干预3个月,干预过程中无不良心血管事件发生。
CN组患者RHR和HRR1与对照组受试者比较(表1):CN组患者的RHR明显高于对照组受试者,HRR1明显低于对照组受试者,差异有统计学意义。
表1 心血管神经症组患者与对照组受试者静息心率和运动后1 min心率恢复比较()

表1 心血管神经症组患者与对照组受试者静息心率和运动后1 min心率恢复比较()
注:与对照组比较*P<0.01
对照组 (n=30) 37.73±9.32 15 15 71.37±10.70 35.67±16.66心血管神经症组 (n=48) 39.73±9.84 24 24 83.02±14.35* 21.25±6.51*
药物组和运动组两个亚组患者的一般资料比较(表2):两组患者在干预前年龄、性别、体力活动水平以及β受体阻滞剂使用情况、地西泮使用情况、RHR、HRR1等一般临床资料,差异均无统计学意义(P>0.05),具有可比性。
药物组和运动组两个亚组患者干预前后SCL-90评分比较(表3):与干预前相比,干预后药物组患者的SCL-90评分中总分、总均分、阳性项目数、阳性分、阳性均分均减少,因子中抑郁、焦虑、敌对、偏执明显改善(P均<0.05),余因子分无明显影响。与干预前相比,干预后运动组患者的SCL-90各项评分均明显降低(P均<0.05),躯体化、人际关系、抑郁、焦虑、恐怖的因子分减少尤为显著。干预后,运动组患者SCL-90各项评分均明显低于药物组(P均<0.05)。
药物组和运动组两个亚组患者干预前后RHR和HRR1比较(表4):与干预前比较,干预后药物组和运动组患者的RHR和HRR1均明显改善,差异有统计学意义(P<0.05);与药物组比较,干预后运动组患者的HRR1改善更为显著(P<0.01),RHR改善不明显。
表2 药物组和运动组两个亚组患者的一般资料比较

表2 药物组和运动组两个亚组患者的一般资料比较
注:体力活动水平采用Schnohr等对体力活动水平的分级[4]:低水平,从事轻微体力活动每周小于2 h;中等水平,轻微体力活动每周2~4 h;高等水平,每周轻微体力活动超过4 h或以任何频次从事更有精力的活动
分组 性别 (例)体力活动水平 (例) 年龄 (岁) 静息心率 (次/min)运动后1 min心率恢复 (次/min) β受体阻滞剂 (mg) 地西泮 (mg)男 女 低 中 高药物组 (n=14) 7 7 3 3 8 37.57±9.16 81.43±17.53 21.07±4.50 37.32±12.20 2.86±2.57运动组 (n=16) 5 11 2 10 4 41.63±10.30 78.43±13.30 21.31±7.06 40.08±11.37 3.13±2.50
表3 药物组和运动组两个亚组患者干预前后SCL-90评分比较(分,
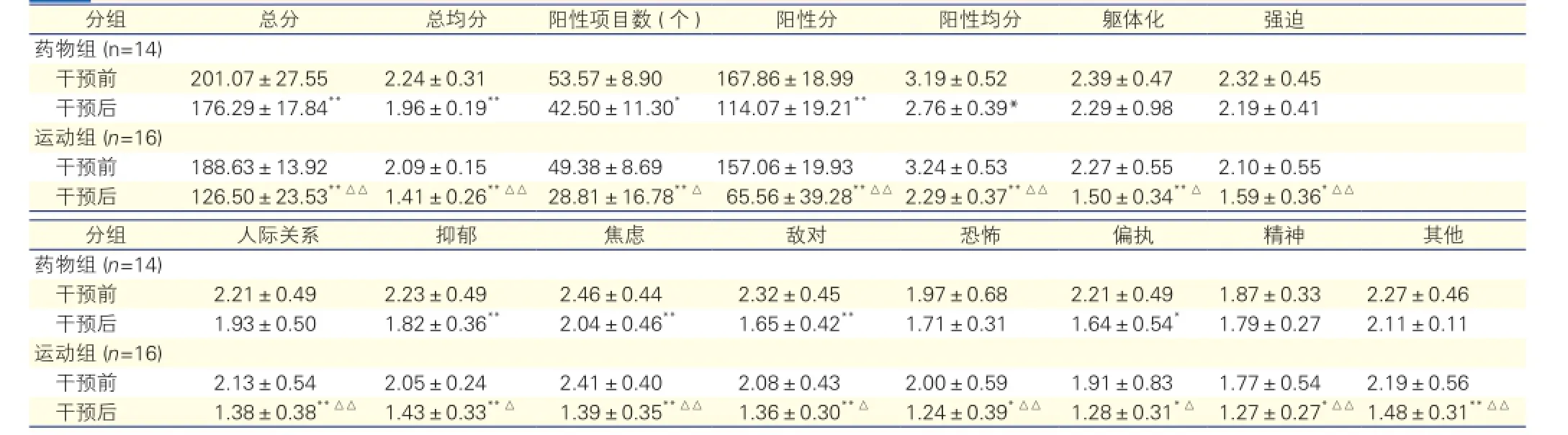
表3 药物组和运动组两个亚组患者干预前后SCL-90评分比较(分,
注:SCL-90:症状自评量表。与干预前比较*P<0.05**P<0.01;与药物组比较△P<0.05△△P<0.01
分组 总分 总均分 阳性项目数 (个) 阳性分 阳性均分 躯体化 强迫药物组 (n=14)干预前 201.07±27.55 2.24±0.31 53.57±8.90 167.86±18.99 3.19±0.52 2.39±0.47 2.32±0.45干预后 176.29±17.84** 1.96±0.19** 42.50±11.30* 114.07±19.21** 2.76±0.39* 2.29±0.98 2.19±0.41运动组 (n=16)干预前 188.63±13.92 2.09±0.15 49.38±8.69 157.06±19.93 3.24±0.53 2.27±0.55 2.10±0.55干预后 126.50±23.53**△△ 1.41±0.26**△△ 28.81±16.78**△ 65.56±39.28**△△2.29±0.37**△△ 1.50±0.34**△ 1.59±0.36*△△分组 人际关系 抑郁 焦虑 敌对 恐怖 偏执 精神 其他药物组 (n=14)干预前 2.21±0.49 2.23±0.49 2.46±0.44 2.32±0.45 1.97±0.68 2.21±0.49 1.87±0.33 2.27±0.46干预后 1.93±0.50 1.82±0.36** 2.04±0.46** 1.65±0.42** 1.71±0.31 1.64±0.54* 1.79±0.27 2.11±0.11运动组 (n=16)干预前 2.13±0.54 2.05±0.24 2.41±0.40 2.08±0.43 2.00±0.59 1.91±0.83 1.77±0.54 2.19±0.56干预后 1.38±0.38**△△ 1.43±0.33**△ 1.39±0.35**△△ 1.36±0.30**△ 1.24±0.39*△△ 1.28±0.31*△ 1.27±0.27*△△1.48±0.31**△△
表4 药物组和运动组两个亚组患者干预前后静息心率和运动后1 min心率恢复比较(次/min,

表4 药物组和运动组两个亚组患者干预前后静息心率和运动后1 min心率恢复比较(次/min,
注:与干预前比较*P<0.01**P<0.05;与药物组比较△P<0.01
分组 静息心率 运动后1 min心率恢复干预前 干预后 干预前 干预后药物组 (n=14)81.43±17.53 67.79±9.55* 21.07±4.5028.57±2.88*运动组 (n=16)78.44±13.30 69.06±9.27**21.31±7.0634.13±4.70*△
3 讨论
CN患者症状多,常常伴有负性情绪,给生活和工作带来极大的影响。目前临床上常采用SCL-90评分对CN的临床症状进行评定。本研究表明,CN患者SCL-90总分以及各因子评分较正常人均明显升高,尤其是躯体化、强迫、焦虑、抑郁、敌对因子等,与前期研究一致[1]。
前期研究亦表明,CN患者存在自主神经功能紊乱[5]。近年来临床用于评估自主神经功能的检查方法包括24 h心率变异性(HRV)、24 h动态血压监测和频谱分析、肌肉神经交感神经活动、心率变时性指数等[6,7]。HRV被认为是目前判断自主神经功能比较好的检查方法,但HRV检查用时久,活动时电极易脱落或者干扰波太多而无法分析,检测指标尚未有统一标准,有关HRV的生理基础和各种指标的生物相关性仍不完全明确,存在一定的局限性和不足。其他方法也均存在操作复杂且易受干扰等缺点。近年来HRR作为衡量自主神经功能紊乱的新指标受到关注,它不仅是预测心血管病及主要心血管事件发生的独立危险因素[8,9],也是病死率强有力的预测因子[10]。有研究报道,HRR的诊断价值与目前常用的HRV意义相当[11],常用的HRR指标有HRR1、HRR2、HRR3。相关研究表明,运动结束后心率快速下降特别是运动后第1个30 s以内的心率下降,主要是由于迷走神经功能再次被激活所引起,由于副交感神经对运动结束后1 min内的HRR影响更大,因此本研究采用HRR1作为观察指标。RHR作为衡量自主神经功能的指标也日益受到临床重视[12,13]。有研究表明,焦虑、抑郁等负性情绪通过增加去甲肾上腺素的水平,抑制迷走神经张力,导致自主神经功能紊乱,临床上常表现为心率变异性降低,静息心率增加,运动峰值心率降低和运动后心率恢复延迟。
有关有氧联合抗阻运动对CN患者临床症状的改善以及对自主神经功能的影响,国内外未见报道。本研究中CN患者与正常人比较,静息心率增快,运动后1 min心率恢复延迟,表明CN患者存在自主神经功能紊乱。进一步观察发现,β受体阻滞剂和综合运动均能改善CN患者的临床症状及自主神经功能,表现为药物组SCL-90评分中总分、总均分、阳性项目数、阳性分、阳性均分及抑郁、焦虑、敌对、偏执均有明显下降;运动组SCL-90评分中总分、总均分、阳性项目数、阳性分、阳性均分及十个因子较药物组均有明显下降,表明在药物治疗基础上结合综合运动较单纯药物效果更显著,特别是在躯体化、强迫、人际关系敏感、恐怖、精神病性、睡眠饮食障碍方面尤为突出。此外,本研究还显示,β受体阻滞剂和综合运动均能改善RHR和HRR1,与药物组相比,运动组HRR1改善更明显,提示在药物基础上结合综合运动较单纯的药物治疗能更好的改善临床症状及自主神经功能,其机制可能与综合运动通过降低交感神经活性和增加迷走神经活性来调节自主神经功能有关。在本研究运动干预过程中,无不良心血管事件发生,安全性好。因此,综合运动治疗应作为CN患者的常规治疗之一。
综上所述,CN患者存在自主神经功能紊乱;有氧运动联合抗阻训练的综合运动治疗对CN患者安全、有效,其机理可能与改善自主神经功能有关,值得临床推广。
[1] 刘遂心, 朱洁, 孙明, 等. 有氧运动干预对心血管神经症的影响.中国行为医学科学, 2005, 14: 421-424.
[2] 陆再英, 钟南山,谢毅, 等. 内科学. 北京: 人民卫生出版社,2011. 545.
[3] Liu Y, Liu S X, Zheng F, et al. Cardiovascular autonomic neuropathy in patients with type 2 diabetes. J Diabetes Investig, 2016, 7: 615-621.
[4] Schnohr P, Scharling H, Jensen JS. Changes in leisure-time physical activity and risk of death: an observational study of 7,000 men and women. Am J Epidemiol, 2003, 158: 639-644.
[5] 李剑, 张文亮, 谢康玲, 等. 滋心阴口服液对心血管神经症患者自主神经功能的影响. 中南医学科学杂志, 2013, 41: 276-279.
[6] Hamner JW, Taylor JA. Automated quantification of sympathetic beatby-beat activity, independent of signal quality. J Appl Physiol, 2001, 91: 1199-1206.
[7] Liu Y, Liu SX, Zheng F, et al. Cardiovascular autonomic neuropathy in patients with type 2 diabetes. J Diabetes Investig, 2016, 7: 615-621.
[8] 汪蕾, 张福春. 运动锻炼改善急性心肌梗死患者运动能力及心率恢复能力. 中国循环杂志, 2009, 24: 421-424.
[9] Dhoble A, Lahr BD, Allison TG, et al. Cardiopulmonary fitness and heart rate recovery as predictors of mortality in a referral population. J Am Heart Assoc, 2014, 3: e559.
[10] Lauer MS. Autonomic function and prognosis. Cleve Clin J Med, 2009, 76( Suppl 2): S18-S22.
[11] Lind L, Andren B. Heart rate recovery after exercise is related to the insulin resistance syndrome and heart rate variability in elderly men. Am Heart J, 2002, 144: 666-672.
[12] 李有信, 王燕慧, 张灏. 静息心率增快的研究现状. 国际心血管病杂志, 2013, 40: 309-311.
[13] Tochikubo O, Mizushima S, Watanabe J, et al. Base heart rate during sleep in hypertensive and normotensive subjects. J Hypertens, 2001, 19: 1131-1137.
Autonomic Nerve Functional Changing and the Impact of Comprehensive Exercise in Patients With Cardiovascular Neurosis
LI Cui, DONG Lei, LIU Sui-xin, ZHANG Wen-liang, Liu Yuan, LI Ning.
Department of Rehabilitation, Xiangya Hospital of Central South University, Changsha (410008), Hunan, China Corresponding Author: LIU Sui-xin, Email: 2278359828@qq.com
Objective: To observe the autonomic nerve functional changing and the impact of comprehensive exercise in patients with cardiovascular neurosis (CN).
Methods: Our research included in 2 groups: CN group, n=48 and Control group, n=30 normal subjects. Resting heart rate (RHR) and heart rate at the first recovery minute (HRR1) were measured by cardiopulmonary exercise testing (CPET) for comparison between 2 groups. In CN group, 30 patients were chosen and randomly assigned into 2 subgroups: Medication subgroup, patients received β-receptor blocker, n=14 and Comprehensive exercise subgroup, patients received the same medication plus aerobic and Thera-band resistance training, n=16; both subgroups were intervened for 3 months. Symptom checklist 90 (SCL-90) was used to evaluate relevant parameters before and after intervention, the changes of RHR and HRR1 were also compared between 2 subgroups.
Results:① Compared with Control group, CN group had the higher RHR and lower HRR1, all P<0.01.② Compared with pre-intervention, both subgroups had improved RHR, HRR1 and SCL-90 scores at postintervention, all P<0.05; compared with Medication subgroup, Comprehensive exercise subgroup showed improved SCL-90 scores and HRR1, all P<0.05.
Conclusion: Comprehensive exercise including aerobic and Thera-band resistance training could effectively improve the clinical symptoms in CN patients, which might be related to changing the autonomic nerve function in relevant patients.
Neurotic disorders; Exercise therapy; Autonomic nervous system
(Chinese Circulation Journal, 2017,32:322.)
2016-11-30)
(编辑:朱柳媛)
湖南省发展和改革委员会科研项目(20121521);湖南省科技厅项目(2013SK5076)
410008 湖南省长沙市,中南大学湘雅医院 康复科(李萃、董蕾、刘遂心、张文亮、刘元);中南大学湘雅二医院 康复科(李凝)
李萃 技师 硕士 研究方向为心血管康复 Email:703401970@qq.com 通讯作者:刘遂心 Email:2278359828@qq.com
R54
A
1000-3614(2017)04-0322-04
10.3969/j.issn.1000-3614.2017.04.004
