巴戟天不同炮制品中水晶兰苷的大鼠体内血药浓度及组织分布研究
2017-04-28史辑景海漪黄玉秋范亚楠贾天柱
史辑,景海漪,黄玉秋,范亚楠,贾天柱
1.辽宁中医药大学药学院,辽宁 大连 116600;2.国家中医药管理局炮制原理解析重点研究室,辽宁 大连 116600;3.辽宁省中药炮制工程技术研究中心,辽宁 大连 116600
巴戟天不同炮制品中水晶兰苷的大鼠体内血药浓度及组织分布研究
史辑1,2,3,景海漪1,黄玉秋1,范亚楠1,贾天柱1,2,3
1.辽宁中医药大学药学院,辽宁 大连 116600;2.国家中医药管理局炮制原理解析重点研究室,辽宁 大连 116600;3.辽宁省中药炮制工程技术研究中心,辽宁 大连 116600
目的 探讨炮制对巴戟天中水晶兰苷在大鼠体内血药浓度及组织分布的影响。方法 分别给予SD大鼠灌胃巴戟肉、盐巴戟天、制巴戟天的正丁醇萃取物,采用HPLC,Venusil MP C18色谱柱(250 mm×4.6 mm,5µm),以甲醇-0.4%磷酸溶液为流动相,梯度洗脱,柱温25℃,检测波长235 nm,测定血浆及各组织中水晶兰苷的含量。结果 巴戟肉、盐巴戟天、制巴戟天中水晶兰苷高、中、低剂量(0.177、1.77、17.7µg/mL)的药代动力学特征符合二室模型,在所研究的剂量范围内,AUC与给药剂量呈现良好的线性相关性,符合线性动力学特征。灌胃给药60 min后,水晶兰苷在肾、肺、肝、脾的浓度达到最大,在肾组织和肝组织中的浓度分布为盐巴戟天>巴戟肉>制巴戟天,在脾组织中浓度分布为制巴戟天>盐巴戟天>巴戟肉。结论 不同炮制方法对巴戟天在大鼠体内血药浓度及组织分布有一定影响。
巴戟天;水晶兰苷;药代动力学;组织分布;高效液相色谱法
巴戟天为茜草科植物巴戟天Morinda officinalis How.的干燥根,具有补肾阳、抗风湿、强筋骨作用。2015年版《中华人民共和国药典》收载其炮制品种有巴戟天、巴戟肉、盐巴戟天、制巴戟天,巴戟天生品偏于祛风湿,盐巴戟天补肾壮阳作用增强,制巴戟天则偏于脾肾双补[1]。环烯醚萜苷类是巴戟天的主要有效成分,其中以水晶兰苷(monotropein)含量最高。本课题组前期研究发现,巴戟天经炮制后水晶兰苷含量显著增加[2]。近年来对巴戟天炮制前后的药理药效学研究逐渐增多[3-6],但炮制影响巴戟天有效成分在体内分布的研究尚未见报道。药物的体内代谢过程在一定程度上对药效有影响。本研究比较巴戟天不同炮制品中水晶兰苷在大鼠体内的血药浓度及其组织分布特征,为系统阐明巴戟天炮制前后功效变化奠定基础。
1 仪器、试药与动物
Agilent 1100系列高效液相色谱仪(美国安捷伦公司),紫外检测器(美国安捷伦公司),Venusil MP C18色谱柱(250 mm×4.6 mm,5µm,天津博纳艾杰尔科技有限公司),MettlerAE240电子分析天平(瑞士METTLER TOLEDO公司),KQ-5200DB型数控超声波清洗器(昆山市超声仪器有限公司),HGC-12A氮吹仪(天津恒奥科技有限公司),XW-80A微型涡旋混合仪(上海青浦沪西分析仪器厂),TGL-16G台式离心机(上海安亭科学仪器厂),微量移液枪(芬兰雷勃仪器厂)。
巴戟天药材购自广东省德庆高粱镇巴戟天GAP种植基地,甘草药材购自大连开发区阳光大药房,经辽宁中医药大学中药鉴定教研室翟延君教授鉴定,分别为茜草科植物巴戟天Morinda officinalis How.的干燥根和豆科植物甘草Glycyrrhiza uralensis Fisch.的干燥根及根茎;精制盐(大连盐业有限公司,批号20110102)。水晶兰苷对照品(批号MUST-11062204,质量分数≥98.0%),成都曼思特生物科技有限公司;栀子苷对照品(批号110749200511,质量分数≥98.0%),中国食品药品检定研究院;乙腈和甲醇为色谱纯;水为娃哈哈纯净水;其他试剂均为分析纯。
SPF级SD雄性大鼠100只,40日龄左右,体质量(200±20)g,大连医科大学实验动物中心,动物合格证号SCXK(辽)2008-0002。在温度20~22℃、相对湿度45%~65%、光照/黑暗12 h/12 h条件下饲养,自由饮食、饮水,适应性饲养1周。
2 方法与结果
2.1 色谱条件
色谱柱为Venusil MP C18柱(250 mm×4.6 mm, 5µm),流动相为甲醇-0.4%磷酸溶液,梯度洗脱(见表1),流速为1.0 mL/min,检测波长为235 nm,柱温为25℃。进样量为20µL。内标为栀子苷。

表1 流动相梯度洗脱条件(%)
2.2 溶液制备
2.2.1 炮制品制备 ①巴戟肉:取原药材,除去杂质及木心,洗净,晒干。②盐巴戟天:取净巴戟天,加入适量食盐水(每100 g巴戟天,盐2 g),拌匀,闷润,待盐水被吸尽后蒸透,趁热除去木心,切段干燥。③制巴戟天:取甘草煎汤3次,去渣,得甘草汁。取净巴戟天,加药材量1.5倍甘草汁(相当于每100 g巴戟天加甘草6 g),文火煮至甘草汁被吸尽,趁热抽去木心,切段,干燥。
2.2.2 供试品溶液制备 分别取巴戟肉、盐巴戟天和制巴戟天,切成2~5 mm的段,加入8倍量80%乙醇,回流提取3次,每次2 h,过滤,弃去药渣,滤液减压浓缩至无醇味,得浓缩液。浓缩液加适量蒸馏水混悬,依次用等体积的石油醚、乙酸乙酯、正丁醇各萃取3次,回收溶剂。收集正丁醇萃取物,加适量蒸馏水混悬至浓度为4 g/mL的提取液。
2.2.3 对照品溶液制备 精密称取水晶兰苷对照品适量,加甲醇制成0.354 0 mg/mL对照品溶液。再分别以适量甲醇按倍数稀释法稀释得水晶兰苷系列对照品溶液,置4℃冰箱中保存备用。
2.3 内标溶液配制
精密称取栀子苷对照品适量,加甲醇制成0.423 0 mg/mL对照品溶液,置4℃冰箱中保存备用。
2.4 给药与样品采集
取健康SD大鼠,随机分为巴戟肉组、盐巴戟天组和制巴戟天组,给药前禁食不禁水24 h,各组大鼠分别灌胃给予相应提取物20 g/kg 1次。于给药前和给药后5、10、15、20、30、45、60、120、240、360、480、720、1440 min经眼眶静脉丛取血约0.5 mL,置预先肝素化的离心试管中,10 000 r/min离心10 min,分离血浆,-20℃冰箱保存备用。
取健康SD大鼠,给药前禁食不禁水24 h,巴戟肉组、盐巴戟天组和制巴戟天组大鼠分别灌胃给予相应药物20 g/kg 1次。分别于给药后15、60、360 min后处死大鼠,每个时间点6只,立即解剖采集心、肝、脾、肺、肾、胃、大肠、小肠和脑组织,组织样品经生理盐水冲洗,去除表面的血液和内容物后,称重,装入自封袋中,-20℃冰箱冰冻保存备用。
2.5 血浆及组织样品预处理
取血浆样品200µL,置2.0 mL肝素化离心管中,精密加入内标溶液(栀子苷)100µL、乙腈200µL、甲醇400µL,涡旋震荡混合2 min,12 000 r/min离心10 min,取上清液,35℃空气流吹干,残留物用甲醇-0.4%磷酸溶液(5∶95)100µL超声溶解,12 000 r/min离心5 min,取上清液20µL进样检测。
取组织样品(心、肝、脾、肺、肾、胃、大肠、小肠和脑)各0.5 g,精密称定,加入生理盐水1 mL,用匀浆机制备组织匀浆。组织匀浆超声后,10 000 r/min离心5 min。取上层液100µL,置2.0 mL离心管中,精密加入内标溶液(栀子苷)100µL、乙腈200µL、甲醇400µL,涡旋震荡混合2 min,12 000 r/min离心10 min,取上清液,35℃空气流吹干,残留物用甲醇-0.4%磷酸溶液(5∶95)100µL超声溶解,12 000 r/min离心5 min,取上清液20µL进样检测。
2.6 方法学考察
2.6.1 专属性 空白血浆、加药血浆和血浆样品HPLC图显示,血浆内源性物质对药物和内标的检测无干扰,水晶兰苷和栀子苷内标峰峰形好、分离度高,表明该法的专属性好。取大鼠空白组织(小肠)匀浆上清液100µL,组织样品中除不加内标溶液外,其余按“2.5”项下组织样品处理操作,获得空白样品色谱图;将水晶兰苷对照品溶液和栀子苷内标溶液加入空白组织(小肠)匀浆中,同法操作,获得相应色谱图;同法操作,获得大鼠灌胃巴戟天提取液后小肠组织样品色谱图。结果表明,组织中内源性物质不干扰水晶兰苷和内标物栀子苷的测定。色谱图见图1。
2.6.2 标准曲线 取大鼠空白血浆100µL,依次加入系列对照品溶液100µL,配制成相当于大鼠血浆药物浓度分别为17.7、7.08、3.54、1.77、0.708、0.354、0.177µg/mL的血浆样品。按“2.5”项下方法处理并测定,建立标准曲线。以血浆中水晶兰苷浓度(µg/mL)为横坐标,水晶兰苷与内标物的峰面积比值为纵坐标,用加权(1/CC)最小二乘法进行回归计算,得回归方程Y=3.509 8X-0.096 8(r=0.996 8),表明血浆中水晶兰苷在0.177~17.7µg/mL浓度范围内线性关系良好。
取大鼠空白组织(小肠)匀浆上层液100 μL,依次加入系列对照品溶液10 μL,配制成相当于大鼠组织药物浓度为17.7、7.08、3.54、1.77、0.708、0.354、0.177 μg/mL的组织样品。按“2.5”组织样品处理项下操作,进样20 μL测定,建立标准曲线。以组织中水晶兰苷浓度(µg/mL)为横坐标,水晶兰苷与内标物的峰面积比值为纵坐标,用加权(1/CC)最小二乘法进行回归计算,得回归方程Y=0.553 6X-0.051 4(r=0.994 0),结果表明,组织中水晶兰苷在0.177~17.7µg/mL浓度范围内线性关系良好。
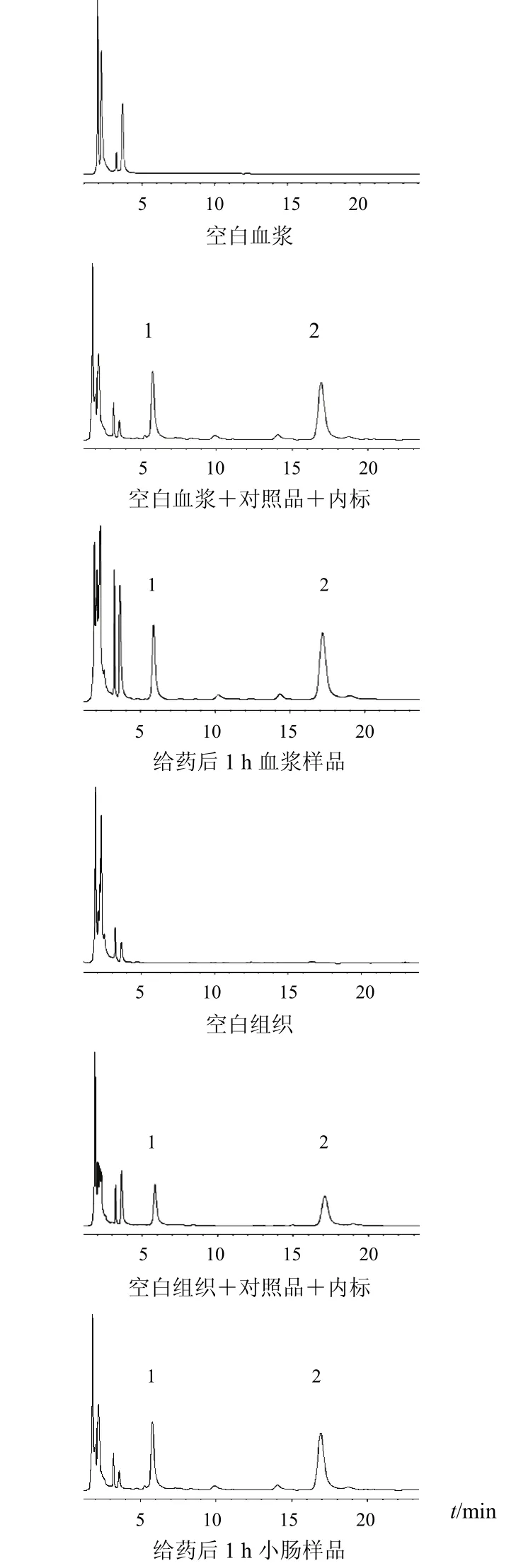
图1 大鼠血浆及组织中水晶兰苷HPLC图
2.6.3 精密度 按“2.5”项下方法分别配制水晶兰苷低、中、高3个浓度的大鼠空白血浆/组织样品(0.177、1.77、17.7µg/mL),每一浓度进样6次,连续测定3 d,随行标准曲线。根据当日标准曲线计算各样品的浓度,与配制浓度对照,求得血浆/组织样品测定方法的日内精密度和日间精密度。测定结果显示,低、中、高浓度日内精密度RSD=5.8%,日间精密度RSD=6.3%,符合测定要求。
2.6.4 稳定性 取大鼠空白血浆(组织)100µL,按“2.5”项下方法配制水晶兰苷低、中、高3个浓度的空白血浆/组织样品(0.177、1.77、17.7µg/mL),室温保存24 h,再次测定,以考察样品在室温条件下的稳定性。每一浓度进行3样本分析。将2次测得结果的均值进行对照,计算相对误差(RE)。低、中、高3个浓度的RE值分别为4.7%(3.8%)、3.9%(4.3%)、4.2%(4.1%),表明水晶兰苷血浆/组织样品处理后在室温至少可稳定存放24 h。
2.6.5 冻融稳定性 同法配制低、中、高3个浓度的血浆/组织样品,经反复3次-20℃冷冻-室温溶解,再测定样品浓度,以考察样品在冷冻和冻融条件下的稳定性。每一浓度进行3样本分析。将冻融前后2次测得结果的均值进行对照,计算相对误差(RE)。低、中、高3个浓度的RE值分别为3.9%(4.5%)、4.1%(4.0%)、4.5%(3.9%),表明血浆样品冻融3次基本稳定。
2.6.6 提取回收率 取大鼠空白血浆100µL,按“2.5”项下方法制备低、中、高3个浓度的样品(分别为0.177、1.77、17.7µg/mL),每个浓度进行6样本分析。另取空白血浆(组织)100µL,按“2.5”项下方法操作,取上清液,分别加入相应浓度的对照品溶液100µL(各浓度平行操作3个样品),于35℃空气流下吹干,残留物用甲醇-0.4%磷酸溶液(5∶95)100µL超声溶解,12 000 r/min离心5 min,取上清液20µL进样检测,获得相应峰面积值(3次测定的平均值)。
以每一浓度2种处理方法得峰面积比值,计算提取回收率,结果本法在大鼠血浆(组织)样品低、中、高3个浓度的提取回收率分别为75.0%±4.1%(80.9%±3.2%)、74.8%±3.5%(90.1%±3.7%)、75.1%±2.8%(87.3%±2.9%)。
同法考察内标回收率为86.8%±4.5%(88.3%± 3.5%)。
2.7 水晶兰苷药时曲线
未知样品测定按“2.5”项下方法操作,记录峰面积,计算血药浓度,并绘制平均血药浓度-时间曲线图,结果见图2。
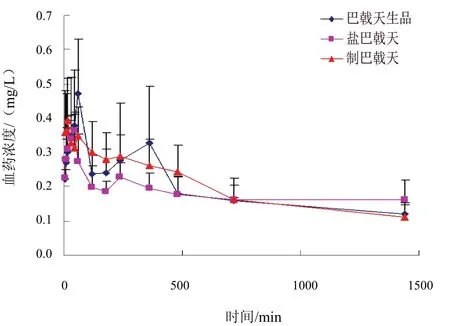
图2 大鼠灌胃给予巴戟天不同炮制品后水晶兰苷平均药时曲线
2.8 药代动力学参数测定
采用DAS2.1.1软件对各组大鼠灌胃巴戟天不同炮制品后组织中水晶兰苷浓度数据进行分析,自选房室数和权重,分别进行一室、二室模型及1、1/C、1/CC 3种权重的曲线拟合,根据AIC最小和R2最大的原则,判定巴戟肉、盐巴戟天和制巴戟天均属于二室模型,权重系数为1/CC。结果见表2。
2.9 水晶兰苷在大鼠体内的组织分布
大鼠分别灌胃给予巴戟肉、盐巴戟天和制巴戟天提取液后,水晶兰苷在大鼠体内不同时间点(15、60、360 min)各组织中的浓度见表3。
采用SPSS19.0统计软件分析各组大鼠灌胃巴戟天不同炮制品后水晶兰苷在不同时间点的组织分布数据,结果见图3~图5。

表2 大鼠灌胃巴戟天不同炮制品后血浆中水晶兰苷药代动力学参数

表3 大鼠灌胃巴戟天不同炮制品后不同时点组织中水晶兰苷浓度(—x,µg/mL,n=6)
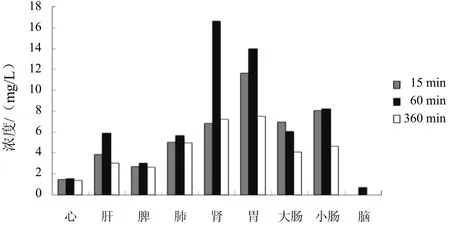
图3 大鼠灌胃巴戟肉后不同时点水晶兰苷组织分布
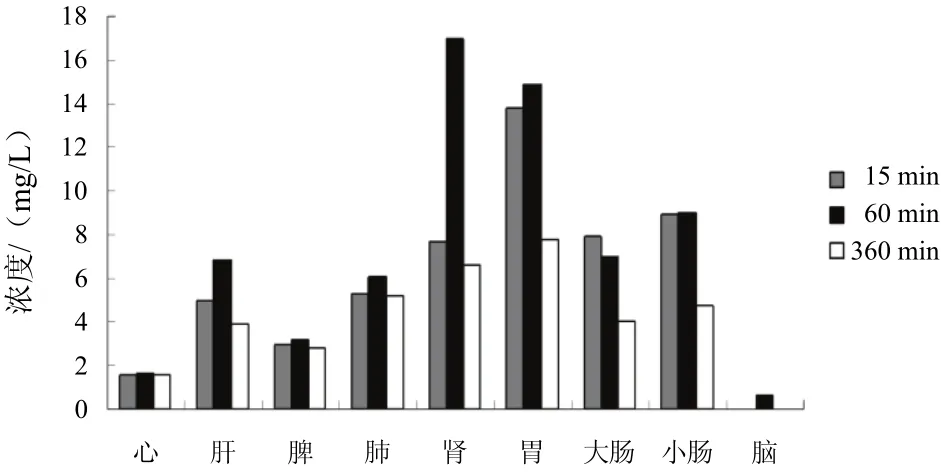
图4 大鼠灌胃盐巴戟天后不同时点水晶兰苷组织分布
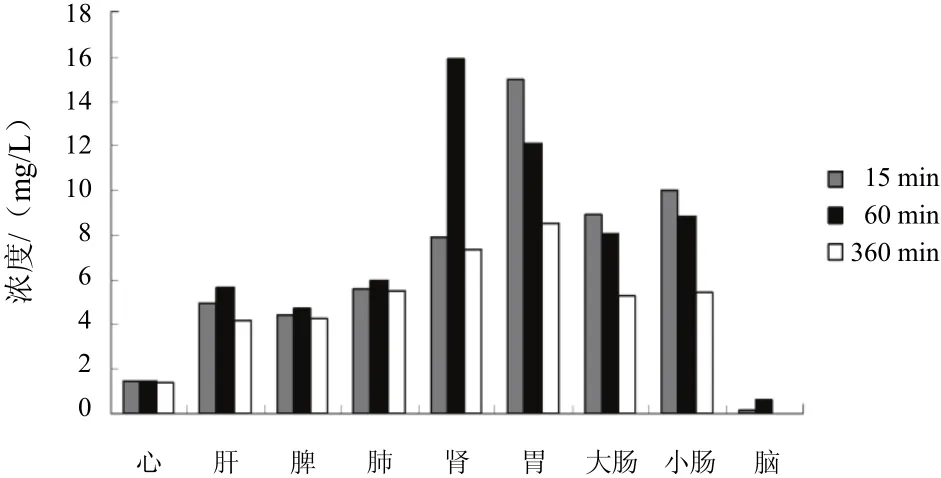
图5 大鼠灌胃制巴戟天后不同时点水晶兰苷组织分布
3 讨论
本试验考察了Cromasil C18(150 mm×4.6 mm,5µm)、Agilent C18(250 mm×4.6 mm,5µm)和Venusil MP C18(250 mm×4.6 mm,5µm)色谱柱,结果表明,Venusil MP C18色谱柱可使水晶兰苷得到较好保留。试验中对乙腈-水、甲醇-水、甲醇-0.2%磷酸溶液、甲醇-0.4%磷酸溶液作为流动相按不同比例进行了考察,同时考察了等度洗脱和梯度洗脱的分离效果,发现甲醇-0.4%磷酸溶液梯度洗脱(0~12 min,5%A~28.8%A;12~18 min,28.8%A~60%A;18~20 min,60%A~75%A;20~25 min,75%A~80%A)时,血浆样品中水晶兰苷达到基线分离,出峰时间适中,血浆中的内源性物质无干扰。水晶兰苷的最大吸收波长为235 nm,栀子苷的最大吸收波长为238 nm,考虑到整体效果,选择235 nm作为采集波长。同时,根据被测组分水晶兰苷的理化性质和色谱行为,选择栀子苷作为内标,经反复调整流动相后无干扰。
本研究采用DAS2.1.1软件进行房室模型拟合分析,结果显示,巴戟肉、盐巴戟天和制巴戟天三者均符合二房室模型,即大鼠灌胃后,水晶兰苷瞬间就可在血液供应丰富的组织(如血液、肝、肾等)分布达到动态平衡,然后在血液供应较少或血流缓慢的组织(如脂肪、皮肤、骨骼等)分布达到动态平衡。巴戟肉、盐巴戟天和制巴戟天中水晶兰苷的体内分布过程没有明显差异。
与巴戟肉相比,大鼠灌胃制巴戟天和盐巴戟天后达峰时间明显加快,半衰期缩短,说明其消除迅速;盐巴戟天AUC增加,表明其生物利用度较高。辅料盐和甘草汁能促进水晶兰苷的吸收。
组织分布实验表明,在心、肝、脾、肺、肾、胃、大肠、小肠组织中都能检测到水晶兰苷的存在,表明水晶兰苷可以在大鼠体内广泛分布与代谢,特别是在肾组织中的浓度较高。
口服给药15 min后,水晶兰苷可分布至多数组织(脑组织除外),胃中含量最高,小肠次之,这可能与口服给药方式有关;大部分血流较丰富的组织(肾、肺、肝和脾)在给药60 min后药物浓度达高峰,然后逐渐下降,至6 h时已不能检测到原型药,这与该药在血液中的消除过程基本同步,表明水晶兰苷的组织分布与血流灌注过程密切相关。
巴戟肉组肝、肺、肾随大鼠代谢时间变化水晶兰苷含量显著增加;盐巴戟天组各组织随大鼠代谢时间变化水晶兰苷含量均有增加,心、肝、肺和肾中水晶兰苷含量在60 min出现最大值;制巴戟天组胃、大肠和小肠随大鼠代谢时间变化水晶兰苷含量显著降低,而心、肝、脾、肺、肾含量增加,且脾中水晶兰苷的含量在60 min出现最大值。
本研究结果表明,巴戟天经盐制后,能改善水晶兰苷在体内分布、吸收、代谢,促进其在肾组织的吸收,这与“盐制入肾经”的传统理论相符。巴戟天经甘草水制后,延长了水晶兰苷在大鼠体内被吸收的时间,且促进了水晶兰苷在脾和胃的吸收,这也从组织分布角度说明了制巴戟天脾肾双补作用增强的原因。
[1]国家药典委员会.中华人民共和国药典:一部[M].北京:中国医药科技出版社,2015:75.
[2]肖新霞,潘胜利.巴戟天属植物化学成分、药理活性与临床应用[J].国外医药:植物药分册,2003,18(6):243-248.
[3]YOSHIKAWAM,YAMAGUCHI S,NISHISAKAH, et al.Chemical constituents of Chinese natural medicine,morindae radix,the dried roots ofmorinda officinalisHow.:structures of morindolide and morofficinaloside[J].Chem Pharm Bull(Tokyo),1995,43(9):1462-1465.
[4]景海漪,史辑,崔妮,等.不同炮制方法对巴戟天中寡糖类成分和水晶兰苷含量的影响[J].中国实验方剂学杂志,2014,20(17):20-23.
[5]崔妮,史辑,贾天柱.巴戟天不同炮制品补肾壮阳作用的比较研究[J].中国中药杂志,2013,38(22):3898-3901.
[6]徐德峰,宓为峰,张素贞,等.巴戟天寡糖抗抑郁作用机制研究[J].中国临床药理学杂志,2015,31(15):1539-1542.
Effects of Monotropein in Different Processing Products of Morindae Officinalis Radix on Plasma Concentration and Tissue Distribution in Rats
SHI Ji1,2,3,JING Hai-yi1,HUANG Yu-qiu1, FAN Ya-nan1,JIATian-zhu1,2,3
(1.College of Pharmacy,Liaoning University of Traditional Chinese Medicine,Dalian 116600,China;2.Key Laboratory of Processing Principle Analysis,State Administration of Traditional Chinese Medicine,Dalian 116600,China;3.Liaoning Research Center of Processing Engineering Technology for TCM, Dalian 116600,China)
Objective To study the effects of monotropein in different processed products of Morindae Officinalis Radix on plasma concentration and tissue distribution in rats.Methods The n-butanol extracts of Morindae Officinalis Radix and its processing products by salt and licorice were given to SD rats orally.HPLC was employed,Venusil MP C18 column(250 mm×4.6 mm,5µm)with the mobile phase consisting of methanol-0.4%phosphoric acid at the detection wavelength of 235 nm and a column temperature of 25℃.The content of monotropein in plasma and tissues was determined.Results The pharmacokinetics of the monotropein in three different dosages(0.177,1.77, 17.7µg/mL)of different processing products of Morindae Officinalis Radix in the rats fit the two-compartment model.In the dose range studied,AUC showed a good linear correlation with dose,which accorded with linear dynamic characteristics.After 60 min of gavage,the concentration of monotropein reached the highest in kidney,lung, liver and spleen.The concentrations of monotropein were Morindae Officinalis Radix processed by salt>Morindae Officinalis Radix>Morindae Officinalis Radix processed by licorice in kidney tissues and liver tissues,Morindae Officinalis Radix processed by licorice>Morindae Officinalis Radix processed by salt>Morindae Officinalis Radix in spleen tissues.Conclusion The different processing methods have certain influence on the plasma concentration and tissue distribution of Morindae Officinalis Radix in rats.
Morindae Officinalis Radix;monotropein;pharmacokinetics;tissue distribution;HPLC
10.3969/j.issn.1005-5304.2017.05.018
R285.5
:A
:1005-5304(2017)05-0076-06
2016-06-20)
(
2016-07-27;编辑:陈静)
国家自然科学基金(81473350);国家自然科学基金青年基金(81001635)
贾天柱,E-mail:jiatzh@126.com
