钩藤中乌索酸和钩藤碱对肝癌细胞株HepG2的影响
2017-04-28吴计超祝杰聂东雷潘思颖黄群
吴计超,祝杰,聂东雷,潘思颖,黄群
1.右江民族医学院研究生学院,广西 百色 533000;2.右江民族医学院附属医院,广西 百色 533000
钩藤中乌索酸和钩藤碱对肝癌细胞株HepG2的影响
吴计超1,祝杰1,聂东雷1,潘思颖1,黄群2
1.右江民族医学院研究生学院,广西 百色 533000;2.右江民族医学院附属医院,广西 百色 533000
目的 观察钩藤中乌索酸和钩藤碱对人肝癌细胞株HepG2的影响,探讨其抗肝癌的机制。方法 将50、25、12.5、6.25 μmol/L乌索酸、钩藤碱分别与人肝癌细胞株HepG2共同培养24、48、72 h后,以1%DMSO为阴性对照组,CCK-8法检测HepG2细胞增殖,吖啶橙荧光染色观察50 μmol/L乌索酸、钩藤碱和1%DMSO作用48 h后HepG2细胞形态。结果 乌索酸对HepG2细胞增殖有明显的抑制作用,并且其抑制率与作用时间、药物浓度呈正相关,钩藤碱对HepG2细胞增殖抑制作用较弱。病理观察结果显示,钩藤碱组大部分细胞出现细胞皱缩、包浆致密、核染色边集等凋亡早期改变,而乌索酸组大部分细胞出现核裂解、凋亡小体等凋亡晚期改变。结论 钩藤中乌索酸和钩藤碱对人肝癌细胞株HepG2增殖有抑制作用,能诱导HepG2细胞凋亡。
乌索酸;钩藤碱;HepG2细胞
流行病学调查显示,肝癌发病率和死亡率在恶性肿瘤中排名居前[1-2]。肝癌的高死亡率反映出其恶性程度高、预后较差的特点。所以,探索高效的肝癌细胞凋亡诱导剂并研究其作用机制,对提高肝癌的疗效具有较重要的意义。钩藤以茜草科植物带钩茎枝入药,原用于清热平肝、降血压等,迄今为止已从该属分离鉴定出数百种化学成分,其中主要生物碱类包括钩藤碱,主要三萜类包括乌索酸。钩藤碱主要作用是降压,乌索酸主要作用抑制肿瘤增殖[3-4]。许多研究表明,乌索酸可以通过Bax/Bcl-2途径抑制多种恶性肿瘤增殖,并诱导其凋亡,如胃癌、乳腺癌、肺癌、白血病等[5-8]。也有研究表明,钩藤碱可上调原癌基因Bax和下调原癌基因Bcl-2的表达,从而诱导血管平滑肌细胞的凋亡[9]。本研究采用CCK-8法和吖啶橙荧光染色法检测乌索酸和钩藤碱对人肝癌HepG2细胞增殖及诱导凋亡作用,探讨其抗肝癌的机制。
1 实验材料
1.1 药物和细胞株
钩藤碱、乌索酸,大连美仑生物技术有限公司,批号分别为O0804AS、N0827AS。肝癌HepG2细胞株,中南大学细胞生物中心。
1.2 主要试剂及仪器
吖啶橙(AO)、DMSO(北京索莱宝科技有限公司),DMEM高糖培养基、胎牛血清(上海依科赛生物制品有限公司),CCK-8(日本同仁化学研究所)。MK3型酶标仪(Labsystem,芬兰),CK-18倒置荧光显微镜(Olympus,日本)、CO2培养箱(SONY,日本),TDL-50B低速速离心机(上海安亭科学仪器厂),SW-CJ-2FD净化工作台(Airtech公司),ME203电子分析天平(Mettler Toledo),DMIL-LED倒置显微镜(Leica,德国)。
2 实验方法
2.1 细胞培养
将HepG2细胞接种于含10%胎牛血清的DMEM高糖培基中常规培养、传代及冻存。
2.2 药物制备
称取15 mg乌索酸溶于6 mL DMSO,取1 mL置于EP管中,加入84 μL DMSO稀释混匀。称取15 mg钩藤碱溶于6 mL DMSO,取1 mL置于EP管中,加入288 μL DMSO稀释混匀。分别取各自混匀液200、100、50、25 μL置于8个EP管中,按次序加入0、100、150、175 μL DMSO稀释混匀。2种成分终浓度分别为50、25、12.5、6.25 μmoL/L,且DMSO浓度<1%。
2.3 CCK-8法检测细胞增殖
待肝癌HepG2细胞生长到对数期取出,调整细胞浓度为2×104个/mL,接种到3组96孔板内,每孔100 μL,空白对照组(培养基、CCK-8、1%DMSO)只加100 μL培养基(无肝癌细胞),而后再放回培养箱培养24 h。向每个培养板的8个实验组(含HepG2细胞、培养基、CCK-8、乌索酸及钩藤碱)分别加入1 μL上述所配8个EP管不同浓度的乌索酸和钩藤碱,向阴性对照组(含HepG2细胞、培养基、CCK-8、1%DMSO)加入1 μL DMSO。取3组培养板分别放回培养箱孵育24、48、72 h,再向培养板内加入10 μL CCK-8试剂,再放回培养箱孵育4 h后取出,于酶标仪波长450 nm处测定吸光度(A)值。钩藤碱和乌索酸每个时段每个浓度设5个平行对照孔,且每次实验重复3次,计算细胞抑制率[(A阴性对照组-A实验组)÷(A阴性对照组-A空白对照组)×100%]。
2.4 HepG2细胞吖啶橙荧光染色
取AO 20 mg,溶于5 mL PBS中混匀,取125 μL加入4875 μL中稀释成100 μg/mLAO溶液待用。将浓度约为1×105个/mL的HepG2肝癌细胞株接种到6孔板内,每孔2 mL。待细胞生长到对数期后,分别向其中加入50 μmoL/L钩藤碱、50 μmoL/L乌索酸和20 μL DMSO。作用48 h后,吸出培养液,加入2 mL PBS和80 μLAO溶液。作用5 min后取出,荧光显微镜下观察HepG2细胞形态。
3 统计学方法
4 结果
4.1 乌索酸和钩藤碱对HepG2细胞增殖的影响
阴性对照组HepG2细胞生长活跃,随时间延长A值逐渐升高,经50 μmol/L乌索酸作用后,随时间延长A值逐渐下降(P<0.05)。经25 μmol/L和50 μmol/L乌索酸作用24、48、72 h后及25 μmol/L和50 μmol/L钩藤碱作用48、72 h后,各给药组A值与阴性对照组比较差异有统计学意义(P<0.05)。根据A值计算各组抑制率,显示乌索酸对HepG2肝癌细胞增殖抑制作用明显,且其抑制率与作用时间、药物浓度呈正相关。结果见表1、表2。
表1 乌索酸对肝癌HepG2细胞增殖的影响(±s)

表1 乌索酸对肝癌HepG2细胞增殖的影响(±s)
24 h 48 h 72 hF值A值 抑制率/% A值 抑制率/% A值 抑制率/%空白对照组 5 0.442±0.016 0 0.448±0.014 0 0.434±0.015 0阴性对照组 5 1.124±0.034 0 1.412±0.037 0 1.524±0.051 0 125.67乌索酸组 6.25 5 1.122±0.033 0.29 1.402±0.037 0 1.396±0.044 11.74 90.02 12.5 5 1.118±0.035 0.88 1.385±0.037 1.04 1.103±0.038 38.62 93.49 25 5 0.971±0.032 22.43 1.083±0.028 34.14 1.062±0.038 42.39 16.53 50 5 0.883±0.030 35.34 0.841±0.025 59.23 0.706±0.027 70.05 56.35 F值 57.46 299.25 36.91组别浓度/(μmol/L) n
表2 钩藤碱对肝癌HepG2细胞增殖的影响(±s)

表2 钩藤碱对肝癌HepG2细胞增殖的影响(±s)
24 h 48 h 72 h组别浓度/(μmol/L) n F值A值 抑制率/% A值 抑制率/% A值 抑制率/%空白对照组 5 0.435±0.015 0 0.450±0.022 0 0.440±0.010 0阴性对照组 5 1.132±0.037 0 1.424±0.048 0 1.513±0.049 0 99.09钩藤碱组 6.25 5 1.126±0.041 0.86 1.417±0.046 0.71 1.505±0.046 0.74 101.60 12.5 5 1.125±0.030 1.00 1.405±0.041 1.92 1.461±0.042 4.82 108.59 25 5 1.126±0.030 0.85 1.372±0.037 5.26 1.406±0.039 9.93 109.83 50 5 1.124±0.030 1.15 1.345±0.035 7.99 1.351±0.036 15.03 88.64 F值 0.04 3.34 12.74
4.2 病理观察结果
阴性对照组HepG2肝癌细胞AO染色后,镜下观察显示,细胞核圆且边界清晰呈深染,细胞质呈均匀弥散绿色荧光;50 μmol/L乌索酸和钩藤碱作用48 h HepG2肝癌细胞后,荧光显微镜下可见细胞边缘皱缩,体积变小,有些细胞核开始模糊甚至消失,并出现细胞分布不均及成团分布现象。此改变与细胞核碎裂、染色质凝集、包浆芽突并脱落、形成含核碎片的膜包被凋亡小体等凋亡形态改变相符;钩藤碱组大部分细胞出现细胞皱缩、包浆致密、核染色边集等凋亡早期改变,而乌索酸组大部分细胞出现核裂解、凋亡小体等凋亡晚期改变。结果见图1。
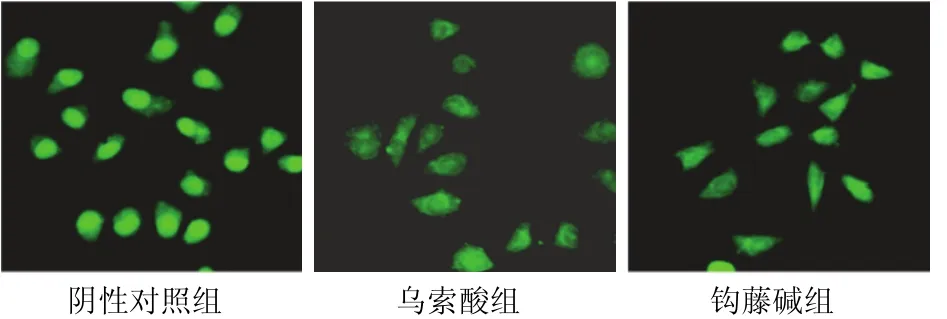
图1 各组肝癌HepG2细胞病理形态(AO荧光染色,×400)
5 讨论
研究表明,钩藤中很多成分都对肿瘤有一定抑制作用,其各自的调节分子机制也不甚相同。赵明宏等[10]研究了钩藤中钩藤酸E对人肝癌细胞的作用,表明钩藤酸E可调节Bax/Bcl-xL比值引起细胞色素C的释放,进而引起caspase级联反应导致肝癌细胞的凋亡。在大多数对乌索酸诱导细胞凋亡的研究中,都显示乌索酸通过Bax/Bcl-2途径诱导肿瘤细胞凋亡[11-13];此外,也有一部分研究显示乌索酸能降低胃癌细胞Mcl-1基因表达,从而增加肿瘤细胞对各种化疗药物的敏感性[14-16]。有学者研究了钩藤碱对肿瘤的作用,发现钩藤总碱在逆转肿瘤细胞耐药性方面作用较强[17]。周于禄等[18]通过人耐药肺腺癌A549/DDP细胞研究了异钩藤碱的逆转耐药性作用,结果表明,逆转强弱与给药剂量有关,其可能机制是通过增加细胞内抗肿瘤药物的浓度并减少药物外排来发挥其逆转肿瘤细胞耐药性的作用。戴国华等[9]研究显示,钩藤碱能通过调节Bax/Bcl-2比值途径诱导血管平滑肌细胞凋亡,并且也可以抑制原癌基因c-Fos、c-Myc的表达。
本实验采用CCK-8法研究了钩藤中主要成分乌索酸和钩藤碱对HepG2肝癌细胞的增殖抑制作用,结果显示,乌索酸和钩藤碱对HepG2肝癌细胞的增殖均有抑制作用,其作用效果不同。本实验还采用AO荧光染色法检测细胞凋亡,结果表明,乌索酸和钩藤碱均能诱导HepG2肝癌细胞凋亡,但钩藤碱诱导的大部分细胞出现凋亡早期形态学改变,而乌索酸诱导的大部分细胞出现凋亡晚期形态学改变。2种成分作用效果的差异可能源于其对HepG2肝癌细胞作用机制的不同。
结合本实验已显示的乌索酸和钩藤碱均能诱导肝癌细胞HepG2细胞发生凋亡,推测两者在诱导肝癌细胞凋亡方面,可能均通过Bax/Bcl-2途径发挥作用,但本实验所知其作用效果存在差异,所以两者对肝癌细胞的作用可能存在不同的分子机制。
综上所述,本研究表明钩藤中乌索酸和钩藤碱对体外人肝癌细胞株HepG2增殖均有一定的抑制作用,其可能的机制是通过诱导肝癌细胞凋亡,两者作用的效果存在差异,可能源于不同的作用机制。至于乌索酸和钩藤碱诱导肝癌细胞凋亡的深入分子机制,以及钩藤对活体肝癌的作用效果,有待后续研究,以便进一步诠释钩藤对肝癌的抑制作用及机制,为临床用药提供依据。
[1]杨春,周晓明.广州市黄埔区2013年恶性肿瘤发病与死亡情况分析[J].中国预防医学杂志,2016,17(6):464-468.
[2]张洋洋,曹海英,王志敏,等.淮安地区2009-2011年肝癌发病率与死亡率分析[J].中华肿瘤防治杂志,2014,21(7):490-497.
[3]田丽娜,高华武,龙子江,等.钩藤碱对自发性高血压大鼠的降压作用及其对血管的调节机制探讨[J].中草药,2014,45(15):2210-2213.
[4]刘毅敏,张定林,肖湘,等.熊果酸抗肿瘤作用及其机制研究进展[J].重庆医学,2012,41(4):398-400.
[5]王宏婷,王存琴.27-O-(E)-香豆酰基-乌索酸通过调控JNK/SAPK通路诱导人乳腺癌细胞MDA-MB-231细胞凋亡[J].中国中药杂志,2015,40(4):722-726.
[6]KIM E,MOON A.Ursolic acid inhibits the invasive phenotype of SNU-484 human gastric cancer cells[J].Oncol Lett,2015,9(2):897-902.
[7] GUO L, MIAO L, BAO W, et al. Ursolic acid inhibits epithelial-mesenchymal transition by suppressing the expression of astrocyte-elevated gene-1 in human nonsmall cell lung cancer A549 cells[J].Anticancer Drugs,2013,24(5):494-503.
[8]DAR B A,LONE A M,SHAH W A,et al.Synthesis and screening of ursolic acid-benzylidine derivatives as potential anti-cancer agents[J].Eur J Med Chem,2016,111(2):26-32.
[9]戴国华,孙敬昌,齐冬梅.钩藤生物碱对自发性高血压大鼠胸主动脉成纤维细胞凋亡/增殖及FN、LN的影响[J].中国中西医结合杂志,2012, 32(9):1233-1237.
[10]赵明宏,郭涛,王敏伟,等.钩藤酸E对人肝癌HepG2细胞的抑制作用及其机制研究[J].现代肿瘤医学,2010,18(11):2091-2094.
[11]WANG X,LI L,WANG B,et al.Effects of ursolic acid on the proliferation and apoptosis of human ovarian cancer cells[J].J Huazhong Univ Sci Technolog Med Sci,2009,29(6):761-764.
[12]虞燕霞,顾振纶,殷江临,等.熊果酸诱导人肝癌SMMC-7721细胞株凋亡机制的研究[J].中成药,2010,32(12):2041-2044.
[13]KWON S H,PARK H Y,KIM J Y,et al.Apoptotic action of ursolic acid isolated from Corni fructus in RC-58T/h/SA#4 primary human prostate cancer cells[J].Bioorg Med Chem Lett,2010,20(22):6435-6438.
[14]SKODA C,EROVIC B M,WACHEK V,et al.Down-regulation of Mcl-1 with antisense technology alters the effect of various cytotoxic agents used in treatment of aquamous cell carcinoma of the head and neck[J].Oncol Rep,2008,19(6):1499-1503.
[15]WACHECK V,CEJKA D,SIEGHART W,et al.Mcl-1 is a relevant molecular target for antisense oligonucleotide stratefies in gastric cancer cells[J].Cancer Biol Ther,2006,5(10):1348-1354.
[16]詹刚,许可.熊果酸对体外胃癌细胞Mcl-1基因表达的影响[J].西南国防医药,2009,19(3):278-280.
[17]张慧珠,杨林,刘叔梅,等.中药活性成分体外逆转肿瘤细胞多药耐药的研究[J].中药材,2001,24(9):655-657.
[18]周于禄,唐铭翔,刘世坤,等.异钩藤碱对人肺腺癌细胞A549/DDP多药耐药的逆转作用[J].中国新药杂志,2009,18(14):1338-1342.
Effects of Ursolic Acid and Rhynchophylline in Uncariae Ramulus Cum Uncis on Human Hepatoma HepG2 Cells
WU Ji-chao1,ZHU-Jie1,NIE Dong-lei1,PAN Si-ying1,HUANG Qun2
(1.Graduate School of Youjiang Medical University for Nationalities,Baise 533000,China;2.Affiliated Hospital of Youjiang Medical University for Nationalities,Baise 533000,China)
Objective To investigate the effects of ursolic acid and rhynchophylline in Uncariae Ramulus Cum Uncis on human hepatoma HepG2 cells;To discuss its antihepatoma mechanism.Methods Culture the human hepatoma HepG2 cells with 50,25,12.5,6.25 μmol/L ursolic acid,rhynchophylline for 24,48,72 hours respectively. 1%DMSO was set as negative control group.CCK-8 based cytotoxicity assay was used to detect the growth of HepG2.Acridine orange fluorescent staining was used to observe human hepatoma HepG2 cells cultured with 50 μmol/L ursolic acid,rhynchophylline and 1%DMSO for 48 hours were observed.Results Ursolic acid significantly acted as a disincentive to the growth of HepG2 cells,which was in positive correlation with time and concentration.Inhibited effect by rhynchophylline on HepG2 cell proliferation was weaker than ursolic acid.Pathological observation showed that most of the cells in rhynchophylline group showed cell shrinkage,dense pulp coating and nuclear staining edge set,and most of the cells in the ursolic acid group showed apoptosis late changes,such as nuclear cleavage and apoptotic bodies.Conclusion Ursolic acid and rhynchophyllinein Uncariae Ramulus Cum Uncis can inhibit the proliferation of HepG2 cells and can induce apoptosis.
ursolic acid;rhynchophylline;HepG2 cells
10.3969/j.issn.1005-5304.2017.05.015
R285.5
:A
:1005-5304(2017)05-0063-04
2016-06-09)
(
2016-07-16;编辑:华强)
广西高等学校重点实验室科学研究开放课题(2014年)
黄群,E-mail:huangqundao@163.com
