纳米钯/石墨烯-辣根过氧化物酶修饰电极的制备与性能
2017-04-27李盼闫丽君张曦盘婷何艳阳文作瑞刘炜孙伟
李盼,闫丽君,张曦,盘婷,何艳阳,文作瑞,刘炜,孙伟
(海南师范大学 化学与化工学院,海南 海口 571158)
纳米钯/石墨烯-辣根过氧化物酶修饰电极的制备与性能
李盼,闫丽君,张曦,盘婷,何艳阳,文作瑞,刘炜,孙伟*
(海南师范大学 化学与化工学院,海南 海口 571158)
以离子液体修饰碳糊电极(CILE)作为基底电极,将纳米钯-石墨烯(Pd-GR)复合材料和辣根过氧化物酶(HRP)分层涂布在电极上后用Nafion膜固定,制备了修饰电极(Nafion/HRP/ Pd-GR/CILE).光谱法证明HRP在膜中结构没有发生变化.循环伏安扫描出现一对峰形良好的电化学氧化还原峰,表明HRP与电极之间的直接电子转移得以实现,Pd-GR复合材料的高导电性有利于加快电子传递速率.该HRP修饰电极对三氯乙酸的电催化还原有较好的效果.
纳米钯-石墨烯复合材料;辣根过氧化物酶;直接电化学;电催化还原
氧化还原蛋白质和酶的电化学行为研究常用于作为其生物功能的模型,但是由于其电活性中心常被包埋在多肽结构之中而难以传递电子,因此修饰电极常被用作工作电极来提高电极表面蛋白质的电子转移速率[1-2].辣根过氧化物酶(HRP)是一种常用的生物酶,由于其极易被提取和纯化,已被广泛应用于酶的物理化学性质研究,并用于推导此类酶在生命体系中的电化学与氧化还原性质[3-4].
离子液体被广泛应用于电化学与化学修饰电极[5],常用的离子液体有吡啶类和咪唑类等,具有化学稳定性高、导电性好、电化学窗口宽等优点[6].钮智刚等合成一种新型的胺基化咪唑类离子液体[7].李静等将电沉积铋膜和离子液体修饰电极应用于痕量铅离子的测定[8].
石墨烯是一种具有单原子层结构的新型碳材料,具有表面积大、导电性好、易于功能化和修饰等特点,已经成为电分析化学研究的热点[9].金属钯是一种性能优良的催化剂,Malekia等将钯纳米粒子修饰在碳离子液体电极(CILE)上形成Pd/CILE[10],并用于电催化氧化肼,表现出良好的电催化活性.石墨烯具有大的比表面积,有利于负载尺寸小、分散度高的钯纳米颗粒,所形成的复合材料具有较好的电催化活性[11].胡忠良等人用插层还原法制备了纳米钯/石墨烯复合材料[12].郭盼等人研究了石墨烯/钯复合材料对乙醇的电催化氧化[13].
本文制备了钯-石墨烯(Pd-GR)复合材料修饰电极,对HRP的直接电化学行为进行了研究,通过扫描电镜表征了复合材料形貌,紫外可见光谱和傅里叶变换红外光谱研究了蛋白质二级结构,实验结果表明Pd-GR复合材料具有良好的生物相容性,其在电极表面的存在有效地促进HRP的电子转移反应.
1 材料与方法
1.1 试剂与仪器
1.1.1 试剂
石墨粉(上海胶体化工厂,颗粒度≤30 μm);1-己基吡啶六氟磷酸盐(HPPF6,兰州雨陆精细化工有限公司);辣根过氧化物酶(HRP,上海雪满生物科技有限公司);Pd-GR纳米复合材料(南京先丰纳米材料公司);三氯乙酸(TCA,国药集团化学试剂公司);0.1 mol/L PBS缓冲液;其它试剂为分析纯.实验所需仪器及厂家如表1所示.
1.1.2 仪器
电化学分析仪(CHI 660D型,上海辰华仪器公司),三电极体系:工作电极为Nafion/HRP/Pd-GR/CILE,参比电极为饱和甘汞电极(SCE),辅助电极为铂电极;扫描电子显微镜(SEM,JSM-7100F型,日本电子公司);傅立叶变换红外光谱仪(Nicolet6700,美国赛默飞世尔科技公司);双光束紫外可见分光光度计(TU-1901型,北京普析通用仪器责任有限公司).
1.2 电极的制备
将1.6 g石墨粉和0.8 g HPPF6在研钵中充分研磨后填入洁净的电极管(Φ=4 cm)中,并以铜丝为导线,即可得到CILE[8].将8 μL 0.5 mg/mL Pd-GR复合材料悬浊液均匀涂到CILE表面,室温干燥后将8 μL 15.0 mg/ mL HRP溶液均匀涂到Pd-GR/CILE的表面,室温干燥.最后将5.0 μL 0.5%Nafion溶液滴到电极表面干燥得到Nafion/HRP/Pd-GR/CILE.
2 结果与讨论
2.1 SEM图分析
用SEM表征CILE和Pd-GR/CILE的表面情况.从图1可以看出,CILE(a)表面较为光滑,表明离子液体与石墨粉充分粘合在一起.而Pd-GR/CILE(图片b)上出现了典型的GR的片层多孔的疏松结构,并有一定程度的团聚,纳米Pd均匀分布在GR表面,有效增加其比表面积,为HRP的进一步固定化提供良好界面.
2.2 紫外可见吸收光谱图分析
紫外可见吸收光谱中Soret吸收带的位置可作为研究蛋白质二级结构的常用手段[14].图2是HRP(曲线a)和Pd-GR-HRP混合液(曲线b)的紫外可见吸收光谱图,其Soret吸收带均在403 nm出现,表明HRP与Pd-GR复合材料混合后仍然保持原有的构象,没有发生结构变化.
2.3 红外光谱图分析
红外光谱也可用于蛋白质的结构鉴定,蛋白质结构的酰胺I(1700~1600 cm-1)和酰胺Ⅱ(1620~1500 cm-1)吸收带的变化可以说明其二级结构发生了改变[15].如图3所示,HRP的酰胺I和II吸收带为1652 cm-1和1542 cm-(1图a),而HRP-Pd-GR混合物吸收带在1642 cm-1和1548 cm-(1图b).从红外光谱图的相似性可以认为HRP在Pd-GR复合材料中基本保持其原有构象.

图1 (a)CILE和(b)Pd-GR/CILE的SEM图Fig.1SEM images of(a)CILE and(b)Pd-GR/CILE
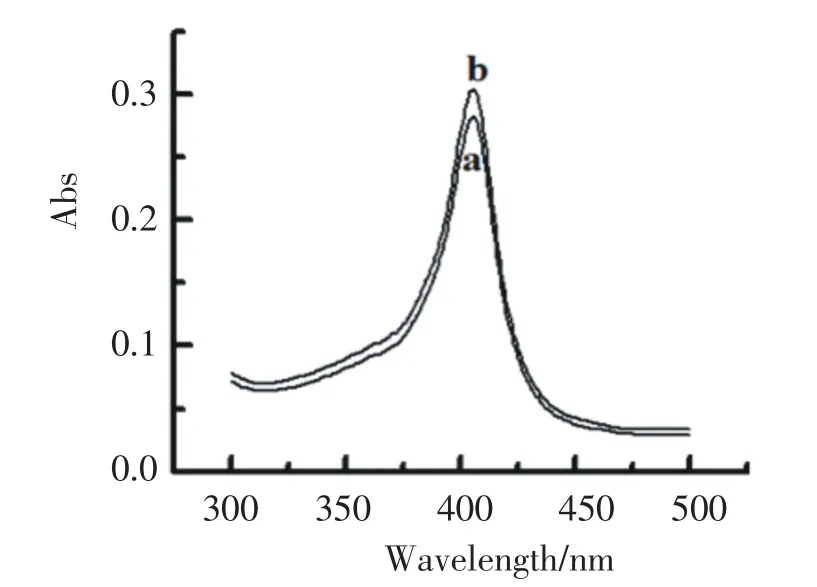
图2 (a)HRP水溶液和(b)HRP-Pd-GR混合液的紫外可见吸收光谱图Fig.2UV-Vis spectra of(a)HRP and (b)HRP-Pd-GR solution

图3 (a)HRP和(b)HRP-Pd-GR的红外光谱图Fig.3FT-IR spectra of(a)HRP and(b)HRP-Pd-GR
2.4 电化学交流阻抗谱图分析
EIS实验结果常被用作判断不同修饰电极表面的电子传递动力学依据.图4展示了不同修饰电极的交流阻抗图,在CILE上的Ret值为66.9 Ω(曲线c),Nafion/CILE的Ret值增大为83.1 Ω(曲线d),表明Nafion的存在会阻碍铁氰化钾电对的电子转移.而Nafion/Pd-GR/CILE的Ret值降为最小值33.3 Ω(曲线a),说明Pd-GR复合材料具有良好的导电性从而降低界面电阻.而Nafion/HRP/Pd-GR/CILE(曲线b)和Nafion/HRP/CILE(曲线e)的Ret值为48.2 Ω和92.8 Ω,说明HRP已被成功固定在电极表面,它的存在增大了界面电阻.
2.5 HRP的直接电化学研究
图5为不同修饰电极在pH 3.0 PBS中的循环伏安扫描图.在电位扫描范围内CILE(曲线a),Nafion/CILE(曲线b)和Nafion/Pd-GR/CILE(曲线c)上没有电化学响应,表明电极表面没有电活性物质.在Nafion/HRP/ CILE(曲线d)上出现一对氧化还原峰,为HRP结构中血红素辅基Fe(III)/Fe(II)的特征峰.而在Nafion/HRP/ Pd-GR/CILE(曲线e)上氧化还原峰电流显著增加,这是由于Pd-GR复合材料具有良好的生物相容性,高导电性和较大的比表面积,可以固定更多的HRP并加速电子转移速率,因此使电化学信号增大.从曲线e上可以读出峰电位值分别为Epc=-0.190 V和Epa=-0.129 V,峰电位差(△Ep)为61 mV.
2.6 扫速的影响
图6展示了扫速对Nafion/HRP/Pd-GR/CILE氧化还原峰的影响.在pH 3.0的PBS中,扫速在100~700 mV/s时,峰电流与扫速成正比,线性方程为Ipc(μA)=167.58 υ(V/s)+0.87 υ(γ=0.995)和Ipa(μA)=-138.20 υ(V/s)-3.53(γ=0.995),表明电极反应为薄层电化学行为.由方程Q=nAFΓ*求出电活性物质的表面浓度(Γ*)为8.93×10-10mol/cm2.峰电位差也随扫速的增加逐渐增大,但式电位相对稳定.氧化还原峰电位Ep与ln υ之间的线性回归方程为Epc(V)=-0.059 ln υ(V/s)-0.241(γ=0.992)和Epa(V)=0.042 ln υ(V/s)-0.106(γ=0.996).根据Laviron理论[16],进而求得电子传递系数(α)为0.41和电极反应速率常数(ks)为0.25 s-1.表明电极表面Pd-GR复合材料的存在为HRP的电子转移提供了一个良好的媒介,可以加快电子转移速率.

图4 不同修饰电极(a)Nafion/Pd-GR/CILE,(b)Nafion/ HRP/Pd-GR/CILE,(c)CILE,(d)Nafion/CILE and(e) Nafion/HRP/CILE的交流阻抗谱图Fig.4 EIS of different electrodes.(a)Nafion/Pd-GR/ CILE,(b)Nafion/HRP/Pd-GR/CILE,(c)CILE,(d)Na⁃fion/CILE and(e)Nafion/HRP/CILE
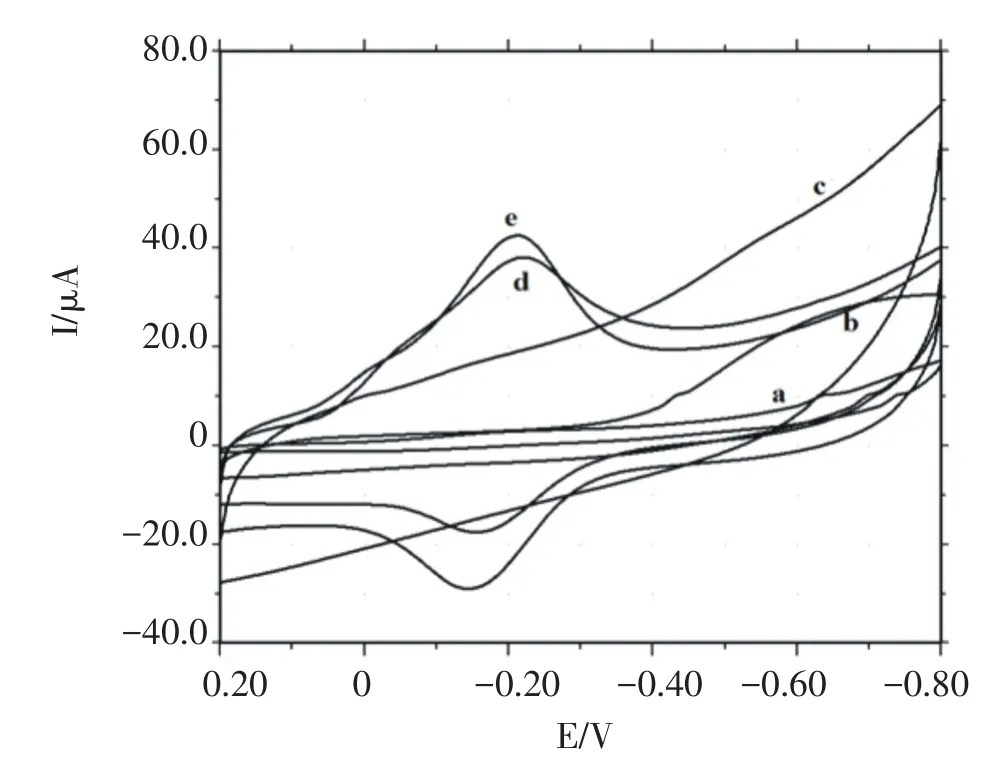
图5 不同修饰电极(a)CILE,(b)Nafion/CILE,(c)Nafion/ Pd-GR/CILE,(d)Nafion/HRP/CILE and(e)Nafion/HRP/ Pd-GR/CILE的循环伏安图(扫速为100 mV/s)Fig.5 Cyclic voltammograms of(a)CILE,(b)Nafion/ CILE,(c)Nafion/Pd-GR/CILE,(d)Nafion/HRP/CILE and (e)Nafion/HRP/Pd-GR/CILE(scan rate:100 mV/s)
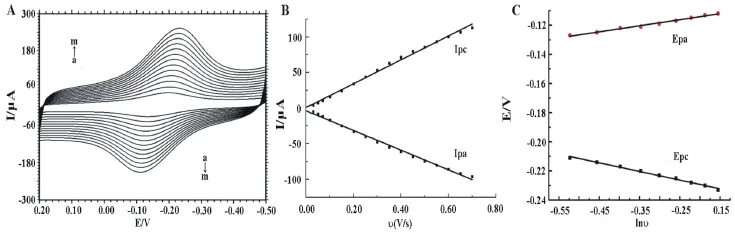
图6 (A)不同扫速下的循环伏安图,a到m分别为100,150,200,250,300,350,400,450,500,550, 600,650,700 mV s-1;(B)氧化还原峰电流与扫速的关系曲线;(C)氧化还原峰电位与lnv的关系曲线Fig.6 (A)Influence of scan rate on electrochemical responses of CTS/HRP/Pd-GR/CILE in pH 3.0 PBS,scan rate(a→m):100,150,200,250,300,350,400,450,500,550,600,650,700 mV s-1;(B) Linear relationship of Ip vs.υ;(C)Linear relationship of Ep vs.lnυ
2.7 缓冲溶液pH值的影响
图7为Nafion/HRP/Pd-GR/CILE在不同pH PBS中的电化学行为.当pH在2.0~9.0范围内时氧化还原峰电位随着溶液pH值增大均发生负移,且式电位(E0′)与pH值呈良好线性关系,线性回归方程为E0′(V)=-0.043 pH-0.050(γ=0.946),表明电极反应有质子参加.
2.8 电催化行为研究
HRP修饰电极可以对稳定性极强的有机卤化物进行电催化还原.本文研究了Nafion/HRP/Pd-GR/CILE对TCA的电催化还原作用,循环伏安扫描结果如图8所示.随着TCA浓度的增加,在-0.21 V出现一个新的电催化还原峰.还原峰电流与TCA的浓度在2.0~45.0 mmol/L范围内呈线性关系,方程为Iss(μA)=3.16 C(mmol/L)+11.57(γ=0.992),检测限为0.69 mmol/L(3σ).当TCA浓度大于45.0 mmol/L后还原峰电流保持不变,为Michaelis-Menten反应过程.由Lineweaver-Burk方程[17],根据(1/Iss~1/[TCA])可求出电催化反应的表观米式常数KMapp为3.37 mmol/L.结果表明,具有良好的生物相容性和高导电性的Pd-GR复合材料可以作为电催化反应的良好媒介.

图7 Nafion/HRP/Pd-GR/CILE在不同pH缓冲液的循环伏安图(a到h 2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0),扫速为100 mV/sFig.7 Cyclic voltammograms of Nafion/HR/Pd-GR/ CILE in different pH(form a to h:2.0,3.0,4.0,5.0,6.0, 7.0,8.0,9.0)with scan rate as 100 mV/s

图8 修饰电极在不同浓度TCA下的循环伏安图(a到j为2、4、6、10、20、25、30、35、40、45.0 mmol/L)(插图:还原峰电流与浓度的线性关系)Fig.8 Cyclic voltammograms of HRP modified electrode with 2,4,6,10,20,25,30,35,40,45 mmol/L TCA(curves a to j)in pH 3.0 PBS,scan rate:100 mV/s(inset was the linear curve of peak currents with TCA concentration)
2.9 稳定性和重现性
Nafion/HRP/Pd-GR/CILE在pH 3.0 PBS中连续扫描50圈,循环伏安结果表明其氧化还原峰电流没有明显的变化.将修饰电极放置在4℃冰箱内保存4周后,进行电化学检测,电流值为初始值的92.3%,说明该电极有很好的稳定性.同一根电极对5.0 mmol/L的TCA溶液进行7次平行测定,相对标准偏差(RSD)为2.7%.将平行制备的6根修饰电极进行循环伏安扫描得到的RSD为3.9%,表明制备的Nafion/HRP/Pd-GR/CILE具有良好的重现性.
3 结论
将Pd-GR纳米复合材料和HRP分层滴涂在CILE上后用Nafion固定,制备了一种新型修饰电极Nafion/ HRP/Pd-GR/CILE.Pd-GR复合材料具有优良的导电性和生物相容性,促进HRP在修饰电极表面的直接电子转移.在pH 3.0 PBS中出现了一对峰形良好的氧化还原峰,对该氧化还原峰进行了详细的研究.Pd-GR纳米复合材料有较大的比表面积,可以用于固定HRP,其良好的导电性为HRP的电子转移提供快速通道,加快电子转移速率.该HRP修饰电极对TCA电催化还原表现出良好的效果.
[1] Zhao X J,Mai Z B,Kang X H,et al.Direct electrochemistry and electrocatalysis of horseradish peroxidase based on clay-chito⁃
[2]san-gold nanoparticle nanocomposite[J].Biosensors and Bioelectronics,2008,23(7):1032-1038. Zhang Q,Yang S J,Zhang J,et al.Fabrication of an electrochemical platform based on the self-assembly of graphene oxide-mul⁃tiwall carbon nanotube nanocomposite and horseradish peroxidase:direct electrochemistry and electrocatalysis[J].Nanotechnolo⁃
[3]gy,2011,22(49):494010-494016. Welinder K G.Amino acid sequence studies of horseradish peroxidase[J].European Journal of Biochemistry,1979,96(3):483-
[4]502. FeraPontova E E.Direct peroxidase bioelectrocatalysis on a variety of electrode materials[J].Electroanalysis,2004,16(13-14):
[5]1101-1112. Sun W,Li X Q,Qin P,et al.Electrodeposition of Conanoparticles on the carbon ionicliquid electrode as a platform for myoglo⁃
[6]bin electrochemical biosensor[J].Journal of Physical Chemistry C,2009,113(26):30-33.
[7]孙伟,高瑞芳,焦奎.离子液体在分析化学中的应用研究进展[J].分析化学,2007,35(12):1813-1819.钮智刚,虎良江,娄梦梦,等.离子液体1-胺乙基-3-甲基咪唑四氟硼酸盐的合成新方法研究[J].海南师范大学学报(自然
[8]科学版),2013,26(2):189-191.李静,王文成,范钦莉,等.铋膜修饰离子液体碳糊电极测定痕量铅离子的研究[J].海南师范大学学报(自然科学版),2015,
[9]28(4):400-404.
[10]孟越,王林萍,黄毅,等.石墨烯电化学研究进展[J].化学传感器,2014,34(2):16-26. Maleki N,Safavi A,Farjami E,et al.Palladium nanoparticle decorated carbon ionic liquid electrode for highly efficient electrocat⁃
[11]alytic oxidation and determination of hydrazine[J].Analytica Chimica Acta,2008,611(2):151-155. Li Y,Fan X B,Qi J J,et al.Palladium nanoparticle-graphene hybrids as active catalysts for the Suzuki reaction[J].Nano Re⁃
[12]search,2010,3(6):429-437.
[13]胡忠良,陈艺峰,陈晗,等.插层还原法制备纳米钯/石墨烯复合材料[J].稀有金属材料与工程,2014,43(6):1426-1466.
[14]郭盼,谷宁,王旭红.石墨烯钯复合材料对乙醇的电催化氧化[J].分析科学学报,2014,30(4):467-471. Theorell H,Ehrenberg A.Spectrophotometric,magnetic,and titrimetric studies on the heme-linked groups in myoglobin[J].
[15]Acta Chemica Scandinavica,1951,5(6):823-848. Kauppinen J K,Moffatt D J,Mantsch H H,et al.Fourier self-decorrvolution:A method forresolving intrinsically overlapped
[16]bands[J].Applied Spectroscopy,1981,35(3):271-276. Laviron E.General expression of the linear potential sweep voltammogram in the case of diffusionless electrochemical systems[J].
[17]Journal of Electroanalytical Chemistry,1979,101(1):19-28. Kamin R A,Wilson G S.Rotating ring-disk enzyme electrode for biocatalysis kinetic studies and characterization of the immo⁃bilized enzyme layer[J].Analytical Chemistry,1980,52(8):1198-1205.
责任编辑:刘 红
Preparation of Palladium/Graphene Nanocomposite and Horseradish Peroxidase Modified Electrode and Its Performances
LI Pan,YAN Lijun,ZHANG Xi,PAN Ting,HE Yanyang,WEN Zuorui,LIU Wei,SUN Wei*
(School of Chemistry and Chemical Engineering,Hainan Normal University,Haikou571158,China)
By using carbon ionic liquid electrode(CILE)as the basic electrode,platinum/graphene(Pd-GR)nanocom⁃posite and horseradish peroxidase(HRP)was modified on the electrode surface step by step by coating method,and fur⁃ther fixed by Nafion to prepare Nafion/HRP/Pd-GR/CILE.Spectroscopic studies showed that HRP maintained the native structure in composite film without denaturation.Electrochemical behavior of HRP was investigated in PBS(pH 3.0)with a pair of good-shape quasi-reversible peaks appeared,showing that electrochemistry of HRP was realized.The presence of high conductive Pd-GR nanocomposite could accelerate the electron transfer rate of HRP with CILE.Electrocatalytic re⁃sults demonstrated this HRP electrode had excellent catalytic property to trichloroacetic acid reduction.
palladium-graphene nanocomposite;horseradish peroxidase;direct electrochemistry;electrocatalytic reduc⁃tion
O 646;Q 554.6
A
1674-4942(2017)01-0034-06
2016-11-17
海南省自然科学基金(20162031);海南省级大学生创新创业训练计划项目(201511658024)
*通讯作者:孙伟,教授,E-mail:swyy26@hotmail.com
10.12051/j.issn.1674-4942.2017.01.007
