偏头痛发作间期疼痛刺激的脑磁图研究
2017-04-27李峰蒋澄陈月秋吴婷姚群马文颖石静萍
李峰,蒋澄,陈月秋,吴婷,姚群,马文颖,石静萍
·论著·
偏头痛发作间期疼痛刺激的脑磁图研究
李峰,蒋澄,陈月秋,吴婷,姚群,马文颖,石静萍
目的 探讨偏头痛患者在发作间期大脑对疼痛电刺激的反应特点。方法 收集30例发作间期的无先兆偏头痛患者(偏头痛组)和30名年龄、性别相匹配的健康对照者(对照组),利用脑磁图描记术记录正中神经疼痛电刺激下诱导的脑电磁信号。比较偏头痛组与对照组之间在痛觉处理上的差异。结果 与对照组相比,偏头痛组疼痛电刺激疼痛阈值显著降低(P<0.05),疼痛电刺激产生的体感诱发磁场M20潜伏期明显延长(P<0.01)。偏头痛组疼痛诱发Gamma振荡平均能量较对照组显著增强(P<0.01),且Gamma震荡能量值与视觉模拟评分法(VAS)、偏头痛残疾程度评估量表(MIDAS)评分均呈正相关(VAS左手:r=0.45,P<0.05; VAS右手:r=0.46,P<0.05; MIDAS左手:r=0.47,P<0.01; MIDAS右手:r=0.59,P<0.01)。结论 偏头痛患者发作间期存在疼痛感觉异常,且痛觉刺激相关的皮质兴奋性增高。
偏头痛;头痛发作间期;脑磁图;疼痛
偏头痛是临床常见的原发性头痛之一,其病因和发病机制目前仍尚不明确。近些年来,脑功能成像技术在偏头痛研究中的发展和应用,揭示偏头痛患者在发作期以及发作间期存在多个脑区结构和功能的异常,进一步提示偏头痛是一种慢性CNS疾病[1]。偏头痛患者存在着十分常见的皮肤痛觉过敏(CA)现象[2],指非伤害性刺激作用于正常皮肤引起的疼痛[3]。CA已被证实是偏头痛慢性转化的一个危险因素[4]。偏头痛CA的发生机制尚不明确,可能与中枢敏化相关[5]。本研究采用脑磁图成像记录疼痛电刺激下诱导出的相关脑磁信号,评价偏头痛患者在痛觉处理上的功能改变,为进一步探索偏头痛的发病机制和治疗策略提供有效线索。
1 对象与方法
1.1 对象 (1)偏头痛组:收集2013年9月~2015年9月就诊于南京脑科医院神经内科头痛门诊的偏头痛患者30例,均符合2006年ICHD-Ⅱ版修订版的诊断标准。其中,男11例,女19例;年龄14~44岁,平均(28.97±8.23)岁;病程2.5~27年,平均(10.82±7.27)年。患者受试前至少72 h内无先兆及头痛发作;无药物滥用史,受试前72 h内无任何用药史;无继发性头痛等其他类型头痛,以及其他内科及神经科疾病;常规MRI检查未见异常。(2)对照组:招募与偏头痛组性别、年龄均相匹配的右利手健康对照者30人,均否认有偏头痛病史和家族史。男11人,女19人;年龄16~42岁,平均(29.33±6.60)岁。本实验经南京医科大学附属脑科医院伦理委员会同意(2011-KY043),每位受试者在交待实验情况和注意事项后签署知情同意书。
1.2 方法
1.2.1 临床资料采集 每位受试者记录其基本信息:姓名、性别、出生年月、受教育程度、联系电话、住址、采集时间、采集者。偏头痛患者记录其初次发病年龄、部位、头痛性质、有无先兆、头痛伴随症状、头痛持续时间、最近1年内头痛发作频率(次/月)。量表与评分标准:采用偏头痛残疾程度评估量表(MIDAS)评估头痛影响;视觉模拟评分法(VAS)评价偏头痛患者头痛程度(0~10分)[6]。
1.2.2 脑磁图检查 采用加拿大CTF/VSM275信道全头型脑磁图仪进行脑磁图信号采集。受试者平躺于磁屏蔽室检查床上,保持安静睁眼,眼睛注视一点,尽量避免肢体活动和眼球的转动。采用Constant current stimulator model DS7A电刺激仪,通过交流电轮流刺激受试者左右手腕部经正中神经,刺激频率0.5 Hz,刺激持续时间0.2 ms,以受试者的拇指有轻微的运动为准。从0.15 mA开始逐渐增加刺激强度,至患者刚开始感轻度疼痛(能忍受)止,并开始描记,刺激100次为1组。采样频率为6000 Hz。检查过程中头移动数据超过5 mm将舍弃[7]。
1.2.3 数据处理 利用美国Cincinnati儿童医院脑磁图中心提供的MEG Processor软件处理和分析数据,信号去除眼动和其他肌肉活动[8]。波形分析:数据经叠加、均化,设置时间窗为刺激前240 ms到刺激后360 ms, 滤波范围30~100 Hz,将光标放置在所测量的诱发磁场波形成分时,软件自动测量平均潜伏期和振幅。频谱分析:对脑磁图数据进行连续小波转换,波形变换时间窗为刺激后100~300 ms,频率范围30~100 Hz。特定时间窗和频带范围内的平均频谱能量值用均方根计量[9]。
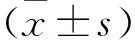
2 结 果
2.1 偏头痛组和对照组临床资料的比较 见表1。两组年龄,性别差异无统计学意义(均P>0.05)。偏头痛组电刺激疼痛阈值较对照组明显降低(左手t=-2.68,P=0.01;右手t=-2.52,P=0.015)。

表1 偏头痛组和对照组临床资料的比较(x±s,n=30)参数偏头痛组对照组女/男(例)19/1119/11年龄(岁)28.97±8.2329.33±6.60病程(年)10.82±7.27-发作频率(次/月)4.70±3.56-症状持续时间(h)18.43±17.30-VAS(分)7.33±1.21-MIDAS(分)45.43±33.65-经皮刺激痛阈(mA) 左手0.25±0.06*0.29±0.04 右手0.26±0.06*0.30±0.04 注:与对照组比较*P<0.05
2.2 两组间体感诱发磁场早期成分M20、M35的潜伏期、振幅以及疼痛诱发Gamma震荡能量的比较 见图1、表2。与对照组相比,偏头痛组体感诱发磁场早期成分中的M20潜伏期明显延长(左手t=3.51,P=0.001;右手t=4.19,P<0.001);两组间M20振幅和M35潜伏期、振幅差异均无统计学意义。偏头痛组Gamma震荡能量较对照组显著增强(左手t=3.21,P=0.002;右手t=3.10,P=0.003)。

图1 体感诱发磁场的波形分析。正中神经电刺激后可见明显的体感诱发磁场M20、M35成分,偏头痛组患者较对照组M20平均潜伏期显著延长

表2 两组间体感诱发磁场早期成分M20、M35的潜伏期、振幅及疼痛诱发Gamma震荡能量的比较(x±s,n=30)组别M20潜伏期(ms)振幅(μV)M35潜伏期(ms)振幅(μV)Gamma震荡能量(fT/Hz)偏头痛组 左手22.30±1.45*426.81±145.3633.97±3.06490.60±224.904.52±0.31* 右手22.90±1.38*421.90±164.7933.06±2.46462.53±214.654.43±0.30*对照组 左手20.99±1.45521.43±258.8632.90±1.98577.57±276.594.28±0.26 右手21.38±1.43511.10±223.6932.74±1.78535.04±261.774.19±0.29 注:与对照组比较*P<0.05
2.3 Gamma震荡频谱能量与偏头痛组临床特征的相关性 偏头痛组Gamma震荡能量值与VAS评分(左手r=0.45,P=0.013;右手r=0.46,P=0.012)及MIDAS评分(左手r=0.47,P=0.009;右手r=0.59,P=0.001)均呈正相关,与年龄、病程、发作频率、平均持续时间无关。
3 讨 论
痛觉过敏现象在偏头痛患者中十分常见, Ashkenazi等[10]利用异常性疼痛问卷(AQ)发现有高达77%的偏头痛患者在发作期以及发作间期都会出现CA。本研究也发现偏头痛组电刺激痛阈明显低于健康对照组,即发作间期偏头痛患者依然存在痛觉异常。CA相关的中枢敏化机制目前尚不明确,可能与兴奋性递质增多,伤害性上下感觉通路改变,大脑皮质兴奋性增加等有关[11]。
躯体感觉包括传导触觉的粗有髓Aβ纤维,传导痛温觉的细有髓Aδ纤维和无髓C纤维。本研究采用经皮肤正中神经电刺激诱发疼痛,因此为混合神经刺激方法,刺激诱发磁场中既包含体感诱发磁场又包含了痛觉诱发磁场。既往研究[12-13]发现,正中神经电刺激体感诱发电位主要有两个成分: (1)早期成分(如N20、P45),产生于对侧初级躯体感觉皮质(SⅠ),可能反映大脑对躯体感觉信息的加工处理;(2)晚期成分(如N120、P240),产生于双侧次级躯体感觉皮质(SⅡ)和前扣带回(ACC),可能反映了大脑对刺激新异性的加工。根据潜伏期来判断,本研究的体感诱发磁场中,M20和M35等同于体感诱发电位中的早期成分(图1),一般不易受意识状态等影响,因其稳定性而更适用于神经传导的研究。
既往研究[14-15]发现,疼痛诱发电位也包括两个主要成分:N1,平均潜伏期约100~150 ms,可能起源于初级躯体感觉皮质SⅠ以及对侧岛叶皮质的电生理活动;P1,平均潜伏期约200~250 ms,可能反映双侧SⅡ、脑岛叶和扣带回(CC)等的电生理活动。本研究将分析时间窗设置为刺激后100~300 ms, 因此包含了大部分疼痛诱发磁场活动信号。本研究波形分析中可见明显的体感诱发磁场波形而未见痛觉诱发磁场波形,可能原因是:一方面由于非伤害性传入纤维比伤害性传入纤维电刺激的阈值低,伤害性传入信号相对被屏蔽,且疼痛诱发电位振幅小,难提取;另一方面,叠加处理方法只能获得与疼痛刺激锁时和锁相的电生理响应信号,而疼痛刺激下产生的非锁相的信号将被遗漏。非锁相信号包括事件相关同步化和事件相关去同步化,可表现特定频带(如Gamma 频带,30~100 Hz)脑电信号活动能量的变化,反映大脑皮质神经元激活或抑制状态[16-17]。有研究[18-19]表明,伤害性刺激可引起大脑SⅠ区产生Gamma振荡能量变化,且该变化直接反映了大脑皮质对疼痛的感知。
本研究利用脑磁图较高的时间和空间分辨率,能更加精确地描记大脑电磁信号的变化。本研究结果显示,在体感诱发电位M20潜伏期明显延长,可进一步推测偏头痛患者在感觉通路传导上存在异常改变的可能。Bokowski等[20]通过视觉诱发电位(VEP)发现偏头痛患者相对紧张型头痛患者,出现P1潜伏期延长,N1/P1 和P1/N2 的波幅升高。Gamma震荡已被发现与伤害性刺激的感知有关,且震荡能量与主观疼痛强度呈显著正相关[18, 21]。Gamma震荡能量的增强,可反映出偏头痛患者大脑皮质兴奋性的增加。本研究中相关分析显示,Gamma 震荡能量与VAS及MIDAS评分呈显著正相关,提示Gamma震荡可能与偏头痛的严重程度有关,可反映头痛的负担程度。Rossiter等[22]利用MEG同样发现SⅠ区Gamma震荡能量大小随着疼痛刺激强度的增加而增加,并由此认为Gamma震荡与疼痛的编码有关。
综上所述,本研究结果显示,偏头痛患者发作间期疼痛阈值降低,经体表疼痛电刺激产生的脑诱发磁场中,M20潜伏期明显延长,提示偏头痛患者在感觉传导通路上存在异常。电刺激产生的疼痛诱发磁场中,Gamma震荡能量明显增强,且与VAS、MIDAS评分正相关,进一步提示偏头痛患者存在着与痛觉相关的皮质兴奋性增高。该发现为偏头痛的疼痛发作机制与偏头痛治疗提供了一定帮助。
[1]Schwedt TJ, Dodick DW. Advanced neuroimaging of migraine [J]. Lancet Neurol, 2009, 8: 560.
[2]徐花, 张炫, 陆新颖,等. 偏头痛患者痛觉超敏症状的临床分析 [J]. 临床神经病学杂志, 2013, 26: 267.
[3]Aguggia M. Allodynia and migraine [J]. Neurol Sci, 2012, 33(Suppl 1): S9.
[4]Bigal ME, Ashina S, Burstein R, et al. Prevalence and characteristics of allodynia in headache sufferers: a population study [J]. Neurology, 2008, 70: 1525.
[5]Burstein R, Yarnitsky D, Goor-Aryeh I, et al. An association between migraine and cutaneous allodynia [J]. Ann Neurol, 2000, 47: 614.
[6]Sauro KM, Rose MS, Becker WJ, et al. HIT-6 and MIDAS as measures of headache disability in a headache referral population [J]. Headache, 2010, 50: 383.
[7]Ge HT, Liu HX, Xiang J, et al. Abnormal cortical activation in females with acute migraine: a magnetoencephalography study [J]. Clin Neurophysiol, 2015, 126: 170.
[8]范捷, 祝东林, 杨露,等. 负性情绪刺激对发作间期偏头痛患者Gamma振荡的脑磁图研究 [J]. 临床神经病学杂志, 2015, 28: 251.
[9]Xiang J, deGrauw X, Korostenskaja M, et al. Altered cortical activation in adolescents with acute migraine: a magnetoencephalography study [J]. J Pain, 2013, 14: 1553.
[10]Ashkenazi A, Silberstein S, Jakubowski M, et al. Improved identification of allodynic migraine patients using a questionnaire [J]. Cephalalgia, 2007, 27: 325.
[11]郁飞宇, 陈春富. 中枢敏感化与偏头痛 [J]. 国际神经病学神经外科学杂志, 2013, 40: 349.
[12]Hu L, Zhang ZG, Hu Y. A time-varying source connectivity approach to reveal human somatosensory information processing [J]. Neuroimage, 2012, 62: 217.
[13]van de Wassenberg W, van der Hoeven J, Leenders K, et al. Multichannel recording of median nerve somatosensory evoked potentials [J]. Neurophysiol Clin, 2008, 38: 9.
[14]Ninomiya Y, Kitamura Y, Yamamoto S, et al. Analysis of pain-related somatosensory evoked magnetic fields using the MUSIC (multiple signal classification) algorithm for magnetoencephalography [J]. Neuroreport, 2001, 12: 1657.
[15]菜敏敏, 郭晓丽, 唐丹丹, 等. 激光诱发疼痛的神经电生理特征及其应用 [J]. 科学通报, 2015, 60: 1150.
[16]Mouraux A, Guerit JM, Plaghki L. Non-phase locked electroencephalogram (EEG) responses to CO2laser skin stimulations may reflect central interactions between a partial partial differential- and C-fibre afferent volleys [J]. Clin Neurophysiol, 2003, 114: 710.
[17]Ploner M, Gross J, Timmermann L, et al. Oscillatory activity reflects the excitability of the human somatosensory system [J]. Neuroimage, 2006, 32: 1231.
[18]Gross J, Schnitzler A, Timmermann L, et al. Gamma oscillations in human primary somatosensory cortex reflect pain perception [J]. PLoS Biol, 2007, 5: e133.
[19]Schulz E, Tiemann L, Schuster T, et al. Neurophysiological coding of traits and states in the perception of pain [J]. Cereb Cortex, 2011, 21: 2408.
[20]Bockowski L, Sobaniec W, Smigielska-Kuzia J, et al. The pattern--reversal visual evoked potentials in children with migraine with aura and without aura [J]. Rocz Akad Med Bialymst, 2003, 48: 154.
[21]Hauck M, Lorenz J, Engel AK. Attention to painful stimulation enhances gamma-band activity and synchronization in human sensorimotor cortex [J]. J Neurosci, 2007, 27: 9270.
[22]Rossiter HE, Worthen SF, Witton C, et al. Gamma oscillatory amplitude encodes stimulus intensity in primary somatosensory cortex [J]. Front Hum Neurosci, 2013, 7: 362.
Magnetoencephalography study of pain stimulation in interictal period of migraine
LIFeng,JIANGCheng,CHENYue-qiu,etal.
DepartmentofNeurology,BrainHospitalAffiliatedtoNanjingMedicalUniversity,Nanjing210029,China
Objective To investigate the response characteristics of brain to electrical pain stimulation during the interictal period in migraine patients.Methods Thirty migraine patients without aura in interictal period (migraine group) and 30 age and gender matched healthy controls (control group) were collected. The brain magnetoencephalography (MEG) signal evoked by median never pain stimulation was collected. The difference of electrical pain stimulation evoked signal between migraine group and control group were analyzed. Results Compared with control group, the pain threshold of electrical stimulation in migraine group was significantly reduced (P<0.05), the latency of somatosensory evoked magnetic fields (SEF) M20 evoked by electrical stimulation in migraine group was significantly longer (P<0.01). The average spectral power of pain evoked Gamma oscillations in migraine group was significantly enhanced than control group (P<0.01). And the Gamma oscillation power value was positively related with visual analogue scale (VAS) and Migraine disability level assessment scale (MIDAS) scores (VAS left hand:r=0.45,P<0.05; VAS right hand:r=0.46,P<0.05; MIDAS left hand:r=0.47,P<0.01; MIDAS right hand:r=0.59,P<0.01).Conclusion Migraine patients have a cutaneous allodynia in interictal period, and the excitability of pain stimulation related cortical is increased.
migraine;headache-free phase;magnetoencephalography;pain
江苏省自然科学基金(BK20151088)
210029南京医科大学附属脑科医院神经内科(李峰,石静萍),脑磁图中心(吴婷);南京医科大学(蒋澄,陈月秋,姚群,马文颖)
石静萍
R747.2
A
1004-1648(2017)02-0081-04
2016-05-02
2016-06-13)
