核转录因子红细胞系相关因子-2干扰质粒构建及鉴定
2017-04-27汤武装李杰
汤武装,李杰
核转录因子红细胞系相关因子-2干扰质粒构建及鉴定
汤武装,李杰
目的 设计及构建小鼠核转录因子红细胞系相关因子-2(Nrf2)基因的干扰质粒,并筛选出效果最好的干扰质粒。方法 设计3组针对Nrf2基因的核糖核酸干扰(RNAi)序列,应用基因重组技术克隆入载体中构建短发夹RNA(shRNA),分别为shRNA1、shRNA2及shRNA3,通过基因测序鉴定,经Lipofectamine 2000转染至BV2细胞, 实时PCR检测Nrf2 mRNA的表达,Western Blot法检测Nrf2蛋白的表达。结果 测序表明,克隆入载体中的Nrf2干扰序列及读码框完全正确,实时PCR及Western Blot显示shRNA3干扰效果最强。结论 成功构建小鼠Nrf2的有效干扰质粒,为Nrf2信号通路在脑卒中领域的功能研究奠定了基础。
核转录因子红细胞系相关因子-2;RNA干扰;BV2细胞
脑卒中目前已成为世界上导致死亡的主要病因,其具有高死亡率、高致残率及高复发率等特点,同时严重危害了人类的健康,并给社会带来了巨大的损失。目前,普遍认为缺血性卒中的损伤机制是由多种因素共同参与的。这是一个复杂的过程,其发病机制主要包括脑组织能量代谢紊乱、兴奋性氨基酸中毒、氧化应激损伤、炎症反应等多个环节,其中氧化应激是众多发病机制中的重要环节。越来越多的证据证明刺激内源性抗氧化系统的表达将会是治疗脑卒中的主要措施[1]。核转录因子红细胞系相关因子-2(Nrf2) 是细胞内重要的抗氧化应激调控因子,其能够调控细胞内一系列保护基因的表达[2-4]。因此,以Nrf2作为脑卒中的治疗靶点已成为当前一大热门话题。破坏基因的结构或者抑制基因的表达是研究靶基因功能的主要手段,常用的一种技术就是RNA干扰(RNAi)技术[5-7]。本研究拟采用基因克隆技术,通过设计针对小鼠Nrf2基因的干扰序列,构建相应短发夹RNA(shRNA)的干扰质粒,并将相应的干扰质粒转染小鼠BV2细胞,从而筛选出干扰效果最佳的shRNA,为进一步观察Nrf2信号通路对于脑卒中的作用奠定实验基础。
1 材料与方法
1.1 材料 Top10化学感受态细胞购自上海吉凯基因化学技术有限公司;BV2细胞购自中科院上海生命科学院细胞库;胎牛血清(FBS)购自美国Hyclone公司;DMEM高糖培养液购自美国GiBco公司;胰蛋白酶购自Invitrogen 公司;Lipofectamine 2000购自Invitrogen 公司;引物序列由上海吉凯基因化学技术有限公司合成;实时PCR(RT-PCR)试剂盒购自Takara公司;质粒小量提取试剂盒购自OMEGA公司;BCA蛋白浓度测定试剂盒购自碧云天生物技术研究所;兔源β-actin抗体购自美国Bioworld公司;兔源Nrf2抗体购自美国Bioworld公司;抗兔二抗购自美国Santa Cruz公司。
1.2 方法
1.2.1 质粒的构建 从基因库中查找出针对小鼠Nrf2的核苷酸序列(NM_010902),并按照相应的设计原则构建针对目的基因(Nrf2)的干扰片段(由上海吉凯基因化学技术有限公司设计合成)。分别设计3条靶序列,各条靶序列如下:靶序列1:CTT ACT CTC CCA GTG AAT A;靶序列2:TGA AGT CTT CAG CAT GTT A;靶序列3:TCG CAT TGA TCC GAG ATA T。此外还设计了1条阴性对照组,其靶序列为:TTC TCC GAA CGT GTC ACG T。最后将设计成功的各组质粒各自命名为shRNA1质粒、shRNA2质粒、shRNA3质粒及NC质粒,并据此分组。
1.2.2 干扰质粒的转化与测序分析 将三组shRNA质粒转化Top10化学感受态细胞,然后接种于筛选平板(含氨苄青霉素),次日随机挑选阳性单克隆菌落,将阳性菌落培养扩增,最后每0.8 ml菌液加入0.2 ml无菌甘油,混匀后放入-70℃冰箱冻存。取1管菌液送至生物公司进行测序分析。
1.2.3 细胞培养与转染 用含10%FBS的DMEM高糖培养液培养BV2细胞,细胞按一定密度铺12孔板,待BV2细胞生长至90%融合度时,按照Lipofec-tamine 2000脂质体转染试剂盒使用说明书,分别转染四组质粒:NC组(NC质粒)、shRNA1组(shNRA1质粒)、shRNA2组(shNRA2质粒)及shRNA3组(shNRA3质粒),转染后在37℃、5%CO2条件下培养4 h,然后移去无血清无抗生素培养液,加入完全DMEM无抗生素培养基继续培养至转染后48 h。
1.2.4 RT-PCR检测BV2细胞中Nrf2 mRNA的表达
按照Trizol说明书提取各组BV2细胞中的总RNA。Nrf2引物[8]:上游:5′-TCT CCT CGC TGG AAA AAG AA-3′,下游:5′-AAT GTG CTG GCT GTG CTT TA-3′;内参β-actin引物:上游:5′-TTC GTT GCC GGT CCA CAC CC-3′,下游:5′-GCT TTG CAC ATG CCG GAG CC-3′。用逆转录试剂盒按照说明书将RNA逆转录为cDNA。按照RT-PCR试剂盒说明书操作,反应体系为: SYBR Premix Ex TaqTM(2×) 10 μl;上游引物0.4 μl ;下游引物0.4 μl ;Rox Reference Dye Ⅱ(50×)0.4 μl;cDNA 2.0 μl,加水至总体积20 μl。反应体系于ABI7500 PCR仪上进行反应。反应采用PCR两步法反应程序:第一步:预变性:95℃ 30 s;第二步:95℃ 5 s,60℃ 34 s,40个PCR循环。
1.2.5 Western Blot检测BV2细胞中Nrf2蛋白的表达 将转染的各组BV2细胞加入适量的蛋白裂解液,4℃ 15000 r/min离心5 min,收集上清液,采用BCA蛋白浓度测定试剂盒检测蛋白含量。蛋白样品加入相应的SDS凝胶上样缓冲液置于沸水中加热5 min使蛋白变性。变性的蛋白样品经SDS-聚丙烯酰氨凝胶电泳后,转膜(100 V,120 min)至PVDF膜上,再经脱脂奶粉室温封闭3 h,依次加入稀释好的一抗4℃孵育过夜,TBST洗膜3遍后加入稀释好的二抗室温孵育2 h,TBST洗膜3遍,加入发光液,暗室曝光。
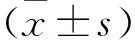
2 结 果
2.1 靶向Nrf2干扰质粒构建成功 将干扰片段与载体连接后形成的各组干扰质粒转化Top10化学感受态细胞,然后小提质粒,送上海吉凯基因化学技术有限公司基因测序,结果表明各组序列无误,具体结果见图1~图3。
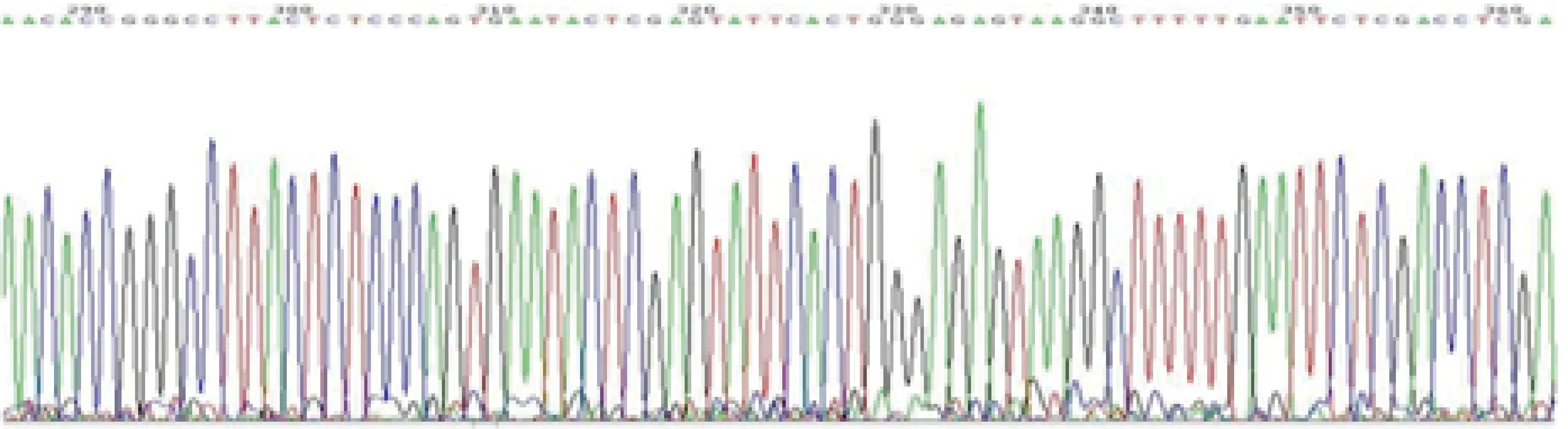
图1 shRNA1靶向Nrf2干扰质粒基因测序图

图2 shRNA2靶向Nrf2干扰质粒基因测序图

图3 shRNA3靶向Nrf2干扰质粒基因测序图
2.2 靶向Nrf2干扰质粒的筛选
2.2.1 各组Nrf2基因mRNA表达水平的比较 见图4。与NC组比较,shRNA1组、shRNA2组及shRNA3组Nrf2基因mRNA表达水平明显降低(均P<0.05),且shRNA3组Nrf2基因mRNA水平最低,该质粒为最佳干扰片段。
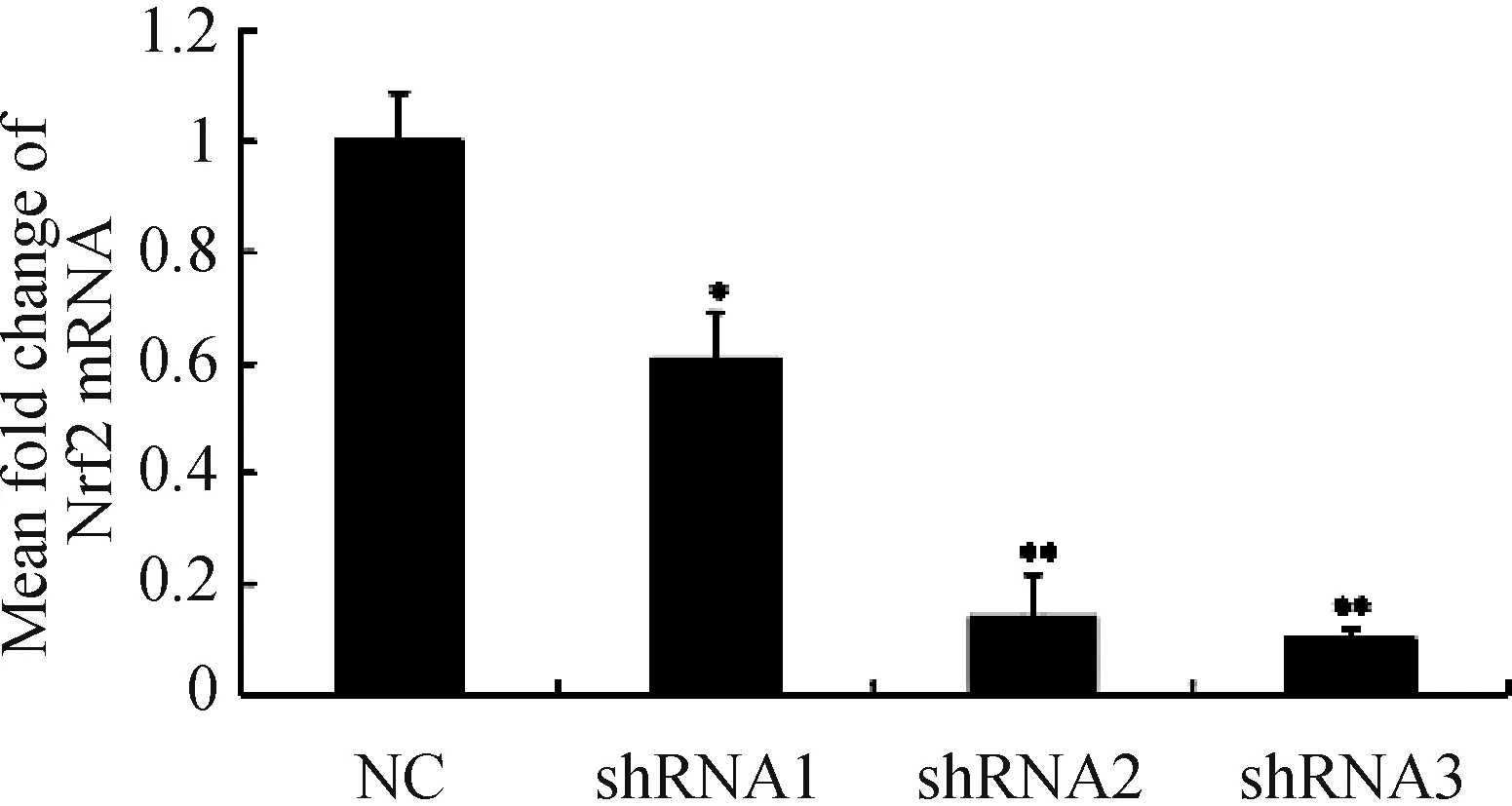
图4 各组Nrf2基因mRNA表达水平的比较。注:与NC组相比*P<0.05,**P<0.01
2.2.2 各组Nrf2基因蛋白表达水平的比较 见图5。与NC组比较,shRNA1组、shRNA2组及shRNA3组Nrf2基因蛋白表达水平明显降低(均P<0.05),且shRNA3组Nrf2基因蛋白水平最低,该质粒为最佳干扰片段。
图5 各组Nrf2基因蛋白表达水平的比较。注:与NC组相比**P<0.01
3 讨 论
Nrf2属于CNC-bZIP,即CNC亮氨酸拉链转录激活因子家族[9]。通过上调Nrf2的表达,激活Nrf2信号通路,可以进一步增加细胞活性,同时可以通过抑制氧化应激反应,进而起到神经保护作用,因此Nrf2可能成为卒中治疗过程中的一个有效治疗靶点[10-13]。
RNAi技术主要通过抑制宿主细胞mRNA转录后的基因表达从而发挥作用。随着RNAi技术的不断成熟和发展,可以通过沉默目的基因从而研究目的基因的各项功能[5-7]。本实验设计并合成了针对Nrf2基因的干扰质粒,同时经基因测序证实各组干扰质粒与设计的靶向链完全一致,说明目的基因被准确地插入到相应的载体中。RT-PCR定量分析结果提示各组干扰质粒对Nrf2基因mRNA水平均有抑制作用,其中shRNA3的干扰作用最强。此外,Western Blot的结果也证实了各组干扰质粒能一定程度地抑制靶基因蛋白水平的表达,其中shRNA3对目的基因的干扰作用最强,因而其为最佳靶点。本实验成功构建了针对Nrf2基因的干扰质粒,并筛选出了具有最强抑制作用的干扰质粒,为后期研究Nrf2基因在脑卒中发病机制中的作用及治疗机制打下了坚实的实验基础。
[1]张宇,张兵.Nrf2-Keap1信号通路与脑卒中[J].中风与神经疾病杂志,2014,31:372.
[2]Wells PG, Bhatia S, Drake DM. Fetal oxidative stress mechanisms of neurodevelopmental deficits and exacerbation by ethanol and methamphetamine[J]. Birth Defects Res C Embryo Today, 2016, 108: 108.
[3]Shi CL, Zhou XE, Zhang JY, et al. Alpha-Lipoic acid protects against the cytotoxicity and oxidative stress induced by Cadmium in HepG2 cells through regeneration of glutathione by glutathione reductase via Nrf2/ARE signaling pathway[J]. Environ Toxicol Pharmacol, 2016, 45: 274.
[4]Kim J, Keum YS. NRF2, a key regulator of antioxidants with two faces towards cancer[J]. Oxid Med Cell Longev, 2016, 2016: 2746457.
[5]Man DK, Chow MY, Casettari LA, et al. Potential and development of inhaled RNAi therapeutics for the treatment of pulmonary tuberculosis[J]. Adv Drug Deliv Rev, 2016, 102: 21.
[6]Dyawanapelly S, Ghodke SB, Vishwanathan R, et al. RNA Interference-Based therapeutics: molecular platforms for infectious diseases[J]. J Biomed Nanotechnol, 2014, 10: 1998.
[7]Kim YH, Issa MS, Cooper AM, et al. RNA interference: Applications and advances in insect toxicology and insect pest management[J]. Pestic Biochem Physiol, 2015, 120: 109.
[8]Zhang JQ, Shi L, Xu XN, et al. Therapeutic detoxification of quercetin against Carbon tetrachloride-induced acute liver injury in mice and its mechanism[J]. J Zhejiang Univ Sci B, 2014, 15: 1039.
[9]Moi P, Chan K, Asunis I, et al. Isolation of NF-E2-related factor 2 (Nrf2), a NF-E2-like basic leucine zipper transcriptional activator that binds to the tandem NF-E2/AP1 repeat of the beta-globin locus control region[J]. Proc Natl Acad Sci USA, 1994, 91: 9926.
[10]Han J, Xiao Q, Lin YH, et al. Neuroprotective effects of salidroside on focal cerebral ischemia/reperfusion injury involve the nuclear erythroid 2-related factor 2 pathway[J]. Neural Regeneration Research, 2015, 10: 1989.
[11] Jiang S, Deng C, Lv J, et al. Nrf2 Weaves an Elaborate Network of Neuroprotection Against Stroke[J]. Mol Neurobiol, 2016.doi 10.1007/s12035-016-9707-7.
[12]Mao J, Li Z, Lin R, et al. Preconditioning with Gua Lou Gui Zhi decoction enhances H2O2-induced Nrf2/HO-1 activation in PC12 cells[J]. Exp Ther Med, 2015, 10: 877.
[13]Mann GE. Nrf2-mediated redox signalling in vascular health and disease[J]. Free Radical Bio Med, 2014, 75: S1.
Construction and identification of nuclear factor erythroid-2-related factor 2 gene RNA interference recombinant plasmid
TANGWu-zhuang,LIJie.
DepartmentofNeurology,YixingHospitalAffiliatedtoJiangsuUniversity,Yixing214200,China
Objective To construct and identify the shRNA plasmid vector targeting nuclear factor erythroid-2-related factor 2 (Nrf2), and to collect the strongest RNAi effect of Nrf2 shRNA sequence. Methods Nrf2 gene was targeted gene. Three shRNA sequences were designed by software and synthesized by chemical method: shRNA-1, shRNA-2 and shRNA-3. The double strand shRNA oligo was ligated to the vector. The construct was verified by sequencing analysis. BV2 cells were transfected with expressing shRNA plasmid vectors using Lipofectamine 2000. The expression of Nrf2 in the levels of mRNA was detected by real-time PCR, and Western Blot was adopted to abserve the expression of Nrf2 protein. Results Sequencing analysis suggested that the shRNA vectors targeting Nrf2 possessed correct nucleotide sequence and read frame. The result of Real-time PCR and Western Blot showed that the sequence of shRNAi-3 could more effectively knockdown the expression level of Nrf2 than the others. Conclusions The shRNA vectors targeting Nrf2 are successfully constructed and the shRNA can signidicantly inhibit the expression of Nrf2. These findings could provide an experimental basis for further study on Nrf2 signaling pathway in stroke field.
nuclear factor erythroid-2-related factor 2;RNA interference;BV2 cells
江苏省科技厅自然科学基金面上项目(BK20141121);无锡市卫生局青年基金 (Q201301;Q201625)
214200江苏大学附属宜兴医院(扬州大学医学院宜兴临床学院)神经内科
李杰
R363
A
1004-1648(2017)02-0120-04
2016-08-15
2016-08-29)
