海水厌氧氨氧化反应器的启动及最佳运行工艺摸索
2017-04-27郝建安张爱君姜天翔张秀芝张晓青张雨山
郝建安,张爱君,杨 波,姜天翔,张秀芝,张晓青,张雨山,王 静
(国家海洋局天津海水淡化与综合利用研究所,天津 300192)
海水厌氧氨氧化反应器的启动及最佳运行工艺摸索
郝建安,张爱君,杨 波,姜天翔,张秀芝,张晓青,张雨山,王 静*
(国家海洋局天津海水淡化与综合利用研究所,天津 300192)
从渤海湾滩涂地区采集泥水样品,通过厌氧氨氧化反应特异引物对样品进行PCR扩增,选取可以扩增出特征条带的样品构建厌氧氨氧化反应器,容积为18 L。当反应器的水力停留时间从7 d延长到14 d时,反应器启动成功。反应器稳定运行的最佳条件为:水力停留时间 7~21 d、盐度 35‰~50‰、进水总氮负荷变化值小于20%、温度 20~35 ℃、pH值 6~7。
海水;厌氧氨氧化反应器;启动;运行工艺
厌氧氨氧化(anaerobicammoniaoxidation,anammox)是一种生物介导的脱氮反应,在此反应中,硝酸盐和铵离子可以直接转化为氮气和水[1]。1977年,Broda[2]预测到了厌氧氨氧化反应的存在;1992年,Mulder[3]在GistBrocades公司的厌氧流化床中发现了该反应的存在;1995年,vandeGraaf等[4]通过一系列研究证明了该反应,并随后证明参与该反应的微生物是自养型细菌。厌氧氨氧化过程可以在不投加电子供体(碳源)的情况下完成脱氮,具有污泥产量低、CO2排放量少、节能等独特优势,荷兰等多个国家已经建立了厌氧氨氧化反应中试或工厂规模反应器[5-7]。
海水利用是解决水资源匮乏的重要手段,许多沿海城市已经采用海水作为市政工程用水(如冲厕、街道洒水等)[8-10]。对于期间产生的污、废海水的处理常借用淡水的处理方法,但由于海水盐度较高,影响微生物的活性,因此,处理效率往往较低。伴随海水利用产业的发展,污、废海水量将大大增加,如何处理这些废水,是海水利用产业亟需解决的问题。
作者在此首次研究海水厌氧氨氧化反应器的构建与启动,并摸索反应器的稳定运行工艺,以期为厌氧氨氧化技术应用于污、废海水处理奠定基础。
1 实验
1.1 泥水样品采集与筛选
于渤海湾海河入海口处滩涂采集泥水样品。用美国MOBIO公司的PowerSoil®DNA Isolation Kit试剂盒提取泥水样品总DNA,用特异引物Amx809F与Amx1066R进行PCR扩增[11]。PCR反应体系(25 μL):基因组DNA 1.5 μL(80~100 ng),引物1.0 μL,10×PCR buffer 2.5 μL,dNTP 2.0 μL,Taq 0.5 μL。反应条件:95 ℃预变性3 min;94 ℃变性1 min,56 ℃退火1 min,72 ℃延伸1.5 min,30个循环;72 ℃延伸10 min;4 ℃暂停。
1.2 反应器构建
海水厌氧氨氧化反应器如图1所示,容积为18 L,用黑色胶皮与黑色漆对反应器进行避光处理,反应温度控制在35 ℃,注满海水以保证厌氧条件。
进水(mg·L-1):NH4Cl 3 000,NaNO2600,MgSO4300,KH2PO430,CaCl2136,NaHCO3500;微量元素Ⅰ 1 mL·L-1,微量元素Ⅱ 1 mL·L-1;海水补齐。
微量元素Ⅰ(mg·L-1):EDTA 5 000,FeSO45 000。
微量元素Ⅱ(mg·L-1):EDTA 50 000,ZnSO4·7H2O430,CoCl2·6H2O 240,MnCl2·4H2O 990,CuSO4·5H2O250,NaMoO4·2H2O 220,NiCl2·6H2O 190,NaSeO4·10H2O 210,H3BO414。
1.3 反应器最佳运行工艺摸索

图1 海水厌氧氨氧化反应器Fig.1 Seawater anammox reactor
分别改变水力停留时间(3 d、7 d、14 d、21 d)、盐度(32‰、35‰、40‰、42‰、50‰)、进水总氮负荷(增加20%、增加10%、减少10%、减少20%)、反应温度(10 ℃、20 ℃、35 ℃、50 ℃)、反应pH值(5、6、7、8、9),观察海水厌氧氨氧化反应器运行参数的变化,以确定最佳的运行工艺。
1.4 检测方法
氨氮含量参照GB 17378.4-2007中的纳氏试剂法测定,亚硝酸盐含量参照GB/T 12763.4-2007中的萘乙二胺分光光度法测定。
2 结果与讨论
2.1 泥水样品的筛选结果
提取泥水样品总DNA,用特异引物进行PCR扩增,结果发现,仅部分样品可以扩增出约200 bp的特异条带。将该条带测序结果与GenBank数据库进行比对,结果见表1。
表1 DNA片段在GenBank中的比对结果
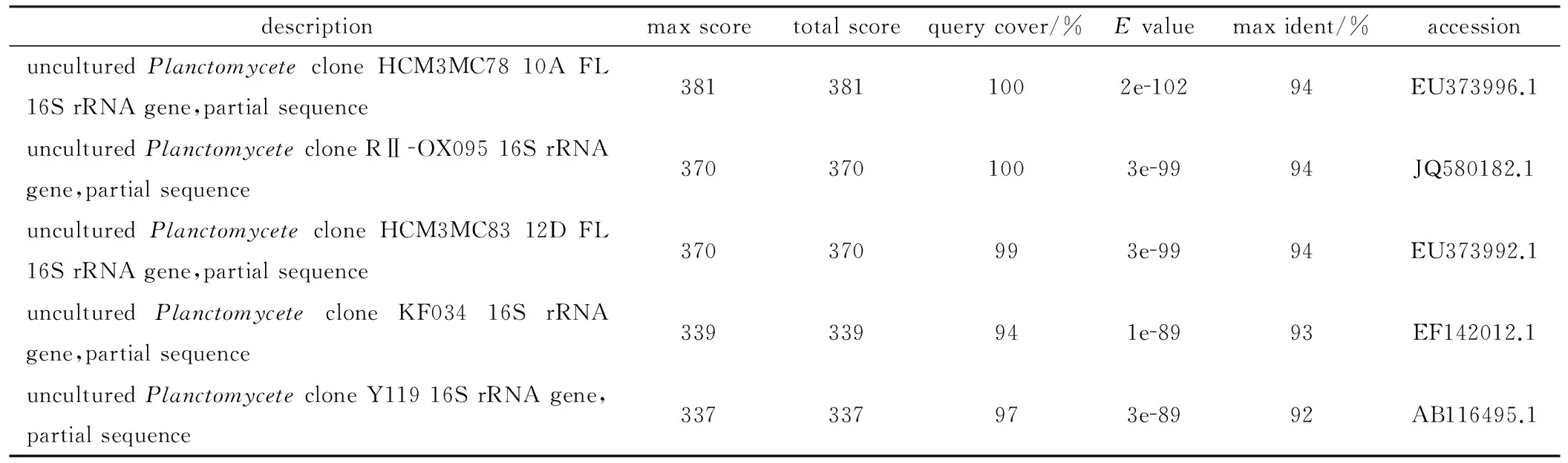
Tab.1 Sequence alignment of DNA fragment in GenBank
由表1可知,该序列与Planctomycete菌株的16S rRNA基因序列相似度很高,说明可以扩增出特异条带的样品中很可能含有厌氧氨氧化特征菌属Planctomycete的菌株。
目前,还未分离到参与厌氧氨氧化反应的微生物纯培养物。但是,通过分子生物学手段发现,产生厌氧氨氧化作用的微生物属于浮霉状菌目(Planctomycetales)[12]。厌氧氨氧化反应在海洋环境中普遍存在,并且可能是海洋中无机氮更重要的汇[13-15]。本实验采样区为渤海滩涂,是沿海大潮高潮位与低潮位之间的潮浸地带,其环境溶氧浓度较低,同时PCR反应显示泥水样品中极有可能存在参与厌氧氨氧化反应的细菌。因此,选择该泥水样品构建反应器,以加快厌氧氨氧化反应的启动。
2.2 海水厌氧氨氧化反应器的启动
反应器接种从渤海湾滩涂采集的泥水样品18 L,定期更换培养液,监测出水的氨氮、亚硝基氮含量,结果如图2所示。
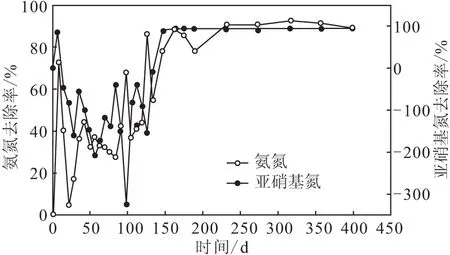
图2 海水厌氧氨氧化反应器的启动Fig.2 Startup of seawater anammox reactor
从图2可以看出,海水厌氧氨氧化反应器的启动耗时长达5个月,主要分为2个阶段。第一个阶段,开始约1周时间,由于反应器刚刚建立,出水参数很不稳定,氨氮去除率与亚硝基氮去除率波动较大,没有规律;紧接着4个月时间,氨氮去除率在50%左右,而亚硝基氮去除率升高至50%以上,有时甚至升高2倍以上,此时反硝化反应占主导地位。第二个阶段,水力停留时间由7 d延长到14 d,氨氮去除率达到70%以上,亚硝基氮去除率达到85%以上,且氨氮去除率与亚硝基氮去除率比值约为1∶1.17。继续监测2个月,发现氨氮去除率、亚硝基氮去除率、氨氮去除率与亚硝基氮去除率比值一直很稳定,且出水pH值一直在6.5左右,反应器中的污泥由黑色变为红色。文献报道,厌氧氨氧化反应器的启动有2个主要特征,一是反应器内污泥变红,这是由于厌氧氨氧化反应发生后,细胞色素累积所致[16];二是出水氨氮与亚硝基氮含量同时降低,且去除率比值为1∶1.32[17]。因此,可以确定海水厌氧氨氧化反应器已经启动。
近年文献报道的厌氧氨氧化反应器大部分是淡水型反应器和耐盐型反应器[18-19]。启动厌氧氨氧化反应器一般采用原位启动法或人工培养富集法。原位启动法是将反应器构建在海底,使反应器在自然环境中启动厌氧氨氧化反应,耗时较长。如Nakajima等[20]发明了一种柱式反应器,将其固定在海底,耗时1年富集厌氧氨氧化细菌,成功启动厌氧氨氧化反应。人工培养富集法是在构建的反应器中用人工配制的培养基启动厌氧氨氧化反应,该法依赖于培养基成分与反应条件的控制。如van de Vossenberg等[21]利用一种基于红海盐配制的培养基,从瑞典的Gullmar峡湾海底沉积物中富集了Scalindua属细菌;Kawagoshi等[22]用合成的海水培养基在海洋环境中成功富集了厌氧氨氧化细菌;Kindaichi等[23]用Hiroshima海湾表面沉积物及人工配制的海水培养基在上流柱反应器中富集了厌氧氨氧化细菌。
本实验选择人工培养富集法启动海水厌氧氨氧化反应器。相比报道的海水厌氧氨氧化反应器,本实验反应器具有更高的效率与更好的稳定性,在环境条件不发生重大改变的情况下,可以稳定运行1年以上,且氨氮去除率超过90%。
2.3 反应器最佳运行工艺的确定
2.3.1 水力停留时间对厌氧氨氧化反应的影响(图3)
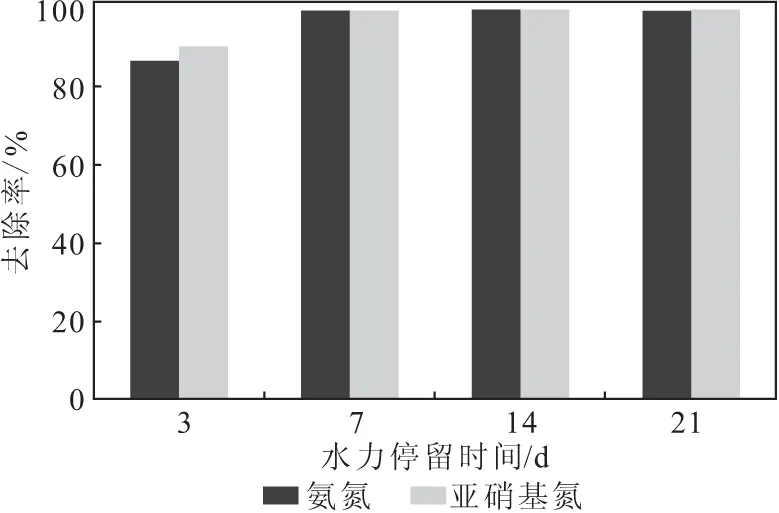
图3 水力停留时间对厌氧氨氧化反应的影响Fig.3 Effect of hydraulic retention time on anammox reaction
从图3可以看出,在海水厌氧氨氧化反应器稳定运行后,当水力停留时间为7~21 d时,氨氮去除率一直稳定在95%以上;当水力停留时间为3 d时,氨氮去除率降至85%。这是因为,水力停留时间直接关系到水中污染物与厌氧氨氧化细菌接触的时间,当水力停留时间过短,水中氨氮来不及被厌氧氨氧化细菌降解,反应效率较低;当水力停留时间延长,水中氨氮与厌氧氨氧化细菌接触充分,反应效率较高;但水力停留时间过长,水中污染物基本耗尽,反应效率也较低。因此,适宜的水力停留时间为7~21 d。
2.3.2 盐度对厌氧氨氧化反应的影响(图4)
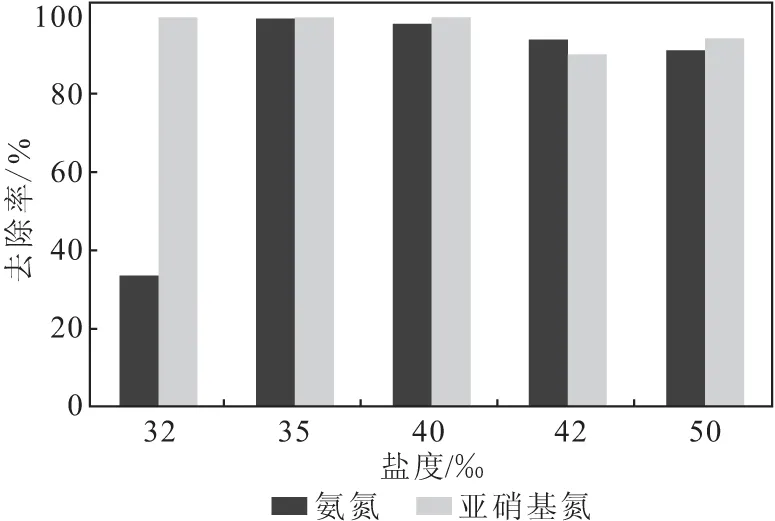
图4 盐度对厌氧氨氧化反应的影响Fig.4 Effect of salinity on anammox reaction
从图4可以看出,盐度过高或过低对厌氧氨氧化反应均有一定影响,其中低盐度对厌氧氨氧化反应的影响更大些。当盐度提高到50‰时,反应效率降低值在10%以内;但当盐度降低至32‰时,反应效率几乎降低70%。这是因为,一方面盐度直接影响渗透压,盐度的波动使得渗透压急剧变化,从而导致细胞活性降低,甚至死亡;另一方面,盐度的波动对生物处理影响很大,对于经过高盐驯化的厌氧氨氧化细菌,一旦盐度突然降低,其生物活性会瞬间降低。因此,适宜的盐度为35‰~50‰。
2.3.3 进水总氮负荷对厌氧氨氧化反应的影响
初始进水总氮负荷:氨氮94.68 mg·L-1,亚硝基氮99.76 mg·L-1。改变进水总氮负荷分别增加20%、增加10%、减少10%、减少20%,考察进水总氮负荷对厌氧氨氧化反应的影响,结果如图5所示。
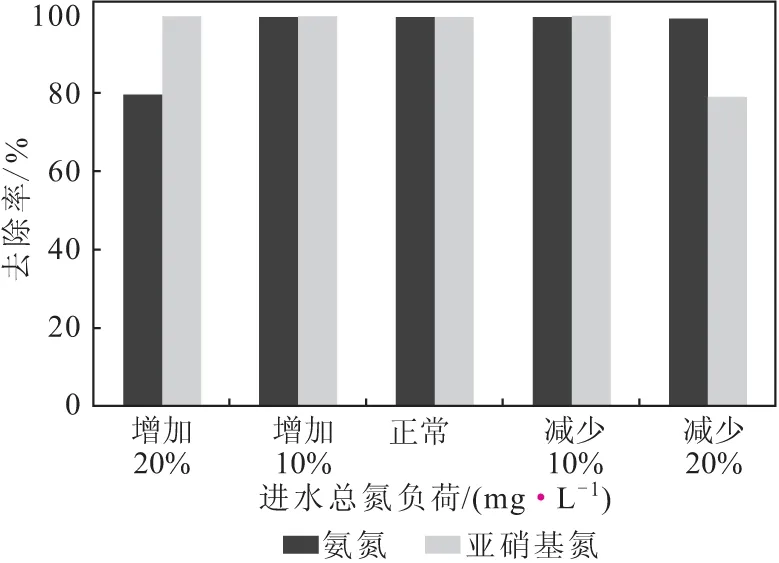
图5 进水总氮负荷对厌氧氨氧化反应的影响Fig.5 Effect of total influent nitrogen loading on anammox reaction
从图5可以看出,当进水总氮负荷变化值在10%以内时,并未影响厌氧氨氧化反应效率;但当进水总氮负荷变化值达到20%时,反应效率明显降低。这是因为,氨氮是厌氧氨氧化的反应基质,在适宜的范围内,浓度越高越有益于反应;但过高的氮浓度对生物有抑制作用,加上亚硝酸盐对生物的抑制作用,当提高进水总氮负荷时,也就同时提高了进水氨氮与亚硝基氮的量,两者发生协同抑制作用,导致反应效率降低。因此,进水总氮负荷变化值应小于20%。
2.3.4 温度对厌氧氨氧化反应的影响(图6)
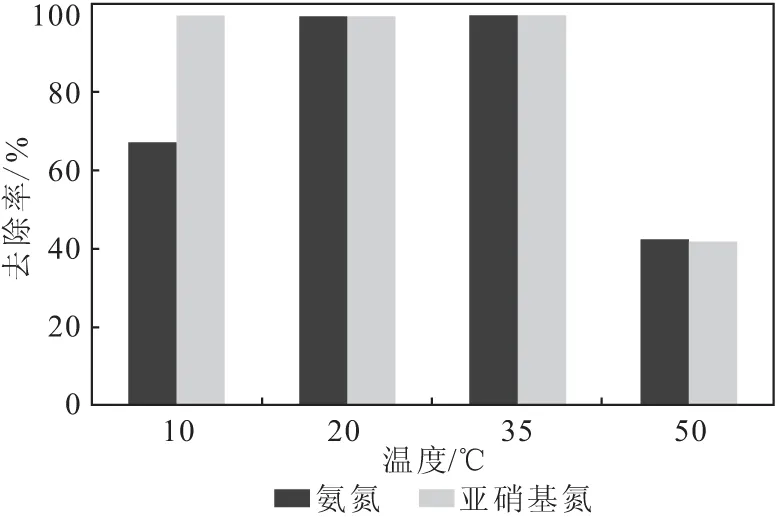
图6 温度对厌氧氨氧化反应的影响Fig.6 Effect of temperature on anammox reaction
从图6可以看出,温度对厌氧氨氧化反应的影响较大。当温度在20~35 ℃时,厌氧氨氧化反应效率较高。因此,适宜的温度为20~35 ℃。
在气候变化较明显地区应用厌氧氨氧化反应时,应注意温度变化对反应的冲击。
2.3.5 pH值对厌氧氨氧化反应的影响(图7)
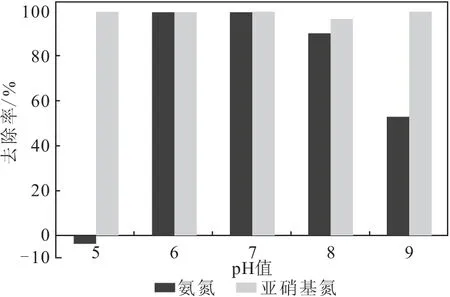
图7 pH值对厌氧氨氧化反应的影响Fig.7 Effect of pH value on anammox reaction
从图7可以看出,厌氧氨氧化反应的适宜pH值范围较窄,在pH值为6~7时厌氧氨氧化反应效率较高,氨氮去除率均达到95%以上;当pH值升高到8时,氨氮去除率降低到90%;当pH值升高到9时,氨氮去除率降低到55%以下;当pH值降低到5时,厌氧氨氧化反应马上停止。因此,适宜的pH值为6~7。
pH值不仅直接影响厌氧氨氧化细菌的生长,还影响厌氧氨氧化细菌基质的有效性。文献报道[24-26],厌氧氨氧化反应的适宜pH值范围为6.0~8.0,本实验结果与之相符。
3 结论
研究了海水厌氧氨氧化反应器的启动与稳定运行的最佳工艺。从渤海湾滩涂地区采集泥水样品,通过特异引物对样品进行PCR扩增,选取可以扩增出特征条带的样品构建厌氧氨氧化反应器,容积为18 L。当水力停留时间从7 d延长到14 d时,反应器启动成功,耗时5个月,反应器稳定运行的最佳条件为:水力停留时间7~21 d、盐度 35‰~50‰、进水总氮负荷变化值小于20%、温度20~35 ℃、pH值6~7。
[1] 宋瑞静,于静洁,王少坡,等.厌氧氨氧化技术应用研究进展[J].环境工程,2014(S1):237-242.
[2] BRODA E.Two kinds of lithotrophs missing in nature[J].Journal of Basic Microbiology,1977,17(6):491-493.
[3] MULDER A.Anoxic ammonia oxidation:US 5078884[P].1992-01-07.
[4] van de GRAAF A A,MULDER A,de BRUIJN P,et al.Anaerobic oxidation of ammonium is a biologically mediated process[J].Applied and Environmental Microbiology,1995,61(4):1246-1251.
[5] van der STAR W R,ABMA W R,BLOMMERS D,et al.Startup of reactors for anoxic ammonium oxidation:experiences from the first full-scale anammox reactor in Rotterdam[J].Water Res-earch,2007,41(18):4149-4163.
[6] DAPENA-MORA A,CAMPOS J L,MOSQUERA-CORRAL A,et al.Anammox process for nitrogen removal from anaerobically digested fish canning effluents[J].Water Science and Technology,2006,53(12):265-274.
[7] VOLCKE E,GERNAEY K V,VRECKO D,et al.Plant-wide (BSM2) evaluation of reject water treatment with a SHARON-anammox process[J].Water Science and Technology,2006,54(8):93-100.
[8] TANG S L,YUE D P T,LI X Z.Comparison of engineering costs of raw freshwater,reclaimed water and seawater for toilet flushing in Hong Kong[J].Water and Environment Journal,2006,20(4):240-247.
[9] COCKRILL J W.The use of sea-water for street-watering, sewer-flushing and the other purposes required by sanitary authorities[J].Minutes of the Proceedings of the Institution of Civil Engineers,2015,110(1892):343-354.
[10] 徐明.海水用于电厂循环冷却系统的探讨[J].电力建设,2002,23(5):12-13.
[11] TSUSHIMA I,KINDAICHI T,OKABE S.Quantification of anaerobic ammonium-oxidizing bacteria in enrichment cultures by real-time PCR[J].Water Research,2007,41(4):785-794.
[12] JETTEN M S M,SLIEKERS O,KUYPERS M,et al.Anaerobic ammonium oxidation by marine and freshwater planctomycete-like bacteria[J].Applied Microbiology and Biotechnology,2003,63(2):107-114.
[13] KUYPERS M M M,SLIEKERS A O,LAVIK G,et al.Anaerobic ammonium oxidation by anammox bacteria in the Black Sea[J].Nature,2003,422(6932):608-611.
[14] THAMDRUP B,DALSGAARD T,JENSEN M M,et al.Anaerobic ammonium oxidation in the oxygen-deficient waters off no-rthern Chile[J].Limnology and Oceanography,2006,51(5):2145-2156.
[15] DALSGAARD T,CANFIELD D E,PETERSEN J,et al.N2production by the anammox reaction in the anoxic water column of Golfo Dulce,Costa Rica[J].Nature,2003,422(6932):606-608.
[16] KLOTZ M G,SCHMID M C,STROUS M,et al.Evolution of an octahaem cytochrome c protein family that is key to aerobic and anaerobic ammonia oxidation by bacteria[J].Environmental Microbiology,2008,10(11):3150-3163.
[17] STROUS M,HEIJNEN J J,KUENEN J G,et al.The sequencing batch reactor as a powerful tool for the study of slowly growing anaerobic ammonium-oxidizing microorganisms[J].Applied Microbiology and Biotechnology,1998,50(5):589-596.
[18] NI S Q,ZHANG J.Anaerobic ammonium oxidation:from laboratory to full-scale application[J].BioMed Research International,DOI:10.1155/2013/469360.
[19] KARTAL B,KOLEVA M,ARSOV R,et al.Adaptation of a freshwater anammox population to high salinity wastewater[J].Journal of Biotechnology,2006,126(4):546-553.
[20] NAKAJIMA J,SAKKA M,KIMURA T,et al.Enrichment of anammox bacteria from marine environment for the construction of a bioremediation reactor[J].Applied Microbiology and Biotechnology,2008,77(5):1159-1166.
[21] van de VOSSENBERG J,RATTRAY J E,GEERTS W J C,et al.Enrichment and characterization of marine anammox bacteria associated with global nitrogen gas production[J].Environmental Microbiology,2008,10(11):3120-3129.
[22] KAWAGOSHI Y,NAKAMURA Y,KAWASHIMA H,et al.Enrichment culture of marine anaerobic ammonium oxidation (anammox) bacteria from sediment of sea-based waste disposal site[J].Journal of Bioscience and Bioengineering,2009,107(1):61-63.
[23] KINDAICHI T,AWATA T,SUZUKI Y,et al.Enrichment using an up-flow column reactor and community structure of marine anammox bacteria from coastal sediment[J].Microbes and Environments,2011,26(1):67-73.
[24] JETTEN M S,STROUS M,van de PAS-SCHOONEN K T,et al.The anaerobic oxidation of ammonium[J].FEMS Microbiology Reviews,1998,22(5):421-437.
[25] 陈曦,崔莉凤,杜兵,等.温度和pH值对厌氧氨氧化微生物活性的影响分析[J].北京工商大学学报(自然科学版),2006,24(3):5-8.
[26] 杨洋,左剑恶,沈平,等.温度、pH值和有机物对厌氧氨氧化污泥活性的影响[J].环境科学,2006,27(4):691-695.
Startup of Seawater Anaerobic Ammonia Oxidation Reactor and Optimization on Operation Process
HAO Jian-an,ZHANG Ai-jun,YANG Bo,JIANG Tian-xiang,ZHANG Xiu-zhi,ZHANG Xiao-qing,ZHANG Yu-shan,WANG Jing*
(InstituteofSeawaterDesalinationandMultipurposeUtilization,SOA(Tianjin),Tianjin300192,China)
Throughanaerobicammoniaoxidation(anammox)specificprimers,sludgewatersamplescollectedfromBohaibeachareawereamplifiedbyapolymerasechainreaction(PCR),andthesamplesamplifiedwithfeaturebandswereselectedtobuildananammoxreactorwithvolumeof18L.Reactorstartedsuccessfullywhenthehydraulicretentiontimechangedfrom7dto14d.Theoptimumoperationconditionswereasfollows:hydraulicretentiontimeof7~21d,salinityof35‰~50‰,changevalueoftotalinfluentnitrogenloadinglowerthan20%,temperatureof20~35 ℃,pHvalueof6~7.
seawater;anaerobicammoniaoxidationreactor;startup;operationprocess
海洋公益性行业科研专项资助项目(201305022-5),中央级公益性科研院所基本科研业务费专项资金资助项目团队项目(K-JBYWF-2015-T11,K-JBYWF-2016-T9),中央级公益性科研院所基本科研业务费专项资金资助项目(K-JBYWF-2016-G10)
2016-11-15
郝建安(1981-),男,天津人,高级工程师,研究方向:微生物学,E-mail:phoenix328@hotmail.com;通讯作者:王静,正高级工程师,E-mail:13820529296@163.com。
10.3969/j.issn.1672-5425.2017.04.015
X172
A
1672-5425(2017)04-0063-05
郝建安,张爱君,杨波,等.海水厌氧氨氧化反应器的启动及最佳运行工艺摸索[J].化学与生物工程,2017,34(4):63-67.
