分光光度法测定黑曲霉孢子浓度的研究
2017-04-27袁洪威陈湖芳高东民刘学策郭博恺李祝
袁洪威,陈湖芳,高东民,刘学策,郭博恺,李祝*
(1.贵州大学生命科学学院,贵州贵阳550025;2.贵州省人民医院,贵州贵阳550025)
分光光度法测定黑曲霉孢子浓度的研究
袁洪威1,陈湖芳1,高东民1,刘学策1,郭博恺2,李祝1*
(1.贵州大学生命科学学院,贵州贵阳550025;2.贵州省人民医院,贵州贵阳550025)
采用分光光度计测定黑曲霉(Aspergillus niger)xj在不同生长期、不同稀释倍数下孢子悬液的OD600nm值,对比血球板计数法得到的孢子悬液浓度,研究在对数期和稳定期OD600nm值与孢子浓度之间的关系;采用微电影拍摄法观察黑曲霉xj产孢结构形成过程,并绘制固体发酵条件下的生长曲线。结果表明,在10~20倍稀释区间内,稀释倍数与OD600nm值之间呈现良好线性关系(对数期R2=0.984 8、稳定期R2=0.991 3),且OD600nm值与孢子浓度之间也保持良好的线性关系(对数期R2=0.995 3、稳定期R2=0.993 6);通过微电影拍摄法观察到黑曲霉xj产孢结构形成是分阶段进行的过程;在固体发酵过程中,孢子浓度呈现“S”型增长趋势。该研究为测定丝状真菌孢子浓度提供另一种可借鉴的方法。
分光光度法;黑曲霉;孢子浓度;产孢结构;生长曲线
黑曲霉(Aspergillus niger)属于半知菌类曲霉属[1],是曲霉属真菌中的一个常见种。黑曲霉作为一种潜在的生防菌剂,对于由齐整小核菌(Sclerotium rolfsii)引起的超过500种植物(如大麦、豇豆、辣椒、花生和大豆[2-6]等)病害有良好的抑制效果。此外,黑曲霉作为一种优良的工业菌株,在食品加工和代谢物(如有机酸和抗菌素)提取方面有广泛应用[7-10]。目前,在黑曲霉的开发和利用方面取得了显著的成果,吴鹏等[12]利用Plackett-Burman(PB)试验和Box-Behnken(BB)试验对黑曲霉HS-5产β-葡萄糖酶的培养基进行优化,使β-葡萄糖酶产率提高了5.91倍。这就要求对其生长过程中菌体的生长变化,产孢结构的形成状况以及孢子量积累规律等要有更加清楚的了解,以便指导工业发酵和基础研究。生长曲线反映了培养过程中生长和繁殖的规律,同一种黑曲霉在不同的生长条件下生长曲线也不尽相同,通过生长曲线了解菌体的生长繁殖情况,对于根据不同的需求有效地利用黑曲霉具有重要的意义。
为更好地开发这种生防菌剂,为工业生产提取大量原料,需要大量黑曲霉孢子来支持生产和研发工作。测定孢子数量的方法主要有直接血球板计数法和间接平板菌落计数法[11],这些方法均较复杂,耗时,精确度低,所以在实际应用中需要寻找更加便捷且精确度高的测定方法。在酿酒酵母的开发利用中,苑伟等[13]采用分光光度法,以菌悬液OD值来衡量酿酒酵母对乙醇的耐受性,ANDREW W等[14]利用OD值作为衡量高产菌株基因与环境相互作用的指标。
以分光光度法测定细胞浓度的研究已有报道[11,17],但黑曲霉xj作为一种丝状真菌,分光光度法在该类真菌中的应用还少见报道。通过测定黑曲霉不同生长时期、不同稀释条件下OD600nm值,对比血球板计数法测得的孢子浓度,寻找OD600nm值与孢子浓度之间的关系,探究用分光光度法测定黑曲霉孢子悬液浓度的可行性。此外,采用微电影拍摄法对黑曲霉xj产孢结构形成过程进行研究,在固体发酵条件下绘制出孢子浓度增长曲线,验证分光光度法测定黑曲霉孢子浓度的实用性,为测定丝状真菌孢子浓度提供另一种可借鉴的方法。
1 材料与方法
1.1 材料与试剂
黑曲霉(Aspergillus niger)xj:中国典型培养物保藏中心保存(No:M206021);麦麸:汝州市华豫面业有限公司;土豆:市售;葡萄糖:成都金山化学试剂有限公司;琼脂粉:上海微生物科技有限公司;
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:土豆200 g/L,葡萄糖20 g/L,琼脂粉20 g/L,自来水1 L,pH自然。121℃灭菌20 min。
麦麸(wheat bran)培养基:麦麸与自来水按照料液比1∶1(g∶mL)混合,拌匀,pH 7.5。121℃灭菌20 min。
1.2 仪器与设备
UV757CRT型紫外分光光度计:上海仪电分析仪器有限公司;CX31型数码生物显微镜:日本奥林巴斯公司;PHS-3D型pH计:上海精密科学仪器有限公司。
1.3 方法
1.3.1 菌种活化
挑取斜面黑曲霉菌种接种于PDA固体培养基中,28℃条件下培养5 d,备用。
1.3.2 孢子悬液的制备
无菌条件下以0.1%(V/V)吐温-80溶液冲洗培养基表面,制成孢子悬液并在4℃条件下保存,孢子悬液浓度采用血球板计数法得到。
1.3.3 固体发酵方法
麦麸培养基在121℃灭菌20 min后,无菌条件下接入黑曲霉xj孢子悬液2 mL(1×105~2×105个/mL),混匀后置于28℃条件下恒温培养。
1.3.4 分光光度法测孢子悬液OD值
取制备好的孢子悬液,在波长λ=600 nm处测定光密度值(OD600nm),使OD600nm值在0.1~0.8[15-16],并分别利用血球板计数法测定孢子浓度。
1.3.5 OD600nm值与稀释倍数回归方程的建立
分别取对数期和稳定期的孢子悬液,记录稀释倍数与具体的OD600nm值,以稀释倍数为自变量,OD600nm值为因变量建立回归方程。
1.3.6 OD600nm值与孢子浓度回归曲线的绘制
分别取对数期和稳定期的孢子悬液,控制OD600nm在 0.1~0.8之间,以OD600nm为横坐标,孢子浓度为纵坐标绘制回归曲线。
1.3.7 黑曲霉产孢结构的观察
取孢子悬液2mL(1×105~2×105个/mL)接种于麦麸培养基中,28℃条件下培养,分别于2 h、6 h、8 h、22 h、27 h、32 h、35 h、37 h时用粘片法[11]观察黑曲霉产孢结构的形成动态。
1.3.8 黑曲霉生长曲线的绘制
取孢子悬液2 mL(1×105~2×105个/mL)接种于麦麸培养基中,28℃条件下培养,分别于0、40 h、64 h、88 h、112 h、120 h、144 h、168 h、192 h时随机取样以分光光度法测孢子浓度,绘制黑曲霉生长曲线。
1.3.9 数据处理
每组实验均在相同条件下重复3次,所有实验均以平均值±标准偏差(±s)形式表示,所有图像由Minitab17.0软件处理。
2 结果与分析
2.1 OD600nm值与稀释倍数回归方程的建立
黑曲霉在不同生长时期下,随机取一定质量样品制成孢子悬液,利用分光光度法测定不同稀释倍数下λ=600 nm时的OD值,以OD600nm表示。用直接血球板计数法测定对应时间点的孢子悬液浓度,结果如表1所示。
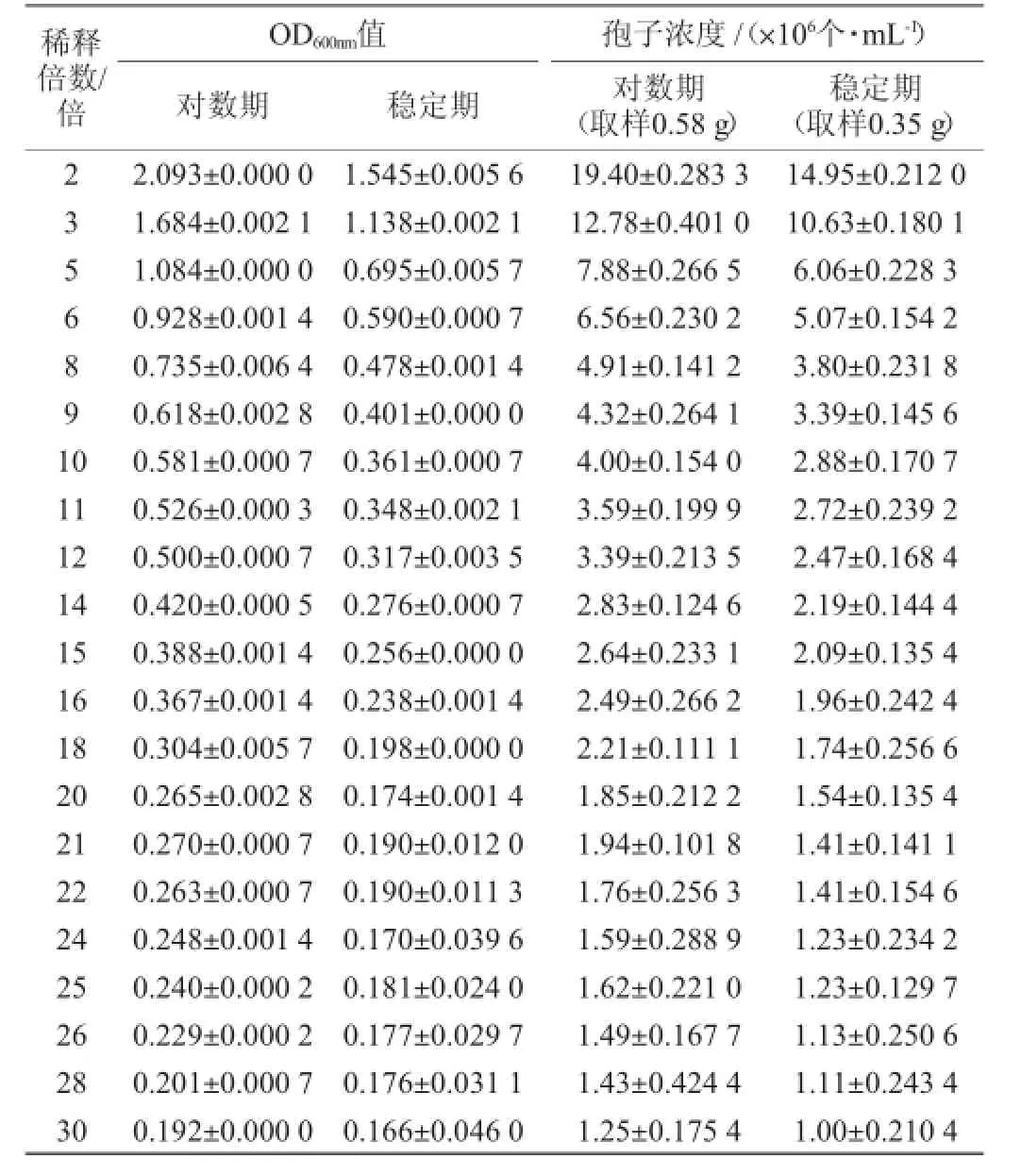
表1 黑曲霉xj不同生长期、不同稀释条件下孢子悬液的OD600nm值和孢子浓度的关系Table 1 Relationship of OD600nmvalue and spore concentration of A.nigerxj spore suspension under different growth stages and dilution ratios
利用OD600nm值来衡量细胞浓度时必须把OD600nm值回归到统一的标准上才可以比较[17]。由表1研究发现,无论处于对数期还是稳定期,不同的稀释倍数范围下,稀释倍数与OD600nm值之间有不同的线性关系,数据的稳定性(即标准差)不同。将稀释倍数为2~10倍、10~20倍、20~30倍作为三个区间,然后在相应区间内对OD600nm值进行分段线性回归,结果如表2所示。由表2可知,在10~20倍稀释区间内,对数期时稀释倍数与OD600nm值相关系数R2=0.984 8,稳定期时二者间相关系数R2=0.9913,无论对数期还是稳定期均表现出较其他稀释区间更明显的线性关系,且在此稀释区间内标准差较小,数据的稳定性和可靠性较高,分段回归方程可以用于OD600nm回归值的计算。

表2 黑曲霉xj孢子悬液不同稀释区间OD600nm值分段回归方程Table 2 Piecewise regression equations of OD600nmofA.nigerxj spore suspension in different dilution range
2.2 不同生长期孢子浓度与OD600nm值的关系
在10~20倍稀释区间内,OD600nm值稳定在0.1~0.8之间,数据可靠度高;OD600nm值标准差小,数据的稳定性好。为了探究OD600nm值与孢子浓度之间的关系,在10~20倍稀释区间内,选取了对数期和稳定期的孢子悬液来研究黑曲霉xj不同生长期OD600nm值与血球计数板计数所得的孢子浓度之间的关系,结果见图1。
由图1A可知,在对数期OD600nm值与孢子数量之间存在良好的线性关系,回归方程和为y=6.663 71x+0.096 50,相关系数R2=0.995 3,当OD600nm为0.618时,孢子数量为4.20×106个/mL。在对数期,OD600nm值和孢子浓度之间呈现良好的线性关系,说明在这一时期,菌体细胞生长旺盛,产孢结构成熟并稳定产生孢子,衰老或死亡很少发生,可以用OD600nm值较为准确地反映孢子浓度。
同样,由图1B可知,在稳定期OD600nm值与孢子浓度之间仍存在良好的线性关系,回归方程为y=6.8755x+0.1372,相关系数R2=0.993 6,当OD600nm值为0.618时,孢子数量为4.39×109个/mL。稳定期OD600nm值和孢子浓度之间呈现良好的线性关系表明,即使菌体生长进入稳定期,但孢子数量不受菌体的生长情况和营养环境的影响,而是保持相对恒定的数量水平,所以在稳定期仍可以用OD600nm值较为准确地反映孢子浓度。
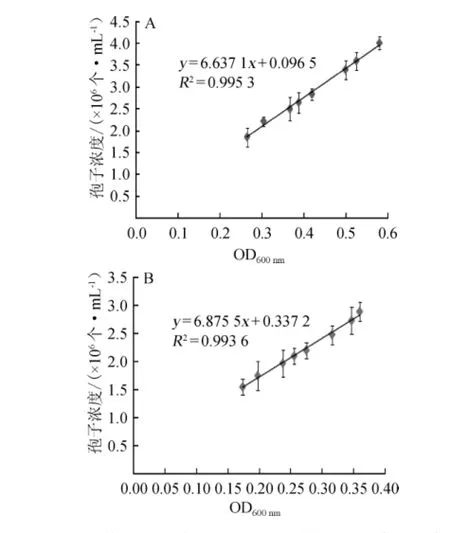
图1 对数期(A)及稳定期(B)OD600nm值与孢子浓度的关系Fig.1 Relationship between OD600nmvalue and spore concentration in log phase(A)and stable phase(B)
对比对数期和稳定期OD600nm值和孢子浓度之间的回归方程可知,孢子浓度的大小仅与OD600nm值存在唯一线性关系,不同的生长期对于二者之间的线性关系没有影响。当OD600nm=0.618时,二者的孢子浓度分别为4.20×106个/mL和4.39×106个/mL,标准差S=1.34×105。在科学研究中,很多情况下对于微生物孢子浓度有明确要求,利用血球计数板测定孢子浓度比较繁琐且主观因素影响较大,故利用OD600nm与孢子浓度之间的关系,可以及时准确地了解孢子浓度,而且两者之间的线性关系不受微生物生长期的影响,具有很好的普适性。
2.3 黑曲霉产孢结构的动态观察和孢子浓度增长曲线的
绘制
采用微电影拍摄的方法研究黑曲霉xj从孢子萌发到产孢结构成熟并开始散落孢子的整个过程,结果如图2所示。
由图2可知,黑曲霉xj产孢结构的形成分阶段进行,产孢结构的形成开始于营养菌丝充分生长、形成菌丝网之后。培养2 h时,孢子萌发产生芽管,开始营养生长;培养6 h时,随着营养菌丝不断进行顶端生长,菌丝直径增加,菌丝开始分支;培养22 h时,菌丝不断分支,分支的菌丝交织形成复杂的菌丝网,在菌丝网上开始分化产生生殖菌丝,产孢结构初见雏形,顶囊已经形成;培养27 h时,在成熟的顶囊上开始产生一轮小梗;培养32 h时,一轮小梗生长成熟,开始产生二轮小梗;培养35 h时,二轮小梗生长完成,至此产孢结构完全形成,开始产生孢子;培养37 h时,孢子成熟,从二轮小梗上散落下来,孢子数量开始增加。
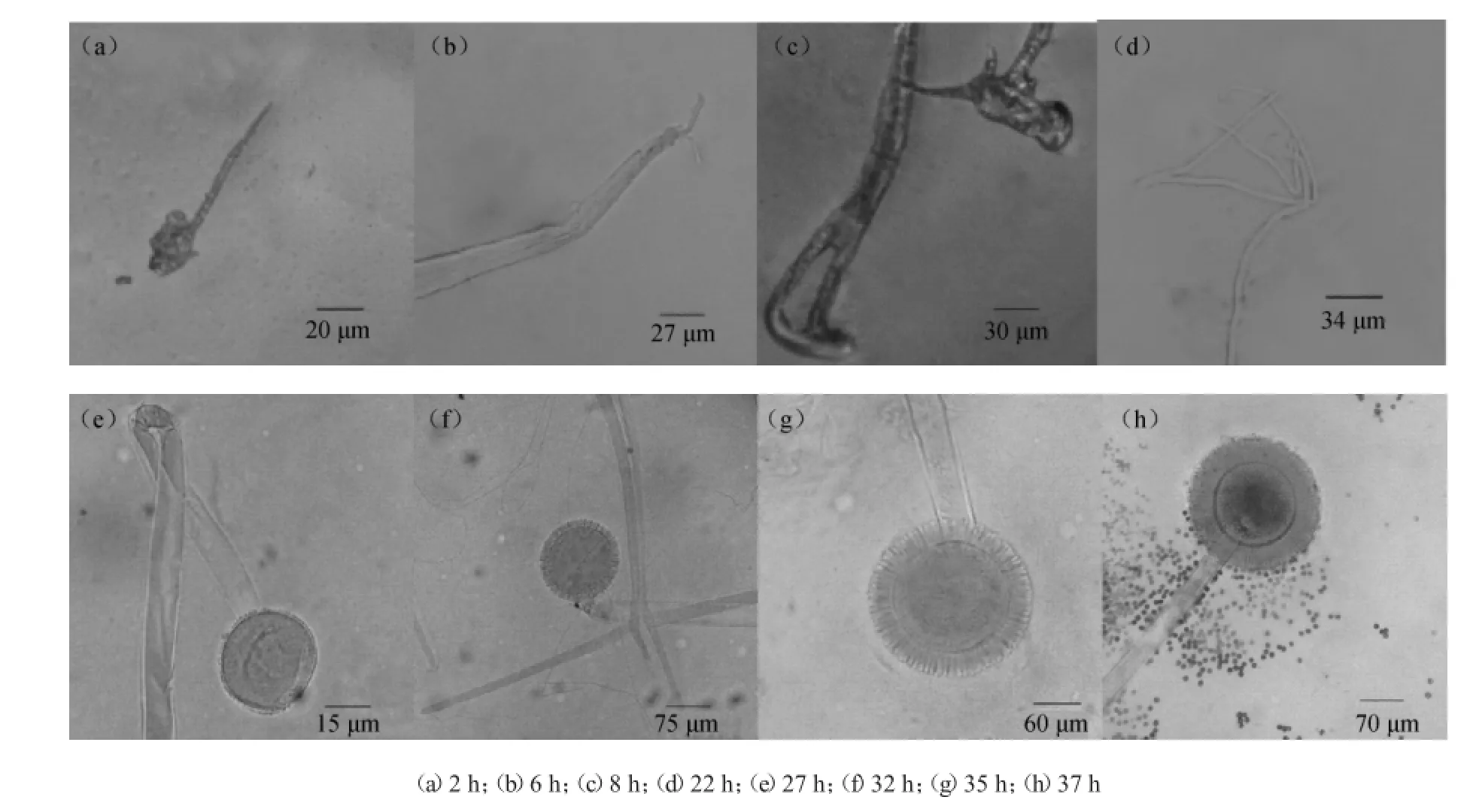
图2 黑曲霉xj产孢结构Fig.2 Conidial fructification ofA.nigerxj
在麦麸培养基中随机取一定质量样品制成孢子悬液,用分光光度法测得孢子悬液浓度,绘制黑曲霉xj生长曲线见图3。

图3 黑曲霉xj生长曲线Fig.3 Growth curve ofA.nigerxj
由图3可知,孢子浓度的增长呈S形曲线。发酵时间0~40 h为生长迟缓期,该时期孢子数量基本不增加,主要是营养菌丝的快速生长和产孢结构的形成,此时还没有成熟的孢子从产孢结构上散落,与图2观察到的结果相符;发酵时间50~100h为生长对数期,该时期孢子数量急剧上升,主要由于产孢结构已经发育成熟,大量的孢子从产孢结构上散落,营养环境优越,有足够的营养物质供其持续、大量地产孢;发酵时间100~168 h为生长稳定期,该时期孢子数量维持在一个相对恒定的水平不再增加,推测主要是营养物质的制约,发酵过程中各种有害物质的积累以及菌丝的衰老、死亡,产孢结构的退化无法继续产孢;发酵时间168~192 h出现衰亡的趋势,孢子浓度未出现明显的下降(P>0.05),主要由于发酵时间较短,还未检测到明显的衰亡期。
3 结论
本研究采用分光光度法测定黑曲霉xj在不同生长期、不同稀释条件下的OD600nm值,研究不同生长期OD600nm值与稀释倍数、OD600nm值与孢子浓度之间的关系。结果表明,无论对数期还是稳定期,在10~20倍稀释区间内,OD600nm值与稀释倍数之间保持良好的线性关系,在此稀释区间内,OD600nm值介于0.1~0.8之间,可以很好地满足分光光度计的测定要求,数据可信度高,OD600nm值标准差小,数据波动小,可重复性好;同时,OD600nm值与孢子浓度之间也保持有良好的线性关系。
此外,通过微电影拍摄法记录黑曲霉xj产孢结构形成的动态过程,对于黑曲霉xj产孢结构形成过程中的动态变化有了较为清楚地认识。绘制固体发酵过程中孢子浓度增长曲线,验证了分光光度法测定黑曲霉孢子浓度的实用性。本研究用OD值来反映培养体系中孢子浓度,为丝状真菌的生产以及基础研究中有关孢子浓度的测定提供了理论指导,为测定丝状真菌孢子浓度提供另一种可借鉴的方法。
[1]武汉大学,复旦大学生物系微生物学教研室.微生物学[M].北京:人民教育出版社,1990:448-452.
[2]CILLIERS A J,PRETORIUS Z A,WYK P S V.Intergrated control of Sclerotium rolfsiion groundnut in South Africa[J].J Phytopathol,2003, 151(5):249-258.
[3]DUKES P D,FERRY R L,JONES A.Evaluating peppers,cowpeas, sweet potatoes and tomatoes for resistance to southern blight incited by Sclerotium rolfsiiSacc[J].Phytopathology,1983,73(4):785-786.
[4]ESNARD J,HEPPERLY P R.First report of southern blight of common barley in Puerto Rico[J].Eur J Plant Pathol,1995,101(5):497-501.
[5]PATIAL F S,MAYEE C D.Fungicidal seed treatment in the control of Sclerotium roifsiiSaccofsoybean[J].Ind J Plant Prot,1997,5(1):35-37.
[6]FERY R L,DUKES P D.Southern blight(SclerotiumrolfsiiSacc.)of cowpea:yield-loss estimates and sources of resistance[J].Crop Prot,2002, 21(5):403-408.
[7]李艳芳,郝建雄,程永强,等.黑曲霉和米曲霉发酵改善豆渣口感[J].农业工程学报,2012,28(7):248-253.
[8]FRISVAD J C,LARSEN T O,THRANE U,et al.Fumonisin and ochratoxin production in industrialAspergillus nigerstrains[J].PLos One, 2011,6(8):891-895.
[9]张辉,桑青.响应面法优化黑曲霉HQ-1产纤维素酶固体发酵条件[J].中国酿造,2011,30(7):17-22.
[10]孙科,周凤侠.以纤维素为原料发酵柠檬酸培养基的研究[J].食品研究与开发,2015,36(21):172-174.
[11]沈萍,陈向东.微生物学实验[M].北京:高等教育出版社,2007:69-87.
[12]吴鹏,姜坤,刘丽,等.黑曲霉HS-5高产β-葡聚糖酶培养基配方的优化[J].中国酿造,2016,35(8):83-86.
[13]苑伟,王学锋,刘延琳.优选酿酒酵母菌株发酵性能研究[J].中国酿造,2010,29(9):48-52.
[14]ANDREW W,JAMES D,CRAIG N G.High-throughput phenotypic profiling of gene-environment interactions by quantitative growth curve analysis inSaccharomyces cerevisiae[J].Anal Biochem,2004,327(1): 23-24.
[15]郭春叶,龚月生,刘林丽,等.酵母菌生长曲线的测定及其转葡萄芪合酶基因重组菌遗传稳定性的检测[J].安徽农业科学,2007,35(7):1909-1910.
[16]陶令霞,夏铁骑,常慧萍.两种测定固氮菌NT06菌株生长曲线方法的比较[J].生物学杂志,2007,24(5):57-58.
[17]曹国珍,缪建顺,张苗苗,等.分光光度法测定酿酒酵母细胞悬液浓度研究[J].中国酿造,2014,33(4):129-133.
Determination ofAspergillus nigerspores concentration by spectrophotometry
YUAN Hongwei1,CHEN Hufang1,GAO Dongmin1,LIU Xuece1,GUO Bokai2,LI Zhu1*
(1.College of Life Science,Guizhou University,Guiyang 550025,China; 2.Guizhou Provincial People's Hospital,Guiyang 550025,China)
OD600nmvalues ofAspergillus nigerxj spore suspension was determined by spectrophotometer under different growth stages and dilution ratios,comparing to the spore suspension concentration which was determined by the blood bat counting method,the relationship between OD600nmvalue and spore concentration in log phase and stable phase were investigated.The micro film shooting method was used to observe the forming process ofA.nigerxj conidial fructification and the growth curve of spore under a solid-state fermentation condition was drawn.The results showed that in the 10-20 times dilution range,it showed a good linear relationship between dilution ratio and OD600nmvalue(log phaseR2=0.984 8,stable phaseR2=0.991 3),and there also had a good linear relationship between OD600nmvalue and spore concentration(log phaseR2=0.995 3,stable phase R2=0.993 6).Moreover,it could be observed that the formation ofA.nigerxj conidial fructification was a stage process through the micro film shooting method,and spore concentration showed a"S"type growth trend during a solid-state fermentation.The study provided another referential method for the determination of filamentous fungal spore concentration.
spectrophotometry;Aspergillus niger;spore concentration;conidial fructification;growth curve
Q939.96
0254-5071(2017)04-0122-05
10.11882/j.issn.0254-5071.2017.04.026
2016-10-24
贵州省社发公关[SY(2014)3053];国家自然科学基金项目(31460486);贵州省农业公关[NY(2014)3033];国家级大学生创新训练项目[2015(006)];毕节烟草公司自然科学基金项目[2011(06)]
袁洪威(1996-),男,本科生,研究方向为微生物农药。
*通讯作者:李祝(1978-),女,教授,博士,研究方向为微生物农药。
