重度痛经的弥漫性子宫腺肌病子宫内膜-肌层交界区神经病理改变初步探讨
2017-04-26王俊文张凤花杨丹鹤丛丽莉
王俊文,张凤花,付 强,杨丹鹤,丛丽莉
(1.大连大学附属中山医院妇产科,辽宁 大连 116001;2.连云港市妇幼保健院,江苏 连云港 222000)
重度痛经的弥漫性子宫腺肌病子宫内膜-肌层交界区神经病理改变初步探讨
王俊文,张凤花,付 强,杨丹鹤,丛丽莉
(1.大连大学附属中山医院妇产科,辽宁 大连 116001;2.连云港市妇幼保健院,江苏 连云港 222000)
目的探讨子宫腺肌病的子宫内膜-肌层交界区(EMI)蠕动异常是否导致神经损伤或异常增殖。方法选择2013年10月至2015年10月在大连大学附属中山医院妇科病房行全子宫切除术患者50例。其中弥漫性子宫腺肌病子宫标本25例为观察组,同期行子宫切除的CINⅢ及子宫肌瘤标本25例为对照组。分别于标本宫底及宫体EMI取材,石蜡切片HE染色确诊后免疫组化检测宫底及宫体EMI中NGF表达,了解神经损伤情况。免疫荧光检测宫底及宫体EMI中PGP 9.5表达,了解神经密度改变。并分析子宫腺肌病患者宫底及宫体EMI中NGF的表达强度与PGP9.5密度的相关性。结果(1)观察组宫底EMI中NGF表达强度与PGP9.5阳性神经纤维密度(7.11±1.08),(16.36±1.76)条/mm2,高于宫体(4.80±0.74),(11.04±2.18)条/mm2,差异有统计学意义(P<0.05)。(2)对照组宫底EMI中NGF表达强度与PGP9.5阳性神经纤维密度1.67,(11.04±2.18)条/mm2与宫体部1.33,(6.87±1.42)条/m2比较,差异无统计学意义(P>0.05)。(3)观察组宫底及宫体NGF的表达强度与PGP9.5阳性神经纤维密度均高于对照组相应部位,差异有统计学意义(P<0.05)。(4)观察组宫底及宫体EMI处NGF表达强度与PGP9.5阳性神经纤维密度呈正相关(分别为r=0.760,P<0.05;r=0.763,P<0.05)。结论EMI神经异常可能参与子宫腺肌病发生发展,采用手术或药物减少EMI可能治疗子宫腺肌病。
子宫腺肌病;内膜-肌层交界区;神经生长因子;神经纤维植入
子宫腺肌病(adenomyosis,AM)[1]是指子宫内膜腺体和间质侵入子宫内膜下肌层3 mm以上,异位内膜引起局部出血,继发局部组织增生,形成弥漫性或局灶性病变。患者由于经量增多、继发性痛经、不孕等症状严重影响生活质量。由于生育年龄延迟,发病率呈上升趋势。因发病机制尚不清楚,诊治均较困难。Leyendecker 等人[2]于2009年提出创伤修复(tissue injury and repair,TIAR)理论,认为宫底部EMI蠕动异常是导致子宫腺肌病的原因。有研究发现子宫腺肌病病灶及内膜存在神经异常,但对EMI神经仍无相关系统研究。本实验分别采用免疫组化和免疫荧光的方法测定子宫腺肌病组和对照组子宫EMI的NGF和PGP9.5表达强度,探讨其神经损伤与分布特点。
1 资料与方法
1.1 研究对象
选取2013年10月至2015年10月,在大连大学附属中山医院妇科病房行全子宫切除术的患者50例。其中弥漫性子宫腺肌病子宫标本(25例)为观察组,同期行子宫切除的CINⅢ及子宫肌瘤标本(25例)为对照组。观察组VAS评分≥7分,对照组VAS评分<3分。所有病例术后均经病理组织学确诊。两组患者均处于月经周期的增殖期,年龄为29~45岁,术前3个月内均未服用过性激素类药物,亦无子宫内膜异位症、神经系统、内分泌或免疫系统疾病史,未放置宫内节育器。
1.2 方法
两组均在宫底及宫体EMI区域内取材。切除新鲜子宫标本,于宫颈前壁向宫底至双侧宫角Y型切开,取双侧宫角连线的中点处,长、宽各1 cm,深度达肌层1 cm组织标本。另于宫底至双侧宫角连线的中点处至宫颈口连线1/2处,取同样大小组织标本。标本立即置4%中性甲醛中固定,常规石蜡包埋,进行4 μm厚连续切片。
1.2.1 NGF测定:采用免疫组织化学SP法。切片脱蜡、水化后后经0.3 %过氧化氢溶液灭活组织内源性过氧化物酶,微波修复抗原,依次滴加10%羊血清、兔抗人NGFⅠ抗(1:200 稀释,武汉博士德)、生物素化羊抗兔Ⅱ抗和SP复合物(SP试剂盒,北京中杉),经二氨基联苯氨(DAB)显色,苏木素复染,脱水透明,封片备检。
光学显微镜下观察。由2人采用双盲法阅片,NGF表达强度采用Remmele和Stegner提出的免疫反应积分(Immunity Response Score,IRS)法表示,即IRS=染色强度(Stain Intensity,SI)×阳性细胞百分比(PP)。SI共分为4个等级,0级与背景颜色一致,视为阴性;1级呈淡黄色,为弱阳性;2级呈棕黄色,为中等阳性;3级呈棕褐色,为强阳性。PP共分为5个等级,0级为阴性即无阳性细胞,1级为阳性细胞数≤10%,2级为阳性细胞数占11%~50%,3级为阳性细胞数占51%~80%,4级为阳性细胞数>80%。当IRS>3表示免疫反应阳性。每张切片随机选取4个不同视野,以IRS的平均值作为NGF的表达强度。
1.2.2 PGP9.5测定:采用FITC-间接免疫荧光法。除滴加的Ⅰ抗为抗人神经细胞胞浆蛋白9.5(PGG9.5)抗体(1:400稀释,北京博奥森)、Ⅱ抗为FITC标记羊抗兔IgG抗体(1:500稀释,北京博奥森)外,余步骤同1.2.1免疫组化SP法。
共聚焦显微镜下观察。每张切片在低倍镜下选取PGP9.5阳性高表达区后转换成高倍镜,计数5个不同视野作为有效单位面积观察,观察记录神经总数,取平均值作为该切片神经密度。用单位面积(mm2)内的神经条数表示。
2 结 果
2.1 光学显微镜下NGF在EMI中的阳性表达情况
观察组及对照组均可见NGF表达,阳性细胞位于EMI内膜层的间质细胞内与EMI肌层的腺上皮细胞胞质中。
NGF阳性表达强度:观察组NGF在宫底EMI中的表达强度(7.11±1.08)高于宫体部(4.80±0.74),两者比较差异有统计学意义(P<0.05)。对照组NGF在宫底EMI的表达(1.67)与宫体部(1.33)相比,差异无统计学意义(P>0.05)。观察组宫底及宫体EMI中NGF的阳性表达强度均明显高于对照组,差异有统计学意义(P<0.05)。见表1、2、3。
表1 NGF在观察组EMI的表达情况(±s)

表1 NGF在观察组EMI的表达情况(±s)
注:观察组宫底与宫体比较,*P<0.05
部位例数NGF表达强度(IRS)宫底EMI257.11±1.08*宫体EMI254.80±0.74

表2 NGF在对照组EMI中的表达(IRS,M)
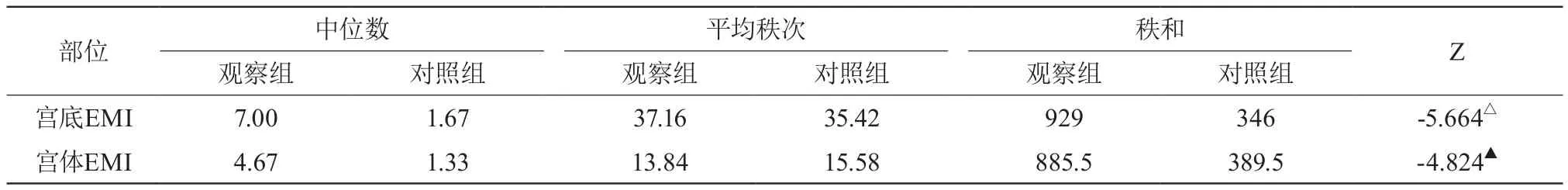
表3 NGF在EMI中的表达(IRS,M)
2.2 激光共聚焦显微镜观察免疫荧光染色子宫腺肌病不同部位EMI神经密度
50例患者中术后病理标本检出为子宫腺肌病及子宫肌瘤、CINⅢ患者均各25例。PGP9.5免疫反应阳性神经纤维在观察组及对照组EMI均有表达。见表4。
表4 检出PGP9.5(+)神经纤维条数及密度的比较(±s)
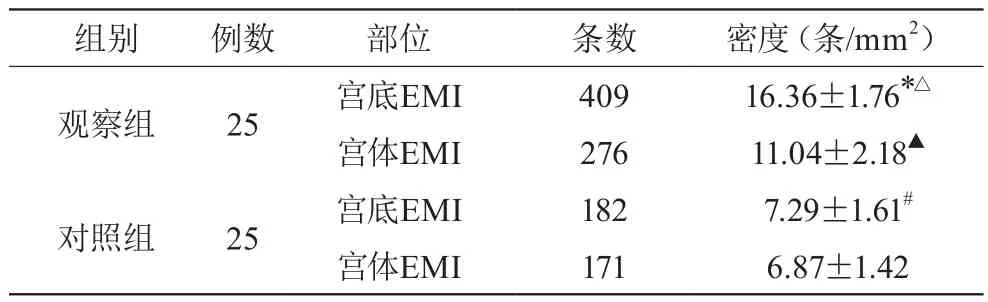
表4 检出PGP9.5(+)神经纤维条数及密度的比较(±s)
组别例数部位条数密度(条/mm2)观察组25宫底EMI40916.36±1.76*△宫体EMI27611.04±2.18▲对照组25宫底EMI1827.29±1.61#宫体EMI1716.87±1.42
2.3 子宫腺肌病患者E M I中N G F表达强度与PGP9.5(+)阳性神经纤维密度关性分析
子宫腺肌病患者宫底EMI处NGF表达强度与PGP9.5阳性神经纤维密度正相关(r=0.760,P<0.05),两者变化关系如图1。
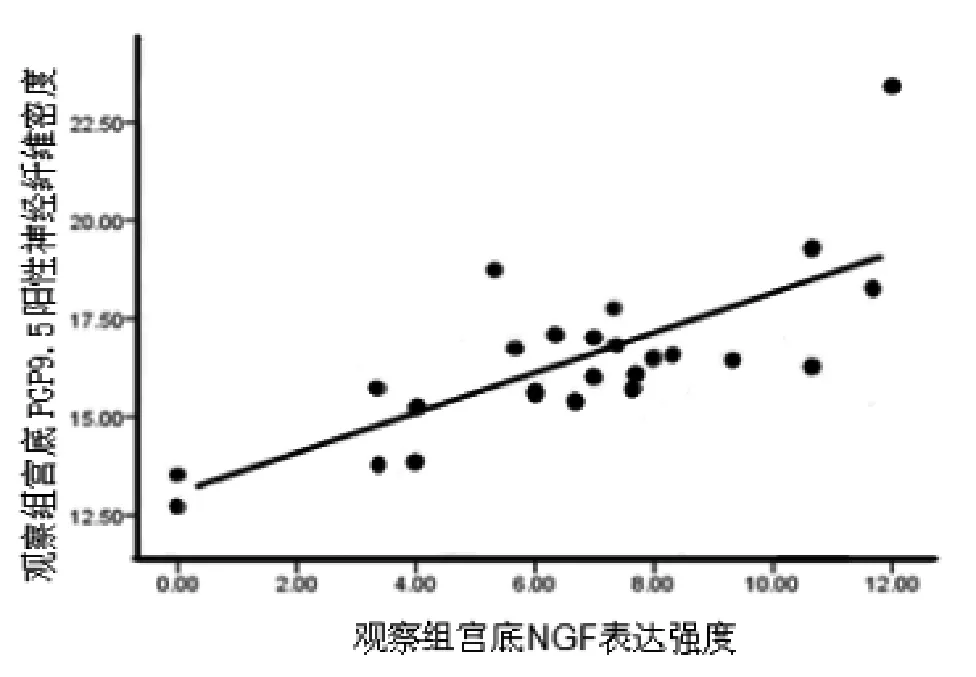
图1 观察组宫底EMI处NGF表达强度与PGP9.5阳性神经纤维密度相关性散点图
子宫腺肌病患者宫体EMI处NGF表达强度与PGP9.5阳性神经纤维密度正相关(r=0.763,P<0.05),两者变化关系如图2所示。
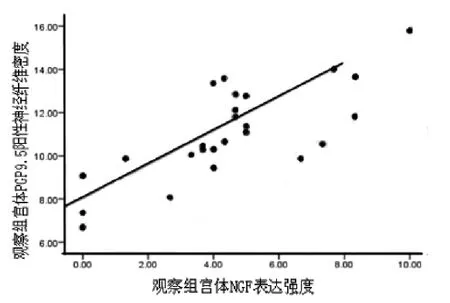
图2 观察组宫体EMI处NGF表达强度与PGP9.5阳性神经纤维密度相关性散点图
3 讨 论
子宫腺肌病可引起月经量过多、痛经、不孕等症状,是妇科常见病之一。严重影响妇女的生活质量。可能造成子宫损伤的情况如剖宫产、人工流产等可能是该病的诱因,但本研究观察组与对照组生育史与子宫手术史无显著性差异。因此,与部分文献报道该病发病与子宫手术无相关性一致。
子宫内膜和子宫肌层的交界区域,即为E M I (endometrial-myometrial interface)。NGF属于神经营养因子家族成员,对受损神经元有促再生和保护作用,在神经受损时表达异常增多。动物试验发现,子宫NGF蛋白表达强度与腺肌病病程进展相关,因此NGF可能参与了子宫腺肌病的发病机制。本研究中观察组无论宫底和宫体NGF表达水平与对照组比较均明显升高,具有统计学意义,此结果与以往文献报道相同即子宫腺肌病存在神经损伤。本研究结果进一步说明子宫腺肌病宫底部EMI神经损伤最为严重,而宫体相对较轻。说明子宫腺肌病的神经损伤与宫底EMI蠕动异常相关,其神经病理改变同样以宫底为中心向宫颈方向蔓延。
蛋白基因产物9.5(Protein gene product 9.5,PGP 9.5)是一种存在于神经纤维中的特异性神经水解酶,可作为神经轴突的标记物。本研究发现观察组EMI中PGP9.5阳性神经纤维密度明显高于对照组,结果与以往对子宫腺肌病病灶及异位内膜的研究报道相同。但本研究发现在观察组宫底部PGP 9.5阳性神经纤维密度明显高于宫体部,再次证明子宫腺肌病发病来源于宫底EMI“蠕动泵”的假设。本研究结果表明,子宫腺肌病EMI的高神经增殖状态与该部位病变程度相关。
本研究发现,观察组NGF强度与PGP9.5阳性神经纤维植入密度正相关,进一步证明子宫腺肌病宫底EMI神经纤维密度增高可能与NGF分泌增加有相关性。文献报道PGP 9.5阳性神经纤维密度与痛经的程度相关[3]。在本研究中发现宫底EMI中NGF与PGP 9.5阳性神经纤维同样存在高表达。
本文通过观察子宫腺肌病子宫不同部位EMI的神经密度改变,证实子宫腺肌病EMI异常蠕动导致神经异常植入并促进了子宫腺肌病发生发展。在临床上,我们根据TIAR假说设计了子宫腺肌病组织减灭术这一术式,在保留子宫的前提下,在明显地缓解痛经、减少经量方面取得良好疗效[4]。
[1]Struble J, Reid S, Bedaiwy MA. Adenomyosis: A Clinical Review of a Challenging Gynecologic Condition. J Minim Invasive Gynecol (Journal of Minimally Invasive Gynecology),2016,23(2):164-185.
[2]Leyendecker G, Wildt L, Mall G. The pathophysiology of endometriosis and adenomyosis:tissue injury and repair [J]. Arch Gynecol Obstet,2009,280(4):529-538.
[3]王文莉,段 华,张 颖,等.子宫腺肌病PGP9.5、NGF的表达及其与痛经的关系[J].首都医科大学学报,2012,33(1):11-15.
[4]徐潇萌,付强.子宫腺肌病组织减灭术治疗弥漫性,子宫腺肌病的临床分析.中国医药指南[J].2015.13(4):141-142.
本文编辑:刘帅帅
Severe dysmenorrhea diffuse pathological adenomyosis endometrial myometrial junction to investigate neural changes
WANG Jun-wen1, ZHANG Feng-hua2, FU Qiang1, YANG Dan-he1, CONG Li-li1
(1.Department of Obstetrics and Gynecology; Zhongshan Hospital Affiliated to Dalian University,Liaoning Dalian 116001;2.Lianyungang Maternal and Child Health-Care Center,Jiangsu Lianyungang 222000,China)
ObjectiveTo investigate whether the abnormal activity of the uterine myometrial junction (EMI) in adenomyosis leads to nerve damage or abnormal proliferation.MethodsFrom October 2013 to October 2015 in Zhongshan Hospital Affiliated to the gynecological ward for 50 patients with resection of the uterus in Dalian University. The diffuse adenomyosis of uterus specimens of 25 cases of the observation group, underwent hysterectomy CIN III and hysteromyoma specimens of 25 cases as control group. Specimens were respectively obtained from the fundus and uterine EMI, paraffin HE staining confirmed after immunohistochemical detection of uterine fundus and uterine EMI NGF expression, to understand the situation of nerve injury. Immunofluorescence and uterine fundus EMI PGP 9.5 expression, understand the nerve density change. And analysis of patients with adenomyosisThe correlation between the expression intensity and PGP9.5 density of fundus and uterine body in EMI NGF.Results(1)Observation group EMI in the palace at the end of the expression of NGF and PGP9.5 positive nerve fiber density (7.11+1.08), (16.36+1.76) /mm2, higher than the palace body (4.80+0.74), (11.04+2.18) /mm2, the difference was statistically significant (P<0.05). (2) the control group Palace at the end of the EMI NGF expression and PGP9.5 positive nerve fiber density of 1.67 (11.04+2.18) /mm2and the palace body 1.33, (6.87+1.42) /m2comparison, the difference was not statistically significant (P>0.05). (3) the expression intensity and density of PGP9.5 positive nerve fibers in the observation group and the uterine fundus NGF were higher than the corresponding control group site, the difference was statistically significant (P<0.05). The observation group (4) and uterine EMI fundus NGF expression intensity and PGP9.5 positive nerve positive fiber density (r=0.760,P<0.05; r=0.763,P<0.05).Conclusion EMI neural abnormalities may be involved in the occurrence and development of uterine adenomyosis, using surgery or drug EMI may reduce the treatment of uterine adenomyosis.
Adenomyosis;Endometrial junction;Nerve growth factor;Nerve fiber implantation
R711.74
B
ISSN.2095-8803.2017.01.126.02
