Caveolin-1在乳腺癌间质中的表达及与预后的关系
2017-04-26李建华吕伟鹏朱瑞萍曹铭谦
李建华,吕伟鹏,朱瑞萍,曹铭谦
(1.大连大学附属中山医院 病理科,辽宁 大连 116001; 2. 大连大学附属中山医院 乳腺科,辽宁 大连 116001)
论 著
Caveolin-1在乳腺癌间质中的表达及与预后的关系
李建华1,吕伟鹏1,朱瑞萍1,曹铭谦2
(1.大连大学附属中山医院 病理科,辽宁 大连 116001; 2. 大连大学附属中山医院 乳腺科,辽宁 大连 116001)
目的 检测Cav-1在乳腺癌间质中的表达,探讨其与临床病理学指标,乳腺癌分子亚型及与三阴型乳腺癌预后的关系。方法 选取258例有完整随访资料的乳腺癌切除标本,用免疫组织化学方法检测间质中CAF细胞的Cav-1表达,与肿瘤临床T分期、病理分级、淋巴结转移情况及肿瘤细胞分子标记物(ER、PR、HER-2、P53、PCNA)的表达情况进行相关性分析,同时分析在Luminal A型、Luminal B型、HER-2型和三阴型中Cav-1的差异性表达,并在三阴型乳腺癌中根据Cav-1的表达进行生存分析。结果 258例乳腺病例中,78例间质Cav-1的阴性/微弱阳性表达,94例中等阳性表达,86例强阳性表达。肿瘤分期越高,Cav-1的表达的阳性率越低,T1、T2及T3~T4各组之间差异有显著性意义(P<0.05)。有淋巴结转移的肿瘤比无淋巴结转移的肿瘤Cav-1表达水平低,二者具有显著性差异(P<0.05)。与患者年龄、肿瘤大小、ER、PR和HER-2的状态无关。三阴型乳腺癌与Luminal A型、B型、HER-2型相比, Cav-1的表达明显降低(P<0.05),而A型、B型、HER-2型之间无明显差异。三阴型乳腺癌间质中Cav-1(-)、Cav-1(+)、Cav-1(++)三组生存率差异有显著性(P<0.05),Cav-1的表达缺失是三阴型乳腺癌预后差的独立预后指标(HR=1.583 95%CI=1.031-2.431,P<0.05)。结论 Cav-1表达水平随着临床分期的增高而降低;间质中Cav-1是三阴型乳腺癌的独立预后指标,Cav-1的低表达与预后差密切相关。
Caveolin-1;乳腺癌;肿瘤间质;预后
目前,乳腺癌的预后风险评估参数主要包括肿瘤的临床分期、病理分级以及上皮标志物(ER, PR和HER-2等),一般认为肿瘤越小、无腋窝淋巴结转移和远处转移的患者预后好,Luminal A型和Luminal B型的患者预后相对较好,HER-2型和三阴型患者的预后较差。临床工作中我们经常发现有的Luminal A型和Luminal B型患者虽然临床分期也不高,手术后不久就出现了复发和转移;同时,有些三阴型乳腺癌术后也有很长的无病生存期和总生存期,所以,除了已知临床应用的的乳腺癌预后评估参数,一定还存在未知的与乳腺癌的预后相关的因素。我们知道恶性肿瘤的发生发展除了依赖于肿瘤细胞自身的恶性增殖以外,也与微环境内的癌相关成纤维细胞(carcinoma-associated fibroblasts,CAFs)有密切的关系[1]。近年来caveolin-1(Cav-1)作为CAFs的标记物在乳腺癌的发生和进展中日益受到重视。Cav-1作为Caveolea的家族成员,是细胞膜主要支架蛋白成分,其主要功能是参与跨膜信号转导调节。体外研究发现,Cav-1-/-成纤维细胞促进细胞增生,而Cav-1重新表达后细胞停留在G0/G1期,这些结果提示Caveolin-1作为抑制细胞周期的抑癌基因,当缺失时能引起成纤维细胞的恶性转化。有研究发现,Caveolin-1在乳腺癌间质中的表达异常与乳腺癌的预后有着密切的相关性,Cav-1的表达缺失可能与乳腺癌的预后较差相关,但也有研究结果认为Cav-1的表达与乳腺癌的预后没有相关性[2-3]。本研究旨在通过检测乳腺癌间质中Cav-1的表达,探讨其与临床病理学指标,乳腺癌分子亚型的关系以及可否作为乳腺癌的预后的标志物。
1 材料和方法
1.1 研究对象
258例乳腺癌病例选自大连大学附属中山医院2001年5月至2002年5月期间诊断的乳腺癌切除标本。患者均为女性,中位年龄为53(28~82岁),具有完整的随访资料。所有标本均经4%中性甲醛固定,常规石蜡包埋。所有患者术前均未接受任何辅助治疗。死于乳腺癌的病例资料为完全数据资料,而存活或死于其它原因病例资料则定义为删失资料。无瘤生存时间定义为从手术之日起至首次发生肿瘤复发或最后一次随访的时间,总生存时间定义为从手术之日起至患者死亡或最后一次随访的时间。随访时间10年以上。
1.2 免疫组织化学染色
采用标记的生物素(LSAB/SP)法检测乳腺癌组织中ER(克隆号6F11)、PR(克隆号16)、HER-2(克隆号4B5)、P53(克隆号D07)、PCNA(克隆号PC10)、Cav-1(克隆号2297)(本研究所用免疫组化试剂除HER-2购自罗氏诊断公司,其余均购自中杉金桥试剂公司)的表达,用PBS缓冲液代替一抗作为阴性对照,用已知阳性片作为阳性对照,染色结果用DAB显色。
1.3 免疫组化染色结果的判定
对于免疫组化染色结果,由两位高级病理医师采用双盲法阅片。
1.3.1 Cav-1蛋白:Cav-1在浸润性癌间质中的表达评估主要集中在CAFs上,位于胞浆中。根据染色强弱或阳性细胞的百分比进行判定,微弱表达或中度以上表达的阳性细胞数<10%为(-),中度表达或强阳性细胞数≥10%~<30%为(+),强阳性细胞数>30%为(++)。
1.3.2 ER和PR染色结果判定:ER和PR的表达主要定位于肿瘤细胞核,呈弥漫棕黄色颗粒,将切片中阳性细胞数占肿瘤细胞数的百分比≥1%定义为阳性, <1%为阴性。
1.3.3 HER-2染色结果判定:阳性细胞的着色主要定位于细胞膜,无染色或≤10%的浸润癌细胞呈现不完整的、微弱的细胞膜染色,判定为(0);>10%的浸润癌细胞呈现不完整的、微弱的细胞膜染色,判定为(+);>10%的浸润癌细胞呈现不完整的和/或弱至中等强度的细胞膜染色或≤10%的浸润癌细胞呈现强而完整的细胞膜染色,判定为(++);>10%的浸润癌细胞呈现强、完整、均匀的细胞膜染色,判定为(+++);本实验将(0)和(+)定义为HER-2阴性;(+++)定义为HER-2阳性,对于(++)组的病例则进一步进行荧光原位杂交技术(FISH)检测(应用VysisToP2A/Her-2/CEP17FISH探针试剂盒),有基因扩增,规定为阳性,无基因扩增,规定为阴性。
1.3.4 P53染色结果判定:阳性细胞的着色主要定位于细胞核,≥50%的癌细胞染色定义为(+)。
1.3.5 PCNA染色结果判定:阳性细胞的着色定位于细胞核,≥10%的癌细胞染色就定义为(+)。
1.4 统计学方法
所有研究数据通过SPSS 19.0统计软件包进行统计,以χ2检验进行组间率的比较及临床病理特征的分析,连续型变量的比较采用方差分析。生存分析利用Kaplan-Meier法,并行Log-rank检验。无病生存时间和总生存时间的分析用Cox风险回归模型。以P<0.05为差异有统计学意义的检验标准。
2 结 果
2.1 Cav-1在乳腺癌间质中的表达及与临床病理学指标的相关性
阴性/微弱阳性表达、中等阳性表达、强阳性分别用(-)、(+)、(++)表示。258例乳腺病例中,78例表现为(-),94例表现为(+),86例表现为(++),见图1;T1期肿瘤72例、T2期肿瘤116例、T3~T4期肿瘤70例, 肿瘤分期越高,Cav-1的表达的阳性率越低,各组之间差异有显著性意义(P<0.05)。在有淋巴结转移的肿瘤中Cav-1(-)、(+)、(++)的表达分别为43.9%、29.8%、26.3%,在无淋巴结转移的肿瘤中Cav-1(-)、(+)、(++)的表达分别为19.4%、41.7%、38.9%,Cav-1在有淋巴结转移的肿瘤中比无淋巴结转移的肿瘤表达水平低,二者具有显著性差异(P<0.05)。Cav-1的表达与肿瘤的病理分级、ER、PR和HER-2的状态、p53和增殖指数经组间率的比较均无明显关系。见表1。

A:强表达; B:中度表达;C;微弱表达图1 乳腺癌间质中caveolin-1的表达(×200)Fig 1 Stromal Cav-1 staining in breast cancer tissues(×200)

表1 肿瘤间质中Cav-1的表达与病理学特征及分子标记的关系Tab 1 Association of stromal Cav-1 expression with pathological and molecular markers n(%)
2.2 间质Cav-1与乳腺癌分子亚型的关系
58例三阴型乳腺癌,28例(48.3%)Cav-1的表达缺失,18例(31.0%)为中度表达,12例(20.7%)为强阳性表达,与A型、B型、HER-2型相比,三阴型乳腺癌间质中Cav-1的表达明显降低(P均<0.05),而A型、B型、HER-2型之间Cav-1的表达无明显差异。见表2。

表2 Cav-1的表达与乳腺癌分子亚型的关系
2.3 三阴型乳腺癌Cav-1的表达与生存率的关系
Kaplan-Meier生存曲线分析显示三阴型乳腺癌间质中Cav-1(-)、Cav-1(+)、Cav-1(++)三组比较,Cav-1(-)组生存率(无论是无病生存率还是总生存率)最低,Cav-1(+)组生存率次之,Cav-1(++)组生存率最高,三组之间差异有显著性(P<0.05),见图2~3。Cox风险回归模型多因素相关分析也显示间质细胞Cav-1的表达缺失是三阴型乳腺癌预后差的独立预后指标(HR=1.583, 95%CI=1.031-2.431,P= 0.036)。
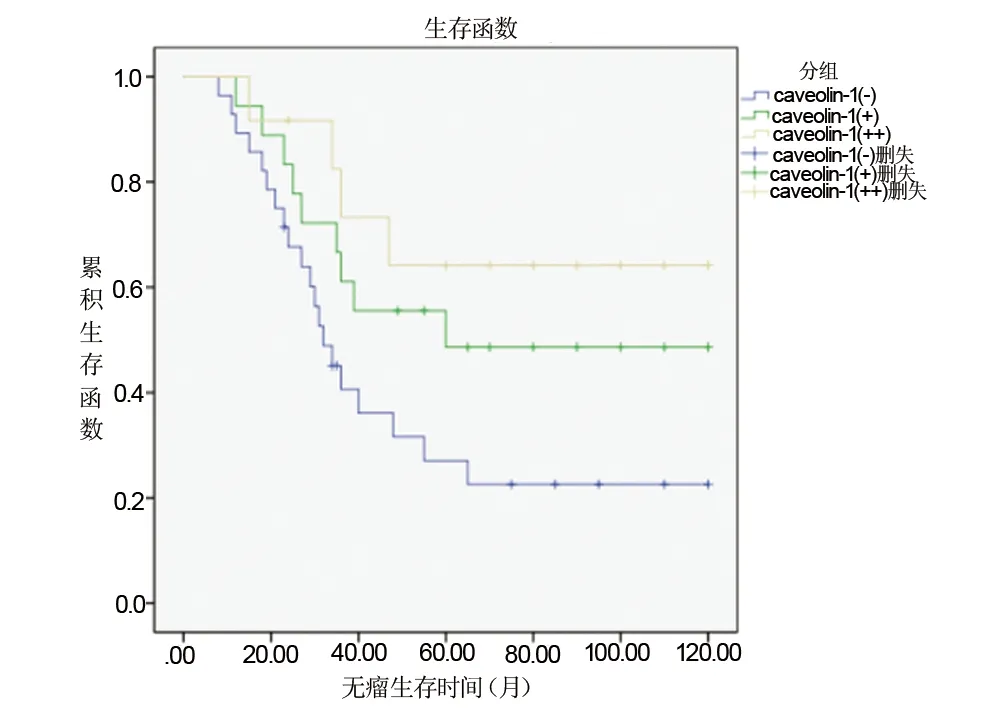
图2 三阴型乳腺癌间质中caveolin-1不同表达水平患者的无瘤生存曲线Fig 2 Kaplan-Meier analysis of stromal Cav-1 levels predicts progression free survival in triple negative breast cancer patients
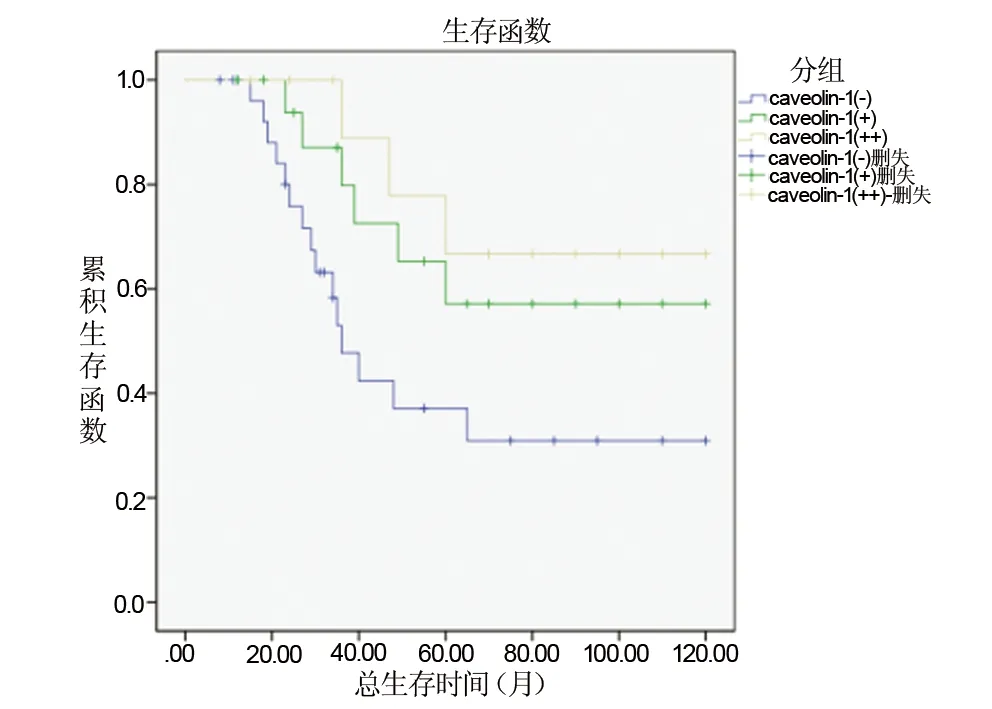
图3 三阴型乳腺癌间质中caveolin-1不同表达水平患者的总生存曲线Fig 3 Kaplan-Meier analysis of stromal Cav-1 levels predicts overall survival in triple negative breast cancer patients
3 讨 论
肿瘤细胞不是独立生存的,而是被周围复杂的微环境所包绕。 微环境内的成纤维细胞(CAFs)与肿瘤微环境中的其他成分相互作用,在肿瘤的发生、发展过程中具有重要作用[4]。乳腺癌作为高度异质性的肿瘤,其生物学行为与微环境内CAFs的关系受到极大关注。Cav-1是一种跨膜转运和负性调控蛋白,在CAFs中的含量相当丰富,已经成为乳腺癌的研究热点。早期的研究报道Cav-1在乳腺癌组织中的表达相对于正常乳腺组织中的表达下调,新的研究发现,Cav-1可以作为CAFs的标记物,并且乳腺癌间质CAFs内Cav-1的表达比肿瘤上皮中Cav-1的表达更有意义[5-7]。
本研究中,我们回顾性地分析了258例乳腺癌患者的手术切除标本中Cav-1在间质中的表达与临床病理学特征及分子标记的关系,结果发现Cav-1的表达与乳腺癌T分期与淋巴结转移有关。在T1、T2与T3~T4三组中,T1组表达水平最高,T3~T4组表达水平最低;伴淋巴结转移的病例Cav-1的表达水平比无淋巴结转移的病例低,差异均具有统计学意义。有研究表明间质Cav-1的表达状态与肿瘤的进展有关,但是并没有明确提出它在肿瘤间质CAFs上的表达可以作为预后的标志物。对于间质Cav-1在乳腺癌中的研究有一些报道,本实验通过对乳腺癌间质Cav-1的表达状态及与临床病理学特征的相关性和肿瘤患者预后的关系进行分析,结果显示:间质CAFs上Cav-1的表达缺失乳腺癌的淋巴结转移及肿瘤大小分期有关。Witkiewicz等[6]曾报道Cav-1在乳腺癌间质CAFs的表达缺失与高的肿瘤大小分期及高的淋巴结转移分期相关,Savage等[8]也同样证实了Cav-1在乳腺癌间质的表达与转移淋巴结数呈负相关,我们的结果与之相同。Cav-1的表达与病理分级、ER、PR和HER-2的状态以及p53、肿瘤细胞增殖指数无关,此结果与 Witkiewicz的研究结论相一致。Agnieszka[9]等发现三阴型乳腺癌间质中Cav-1表达缺失与不良的预后相关,本研究中我们也有类似的发现。258例乳腺癌中,三阴型乳腺癌(58例)的Cav-1的表达水平较低,58例三阴型乳腺癌中28例(48.3%)表达缺失,而Lumina A型、Lumina B型、HER-2型表达缺失分别有20.0%、26.5%和22.6%,这三组之间没有明显区别。进一步对58例三阴型乳腺癌间质Cav-1的表达不同进行生存分析,Kaplan-Meier生存曲线分析显示三阴型乳腺癌间质中Cav-1的表达水平与患者无病生存率和总生存率均密切相关,Cav-1(-)、Cav-1(+)、Cav-1(++)三组比较,Cav-1(-)组(无论是无病生存率还是总生存)最低,Cav-1(+)组生存率次之,Cav-1(++)组生存率最高,三组之间差异有显著性,多因素相关分析也显示间质细胞Cav-1的表达缺失是三阴型乳腺癌预后差的独立预后指标。
综上所述,Cav-1随着临床分期的增高其表达水平降低,三阴型乳腺癌间质中Cav-1的低表达与预后差密切相关。因此可以利用间质Cav-1的表达对这些病人进行疾病预后的风险分层。间质Cav-1表达缺失的高肿瘤复发风险人群可以考虑采取更为积极的早期治疗干预。乳腺癌间质CAF中Cav-1差异性表达的原因,以及可否作为其它类型乳腺癌的预后指标,还需要进一步的研究。
[1] Witkiewicz AK, Casimiro MC, Dasgupta A, et al. Towards a new "stromal-based" classification system for human breast cancer prognosis and therapy[J]. Cell Cycle, 2009, 8(11): 1654-1658.
[2] Shan-Wei W, Kan-Lun X, Shu-Qin R, et al. Overexpression of caveolin-1 in cancer-associated fibroblasts predicts good outcome in breast cancer[J]. Breast Care (Basel), 2012, 7(6): 477-483.
[3] Prat A, Lluch A, Albanell J, et al. Predicting response and survival in chemotherapy-treated triple-negative breast cancer[J]. Br J Cancer, 2014, 111(8): 1532-1541.
[4] Ren M, Liu F, Zhu Y, et al. Absence of caveolin-1 expression in carcinoma-associated fibroblasts of invasive micropapillary carcinoma of the breast predicts poor patient outcome[J]. Virchows Arch, 2014, 465(3): 291-298.
[5] Vargas AC, McCart Reed AE, Waddell N, et al. Gene expression profiling of tumour epithelial and stromal compartments during breast cancer progression[J]. Breast Cancer Res Treat, 2012, 135(1): 153-165.
[6] Witkiewicz AK, Dasgupta A, Nguyen KH, et al. Stromal caveolin-1 levels predict early DCIS progression to invasive breast cancer[J]. Cancer Biol Ther, 2009, 8(11): 1071-1079.
[7] El-Gendi SM, Mostafa MF, El-Gendi AM. Stromal caveolin-1 expression in breast carcinoma. Correlation with early tumor recurrence and clinical outcome[J]. Pathol Oncol Res, 2012, 18(2): 459-469.
[8] Savage K, Lambros MBK, Robertson D, et al. Caveolin 1 Is Overexpressed and Amplified in a Subset of Basal-like and Metaplastic Breast Carcinomas: A Morphologic, Ultrastructural, Immunohistochemical, and In situ Hybridization Analysis[J]. Clin Cancer Res, 2007, 13(1): 90-101.
[9] Witkiewicz AK, Dasgupta A, Sammons S, et al. Loss of stromal caveolin-1 expression predicts poor clinical outcome in triple negative and basal-like breast cancers[J]. Cancer Biol Ther, 2010, 10(2): 135-143.
Expression of caveolin-1 in cancer-associated fibroblasts as a prognostic indicator in breast cancer
LI Jianhua1, LYU Weipeng1, ZHU Ruiping1, CAO Mingqian2
(1.DepartmentofPathology,ZhongshanAffiliatedHospitalofDalianUniversity,Dalian116001,China; 2.DepartmentofBreastSurgery,ZhongshanAffiliatedHospitalofDalianUniversity,Dalian116001,China)
Objective To investigate the stromal caveolin-1(Cav-1) expression and its association with clinicalpathologic parameters, molecular subtypes of breast cancer and its prognostic significance. Methods Cav-1 expression was detected in the stroma of 258 breast cancer patients with at least 10 years of follow-up in IHC. Three groups were divided according to the staining strength (weak- , moderate+ and strong ++). Differential expression was analyzed in the light of clinical stage, pathology grade, lymphatic metastasis and the expression of molecular markers (ER,PR,HER-2,P53 and PCNA ). Further analysis was performed in Luminal A, Luminal B, HER-2 and triple negative subtypes of breast cancer. Results Overexpression of stromal Cav-1 in breast cancer was associated with early stage(P=0.014) and no lymph node metastasis(P=0.011).The expression had no relationship with histological grade,ER status,PR status,HER-2 status, p53 status and PCNA status. Stromal Cav-1 expression in TN breast cancer was significantly lower than that in Luminal A, Luminal B, HER-2 molecular subtypes (P=0.014,0.035 and 0.047 respictively). Furthermore, stromal expression of Cav-1 was significantly correlated with the progression-free survival(P=0.033) and overall survival rate(P=0.031). Conclusion The absence or reduction of Cav-1 expression in stromal CAFs of invasive breast cancer would predict the poor prognostic outcome. Stromal Cav-1 expression would become a prognostic indicator.
Caveolin-1; breast cancer;cancer-associated fibroblast;prognostic outcome
10.11724/jdmu.2017.02.06
李建华(1967-),女,主任医师。E-mail: lijianhua_ljh@126.com
R737.9
A
1671-7295(2017)02-0132-05
李建华,吕伟鹏,朱瑞萍,等.Caveolin-1在乳腺癌间质中的表达及与预后的关系[J].大连医科大学学报,2017,39(2):132-136.
2017-03-01;
2017-03-27)
