β-葡萄糖醛酸苷酶的重组表达及对黄芩苷的生物转化
2017-04-26窦同意丁乐乐曲明佳翁仔淼吴大畅
周 琪,窦同意,丁乐乐,曲明佳,翁仔淼,吴大畅,侯 洁
(1. 大连医科大学 生物技术系, 辽宁 大连 116044;2. 中国科学院大连化学物理研究所 生物技术部 药用资源开发组, 辽宁 大连 116023)
论 著
β-葡萄糖醛酸苷酶的重组表达及对黄芩苷的生物转化
周 琪1,窦同意2,丁乐乐1,曲明佳1,翁仔淼1,吴大畅1,侯 洁1
(1. 大连医科大学 生物技术系, 辽宁 大连 116044;2. 中国科学院大连化学物理研究所 生物技术部 药用资源开发组, 辽宁 大连 116023)
目的 构建表达β-葡萄糖醛酸苷酶(β-glucuronidase,GUS)的重组菌株,得到高纯度β-葡萄糖醛酸酶,进而对黄芩苷进行生物转化获得黄芩素。方法 以E.coliK12基因组DNA为模板,采用PCR方法扩增GUS基因,经酶切后连接到表达载体pET-28a中,获得重组表达载体pET28a-GUS,将重组载体转化到感受态细胞BL21(DE3)中,对所得基因工程菌进行培养条件和表达条件的优化;后经分离纯化后得到高纯度β-葡萄糖醛酸酶。以黄芩苷为底物进行酶法转化生产黄芩素,并对反应条件进行优化。结果 经测序,扩增的重组质粒目的基因序列与数据库中GUS基因序列一致。经IPTG(isopropy-β-D-thiogalactoside)诱导表达后, SDS-PAGE分析获得分子质量70 kDa的单一蛋白条带,工程菌最适培养条件为: 37 ℃、pH7.2、IPTG浓度0.6 μmol/L、诱导时间12 h。经过离心破碎、亲和层析、冻干后得到高纯度β-葡萄糖醛酸酶冻干粉。在该酶催化转化下,黄芩苷可转化为黄芩素,在40 ℃,pH 6.5,酶浓度60 μg/mL条件下,反应2.5 h,黄芩苷转化率可达72.5%。结论 成功构建了β-葡萄糖醛酸苷酶高表达菌株,并用于黄芩苷的定向水解制备黄芩素,为生物转化法生产黄芩素提供了新思路。
黄芩素;酶解;黄芩苷;β-葡萄糖醛酸苷酶
黄芩是传统中药,为唇形科植物黄芩ScutellariabaicalensisGeorgi的干燥根,具有抗菌,抗炎,抗病毒、抗肿瘤等作用[1-2]。黄芩中含有多种黄酮类化合物:黄芩苷、黄芩素、汉黄芩苷、汉黄芩素等20余种成分[1-3]。其中,黄芩苷经口服进入肠道后,在肠道内经肠道菌水解为黄芩素被吸收入血,进而发挥作用[4-5]。临床药效实验证明,黄芩素比黄芩苷具有更强的生理活性[1,6]。目前,黄芩素的制备方法主要有以下3种:(1)从药材黄芩中分离提取;(2)水解黄芩苷制备黄芩素;(3)黄芩苷生物转化制备黄芩素[7-8]。在黄芩中,黄芩素含量低(一般在0.1%~0.5%之间),直接提取分离收率很低。采用生物转化法生产黄芩素反应温和,易于控制,且无环境污染[9]。目前,国内已报道多种微生物用于黄芩素的生物制备,如黑曲霉[8]、人肠道菌[4]、白腐真菌[10]、米曲霉[11]等。由于黄芩苷为β-葡萄糖醛酸苷,苷元为黄芩素。在β-葡萄糖醛酸酶的催化作用下,黄芩苷可定向水解为黄芩素(图1)。因此,本实验提出酶法生物转化黄芩苷制备黄芩素,首先对β-葡萄糖醛酸苷酶基因进行克隆,并构建β-葡萄糖醛酸苷酶基因工程菌,通过发酵生产获得高纯度β-葡萄糖醛酸苷酶。在此基础上,建立β-葡萄糖醛酸苷酶催化体系,对黄芩苷进行生物转化制备黄芩素。
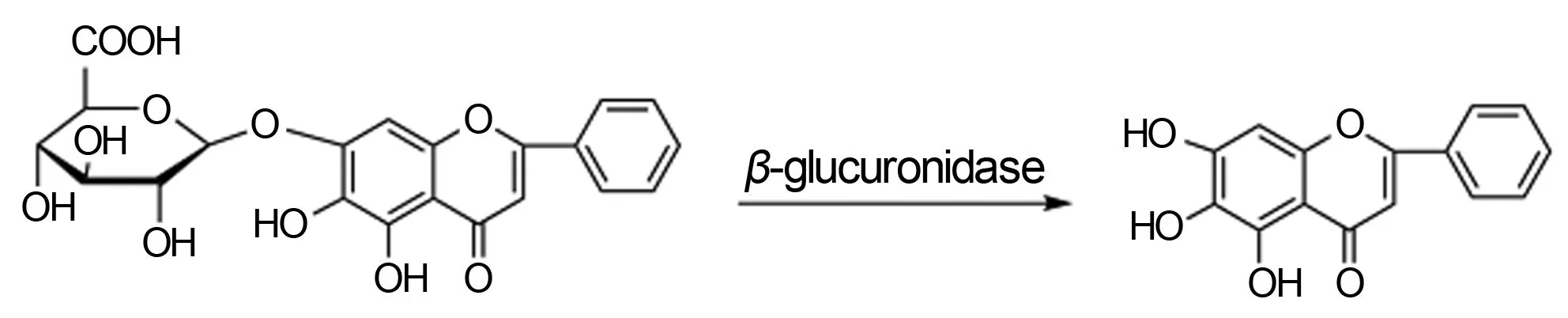
图1 黄芩苷生物转化过程Fig 1 Biotransformation of baicalin to baicalein
1 材料和方法
1.1 材料与仪器
大肠杆菌E.coliK12菌株、质粒载体pET-28a(+)、表达菌株感受态细胞JM109、BL21(DE3)、DNA Polymerase(Code No.R045A)、Nde I和Xho I限制性内切酶、DNA纯化试剂盒、5×In-Fusion HD Enzyme Premix均购自大连Takara公司。LB培养基琼脂、异丙基硫代半乳糖苷(IPTG)、苯甲基磺酰氟(PMSF, Phenylmethanesulfonyl fluoride)、对硝基酚-β-葡萄糖醛酸苷(PNPG, p-nitrophenyl-β-D-galactopyranoside)等均为国产分析纯。黄芩苷、黄芩素标准品购自成都普菲德生物技术有限公司,其他试剂为分析纯。
电泳仪(Bio-rad),高速冷冻离心机(日本日立公司),超声波细胞粉碎机(JY-96-Ⅱ宁波科生仪器厂),PCR扩增仪(美国Applied Biosystems公司),酶标仪(美国Thermo公司),高效液相色谱仪(日本岛津公司)。
1.2 方 法
1.2.1 GUS基因PCR扩增
根据NCBI数据库查找E.coliK12 GUS基因序列,并根据基因序列设计引物对将大肠杆菌E.coliK12株菌体于50 μL 裂解液(TaKaRa Lysis Buffer for Microorganism to Direct PCR(Code No.9164))中变性后离心取上清作为模版,扩增GUS基因,反应体系:DNA模板1 μL,2×PrimeSTAR Max Premix: 25 μL,P1 (20 pmol/μL) 1 μL,P2 (20 pmol/μL) 1 μL,ddH2O 20 μL。反应条件:94 ℃变性10 s,55 ℃复性15 s,72 ℃延伸10 s,35个循环。琼脂糖凝胶电泳检测并回收PCR产物。
引物: P1,5'-GGTGCCGCGCGGCAGCCATATG-TTACGTCCTGTAGAA-3',P2,5'-GGATCTCAGTGGTGGTGGTGGTGGTGCTCGAGTCATTGTTTGCCTCC-3',划线部分分别为Nde I和Xho I酶切位点。
1.2.2 构建重组质粒pET-28a-GUS
使用限制酶Nde I和Xho I对pET-28a(+)质粒进行酶切,反应体系如下:pET-28a(+)30 μL,10×H Buffer 5 μL,Nde I(10 U/μL)2.5 uL,Xho I(10 U/μL)2.5 μL,用ddH2O 补至总体积为50 μL,反应条件37 ℃,16 h。反应结束后取5 μL进行琼脂糖凝胶电泳。
将PCR产物和质粒进行连接反应制备重组表达载体pET-28a-GUS。反应体系:质粒 5 μL,PCR产物 (50 ng/μL ) 2 μL,5×In-Fusion HD Enzyme Premix 2 μL,用ddH2O将体积补至10 μL。连接反应条件:50 ℃,15 min。取连接产物1 μL热转化至E.coliCompetent Cell JM109(Code No.9052)中,涂布平板,37 ℃过夜培养,挑取阳性克隆植菌,提取质粒后对其进行测序。
1.2.3 重组β-葡萄糖醛酸苷酶在大肠杆菌中的表达
经证实,质粒测序结果与参考序列完全一致后,取该质粒1 μL热转化至BL21(DE3)菌株中,涂布平板,37 ℃过夜培养,挑取阳性克隆菌即为重组基因工程菌。在划线平板上选取阳性重组子放入5 mL LB液体培养基中,于37 ℃、120 r/min振荡培养过夜;按1%接种量转接到含有卡那霉素(50 μg/mL)的LB培养基中,于37 ℃ 振荡培养至对数中期(OD600=0.6~0.8)时,加入IPTG至终浓度1 μmol/L,继续在37 ℃ 摇床振荡培养,诱导过夜,取出1 mL培养物,进行SDS-PAGE电泳分析及酶活力测定,选取酶活力及表达量最高的发酵条件进行后续实验。
1.2.4 β-葡萄糖醛酸酶的分离纯化
诱导培养结束后,取菌液于5000×g条件下离心15 min,弃上清,用PBS(pH 7.4)对沉淀进行重悬,加入PMSF(终浓度0.1 mmol/L)后于冰浴条件下超声破碎1 h。随后在20000×g、4 ℃条件下离心20 min,所得上清即含有目的蛋白。
使用Ni亲和层析柱对目的蛋白进行亲和层析,目的蛋白将随洗脱液一起流下。收集洗脱液于透析袋中,在水中透析2次,每次1~2 h,随后透析过夜即可,透析结束后透析袋中的蛋白会有所析出而使袋内液体呈现白色。收集透析后液体于离心管中,于-80 ℃冰箱放置过夜,随后至冻干机冷冻干燥,即得到高纯度β-葡萄糖醛酸酶冻干粉。
1.2.5 酶活力的测定
取10 μL PNPG(20 mmol/L)的PBS溶液,加入5 μL的酶溶液(10 μg/mL),补充85 μL的PBS缓冲液,混匀后,在37 ℃条件下连续测定反应液在405 nm条件下的OD变化值,将在37 ℃,pH 7.4条件下,每分钟形成1 μmol pNP所需要的酶量定义为一个酶活力单位(U)。
1.2.6 黄芩苷转化分析方法的建立
参照文献[4]方法,测定转化液中黄芩苷水解产物黄芩素的含量。黄芩素的测定选用紫外吸光光度法。黄芩素结构中A环上有5,6,7三羟基结构,经测定黄芩素在紫外光区355 nm处有最大吸收,可通过其吸光度值来测定黄芩素生成量。以DMSO为溶剂,配制10 mmol/L 的黄芩素标准品溶液,用PBS分别稀释到20、40、60、80、100、120、160 和200 μmol/L,然后利用酶标仪在355 nm处检测其吸光度值,以吸光度对溶液浓度作黄芩素的标准曲线。
1.2.7 黄芩苷的生物转化
取200 μmol/L的黄芩苷溶液10 μL,加入10 μL的酶溶液,补充PBS缓冲液至100 μL,混匀后,在37℃下孵育一定时间后,向反应液中加入等体积的乙醇终止反应,反应体系经高速(20000×g)离心后取上清液用甲醇稀释后备用。以PBS为空白参照,测定离心上清液中黄芩素的吸光度值,根据黄芩素标准曲线,计算黄芩素的生成量。
1.2.8 反应条件的优化及确定
对以下6个因素:pH、接种比、培养时间、IPTG浓度、诱导时间和诱导温度(表1),使用minitab 17 软件的实验设计部件对蛋白表达的最适条件进行实验设计和探究,得出因子回归方程。对不同诱导时间点的总酶活力、细菌密度和总蛋白浓度进行测定,探究诱导时间与总酶活力之间的关系。
按照表2中的试验因素和水平进行正交设计。选择L9(34)正交表作为实验方案(表3)进行条件优化。通过单因素实验确定正交试验的设计范围,优化黄芩甘苷转化反应条件,并进行正交试验。

表2 实验因素和水平Tab 2 Factors and levels in orthogonal array design for reaction optimization

表3 正交试验优化方案Tab 3 Orthogonal assay for reaction optimization
2 结 果
2.1 β-葡萄糖醛酸酶的重组表达
2.1.1 GUS基因的克隆与序列分析
琼脂糖凝胶电泳产物的分子量约为1.8 kb(图 2),扩增目的基因序列与数据库中GUS基因(GenBank accession no: NC_000913.3)序列一致。

图2 GUS基因的PCR扩增结果Fig 2 PCR amplification of GUS gene
2.1.2 重组蛋白的诱导表达纯化
将重组菌株诱导表达前后的粗酶提取物(未经纯化的β-葡萄糖醛酸酶,含杂质)进行SDS-PAGE分析(图3a),结果表明,与诱导前相比,经IPTG诱导后酶的表达量明显提高,且分布于细胞裂解液中(图3a,条带3)。经镍亲和色谱进一步纯化后得到蛋白,并进行SDS-PAGE分析,结果表明蛋白条带清晰单一,大小约为70 kDa,与目标蛋白相符,且纯度较高(图3b)。
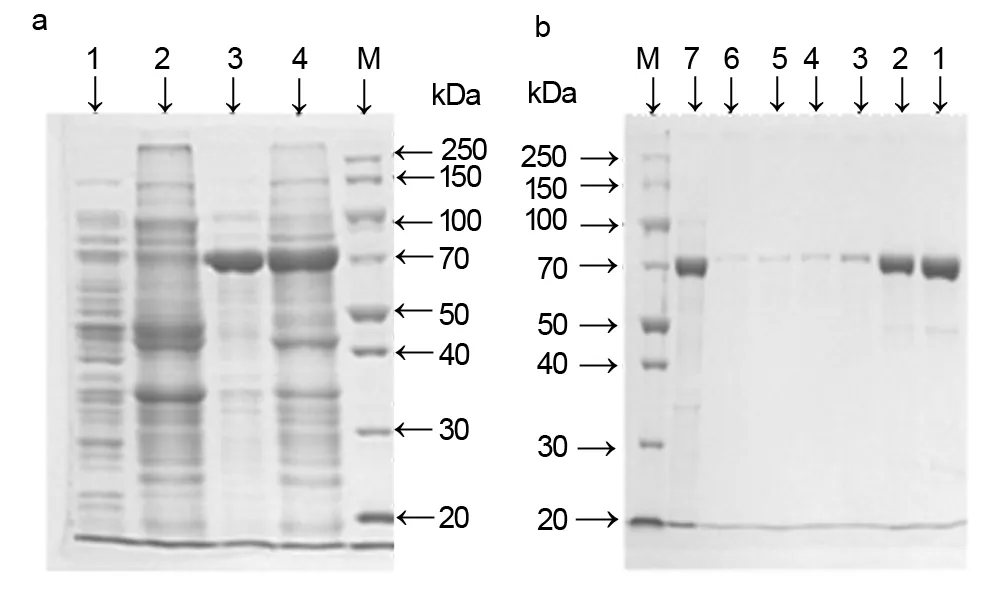
a:1和2条带分别为未诱导细胞裂解液的上清和沉淀;3和4条带分别为诱导细胞裂解液的上清和沉淀。b:1~6条带为依次被洗脱下的后β-葡萄糖醛酸苷酶,7条带为纯化前的粗酶液。 M 均为蛋白marker 图3 裂解细胞和β-葡萄糖醛酸苷酶纯化酶的SDS-PAGE分析Fig 3 SDS-PAGE analyze of lysis cell and β-glucuronidase
2.1.3 诱导条件的优化
使用minitab 17软件对实验结果进行分析,条件1~8(表1)诱导的粗酶液总酶活力分别为471.4 U,2988 U,2177.1 U,2338.2 U,1256.3 U,1028.5 U,2948.5 U,1332 U,可知诱导时间是粗酶液总酶活力的显著性影响因素(图4a)。对实验结果进行回归分析,其因子回归方程如下:酶液活力(U)=-10393+1170A+104.2B+60.42C+594.6D+397.7E+300.1F-37.27A*F。其中A: pH; B: 接种比(mL); C: 培养时间 (h); D: IPTG 浓度 (μmol/L); E: 诱导时间 (h); F: 诱导温度 (℃)。
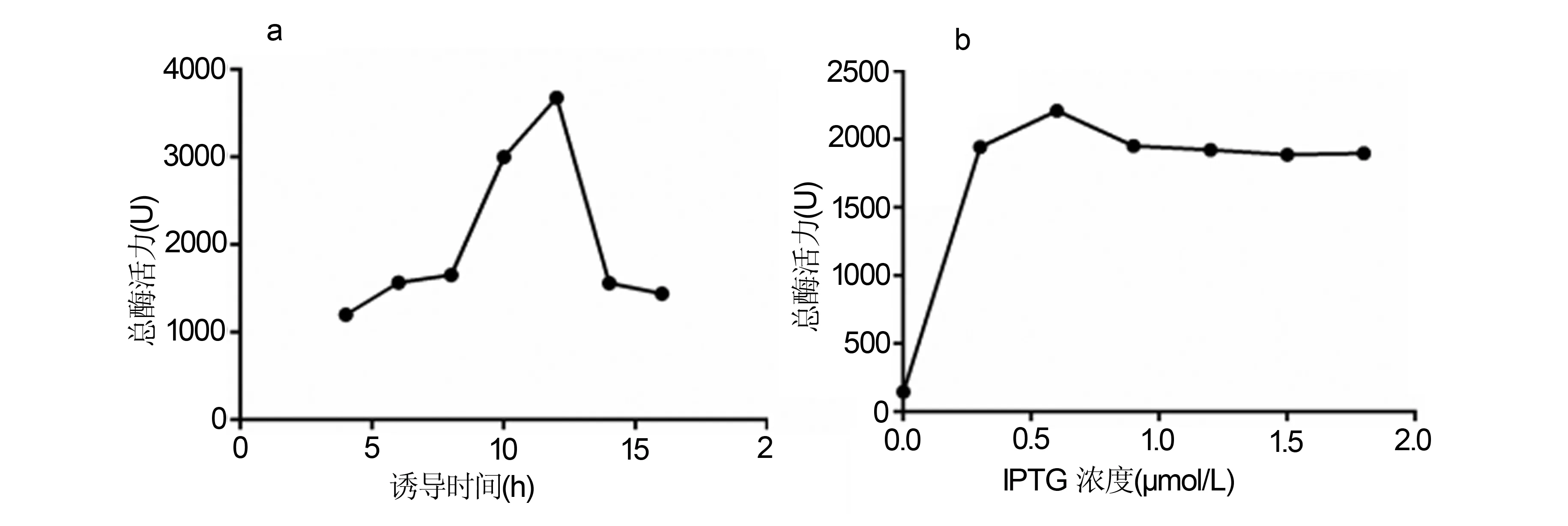
a:诱导时间对总酶活力的影响;b:IPTG浓度对总酶活力影响图4 诱导时间和IPTG浓度对总酶活力的影响Fig 4 Effect of induction time and IPTG concentration on the total enzyme activity
2.1.4 诱导表达条件的确定
当诱导时间为8 h时蛋白浓度达到最高,而诱导时间为12 h时总酶活力达到最高(图5a和b),并且此时菌处于稳定期生长。因此,β-葡萄糖醛酸苷酶表达的最适条件为37 ℃、pH 7.2、0.6 μmol/L IPTG诱导12 h,在此条件下可以从1 L培养液中获得320 mg高纯度β-葡萄糖醛酸酶冻干粉纯酶。
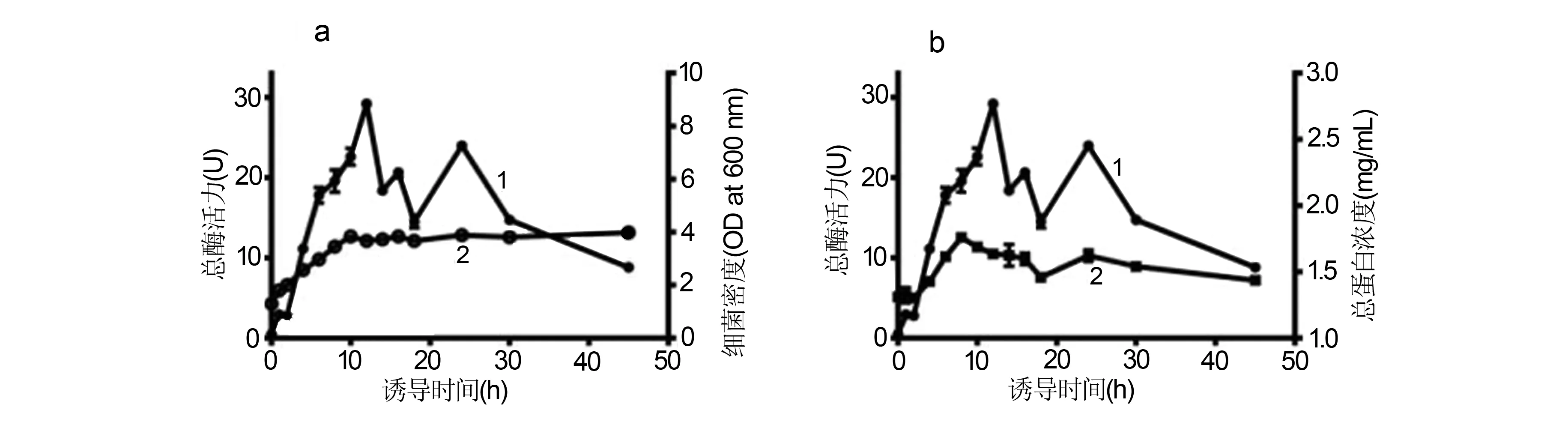
a:诱导时间对总酶活力及细菌密度的影响,1为总酶活力,2为细菌密度;b:诱导时间对总酶活力及总蛋白浓度的影响,1为总酶活力,2为总蛋白浓度图5 诱导时间对蛋白表达及酶活力的影响Fig 5 Effect of the induction time on the protein expreesion and enzyme activity
2.2 黄芩苷的生物转化
2.2.1 黄芩苷转化分析方法的建立
对黄芩素和黄芩苷进行了吸收波长波谱扫描,黄芩素最大吸收峰出现在355 nm处(图6a),而在相同情况下黄芩苷几乎没有吸收(图6b)。利用酶标仪检测355 nm处吸光度值,并以吸光度对溶液浓度作黄芩素的标准曲线,以进行反应体系中黄芩素的定量检测。

a:黄芩素和黄芩苷吸收波长波谱;b:黄芩素的标准曲线图6 黄芩素检测方法的建立Fig 6 Analysis method for the biotransformation
2.2.2 优化转化反应条件
正交试验结果可以看出,采用A3B3C3方案确定底物转化效率最高的反应条件。即在底物浓度为200 μmol/L,pH为6.5,酶浓度为60 μg/mL,反应温度为40 ℃时,经过2.5 h的孵育后黄芩苷的转化率最高,可达72.5%。见表4。
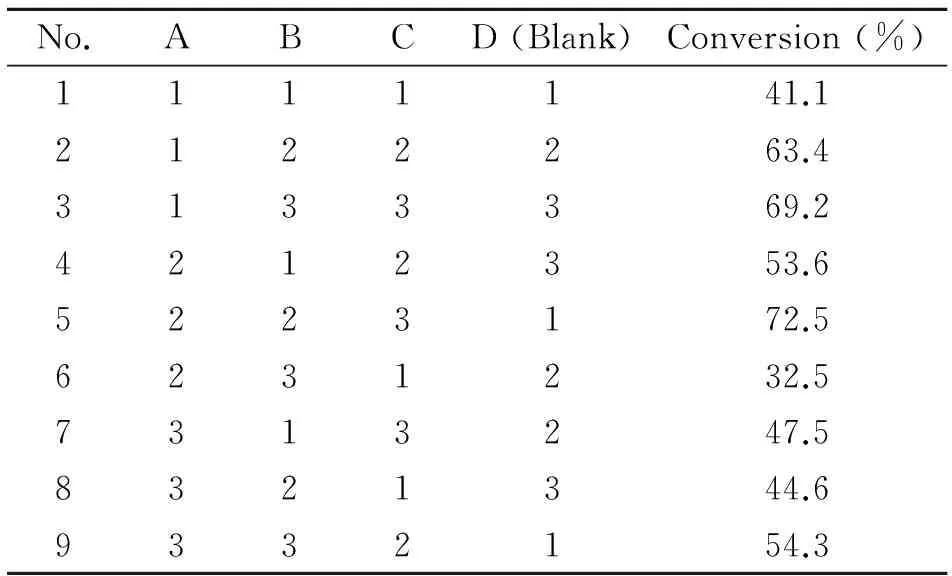
表4 黄芩苷转化条件的优化Tab 4 Condition optimization of the baicalin biotransformation to baicalein
3 讨 论
生物转化是一种高效和具有选择性的温和催化体系,酶及酶体系能将许多天然化合物转化为具有高生物活性物质。酶法生物转化黄芩苷制备黄芩素,可以获得更高效、更稳定的活性物质。黄芩苷结构中包含黄芩素苷元和1个分子葡萄糖醛酸,利用β-葡萄糖醛酸苷酶或产酶菌可对黄芩苷进行生物转化,得到黄芩素。β-葡萄糖醛酸苷酶是一种酸性水解酶,黑曲霉[8]、人肠道菌E.coli[4]、白腐真菌[10]、米曲霉均可作为野生型产酶菌,在发酵过程中将黄芩苷作为底物,对其催化水解。然而微生物发酵过程中,发酵液成分复杂,分离纯化困难,往往收率较低。通过对β-葡萄糖醛酸苷酶基因进行克隆制备得到高效产酶菌,进而获得高纯度酶粉,对黄芩苷进行酶催化水解,体系稳定且有利于黄芩素的分离提取。
鉴于β-葡萄糖醛酸苷酶在野生E.coli中高度表达,本研究通过对野生型E.coliK12中的β-葡萄糖醛酸苷酶基因进行克隆表达,使用pET-28a(+)作为质粒载体,最终将其转入BL21(DE3)宿主菌种,构建了基因工程菌。通过对比发酵后,野生型及工程菌中发酵液及破碎后菌体中的蛋白成分,发现野生型发酵液及裂解液中,蛋白成分均比较复杂,将为β-葡萄糖醛酸苷酶的纯化带来困难;而工程菌细胞裂解液中,β-葡萄糖醛酸苷酶为单一蛋白成分,有利于蛋白的进一步分离纯化。使用镍柱亲和层析对酶进行纯化,得到高纯度的冻干酶粉。以上结果说明通过基因克隆及诱导表达,获得了目标单酶。
工程菌发酵过程中,蛋白在诱导早期迅速积累并容易形成结构折叠错误、无功能的蛋白,而在诱导后期由于营养缺乏使菌体处于应激状态,结构折叠错误的蛋白进行重新折叠形成结构正确、功能完整的蛋白[12]。因此,为了探究诱导时间与总酶活力之间的关系,对不同诱导时间的总酶活力、细菌密度和总蛋白浓度进行了考察。通过实验发现产β-葡萄糖醛酸苷酶最适条件为37 ℃、pH 7.2、0.6 μmol//L IPTG诱导12 h,在此条件下可以从1 L培养液中获得320 mg纯酶。
将上述分离得到的β-葡萄糖醛酸苷酶用于黄芩苷的催化水解中,得到黄芩素。通过前期对单一条件实验确定正交试验的设计范围,采用A3B3C3方案对反应进行优化。最终确定底物浓度为200 μmol/L,pH为6.5,酶浓度为60 μg/mL,反应温度为40 ℃时,经过2.5 h的孵育后黄芩苷的转化率最高,可达72.5%。在3种因素中,温度对反应转化率影响最大,pH影响较小,而酶浓度的增加有利于转化率的提高。由于产物黄芩素本身对酶活性可能存在一定的抑制关系,延长反应时间并不能明显提高黄芩苷的转化率。在前期工作中,我们利用C18WAX固相萃取柱可以实现葡萄糖醛酸苷和苷元的快速分离,由于黄芩苷与黄芩素两者存在类似的结构差异[13],因此,可以利用此方法进行分离纯化产物黄芩素,在后续研究中将体系中黄芩素的分离提纯进行优化,为黄芩素的生物制备提供条件。
本研究成功构建了表达β-葡萄糖醛酸苷酶的高产菌株,并得到高纯度β-葡萄糖醛酸苷酶,成功对黄芩苷进行催化水解获得黄芩素,并建立了利用β-葡萄糖醛酸苷酶对黄芩苷进行生物转化的方法。本方法成本低、对环境无污染,为生物转化黄芩苷制备黄芩素提供了新的思路。
[1] 辛文妤, 宋俊科, 何国荣, 等. 黄芩素和黄芩苷的药理作用及机制研究进展 [J]. 中国新药杂志, 2013, 22(6): 647-659.
[2] Chen J, Li Z, Chen AY. Inhibitory effect of baicalin and baicalein on ovarian cancer cells [J]. Int J Mol Sci, 2013, 14(3): 6012-6025.
[3] 马文转, 王金玲, 屠鹏飞. 黄芩苷纳米胶束的制备、表征及其对MCF-7细胞抑制作用的研究 [J]. 中草药, 2015, 46(4): 507-512.
[4] 刘伶文, 司磊,任树勇,等. 人肠道菌对黄芩苷的生物转化 [J]. 天然产物研究与开发, 2012, 24: 1437-1440, 1392.
[5] Muto R, Motozuka T, Nakano M, et al. The chemical structure of new substance as the metabolite of baicalin and time profiles for the plasma concentration after oral administration of sho-saiko-to in human [J]. Yakugaku Zasshi, 1998, 118(3): 79-87.
[6] Noh K, Kang Y, Nepal MR, et al. Role of intestinal microbiota in baicalin-induced drug interaction and its pharmacokinetics [J]. Molecules, 2016, 21(3): 337.
[7] 于蓓蓓, 吕凌, 于宗渊, 等. 基于抑菌药效的黄芩提取物精制工艺优选[J]. 中草药, 2014, 45(3): 362-366.
[8] 薛慧玲, 徐萌萌, 阳泰, 等. 黄芩苷微生物发酵产物的分离提取[J]. 天然产物分离, 2005, 3(5): 5-7.
[9] 冯冰, 马白平. 天然产物的生物转化研究进展[J]. 中草药, 2005,36(6): 941-945.
[10] 杨希, 刘伶文, 王璐倩, 等. 白腐真菌转化黄芩苷生成黄芩素的研究[J]. 西安工程大学学报, 2015(1): 57-61.
[11] 贺美, 邱德全, 柏仕杰. 米曲霉两步活化法对黄芩苷的生物转化及转化产物的纯化与鉴定[J]. 广东海洋大学学报, 2007, 27(6): 41-44.
[12] Villaverde A, Carrió MM. Protein aggregation in recombinant bacteria: biological role of inclusion bodies [J]. Biotechnol Lett, 2003, 25(17), 1385-1395.
[13] 杨刚, 朱亮亮, 吕侠, 等. 双酚A葡萄糖醛酸苷的高效制备[J]. 高等学校化学学报, 2014, 35(2): 314-318.
Bioconversion of baicalin to baicalein with recombinantβ-glucuronidase in Escherichia coli
ZHOU Qi1, DOU Tongyi2, DING Lele1, QU Mingjia1, WENG Zimiao1, WU Dachang1, HOU Jie1
(1.DepartmentofBiotechnology,DalianMedicalUniversity,Dalian116044,China; 2.DalianInstituteofChemicalPhysics,ChineseAcademyofSciences,Dalian116023,China)
Objective To develop a novel and environmental-friendly method for bioconversion of baicalin to baicalein with recombinantβ-glucuronidase. Methods Theβ-glucuronidase encoding gene (GUS) was cloned fromEscherichiacoliwild strain K12, and transformed intoEscherichiacoliBL21 (DE3) with pET-28a (+) as the vector.β-Glucuronidase was overexpressed and then purified by Ni affinity chromatography in one step. The biotransformation of baicalin to baicalein was performed by the recombinantβ-glucuronidase, and the reaction conditions were optimization with orthogonal design. Results The protein was identified by SDS-PAGE with 70 kDa, and the maximum expression level could be achieved after induction for 12 h with 0.6 μmol/L IPTG, and 320 mg of purified enzyme, which could be obtained from one liter of bacterial culture. With the catalysis of the recombinantβ-glucuronidase, the baicalin was transformed to baicalein with 72.5% conversion ratio under optimized conditions. Conclusion A novel and environmental-friendly scheme for bioconversion of baicalin to baicalein with recombinantβ-glucuronidase was established. The method would hold great promise for further applications in both scientific research and biomedical industry.
baicalein;biosynthesis; baicalin;β-glucuronidase
10.11724/jdmu.2017.02.02
国家自然科学基金项目(81273590,81302793);精细化工国家重点实验室开放课题(KF1408)
周 琪(1988-),女,助理实验师。E-mail: zhouqi@dmu.edu.cn
侯 洁,副教授。E-mail: houjie@nankai.edu.cn
Q819; R284.3
A
1671-7295(2017)02-0110-06
周琪,窦同意,丁乐乐,等.β-葡萄糖醛酸苷酶的重组表达及对黄芩苷的生物转化[J].大连医科大学学报,2017,39(2):110-115.
2016-12-14;
2017-03-28)
