一种新型的焦磷酸根可视化检测方法
2017-04-26苏荟娟赵旭东张丽樊雯洁王愈聪贾红霞
苏荟娟,赵旭东,张丽,樊雯洁,王愈聪,贾红霞
(河北大学 化学与环境科学学院,河北 保定 071002)
一种新型的焦磷酸根可视化检测方法
苏荟娟,赵旭东,张丽,樊雯洁,王愈聪,贾红霞
(河北大学 化学与环境科学学院,河北 保定 071002)
焦磷酸根(PPi)在生命体系和环境体系中都占有重要的地位,利用Cu2+诱导CdTe量子点产生荧光谱带红移的现象和PPi对铜离子的配位作用,建立了一种新型的PPi可视化检测方法.结果表明,PPi在5~50μmol/L的浓度内可通过CdTe量子点荧光颜色的变化进行可视化检测,其他阴离子对PPi测定均无干扰.此外,利用该方法对焦磷酸酶的活性进行了检测,初步取得了满意的结果,说明本文所建立的方法可以用于PPi相关物质的检测.
焦磷酸根;CdTe量子点;Cu2+;可视化
焦磷酸盐(pyrophosphate,PPi)广泛参与生物体的新陈代谢和能量传递,如细胞内三磷酸腺苷水解[1]和核酸复制等[2-3],在生命过程中起着非常重要的作用.研究发现,PPi的含量跟许多疾病有密切关联,比如癌症[4]、关节炎和动脉中层硬化等[5-6].此外,PPi还广泛应用于日常生产生活中,比如毛纺业、造纸业和食品业等.因此,选择性识别并检测PPi对于生命科学、疾病诊断、食品安全及环境监测等方面都具有重要的意义,该方面的工作成为了近年来的研究热点.
目前,PPi的检测方法主要有酶法[7]、比色法[8]、色谱法[9]和荧光法[3]等,其中荧光法因操作简单和灵敏度高成为了近年来最热门的方法之一.利用荧光法测定PPi主要是基于PPi与Zn2+、Cu2+、Fe3+、Ce3+和Eu3+等特定的金属离子之间的强配位作用引起荧光探针信号的变化而进行的,因此荧光探针的设计非常重要.当前荧光探针的类型主要有3种,包括有机金属离子配合物[10]、荧光共轭聚合物[11]及量子点[12].以有机金属离子配合物作为探针的方法只能在极性有机溶剂中才能够发挥较好的作用,而且在灵敏度和选择性方面,结果并不尽如人意[13-18].荧光共轭聚合物是一类水溶性的聚合物,因其结构特殊而具有荧光放大作用,常用来作为生物检测体系中的传感原件,跟有机金属离子配合物相比,该探针对PPi检测更灵敏,具有更好的选择性,但该探针合成比较复杂,不利于进一步推广使用.量子点是一种半导体的纳米晶体,具有stokes位移大、激发光谱宽、发射光谱窄、荧光量子产率高和生物兼容性好等优点,已被广泛应用于生命科学研究领域[19].目前利用量子点作为荧光探针的PPi检测方法主要是通过金属离子对量子点的猝灭作用及PPi对金属离子的络合从而使量子点荧光恢复进行的,然而众所周知,可以猝灭量子点的金属离子有很多[20-29],而且一些共存基质也会影响量子点的荧光,因此该方法虽然灵敏度较高,但容易受到外界因素的干扰,导致选择性大大降低.
近期本课题组研究建立了一种基于Cu2+被还原为Cu+,进而诱导CdTe量子点(CdTe QDs)荧光谱带红移的Cu2+的可视化检测方法,这种方法不受其他猝灭离子的干扰,在选择性方面具有明显的优势[30].另外有文献报道指出PPi与Cu2+结合之后,可有效阻止Cu2+被还原为Cu+[31].受上述二者的研究成果的启发,提出了一种新型的PPi检测方案.首先,当Cu2+与巯基乙酸修饰的绿色CdTe QDs共存时,由于巯基乙酸的还原作用,Cu2+被还原为Cu+,诱导CdTe QDs产生荧光光谱的红移,同时其荧光颜色由绿色变为红色.当PPi存在时,由于PPi对铜离子的保护作用,抑制了CdTe QDs荧光光谱的红移,同时其荧光颜色为绿色,由此实现了PPi的可视化检测.该方法简单、省时、成本低,不需要大型的仪器即可实现PPi的裸眼检测,为焦磷酸的检测尤其是野外现场作业提供了一种新的途径.
1 实验部分
1.1 仪器与试剂
仪器:HORIBA○RFL3-211型荧光分析仪(美国);GL-9406型手提式紫外灯(海门市);CHB-100型恒温金属浴(杭州);Canon IXUS230HS数码相机(北京);ME104E型电子天平(上海);ZHWY-103D型恒温培养振荡器(上海).
试剂:焦磷酸酶(购于Sigma-Aldrich,中国);巯基乙酸(购于Fluka,中国);抗坏血酸(AscorbicAcid,C6H8O6,Vc)、五水合硫酸铜(CuSO4·5H2O)、焦磷酸钠(Na4P2O7)、磷酸钠(Na3PO4)、磷酸一氢钠(Na2HPO4)、磷酸二氢钠(NaH2PO4)、硫酸钠(Na2SO4)、碳酸钠(Na2CO3)、硝酸钠(NaNO3)、氟化钠(NaF)、氯化钠(NaCl)、溴化钠(NaBr)、碘化钠(NaI)均为分析纯;实验中所用的水均为二次去离子水.
1.2 实验步骤
1.2.1CdTeQDs的制备
CdTeQDs按照文献[32-33]制备,具体步骤如下:首先将0.280 8gCdCl2和120μL巯基乙酸(Thioglycolicacid,TGA)溶解于180mL超纯水中,用NaOH调节pH值为12,待用.然后取12mL超纯水于3口烧瓶中,将烧瓶置于冰水浴,通氮气除氧,并在氮气保护下加入0.030 0g碲粉和0.108 0g硼氢化钠,磁力搅拌下反应8h,得到碲氢化钠,往其中滴加1mol/L硫酸溶液22.5mL,产生H2Te气体,该气体随氮气一起通入准备好的CdCl2溶液中,形成CdTe前驱体,继续加热回流2h,得到巯基乙酸修饰的绿色量子点.将制备好的CdTe量子点置于日光灯下照射8d,以增强其荧光强度,然后避光保存,备用.
1.2.2PPi的测定
本实验反应体系的终体积为100μL,其中包含10mmol/LpH7.0HEPES、10μmol/LCu2+、100μmol/LVc、5μLCdTeQDs和一定浓度的PPi,将该体系置于60 ℃恒温金属浴下反应30min.反应结束后将样品冷却至室温,用FL3-211荧光光谱仪扫描样品的发射光谱,测量参数:激发波长为365nm,激发和发射的狭缝宽度均为2 nm,扫描的波长为450~700 nm.然后在手提式紫外灯(波长为365 nm)的照射下观察溶液的颜色变化,并使用数码相机照相.为保证结果的准确性,实验中所有的数据均平行测定3次.

图1 焦磷酸根(PPi)可视化检测原理Fig.1 Schematic illustration of the visual detection of PPi
2 结果与讨论
2.1 实验原理
本实验的原理如图1所示,当Cu2+和CdTe QDs混合之后,由于本实验所使用的QDs表面为TGA,因此Cu2+被TGA还原为Cu+,Cu+诱导CdTe QDs的发射峰产生红移,并引起其激发光照射下荧光颜色从绿色变为红色,这一点在笔者前期的研究工作中已有证明[30].当PPi加入到上述体系时,由于PPi对Cu2+强烈的配位作用有效地阻止了Cu2+的还原,Cu+的生成量减小,CdTe QDs发射峰的红移减弱,溶液从之前的红色逐渐恢复为绿色.在紫外灯照射下,裸眼即可从颜色变化分辨出PPi的含量,并且利用PPi加入前后CdTe QDs的发射峰位移差和PPi的含量的关系可定量的检测PPi.另外为了实验现象更加明显,在体系中加入一定量的Vc,并且加热到60 ℃,以增强Cu2+的还原.
为了证明方案的可行性,对实验结果进行了初步的验证(图2).为了更直观地反映谱峰的变化情况,文中对每个谱图以最大发射波长处的荧光强度做了归一化处理.图2A中曲线a为CdTe QDs的荧光发射谱图,λem为534 nm,对应图2B中a,可以看出此时溶液的荧光颜色为绿色;曲线b为加入100 μmol/L Vc后CdTe QDs的荧光发射谱图,该谱图几乎与单一CdTe QDs的谱图重合,对应的荧光颜色照片为B图中的b,说明Vc对CdTe QDs的荧光发射无影响;曲线c为加入100 μmol/L Vc 和10 μmol/L Cu2+后CdTe QDs的荧光发射谱图,λem为587 nm,可以看出CdTe QDs的荧光谱峰发生了明显的红移,对应的荧光颜色照片为B图中的c,此时溶液的荧光颜色为红色;曲线d为加入100 μmol/L Vc 、10 μmol/L Cu2+与100 μmol/L PPi后CdTe QDs的荧光峰,λem为560 nm,相比未加入PPi的光谱图c,谱峰红移明显减小,对应的荧光颜色为B图中的d,此时显示为绿色.以上结果可以说明,在PPi加入前后,反应体系的颜色从明显的红色变为绿色,最大发射波长从587 nm蓝移为560 nm,因此,可以根据CdTe QDs的荧光颜色和最大发射波长的变化与PPi的含量建立一定的关系,实现PPi检测.同时也证明,在不需要大型仪器的情况下,通过一台简易便捷的手提式紫外灯即可实现PPi的可视化检测.

a.CdTe QDs;b.CdTe QDs+100 μmol/L Vc;c.CdTe QDs+100 μmol/L Vc+10 μmol/L Cu2+;d.CdTe QDs+100 μmol/L Vc+10 μmol/L Cu2++100 μmol/L PPi.图2 不同体系中CdTe QDs的荧光光谱归一化图(A)及照片(B)Fig.2 Normalized fluorescence emission spectra(A)and photos(B)of the QDs mixed with different reagent
2.2 实验条件的优化
为了使方法发挥更好的性能,对实验中涉及到的关键步骤进行了优化.首先是Cu2+浓度的优化.本实验建立在Cu2+诱导CdTeQDs荧光发射峰红移和PPi通过配位作用减弱这种红移效应的基础上,如果Cu2+浓度太小,CdTeQDs谱峰红移小,在PPi作用下该峰的蓝移空间就小,影响PPi的线性范围,如果Cu2+浓度太大,则会影响PPi的检测灵敏度,因此合理的Cu2+浓度非常重要.以不加入PPi的体系作为空白,以不同Cu2+浓度下空白和样品的最大发射波长差值(Δλ)作为条件筛选的依据,结果如图3A所示.从图3A可以看出,随着Cu2+浓度的增加,Δλ呈先增加后减小的趋势,在Cu2+浓度为10μmol/L时达到了最大值,因此选择10μmol/L为最佳Cu2+浓度.
接下来优化了PPi与Cu2+结合时间.PPi与Cu2+是否结合完全,直接影响到实验结果的准确性和稳定性.结果表明,PPi与Cu2+结合不论时间长短,Δλ基本不变,说明PPi与Cu2+络合速度很快,不需要单独把PPi和Cu2+提前反应,直接加到总反应体系中即可.
对总体系的反应温度进行了优化,结果如图3B.从图3B可以看出,随着温度的增加,Δλ呈先显著增加后降低的趋势,这主要是由于温度增加有利于铜离子的还原,但当温度大于60 ℃时,PPi会发生分解反应,因此导致信号降低.最终选择最佳反应温度为60 ℃.
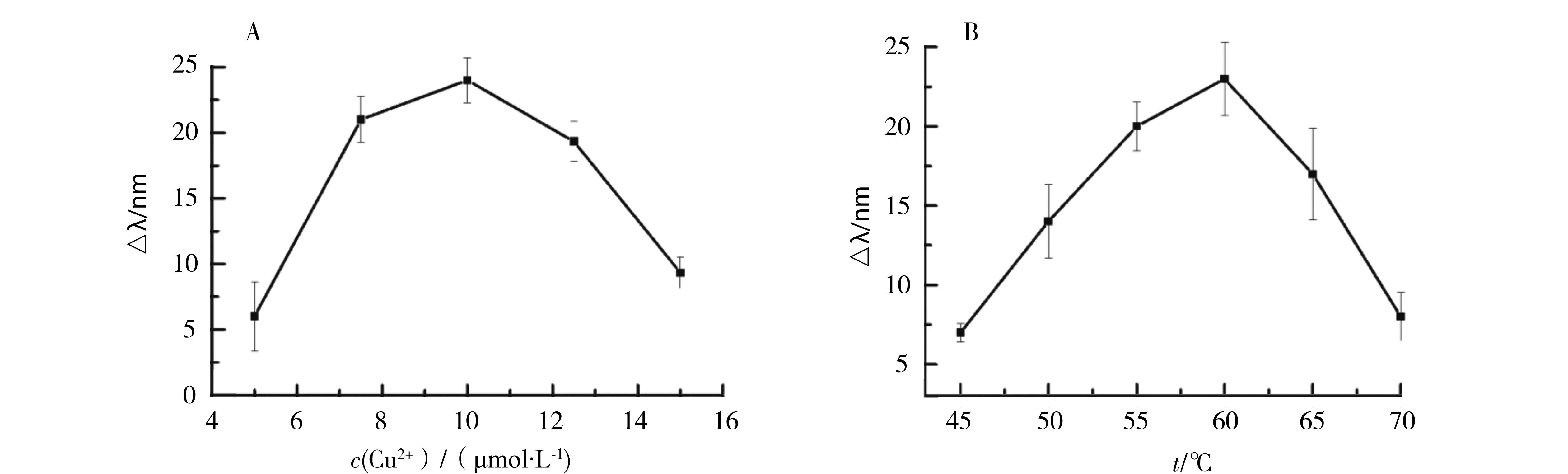
实验条件:A.30 min,60 ℃,PPi:100 μmol/L,Vc:100 μmol/L;B.30 min,Cu2+:10 μmol/L,PPi:100 μmol/L,Vc:100 μmol/L.图3 Cu2+浓度(A)和反应温度(B)的影响Fig.3 Effect of the Cu2+ concentration(A)and the incubation temperature(B)
2.3 线性范围及方法评价
在最佳实验条件下,考察了本方法对PPi的分析性能,结果如图4所示.图4A为不同PPi浓度下CdTe QDs的荧光光谱归一化图.从图4A可以看出,随着PPi浓度的增加,CdTe QDs的荧光谱峰逐渐蓝移.图4B为紫外灯照射下与图4A相对应的溶液的颜色,可以看出,随着PPi浓度的增加,溶液从红色变为黄色直至绿色,颜色对比非常明显,可以通过肉眼的观察,实现PPi的可视化检测,需要重点指出的是,该检测无需大型仪器,只需要30 min的反应时间和一台手提式的紫外灯即可完成,为PPi的现场检测或者家庭检测提供了可能.图5为Δλ与PPi浓度的线性关系图,可以看出在5 μmol/L到50 μmol/L的范围内,PPi的浓度与Δλ成良好的线性关系,线性方程为Δλ=0.384 6ρ(PPi)+3.166,其中R2=0.955 7.
为了更好地评价本文提出的方案,表1中列举了近几年利用荧光法进行PPi检测的方法,与本文方法进行比较.目前荧光法检测PPi主要是采用荧光聚合物、有机金属配合物及荧光纳米粒子作为探针.从表中可以看出,在检测灵敏度和线性范围方面,本方法处于中间水平;但在可视化检测方面,本方法优点较为突出.表中方法一大部分不能实现直接裸眼可视化,需要复杂昂贵的仪器才能够达到检测PPi的目的,另外有2种可以实现可视化的方法均以荧光聚合物为探针,众所周知,荧光聚合物的合成和纯化比较复杂,而本文使用量子点实现了从红色到黄色到绿色的可视化效果,颜色对比明显,而且水相量子点的制备相对简单,不需要复杂的纯化过程.因此,综合考虑上述2方面的因素,本文提出的方案在目前荧光法检测PPi的众多方法中具有明显的优势.

实验条件:30 min,60 ℃,Vc:100 μmol/L,Cu2+:10 μmol/L.从a到j,PPi浓度依次为0,2,5 10,20,30,40,50,100,200 μmol/L.图4 不同浓度的PPi下QDs荧光光谱归一化图(A)和荧光照片(B)Fig.4 Normalized fluorescence emission spectra(A)and photos(B)of the QDs treated with different concentration of PPi
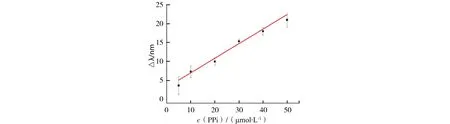
Δλ为空白和样品溶液的最大发射波长之差;实验条件:30 min;60 ℃;Vc:100 μmol/L;Cu2+:10 μmol/L.图5 标准曲线Fig.5 Relationship between Δλ and the PPi concentration
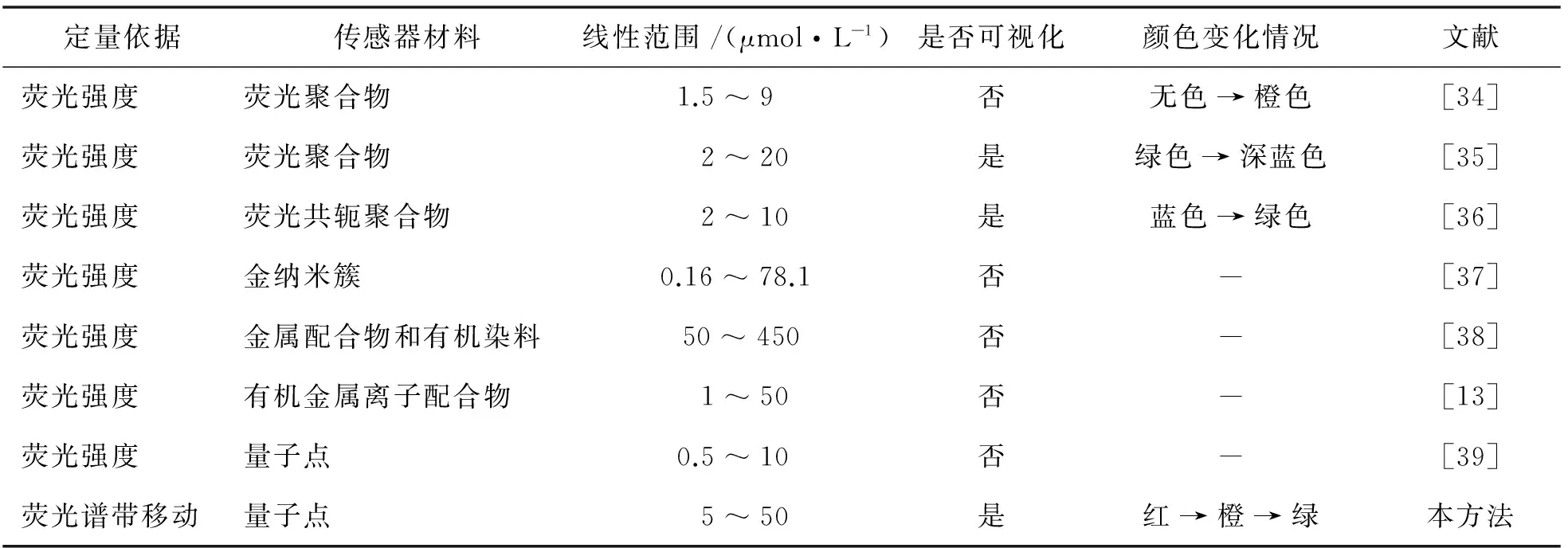
定量依据传感器材料线性范围/(μmol·L-1)是否可视化颜色变化情况文献荧光强度荧光聚合物1.5~9 否无色→橙色[34]荧光强度荧光聚合物2~20 是绿色→深蓝色[35]荧光强度荧光共轭聚合物2~10 是蓝色→绿色[36]荧光强度金纳米簇0.16~78.1否-[37]荧光强度金属配合物和有机染料50~450 否-[38]荧光强度有机金属离子配合物1~50 否-[13]荧光强度量子点0.5~10 否-[39]荧光谱带移动量子点5~50 是红→橙→绿本方法
2.4 特异性


实验条件:30 min;60 ℃;Vc:100 μmol/L;Cu2+:10 μmol/L;PPi及干扰离子:50 μmol/L.图6 CdTe QDs和Cu2+的混合物在PPi或其他干扰离子作用下的荧光光谱归一化图(A)及荧光照片(B)Fig.6 Normalized fluorescence emission spectra(A)and photos(B)of CdTe QDs/ Cu2+ mixture afterincubation with PPi or different interfering ions
2.5 焦磷酸酶活性的检测
焦磷酸酶(pyrophosphatase,PPase)是一种以PPi为底物的水解酶,可催化PPi水解为磷酸,广泛存在于生物体中,跟生命过程中的糖代谢、脂代谢等直接相关,因此PPase活性的检测也是当前的研究热点之一.在本实验的基础上,利用PPase对PPi的水解作用,设计了一种PPase活性的测定方法.当PPase不存在时,PPi有效地保护了Cu2+,使Cu2+诱导之后的CdTe QDs谱峰蓝移,溶液颜色为绿色,当PPase存在时,PPi在其催化作用下水解为磷酸根,在特异性考察实验中已经证明磷酸根对Cu2+没有保护作用,此时谱峰相对于上述光谱图,发生红移,结果如图7所示.从图7可以看出,随着PPase加入量的增加,谱峰逐渐红移,相应的反应体系在紫外灯下的颜色由绿色变为黄色,证明这种方法可以用于PPase活性的测定,另外也说明该方法在PPi相关物质的检测中具有很好的潜力.

实验条件:30 min;60 ℃;Vc:100 μmol/L;Cu2+:10 μmol/L;PPi:100 μmol/L.图7 焦磷酸酶活性检测的荧光光谱归一化图(A)和可视化照片(B)Fig.7 Normalized fluorescence emission spectra(A)and photos(B)for the PPase activity detection
3 结论
本文利用Cu2+诱导CdTe QDs荧光谱峰位移和PPi与Cu2+的配位作用,建立了一种可视化检测PPi的新方法.该方法实验过程只需要一步,使用30 min即可完成,并且利用便捷的手提式紫外灯即可实现PPi的裸眼检测,省时,方便,无需复杂的前处理步骤和昂贵的仪器,特异性良好,并可拓展应用于PPase活性的检测,在贫困地区、野外或家庭等不具备或者不方便使用大型仪器的场合中具有很好的发展前景.
[1]MATHEWSCK,VANHOLDEKE.Biochemistry[M].RedwoodCity,CA,USA:TheBenjamin/CummingsPublishingCompany,1990.
[2]LEHNINGERA,NELSONDL,COXMM.Lehningerprinciplesofbiochemistry[M].5thedn.NewYork,NY:W.H.Freeman,2008.
[3]KIMSK,LEEDH,HONGJI,etal.Chemosensorsforpyrophosphate[J].AccChemRes,2009,42(1):23-31.DOI:10.1021/ar800003f.
[4]XUSQ,HEM,YUHP,etal.Aquantitativemethodtomeasuretelomeraseactivitybybioluminescenceconnetedwithtelomericrepeatamplificationprotocol[J].AnalBiochem,2001,299(2):188-193.DOI:10.1006/abio.2001.5418.
[5]TIMMSAE,ZHANGY,RUSSELLRGG,etal.Geneticstudiesofdisordersofcalciumcrystaldeposition[J].Rheumatology,2002,41(7):725-729.DOI:10.1093/rheumatology/41.7.725.
[6]RATNERB,HOFFMANA,SCHOENF,etal.Biomaterialsscience[M].London:AcademicPress,1996.
[7]CHEUNGCP,SUHADOLNIKRJ.Analysisofinorganicpyrophosphateatthepicomolelevel[J].AnalBiochem,1977,83(1):61-63.DOI:10.1016/0003-2697(77)90510-3.
[8]LEESL,YUENK,JOLLIFFEKA,etal.Fluorescentandcolorimetricchemosensorsforpyrophosphate[J].ChemSocRev,2015,44:1749-1762.DOI:10.1039/c4cs00353e.
[9]CUIH,CAIF,XUQ.Determinationoftripolyphosphateinfrozencodandscallopadductorbyionchromatography[J].JChromatogrA,2000,884(1-2):89-92.DOI:10.1016/S0021-9673(00)00055-8.
[10]NGOHT,LIUXJ,JOLLIFFEKA.AnionrecognitionandsensingwithZn(Ⅱ)-dipicolylaminecomplexes[J].ChemSocRev,2012,41:4928-4965.DOI:10.1039/C2CS35087D.
[11]ZHAOXY,LIUY,SCHANZEKS.Aconjugatedpolyelectrolyte-basedfluorescencesensorforpyrophosphate[J].ChemCommun,2007:2914-2916.DOI:10.1039/B706629E.
[12]LIUJX,DINGSN.Monitoringpyrophosphateanionsviacobalt(Ⅱ)-modulatedfluorescenceofcadmiumsulfidequantumdots[J].AnalMethods,2016,8:2170-2175.DOI:10.1039/C5AY03116H.
[13]TSAYOG,MANJAREST,KIMH,etal.NovelreversibleZn2+-assistedbiologicalphosphate“turn-On”probingthroughstablearyl-hydrazonesalicylaldimineconjugationthatattenuatesligandhydrolysis[J].InorgChem,2013,52(17):10052-10061.DOI:10.1021/ic4013526.
[14]LOHANICR,KIMJM,CHUNGSY,etal.Colorimetricandfluorescentsensingofpyrophosphatein100%aqueoussolutionbyasystemcomprisedofrhodamineBcompoundandAl3+complex[J].Analyst,2010,135:2079-2048.DOI:10.1039/C0AN00059K.
[15]ZHAOXJ,HEL,HUANGCZ.Highlyselectivevisualdistinctionofpyrophosphatefromotherphosphateanionswith4-[(5-chloro-2-pyridyl)azo]-1,3-diaminobenzeneinthepresenceofcopper(Ⅱ)ions[J].Talanta,2012,101:59-63.DOI:10.1016/j.talanta.2012.08.046.
[16]ZHUWH,HUANGXM,GUOZQ,etal.AnovelNIRfluorescentturn-onsensorforthedetectionofpyrophosphateanionincompletewatersystem[J].ChemCommun,2012,48,1784-1786.DOI:10.1039/C2CC16902A.
[17]LIY,DONGXH,ZHONGC,etal.Awater-solubletwo-photonfluorescentturn-onprobeforpyrophosphateanion:design,synthesisandproperties[J].SensorActuatB:Chem,2013,183:124-128.DOI:10.1016/j.snb.2013.03.112.
[18]SUX,ZHANGC,XIAOXJ,etal.Akineticmethodforexpeditiousdetectionofpyrophosphateanionsatnanomolarconcentrationsbasedonanucleicacidfluorescentsensor[J].ChemCommun,2013,49,798-800.DOI:10.1039/C2CC38020J.
[19]BAWENDIMG,STEIGERWALDMW,BRUSLE.Thequantummechanicsoflargersemiconductorclusters(“quantumdots”)[J].AnnuRevofPhysChem,1990,41:477-496.DOI:10.1146/annurev.pc.41.100190.002401.
[20]CHENYF,ROSENZWEIGZ.LuminescentCdSquantumdotsasselectiveionprobes[J].AnalChem,2002,74(19):5132-5138.DOI:10.1021/ac0258251.
[21]SONGYY,CAOXB,GUOY,etal.FabricationofmesoporousCdTe/ZnO@SiO2core/shellnanostructureswithtunabledualemissionandultrasensitivefluorescenceresponsetometalions[J].ChemMater,2009,21(1):68-77.DOI:10.1021/cm801925j.
[22]KONESWARANM,NARAYANASWAMYR.L-Cysteine-cappedZnSquantumdotsbasedfluorescencesensorforCu2+ion[J].SensorActuatB:Chem,2009,139(1):104-109.DOI:10.1016/j.snb.2008.09.028.
[23]LOUYB,ZHAOYX,CHENJX,etal.Metalionsopticalsensingbysemiconductorquantumdots[J].JMaterChemluorC,2014,2:595-613.DOI:10.1039/C3TC31937G.
[24]ZHAOX,DUJ,WUYZ.SynthesisofhighlyluminescentPOSS-coatedCdTequantumdotsandtheirapplicationintraceCu2+detection[J].JMaterChemA,2013,1:11748-11753.DOI:10.1039/C3TA12335A.
[25]XIAYS,ZHUCQ.Aqueoussynthesisoftype-IIcore/shellCdTe/CdSequantumdotsfornear-infraredfluorescentsensingofcopper(Ⅱ)[J].Analyst,2008,133:928-932.DOI:10.1039/B801963K.
[26]FREEMANR,FINDERT,WILLNERI.MultiplexedanalysisofHg2+andAg+ionsbynucleicacidfunctionalizedCdSe/ZnSquantumdotsandtheiruseforlogicgateoperations[J].AngewChem,IntEd,2009,48(42):7818-7821.DOI:10.1002/anie.200902395.
[27]CHENJL,ZHUCQ.Functionalizedcadmiumsulfidequantumdotsasfluorescenceprobeforsilveriondetermination[J].AnalChimActa,2005,546(2):147-153.DOI:10.1016/j.aca.2005.05.006.
[28]ALIEM,ZHENGYG,YUHH,etal.UltrasensitivePb2+detectionbyglutathione-cappedquantumdots[J].AnalChem,2007,79(24):9452-9458.DOI:10.1021/ac071074x.
[29]KEJ,LIXY,ZHAOQD,etal.Ultrasensitivequantumdotfluorescencequenchingassayforselectivedetectionofmercuryionsindrinkingwater[J].SciRep-uk,2014,4:5624.DOI:10.1038/srep05624.
[30]LUXH,ZHAOYJ,ZHANGJJ,etal.Copperion-inducedfluorescencebandshiftofCdTequantumdots:ahighlyspecificstrategyforvisualdetectionofCu2+withaportableUVlamp[J].Analyst,2015,140:7859-7863.DOI:10.1039/C5AN01963J.
[31]XUKF,CHENZH,ZHOUL,etal.Fluorometricmethodforinorganicpyrophosphataseactivitydetectionandinhibitorscreeningbasedonclickchemistry[J].AnalChem,2015,87(1):816-820.DOI:10.1021/ac503958r.
[32]POZNYAKSK,OSIPOVICHNP,SHAVELA,etal.Size-dependentelectrochemicalbehaviorofthiol-cappedCdTenanocrystalsinaqueoussolution[J].JPhysChemB,2005,109(3):1094-1100.DOI:10.1021/jp0460801.
[33]ZHANGK,MEIQS,GUANGJ,etal.Ligandreplacement-inducedfluorescenceswitchofquantumdotsforultrasensitivedetectionoforganophosphorothioatepesticides[J].AnalChem,2010,82(22):9579-9586.DOI:10.1021/ac102531z.
[34]GUOZQ,ZHUWH,TIANH.Hydrophiliccopolymerbearingdicyanomethylene-4H-pyranmoietyasfluorescentfilmsensorforCu2+andpyrophosphateanion[J].Macromolecules,2010,43:739-744.DOI:10.1021/ma902466g.
[35]GEJZ,LIUZH,CAOQY,etal.Apyrene-functionalizedpolynorborneneforratiometricfluorescencesensingofpyrophosphate[J].ChemAsiaJ,2016,11:687-690.DOI:10.1002/asia.201501363.
[36]ZHAOXY,SCHANZEKS.Fluorescentratiometricsensingofpyrophosphateviainducedaggregationofaconjugatedpolyelectrolyte[J].ChemCommun,2010,46:6075-6077.DOI:10.1039/c0cc01332c.
[37]LIUJM,CUIML,JIANGSL,etal.BSA-protectedgoldnanoclustersasfluorescentsensorforselectiveandsensitivedetectionofpyrophosphate[J].AnalMethods,2013,5:3942-3947.DOI:10.1039/c3ay00054k.
[38]GAOJ,RIIS-JOHANNESSENT,SCOPELLITIR,etal.AfluorescentsensorforpyrophosphatebasedonaPd(Ⅱ)complex[J].DaltonTrans,2010,39:7114-7118.DOI:10.1039/c0dt00434k.
[39]NOIPAT,NGAMDEEK,TUNTULANIT,etal.CysteamineCdSquantumdotsdecoratedwithFe3+asafluorescencesensorforthedetectionofPPi[J].SpectrochimActaPartA,2014,118:17-23.DOI:10.1016/j.saa.2013.08.067.
(责任编辑:梁俊红)
A new method for visual detection of pyrophosphate
SU Huijuan,ZHAO Xudong,ZHANG Li,FAN Wenjie,WANG Yucong,JIA Hongxia
(College of Chemistry and Environmental Science,Hebei University,Baoding 071002,China)
Pyrophosphate(PPi)plays an important role in the biological and environmental systems.Therefore,a simple,rapid,high sensitivity determination of the pyrophosphate is of great significance.A new colorimetric strategy for the visual detection of pyrophosphate by the naked eye under the irradiation of a UV lamp was developed on the basis of Cu2+-induced fluorescence band shift of CdTe quantum dots(QDs)and the strong interaction between PPi and Cu2+. PPi can be visually detected in the range of 5 μmol/L to 50 μmol/L.Furthermore,this method was of good specificity and it also can be used for the detection of the pyrophosphatase activity.
pyrophosphate;CdTe quantum dots;Cu2+;visual detection
10.3969/j.issn.1000-1565.2017.02.007
2016-11-21
河北省自然科学基金资助项目(B2015201130);河北大学2016校级创新创业计划项目(149)
苏荟娟(1992—),女,河北邢台人,河北大学在读硕士研究生,主要从事发光材料在生物分子上的应用研究. E-mail:suhuijuan2016@163.com
王愈聪(1979—),女,山西河曲人,河北大学副教授,博士,主要从事生物功能材料的制备及应用研究. E-mail:15931795521@163.com 贾红霞(1980—),女,河北宣化人,河北大学讲师,博士,主要从事生化分析及光谱分析研究. E-mail:jia123renren@126.com
O
A
1000-1565(2017)02-0147-08
