透明质酸接枝普鲁兰糖的制备与表征
2017-04-26杨文智王树根刘娇艳贾蓓李海鹰
杨文智,王树根,刘娇艳,贾蓓,李海鹰
(河北大学 药学院,河北 保定 071002)
透明质酸接枝普鲁兰糖的制备与表征
杨文智,王树根,刘娇艳,贾蓓,李海鹰
(河北大学 药学院,河北 保定 071002)
采用化学交联法,以1-(3-二甲氨基丙基)-3-乙基碳二亚胺(EDC)为脱水剂、4-二甲基氨基吡啶(DMAP)为催化剂,将透明质酸(Hyaluronicacid,HA)接枝到普鲁兰(Pullulan,Pu)糖长链上,制备透明质酸-普鲁兰糖(HA-Pu)新型材料.傅里叶变换红外和氢核磁表征显示,成功合成HA-Pu材料,并用1HNMR法确定HA-Pu的透明质酸取代度.合成新材料冻干后可压制获得HA-Pu膜,扫描电镜下观察,HA-Pu膜为层状结构,具备很多微小孔洞.体外酶降解实验表明,新型HA-Pu膜较透明质酸具有更好的抵抗酶降解性能.HA-Pu新材料合成有望拓展透明质酸在医药领域的应用.
透明质酸;普鲁兰糖;化学接枝;体外酶降解
透明质酸(hyaluronic acid,HA)俗名玻尿酸,是一种线性阴离子多糖,由D-葡萄糖醛酸和N-乙酰氨基葡萄糖双糖重复单元组成,1934年首次从牛眼中分离获得.HA广泛分布于动物和人体结缔组织细胞外基质中,在眼玻璃体、皮肤、软骨和滑液中含量较高.HA具备良好的生物相容性,广泛用于医药与化妆品行业[1-2].普鲁兰多糖(pullulan,Pu)是出芽短梗霉菌分泌的次级代谢产物,由3个葡萄糖单元通过α-(1-4)和α-(1-6)糖苷键连接而成[3].Pu具备良好生物安全性而广泛应用于食品及医药行业.近年,为了扩展天然普鲁兰多糖在医药领域的应用,化学修饰普鲁兰糖成为热点研究领域[4,5].为解决HA易被体内酶分解导致体内存留时间短的问题[6,7],专利[8]采用1,4-丁二醇二缩水甘油醚(BDDE)为交联剂,化学接枝透明质酸与普鲁兰糖,制备其用于皮下注射的颗粒剂,可延缓体内降解时间.但BDDE交联剂有毒,痕量残留会导致机体毒性反应,故严控产品BDDE残留量尤为重要[9].本研究针对BDDE交联剂有毒的突出问题,尝试催化透明质酸与普鲁兰糖自身交联反应,避免引入第3种化学交联剂,对HA进行化学改性,希望制备具备较好生物安全性的HA-Pu接枝材料以减缓其在体内的降解速度.
1 实验部分
1.1 仪器
FA2104N型电子天平(上海民桥精密科学仪器有限公司);FTIR-8400S傅里叶变换红外光谱仪(日本,岛津仪器有限公司);AVANCEⅢ型600MHz核磁共振波普仪(美国,Bruker仪器公司);UV-8500型紫外可见分光光度计(北京普析通用仪器有限公司);TM3000型扫描电镜仪(日本,日立仪器有限公司);KQ-250B型超声波清洗器(昆山市超声仪器有限公司,250W);THZ-82型气浴恒温振荡箱(金坛市医疗仪器厂);HJ-6型磁力加热搅拌器(金坛市城东鑫瑞仪器厂).
1.2 试剂
透明质酸(5 400u,山东福瑞达医药有限公司);普鲁兰多糖(10ku,郑州明鑫化工有限公司);1-(3-二甲氨基丙基)-3-乙基碳二亚胺、4-二甲基氨基吡啶(国药集团上海试剂有限公司);葡萄糖醛酸标准品、透明质酸酶(300U/mg,Sigma);其他试剂均为分析纯(天津科密欧化学试剂有限公司).
1.3 新型HA-Pu材料的制备
按照图1所示合成路线,称取EDC(200mg,0.001mmol)、DMAP(150mg,0.0015mmol),分别投料按HA(100mg,0.002mmol)、普鲁兰糖(100mg,0.001mmol)以及HA(400mg,0.008mmol)、普鲁兰糖(100mg,0.001mmol)制备材料HA-Pu-Ⅰ、HA-Pu-Ⅱ.首先将HA溶于25mL二甲基亚砜中, 1mol/L盐酸调pH至3.5~4.0,将EDC和DMAP依次加入到透明质酸液中,室温磁力搅拌2h.将普鲁兰多糖溶于适量的二甲基亚砜中,将其溶液缓慢滴加至已活化的透明质酸液中,50 ℃磁力搅拌48h,将反应液转移至透析袋(8 000~14 000u)去离子水中透析48h,透析液冷冻干燥,得到海绵状样品.

图1 HA-Pu接枝材料合成路线Fig.1 Synthetic route of Hyaluronic acid grafted pullulan
1.4 样品红外光谱分析
将待测样品放在红外灯下照射烘干,取适量样品与KBr充分研磨至细粉末状,压片后采用FTIR-8400S傅里叶变换红外光谱仪检测,扫描波数400~4 000 cm-1,分辨率2 cm-1.
1.5 样品1H NMR波谱检测
测定HA、Pu以及HA-Pu氢核磁波谱,取样品20 mg溶于0.5 mL D2O中,以四甲基硅烷为内标,置于AVANCE Ⅲ 600 MHz核磁共振仪中,测定样品的氢核磁图谱.采用1H NMR法测定透明质酸接枝取代度,计算每个葡萄糖残基上偶联透明质酸个数.
1.6 HA-Pu材料体外酶降解实验
1.6.1 葡萄糖醛酸标准曲线的建立
精密称取葡萄糖醛酸标准品,配成40 μg/mL储备液,分别量取储备液0,1.25,2.50,5.00和7.50 mL加至10 mL容量瓶中,加水定容,移取上述溶液1 mL加至25 mL具塞试管中,冰浴中冷却,缓慢滴加0.025 mol/L硫酸硼砂液5.0 mL,加塞密闭,沸水浴加热10 min后冷却,移取质量分数0.125%咔唑试剂0.2 mL,摇匀,沸水浴15 min后冷却至室温.采用紫外-可见光光度法,于530 nm处测定吸光度[7].以吸光度A对药物质量浓度ρ(μg/mL)作图,得到葡萄糖醛酸标准曲线为A=1.34×10-2ρ+9.44×10-2(R2=0.998 4;n=5),线性范围为5~40 μg/mL.
0.025mol/L的硫酸硼砂溶液:称取四硼酸钠4.77g,溶于浓硫酸500mL中即得.
质量分数0.125%的咔唑试剂:称取咔唑0.125g,溶于100mL无水乙醇,即得.
1.6.2HA和HA-Pu新型材料的体外酶降解实验
分别剪取尺寸为0.5cm×0.5cm,质量约为7mgHA和HA-Pu(Ⅰ~Ⅱ)样品至10mLEP管中,加入2mL100U/mL新鲜透明质酸酶溶液,样品置于37 ℃ 150r/min恒温气浴摇床中,在设定时间从EP管中移取200μL样品,立即补充同体积的新鲜酶液.200μL样品液稀释50倍,取1mL置于25mL具塞试管,冰浴冷却,振摇下缓慢滴加0.025mol/L硫酸硼砂液5.0mL,加塞密闭,按照1.6.1项下操作,测定样品吸光度,计算累积释放量[7].
2 结果与讨论
2.1 红外图谱分析
样品红外图谱见图2,由于普鲁兰多糖、透明质酸、物理混合物样品和透明质酸接枝普鲁兰糖分子中存在大量游离-OH与-CH2-,故3 200~3 600 cm-1显示出强的-OH的伸缩振动峰和2 925 cm-1较强C—H伸缩振动峰[10];由于透明质酸、物理混合物样品、接枝普鲁兰糖样品中存在-NHCOCH3取代基团,故1 655 cm-1处出现较强的酰胺带吸收峰,而普鲁兰多糖分子中没有-NHCOCH3基团,在此波数处未见强吸收[11].透明质酸接枝普鲁兰糖样品与物理混合物样品相比,在1 720 cm-1处出现酯羰基伸缩振动吸收峰[12],此重要特征峰出现,证明透明质酸接枝普鲁兰糖样品非简单的普鲁兰糖与透明质酸的物理混合,而是透明质酸的羧基与普鲁兰糖的羟基经酯化反应接枝到多糖分子长链上.
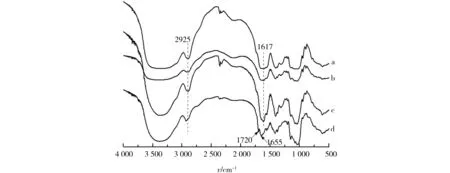
a.透明质酸;b.普鲁兰糖;c.透明质酸普鲁兰糖混合物;d.透明质酸-普鲁兰材料.图2 红外光谱图Fig.2 FTIR spectra for the simple
2.21H NMR 谱图分析
样品1H NMR谱图见图3,透明质酸和透明质酸接枝普鲁兰糖样品中存在-NHCOCH3基团,故在1.8~2.0出现较强的-CH3峰;透明质酸在4.36和4.45分别出现dd峰,分属透明质酸中葡萄糖醛酸和N-乙酰氨基葡萄糖单元H-1质子峰[13],而透明质酸接枝普鲁兰糖对应透明质酸H-1质子峰出现在4.35和4.44,由于接枝后H-1化学环境发生变化,导致透明质酸H-1质子峰化学位移迁移0.01.而酯化反应对普鲁兰糖H-1影响较小,故普鲁兰糖与透明质酸接枝普鲁兰糖样品中普鲁兰糖分子链α-(1-4)糖苷键连接的H-1位dd峰出现在5.25~5.29[14].由于反应过程采用酸化步骤,此过程可催化乙酰氨基水解,脱除乙酰基而游离部分氨基,故透明质酸接枝普鲁兰糖样品图谱在2.7~2.8出现糖单元游离氨基后的H-2吸收峰.
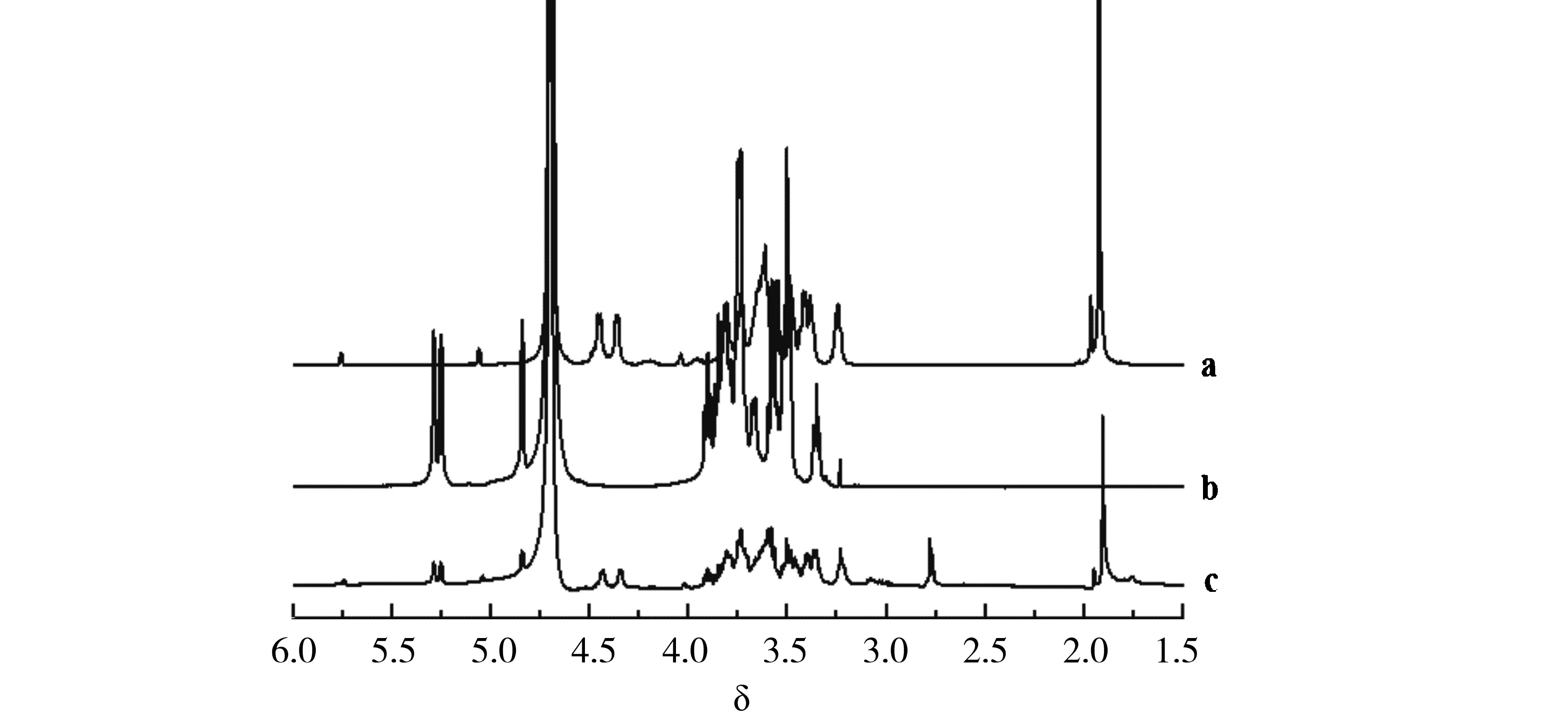
a.透明质酸;b.普鲁兰糖;c.透明质酸-普鲁兰糖材料.图3 核磁波谱图Fig.3 Spectra of 1H NMR
按照公式以特征峰峰面积比值计算取代度[15](见表 2)
公式中,DS代表HA-Pu材料中透明质酸的取代度;I4.34和I4.45分别代表透明质酸中葡萄糖醛酸和N-乙酰氨基葡萄糖单元H-1对应氢核磁峰面积;I5.25 ~ 5.29代表普鲁兰糖分子α-(1-4)糖苷键连接的H-1对应氢核磁峰面积.

表2 HA-Pu材料中透明质酸取代度
2.3 扫描电镜显微观察
取膜样品于扫描电镜下观察,由图4可知,天然透明质酸膜表面呈层状叠放且分布较大孔洞;普鲁兰多糖膜呈致密层叠状,表面平整光滑,少见孔洞;透明质酸-普鲁兰糖膜表面呈疏松层状叠放,具有10~20 μm较小孔洞.膜结构差异,一方面可改变材料的吸水率,作为伤口膜敷料可吸收更多组织渗液,利于创面修复;此外,疏松多孔层状叠放的HA-Pu膜材料,可获得柔软膜材料,利于与伤口紧密贴合,膜材料的多孔结构利于伤口与外界空气接触,可有效促进伤口愈合.

a.透明质酸;b.普鲁兰糖;c.透明质酸-普鲁兰糖材料.图4 扫描电镜图Fig.4 SEM photographs of sumple
2.4 体外酶降解实验
合成的HA-Pu材料酶降解实验结果见图5,合成的HA-Pu-Ⅰ与HA-Pu-Ⅱ材料相比透明质酸,显示出较好的抵抗透明质酸酶降解特性.制备的2种HA-Pu材料和透明质酸降解速度明显不同,考虑到5 400 u的透明质酸属长链有机高分子,此时的透明质酸酶可以充分接触到透明质酸分子链,有效降解透明质酸.HA-Pu材料上残存短链透明质酸分子段,由于接枝,残留透明质酸分子段可被普鲁兰糖分子长链缠绕或包裹,增大透明质酸酶与残留透明质酸分子段接触的难度,减缓残留透明质酸分子的酶降解,故透明质酸3d接近完全降解,而HA-Pu-Ⅰ和HA-Pu-Ⅱ材料分别降解约20%和30%,HA-Pu-Ⅰ和HA-Pu-Ⅱ材料完全降解时间分别延长到12 d和14 d.研究结果显示:随着HA-Pu材料中透明质酸取代度增大,制备获得的HA-Pu材料对抗酶降解能力增强,HA-Pu新材料较纯透明质酸抵抗透明质酸酶降解能力显著.
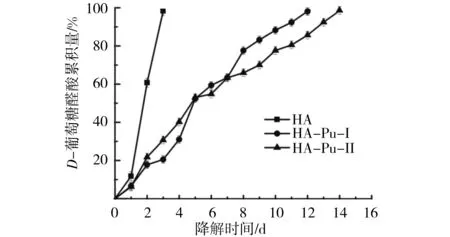
图5 体外酶降解释放图(n=5,P<0.02)Fig.5 Enzyme degradation in vitro(n=5,P<0.02)
3 结论
本文采用酯化反应将透明质酸接枝到普鲁兰糖长链上,其合成方法简便易行.获得HA-Pu样品经红外和1H NMR表征证明,此合成方法可成功制备HA-Pu新材料.HA-Pu膜材料酶降解实验表明,合成2种不同透明质酸取代度的HA-Pu膜材料较透明质酸相比,具备较优的对抗透明质酸酶降解作用且随透明质酸取代度增大其抗降解能力相应提高.HA-Pu膜的扫描电镜图显示,材料表面疏松多孔,利于组织细胞增殖有望促进皮肤伤口愈合.
[1]TEHBM,SHENY,FRIEDLANDPL,etal.Areviewontheuseofhyaluronicacidintympanicmembranewoundhealing[J].ExpertOpiniononBiologicalTherapy,2012,12(1):23-36.DOI:10.1517/14712598.2012.634792.
[2]CUIN,QIANJM,XUWJ,etal.Preparationcharacterizationandbiocompatibilityevaluationofpoly(Nε-acryloyl-l-lysine)hyaluronicacidinterpenetratingnetworkhydrogels[J].CarbohydratePolymers,2016,136:1017-1026.DOI:10.1016/j.carbpol.2015.09.095.
[3]WANGDH,BIANJJ,WEIGY,etal.Simultaneouslyenhancedproductionandmolecularweightofpullulanusingatwo-stageagitationspeedcontrolstrategy[J].JournalofChemicalTechnologyandBiotechnology,2016,91(2):467-475.DOI:10.1002/jctb.4600.
[4]ROGERSYE,IION,TAKEMURA,etal.Synthesisandcharacterizationofpullulanalkylesters[J].EuropeanPolymerJournal,2015,66:470-477.DOI:10.1016/j.eurpolymj.2015.03.007.
[5] 杨文智,王苗苗,李海鹰,等.生物素化胆甾醇基普鲁兰糖合成及其自聚集性质[J].河北大学学报(自然科学版),2014,34(1):34-39.DOI:10.3969/j.issn.1000-1565.2014.01.007.YANGWZ,WANGMM,LIHY,etal.Synthesisofbiotinmodifiedcholesterylpullulananditsself-aggregatedbehavior[J].JournalofHebeiUniversity(NaturalScienceEdition),2014,34(1):34-39.DOI:10.3969/j.issn.1000-1565.2014.01.007.
[6]BURDICKJA,PRESTWICHGD.HyaluronicAcidhydrogelsforbiomedicalapplications[J].AdvancedMaterials,2011,23(12):41-56.DOI:10.1002/adma.201003963.
[7]JEONO,SONGSJ,LEEKJ,etal.Mechanicalpropertiesanddegradationbehaviorsofhyaluronicacidhydrogelscross-linkedatvariouscross-linkingdensities[J].CarbohydratePolymers,2007,70(3): 251-257.DOI:10.1016/j.carbpol.2007.04.002.
[8] 李贤.普鲁兰多糖-透明质酸水凝胶及其制备方法:中国,CN104861178A[P].2015-05-26.
[9] 张健,奚宏伟,朱彬,等.荧光分光光度法检测交联透明质酸中交联剂残留量[J].生物学医学工程学进展,2011,3(4):198-200.DOI:10.3969/j.issn.1674-1242.2011.04.005.ZHANGJ,XIHW,ZHUB,etal.Fluorescencespectrophotometrydetectioncrosslinkingagentresiduesincrosslinkinghyaluronicacid[J].ProgressinBiomedicalEngineering,2011,3(4):198-200.DOI:10.3969/j.issn.1674-1242.2011.04.005.
[10]MANETAC,IONUTM,IONELAO,etal.Studiesongraftcopolymerizationof3-acrylamidopropyltrimethylammoniumchlorideonpullulan[J].CarbohydratePolymers,2011,84(3):926-932.DOI:10.1016/j.carbpol.2010.12.043.
[11] 孙汉文,许成燕,赵燕燕,等.枸杞多糖硫酸酯化修饰及其对Hela细胞的体外抑制作用[J].河北大学学报(自然科学版),2009,29(6):591-595.DOI:10.3969/j.issn.1000-1565.2009.06.009.SUNHW,XUCY,ZHAOYY,etal.Sulfationformodificationoflyciumbarbarumpolysaccharideanditsinhibitingeffecttogrowthofhelacellinvitro[J].JournalofHebeiUniversity(NaturalScienceEdition),2009,29(6):591-595.DOI:10.3969/j.issn.1000-1565.2009.06.009.
[12]SHAHNN,VISHWASRAOC,SINGHALRS,etal.n-Octenylsuccinylationofpullulan:Effectonitsphysico-mechanicalandthermalpropertiesandapplicationasanediblecoatingonfruits[J].FoodHydrocolloids,2016,55:179-188.DOI:10.1016/j.foodhyd.2015.11.026.
[13]WELTID,REESDA,WELSHEJ,etal.Solutionconformationofglycosaminoglycans:assignmentofthe300-MHzH-magneticresonancespectraofchondroitin4-sulphate,chondroitin6-sulphateandhyaluronate,andinvestigationofanalkali-inducedconformationchange[J].EuropeanJournalofBiochemistry,1979,94(2):505-514.DOI:10.1111/j.1432-1033.1979.tb12919.x.
[14]DEANEDM,HANSJV.Structuralstudiesofpullulanbynuclearmagneticresonancespectroscopy[J].Starch-Starke,1993,45(11):406-410.DOI:10.1002/star.19930451108.
[15]YANGXD,ZHANGQQ,WANGYS,etal.Self-aggregatednanoparticlesfrommethoxypoly(ethyleneglycol)-modifiedchitosan:synthesis;characterization;aggregationandmethotrexatereleaseinvitro[J].ColloidsandSurfacesB:Biointerfaces,2008,61(2):125-131.DOI:10.1016/j.colsurfb.2007.07.012.
(责任编辑:梁俊红)
Preparation and characterization of a new hyaluronic acid grafted pullulan material
YANG Wenzhi,WANG Shugen,LIU Jiaoyan,JIA Bei,LI Haiying
(College of Pharmacy,Hebei University,Baoding 071002,China)
A series of hyaluronic acid grafted pullulan(HA-Pu)were prepared by esterification reaction,using 1-(3-Dimethylaminopropyl)-3-ethylcarbodiimide(EDC)as dehydrating agent and 4-dimethylaminopyridine(DMAP)as catalyst.The structure of HA-Pu was confirmed by the Fourier transform infrared spectrum(FTIR)and proton nuclear magnetic resonance(1H NMR),and the degree of substitution(DS) of hyaluronic acid moiety was determined by1H NMR.The freeze-dried HA-Pu materials could be compressed to obtain a HA-Pu film.The HA-Pu film was observed by scanning electron microscopy(SEM),which obtained the layered microstructure with a lot of small holes.Compared with hyaluronic acid,the HA-Pu materials have better ability to resist enzyme degradationinvitro.Therefore,HA-Pu should be a promising novel material to expand the application of hyaluronic acid in pharmaceatics.
hyaluronic acid;pullulan;chemical grafting;enzyme degradation in vitro
10.3969/j.issn.1000-1565.2017.02.006
2016-08-10
河北省高等学校科学技术研究项目(ZD2016102);河北大学研究生创新项目(X2016071)
杨文智(1972—),男,内蒙古锡林浩特人,河北大学副教授,从事生物医用材料及药物缓控释制剂方面研究.E-mail:wenzhi_yang@sina.com
O
A
1000-1565(2017)02-0141-06
