BIX—01294靶向组蛋白甲基转移酶G9a在小细胞肺癌患者中的应用研究
2017-04-26王丹丹朱丹燕王丹徐文震
王丹丹 朱丹燕 王丹 徐文震
[摘要] 目的 探討BIX-01294靶向组蛋白甲基转移酶G9a在小细胞肺癌患者中的应用。 方法 选择2016年2~8月医院收治的小细胞肺癌患者50例,患者均行手术治疗,取小细胞肺癌病灶标本及相应癌旁正常组织标本,采用HE染色及免疫组化染色检测两种不同标本中BIX-01294靶向组蛋白甲基转移酶G9a表达情况。 结果 50例小细胞肺癌患者中,29例发生淋巴或远处转移,21例未发生转移。50例肿瘤相应癌旁3 cm以上的肺组织均为正常组织。G9a抑制剂BIX-01294在两种组织阳性表达率比较差异有统计学意义(P<0.05);小细胞肺癌G9a抑制剂BIX-01294表达水平与临床分期、肿瘤分级关系密切(P<0.05);G9a抑制剂BIX-01294在小细胞肺癌癌旁组织及小细胞肺癌中均有表达,主要集中在细胞质中,细胞膜及细胞核中也有表达,免疫组化颗粒呈棕黄色。小细胞肺癌组织中29份标本呈阳性表达,50例癌旁组织中,14例阳性表达。 结论 G9a抑制剂BIX-01294在小细胞肺癌组织中表达上调,能调控小细胞肺癌患者Wnt信号通路。
[关键词] 小细胞肺癌;DNA异常甲基化;组化蛋白;Wnt信号通路;BIX-01294靶向组蛋白甲基转移酶G9a
[中图分类号] R734.2 [文献标识码] A [文章编号] 1673-9701(2017)04-0001-04
Study on the application of BIX-01294 targeted histone methyltransferase G9a in the patients with small cell lung cancer
WANG Dandan1 ZHU Danyan1 WANG Dan1 XU Wenzhen2
1.Department of Pharmacy, Taizhou Hospital of Zhejiang Province, Taizhou 318000, China; 2.Department of Thoracic Surgery, Sanmenwan Branch, the First Affiliated Hospital of Zhejiang University, Sanmen 317100, China
[Abstract] Objective To investigate the application of BIX-01294 targeted histone methyltransferase G9a in small cell lung cancer. Methods From February to August 2016, 50 patients with small cell lung cancer who were admitted to our hospital were selected. Patients were given surgical treatment. Small cell lung cancer specimens and the corresponding adjacent normal tissue specimens were collected. The expression of BIX-01294 targeted histone methyltransferase G9a in two different specimens was detected by HE staining and immunohistochemical staining. Results Of the 50 patients with small cell lung cancer, 29 patients had lymphatic or distant metastases and 21 had no metastases. In 50 cases of tumor, the lung tissues adjacent to the cancer 3 cm and above were normal tissues. The positive expression rate of G9a inhibitor BIX-01294 in two tissues was compared, and the differences were statistically significant(P<0.05); the expression level of G9a inhibitor BIX-01294 in small cell lung cancer was closely related to clinical staging and tumor classifications(P<0.05); G9a inhibitor BIX-01294 in paracancerous tissues of small cell lung cancer and small cell lung cancer was expressed, mainly concentrated in the cytoplasm. It was also expressed in cell membrane and nucleus, and immunohistochemical particles were brown. In the small cell lung cancer tissues, 29 specimens were positively expressed. In 50 cases of paracancerous tissue, 14 cases were positively expressed. Conclusion G9a inhibitor BIX-01294 is up-regulated in small cell lung cancer and can regulate Wnt signaling pathway in small cell lung cancer.
[Key words] Small cell lung cancer; DNA aberrant methylation; Immunohistochemical protein; Wnt signaling pathway; BIX-01294 targeted histone methyltransferase G9a
肺癌是临床上常见的恶性肿瘤,我国肺癌每年发病人数超过100万,并且以每年26.9%的速度迅速增长,虽然临床对于肺癌技术的治疗取得了较大的发展,但是患者5年生存率低于15%。因此,肺癌已经取代肝癌成为恶性肿瘤死亡的主要原因[1]。根据病理特征不同,临床上将肺癌分为两类:非小细胞肺癌(包括肺腺癌、肺鳞癌、大细胞肺癌)和小细胞肺癌[2]。小细胞肺癌占肺癌的20.0%~25.0%,但是具有恶性程度最高、分化最低的一类肿瘤。目前,临床上对于肺癌发病机制尚不完全知晓,多与吸烟、环境污染等有关,且随着环境污染的加重,导致小细胞肺癌发生率呈现上升及年轻化趋势,严重影响我国居民健康[3]。
组蛋白修饰是指发生在组蛋白氨基酸残基上一系列化学修饰,主要包括乙酰化、甲基化、磷酸化等[4]。而组蛋白修饰则是表性遗传的一种主要机制,在多种肿瘤的发生、发展中发挥了重要的作用[5]。G9a是一种组蛋白甲基化转移酶,主要负责常染色质区域蛋白H3中K9及K27位点的甲基化[6]。G9a可以通过两种不同的机制完成基因转录的调控,一方面能促进基因启动子区域组蛋白或DNA甲基化,能有效地甲基化。而G9a能作为脚手架蛋白进一步激活转录因子,从而能促进基因的转录[7]。文献报道显示[8],BIX-01294靶向组蛋白甲基转移酶G9a能直接参与肿瘤的发生、发展,但是该机制尚不完全知晓。为探讨BIX-01294靶向组蛋白甲基转移酶G9a在小细胞肺癌患者中的应用,取2016年2~8月医院收治的小细胞肺癌患者50例,现报道如下。
1 资料与方法
1.1 临床资料
选择2016年2~8月医院收治的小细胞肺癌患者50例,男31例,女19例,年龄39~79岁,平均(60.14±4.21)岁。肿瘤组织病理分级:高分化23例,中分化12例,低分化15例。TNM分期: Ⅰ~Ⅱ期22例,Ⅲ~Ⅳ期28例。29例发生淋巴或远处转移,21例未发生转移。纳入标准:①符合小细胞肺癌临床诊断标准;②均经过手术病理检查最终确诊为小细胞肺癌;③患者均行手术治疗,术中取病灶组织及癌旁组织;④对本课题知情同意,自愿签署知情同意书。排除标准:①排除不符合小细胞肺癌临床诊断标准者;②排除合并有影响效应指标观测、判断其他生理或病理者;③排除合并由于电解质紊乱以及酸碱平衡失调引起的心律失常。不同患者性别、年龄、肿瘤组织病理分级及TNM分期比较差异无统计学意义。
1.2主要仪器与试剂
为保证试验顺利完成,采用的主要仪器和试剂主要由倒置相差显微镜(Leica,Germany )、兔抗人G9a抗体(美国 Upsate 公司)、Ultrasensitive TMS-P试剂盒(福州迈新生物有限公司)、石蜡切片机(德国 Leica RM2016)、数码医学图像分析系统(德国Motic Med 6.0B)、电热恒温培养箱(上海跃进医疗器械厂)、DAB显色试剂盒(中杉公司)等。
1.3 方法
采用HE染色及免疫组化染色检测两种不同标本中BIX-01294靶向组蛋白甲基转移酶G9a表达情况。对每一例病理标本连续制备3张4 μm切片,并进行染色。抗G9a抗体稀释浓度为1:100,PBS代替一抗作为对照。(1)HE染色。取新鲜的病灶组织及癌旁组织,放入10.0%中性甲醛溶液中固定,常规脱水、透明,浸润包埋后处理,采用切片机制备4 μm切片,HE染色,倒置显微镜下观察细胞的形态[9,10]。(2)免疫组化染色。制备4 μm石蜡切片,采用二甲苯脱蜡、乙醇水化,利用高压锅高温、高压下进行抗原修复,自然冷却后水洗采用PBS在pH为7.4下进行漂洗,滴加50 μL兔抗人G9a抗体,放入4℃冰箱中过夜,采用PBS进行冲抵,滴加50 μL二抗(酶标抗兔聚合物)在37℃孵育,采用PBS进行3次冲洗,加入DAB显色剂显色,利用自来水进行漂洗,苏木精衬染及蓝花,梯度乙醇脱水后,二甲苯透明,中性树脂胶封片,倒置显微镜下观察细胞形态[11,12]。
1.4 判断标准
(1)HE染色。采用单盲法对病理学进行复查,确诊为小细胞肺癌,并进行病理分级。(2)G9a抑制剂BIX-01294免疫组化表达判断标准。对病灶组织与癌旁组织采用二级积分法进行判定[13]。①根据染色范围进行积分。着色范围<1%记为0分,1%~19%记1分,20%~50%记2分,>50%记3分;②根据着色程度进行评分。无着色记0分,较浅记1分,较深着色记2分。将两种评分相加作为总计分。总得分≤1.9分为阴性(-),2.0~2.9分弱阳性(+),3.0~3.9分为阳性(2+),≥4.0分为强阳性[14,15]。
1.5 统计学分析
采用SPSS18.0统计学软件处理,计数资料以[n(%)]表示,采用χ2检验,计量资料以(x±s)表示,采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 50例小細胞肺癌患者HE染色结果
50例小细胞肺癌患者中,29例发生淋巴或远处转移,21例未发生转移。50例肿瘤相应癌旁3 cm以上的肺组织均为正常组织。
2.2 G9a抑制剂BIX-01294在小细胞肺癌组织及正常组织中的表达
G9a抑制剂BIX-01294在50例胃癌患者中29例阳性表达,21例表达缺失,阳性表达率为58.0%。而在50例癌旁组织中,14例阳性表达,36例表达缺失,阳性表达率为28.0%,两种组织阳性表达率比较差异有统计学意义(P<0.05),见封三图1。
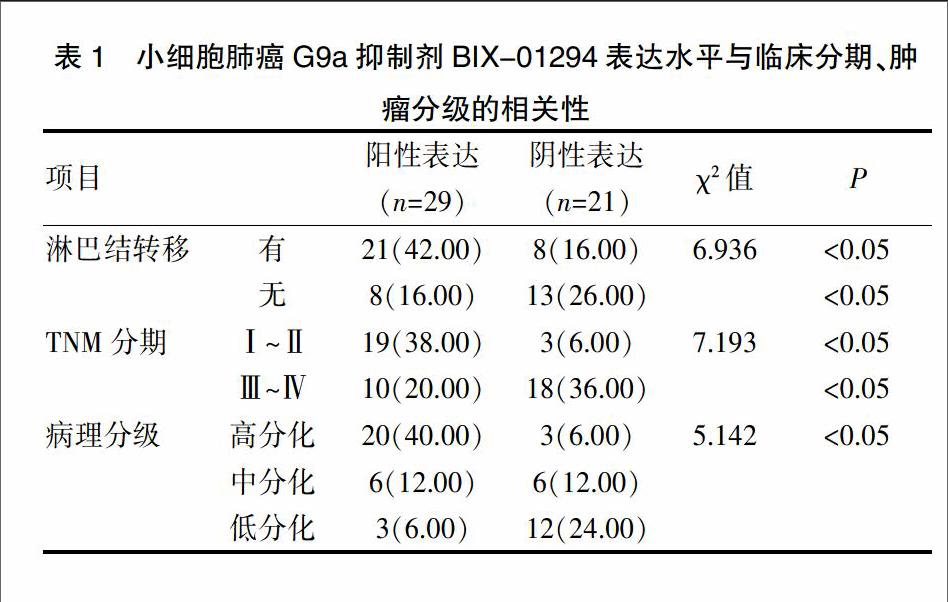
2.3 小细胞肺癌G9a抑制剂BIX-01294表达水平与临床分期、肿瘤分级的相关性
小细胞肺癌G9a抑制剂BIX-01294表达水平与临床分期、肿瘤分级关系密切(P<0.05),见表1。
表1 小细胞肺癌G9a抑制剂BIX-01294表達水平与临床分期、肿瘤分级的相关性
2.4 小细胞肺癌G9a抑制剂BIX-01294表达水平免疫组化染色结果
G9a抑制剂BIX-01294在小细胞肺癌癌旁组织及小细胞肺癌中均有表达,主要集中在细胞质中,细胞膜及细胞核中也有表达,免疫组化颗粒呈棕黄色。小细胞肺癌组织中29份标本呈阳性表达,50例癌旁组织中,14例阳性表达,见封三图2。
3讨论
肺癌是临床上常见的恶性肿瘤,根据WHO最新报道,2015年全世界每年有640万人死于肺癌,比2005年增加了100万。我国每年肺癌新增例数超过100万,成为世界上“肺癌第一大国”。临床根据肺癌的病理特征不同将其分为非小细胞肺癌和小细胞肺癌[16,17]。前者又分为肺腺癌、肺鳞癌及大细胞肺癌。数据报道显示,小细胞肺癌仅占肺癌的20.0%~25.0%,是肺癌中恶性程度最高、分化最低的恶性肿瘤。流行病学调查研究显示[18],小细胞肺癌发病年龄在30~70岁之间,且男性多于女性,起源于支气管黏膜或腺上皮内的Kulchitsky细胞,具有一定的神经内分泌功能。
组蛋白甲基化是染色质结构改变和基因转录的重要调控机制,多于肿瘤的发生、发展有关。组蛋白甲基化转移酶是一类催化1~3个甲基基团转移到组蛋白赖氨酸或精氨酸上的酶[19,20]。而G9a属于含SET结构的Suv39h蛋白家族成员之一,属于小细胞肺癌中比较重要的常染色质HMT,在肺癌的发生、发展中发挥重要的作用。本研究中,50例小细胞肺癌患者中,29例发生淋巴或远处转移,21例未发生转移。50例肿瘤相应癌旁3 cm以上的肺组织均为正常组织。从大的角度来说,G9a又称为常染色质组蛋白赖氨酸N-甲基转移酶-2,在哺乳动物中相对保守。数据报道显示,人源、牛源、大鼠与小鼠G9a同源性高达95.0%。而小鼠G9a的N端含谷氨酸和半胱氨酸区域,可能参与G9a自身的甲基化。同时,G9a在多种组织中表达[21]。相关学者对正常不同小鼠G9a表达进行测定,结果显示:G9a在肌肉、心脏、脑等组织中存在高表达,而在白色脂肪、脾脏及肺部组织中表达相对较低。当机体肺部组织发生异常后,G9a水平将会出现上升趋势[22]。本研究中,G9a抑制剂BIX-01294在50例胃癌患者中29例阳性表达,21例表达缺失,阳性表达率为58.0%。而在50例癌旁组织中,14例阳性表达,36例表达缺失,阳性表达率为28.0%,两种组织阳性表达率比较差异有统计学意义(P<0.05)。
G9a抑制剂BIX-01294是继Suv39h1后发现的第2个哺乳动物中甲基化赖氨酸的HMT,能直接作用在H3K9和K27等位点[23]。同时,G9a抑制剂BIX-01294能将甲基从SAM转移到目的氨基上,从而能有效地抑制基因的转录。同时,G9a抑制剂BIX-01294与GLP关系密切,人源G9a抑制剂BIX-01294与GLP的相似度达到45.0%。此外,G9a抑制剂BIX-01294不仅能调控组蛋白的甲基化,还能调控DNA甲基化程度,并且能在DNA甲基转移酶的作用下出现高表达。本研究中,小细胞肺癌G9a抑制剂BIX-01294表达水平与临床分期、肿瘤分级关系密切(P<0.05)。由此看出:G9a抑制剂BIX-01294在小细胞肺癌中具有高表达,并且其表达水平与肿瘤的临床分期、肿瘤的分级等有关。因此,小细胞肺癌患者治疗过程中应该加强G9a抑制剂BIX-01294水平监测,根据监测结果调整治疗方案,使得患者的治疗更具针对性[24]。本研究中,G9a抑制剂BIX-01294在小细胞肺癌癌旁组织及小细胞肺癌中均有表达,主要集中在细胞质中,细胞膜及细胞核中也有表达,免疫组化颗粒呈棕黄色。小细胞肺癌组织中29份标本呈阳性表达,50例癌旁组织中,14例阳性表达。文献报道显示:G9a抑制剂BIX-01294能有效地促进肿瘤的发生、发展,能持续引发自噬,从而引起癌细胞的增殖和分化,并且G9a抑制剂BIX-01294能座位癌细胞自噬诱导剂,能为癌症的治疗提供新的思路和方法[25]。
综上所述,G9a抑制剂BIX-01294在小细胞肺癌组织中表达上调,能调控小细胞肺癌患者Wnt信号通路,直接参与肿瘤的发生、发展,加强G9a抑制剂BIX-01294监测能为临床治疗提供依据和参考。
[参考文献]
[1] Kim Y,Kim YS,Kim DE,et al.BIX-01294 induces autophagyassociated cell death via EHMT2/G9a dysfunction and intracellular reactive oxygen species production[J]. Autophagy,2013,9(12):212621-212639.
[2] 冯兵,朱莹,贺嵩敏,等.罗勒多糖对缺氧条件下肝癌细胞组蛋白H3K9me2甲基化及G9a、JMJD1A表达的影响[J].中药材,2015,38(7):1460-1465.
[3] 李青云,郝亚荣,秦健,等.BIX-01294对肝癌细胞增殖能力的影响[J].中华肿瘤防治杂志,2016,23(8):487-492.
[4] Ding J,Li T,Wang X,et al.The histone H3 methyltransferase G9A epigenetically activates the serine-glycine synthesis pathway to sustain cancer cell survival and proliferation[J].Cell Metab,2013,18(6): 896-907.
[5] 张真真,杨娇娇,居玲莎,等.组蛋白甲基转移酶 G9a 在七氟醚致乳鼠远期认知功能损伤中的作用[J].临床麻醉学杂志,2016,32(9):901-904.
[6] 薛伟丽,孙瑜,郑凌.组蛋白甲基化转移酶G9a的最新研究进展[J].生命科学仪器,2015,14(2):23-29.
[7] 杜漸,谭广,罗海峰,等.下调组蛋白甲基转移酶EZH2对人胰腺癌细胞RUNX3基因表达及增殖、凋亡的影响[J].中华肝胆外科杂志,2016,22(4):249-252.
[8] 刘奔,张熙凝,陈可欣.组蛋白赖氨酸甲基转移酶SET8对蛋白的甲基化修饰及与肿瘤相关性的研究进展[J].中国肿瘤临床,2015,42(15):765-769.
[9] Oyer JA,Huang X,Zheng Y,et al.Point mutation E1099K in MMSET/NSD2 enhances its methyltranferase activity and leads to altered global chromatin methylation in lymphoid malignancies[J]. Leukemia,2014,28(1):198-201.
[10] 齐琳洁,袁媛,黄璐琦,等.金银花组蛋白甲基转移酶基因生物信息学及表达分析[J].中国中药杂志,2015,40(11):2062-2067.
[11] 亢盼,李朝阳,牛侨.亚慢性铝暴露对大鼠学习记忆能力及组蛋白H3K4甲基转移酶影响研究[J].中国职业医学,2015,42(5):510-515.
[12] 崔昂,崔龙.组蛋白三甲基转移酶SETD2与肿瘤发生发展的关系[J].中国肿瘤生物治疗杂志,2016,23(1):119-123.
[13] 孙芳,潘云,李艳.组蛋白修饰在常见血液系统肿瘤中作用的研究进展[J].中国实验血液学杂志,2015,23(4):1184-1189.
[14] 郇通,潘云,李艳.NSD家族组蛋白甲基化转移酶与肿瘤发生[J].中国细胞生物学学报,2015,35(5):728-733.
[15] Shiba N,Ichikawa H,Taki T,et al.NUP98-NSD1 gene fusion and its related gene expression signature are strongly associated with a poor prognosis in pediatric acute myeloid leukemia[J].Genes Chromosomes Cancer,2013,52(7):683-693.
[16] Akiki S,Dyer SA,Grimwade D,et al.NUP98-NSD1 fusion in association with FLT3-ITD mutation identifies a prognostically relevant subgroup of pediatric acute myeloid leukemia patients suitable for monitoring by real time quantitative PCR[J]. Genes Chromosomes Cancer,2013,52(11):1053-1064.
[17] Yang S,Zhang Y,Meng F,et al.Overexpression of multiple myeloma SET domain(MMSET) is associated with advanced tumor aggressiveness and poor prognosis in serous ovarian carcinoma[J]. Biomarkers,2013,18(3):257-263.
[18] Ezponda T,Popovic R,Shah MY,et al. The histone methyltransferase MMSET/WHSC1 activates TWIST1 to promote an epithelial-mesenchymal transition and invasive properties of prostate cancer[J]. Oncogene,2013,32(23):2882-2890.
[19] Kuo CH,Chen KF,Chou SH,et al.Lung tumor-associated dendritic cell-derived resistin promoted cancer progression by increasing Wolf-Hirschhorn syndrome candidate 1/Twist pathway[J].Carcinogenesis,2013,34(11):2600-2609.
[20] 刘腾,瞿鑫兰,王子一,等.多氯联苯暴露对着床期子宫内膜组织中组蛋白甲基化转移酶的影响[J].武汉大学学报(医学版),2015,36(6):849-852.
[21] 关景云,杨阳,邱春红,等.组蛋白乙酰转移酶MOF在多发性硬化发病机制中的作用[J].山东大学学报(医学版),2016,54(2):27-32.
[22] 李智佳,章海波,杨柳,等.肺癌mdig基因对组蛋白H3及H4部分位点赖氨酸残基甲基化状态的作用[J].中国当代医药,2016,23(20):11-14.
[23] 韦秀望,易晓明,唐朝朋,等.肾细胞癌组织中的组蛋白甲基化酶表达及其临床意义[J].医学研究生学报,2015,28(10):1048-1052.
[24] 董杰,王龙信,唐朝朋,等.转化生长因子β不敏感的树突状细胞疫苗对肾细胞癌荷瘤小鼠细胞毒性T淋巴细胞的影响[J].医学研究生学报,2013,26(5):455-459.
[25] 唐朝朋,徐振宇,周文泉,等.加速康复外科在后腹腔镜肾上腺切除术中的应用[J].医学研究生学报,2014,27(8):829-832.
(收稿日期:2016-12-06)
