原发性肝细胞癌中内源性大麻素的含量变化及其意义
2017-04-25邱福南张昳博林天生田毅峰
邱福南, 李 蕾, 张昳博, 林天生, 任 杰, 田毅峰
原发性肝细胞癌中内源性大麻素的含量变化及其意义
邱福南1, 李 蕾2, 张昳博2, 林天生1, 任 杰2, 田毅峰1
目的 检测并比较临床肝癌组织与相应癌旁组织中内源性大麻素及其相关受体、合成代谢酶的含量变化,为寻找肝癌新型标志物和治疗靶点提供依据。 方法 采用HPLC-MS检测47例肝癌组织以及相应癌旁组织的内源性大麻素含量,采用RT-PCR和Western-blot法检测相关受体及合成代谢酶的mRNA、蛋白表达。 结果 在肝癌组织中,内源性大麻素2-花生四烯酰甘油酯(2-AG)含量最高,且显著高于癌旁组织(P<0.01);内源性大麻素花生四烯酰乙醇胺(AEA)的含量最低,且显著低于癌旁组织(P<0.05)。类内源性大麻素油酰乙醇胺(OEA)和棕榈酰乙醇胺(PEA)的含量在肝癌组织与癌旁组织中未检测到显著差异。肝癌组织中2-AG受体CB2的表达较癌旁组织显著上升(P<0.05);AEA受体CB1的表达则呈显著下降趋势(P<0.05)。 结论 肝癌组织中内源性大麻素系统发生了显著变化,提示2-AG高表达和AEA低表达可能对原发性肝细胞癌的形成和发展具有重要作用。
癌,肝细胞; 内源性大麻酚类; 受体,大麻酚; 水解酶类
原发性肝细胞癌(hepatocellular carcinoma, HCC)是肝脏主要的恶性肿瘤,癌症初期症状不明显且癌变发展迅速。虽然手术切除、移植、化疗、放疗以及化学药物的联合使用等一系列疗法提高了HCC患者的生存率,但是进一步探索其肿瘤生成机制,寻找新的肿瘤标志物及治疗靶点仍是研究的重中之重。
近年来,随着对内源性脂质代谢与癌症相关性研究的深入,人们逐步发现内源性大麻素系统与多种肿瘤的发生发展密切相关[1-4]。内源性大麻素花生四烯酰乙醇胺(anandamine, AEA)和2-花生四烯酰甘油酯(2-arachidonoylglycerol, 2-AG)分别是大麻素受体1和2(canabinoid receptors 1 and 2, CB1和CB2)的天然受体,与大麻中的主要活性成分四氢大麻酚具有类似的药理作用。在乳腺癌、前列腺癌、直肠癌及脑胶质瘤等肿瘤细胞中均可观察到内源性大麻素通过激活大麻素受体诱导肿瘤细胞凋亡和自噬,抑制肿瘤细胞增殖[1-4]。大麻素系统可能成为抗肿瘤药物研发的重要靶点之一。
目前关于内源性大麻素系统在肝癌中的调节及其可能的作用机制尚不完全明确。笔者回顾性分析2013年6月-2015年6月47例肝癌患者的临床病理资料,检测上述临床肝癌组织以及相应癌旁组织的内源性大麻素含量,同时检测相关受体和合成代谢酶的表达,分析内源性大麻素表达差异的原因,并探索其在HCC中的作用。
1 材料与方法
1.1 材料 肝癌组织及癌旁组织均来自笔者医院肝胆外科,经过病理学验证为HCC。手术后分离部分组织,在液氮中速冻为冰冻样本后在-80 ℃冰箱中长期保存。共计47人94份组织,包括肝癌组织47份,对应癌旁组织47份,基本资料见表1,2。
1.2 试剂 (类)内源性大麻素标准品AEA,2-AG,油酰乙醇胺(oleylethanolamide,OEA)和棕榈酰乙醇胺(palmitoylethanolamide,PEA)(美国Sigma公司);逆转录试剂盒(日本Toyobo公司);蛋白酶抑制剂(瑞士Roche公司);BCA蛋白定量试剂(美国Thermo公司);5×蛋白上样液(美国Thermo公司);Tris-HCl(中国索莱宝公司);BSA(中国索莱宝公司);脱脂奶粉(中国伊利乳业);Marker蛋白(美国Thermo公司);Hybond PVDF膜(美国Bio-rad公司);柱层析硅胶(中国黄海化学试剂公司);甲醇(美国Sigma 公司,色谱纯);氯仿(中国西陇化工有限公司),CB1及CB2一抗(英国Abcam公司),抗兔二抗(美国Thermo公司),β-actin抗体(美国Cayman公司),ECL试剂(A+B)(美国Advansta公司)。
1.3 方法
1.3.1 内源性脂质检测 精密称取50 mg组织于8 mL圆底玻璃瓶中,加入含1 nmoL内参17∶1脂肪酰基乙醇胺(fatty acid ethanolamides,FAE)的裂解液2 mL,匀浆混匀。每管取出50 μL,BCA法测定蛋白浓度,剩余液每管加入3 mL氯仿,涡旋5 min,4 ℃ 3 000 r/min离心10 min。转移下层液体至干净尖底玻璃离心管中,氮气吹干,加入1 mL氯仿复溶。将氯仿溶液转移至硅胶柱,1 mL氯仿洗脱,合并收集洗脱液,氮气吹干。加入100 μL溶剂(甲醇∶氯仿=3∶1)溶解,转移至进样瓶中,-80 ℃保存。
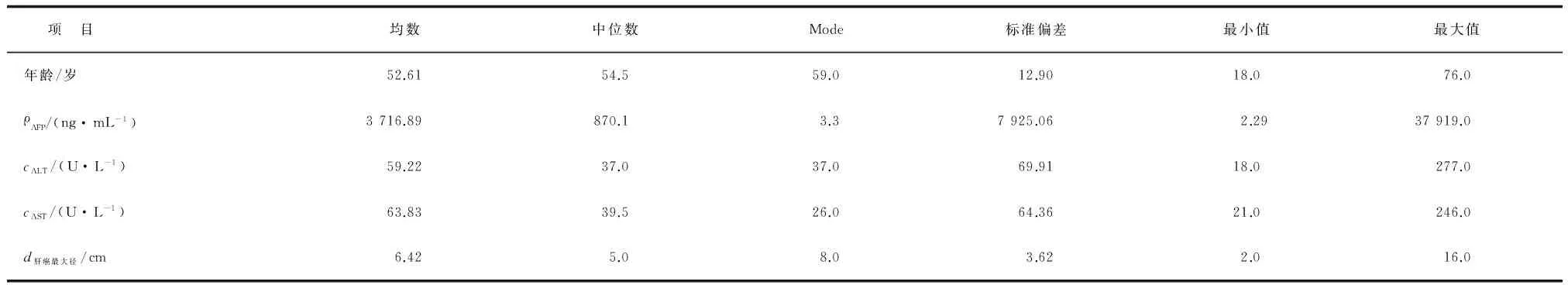
表1 47例肝癌病例的临床病理特点
AFP:甲胎蛋白; ALT:谷丙转氨酶; AST:谷草转氨酶.
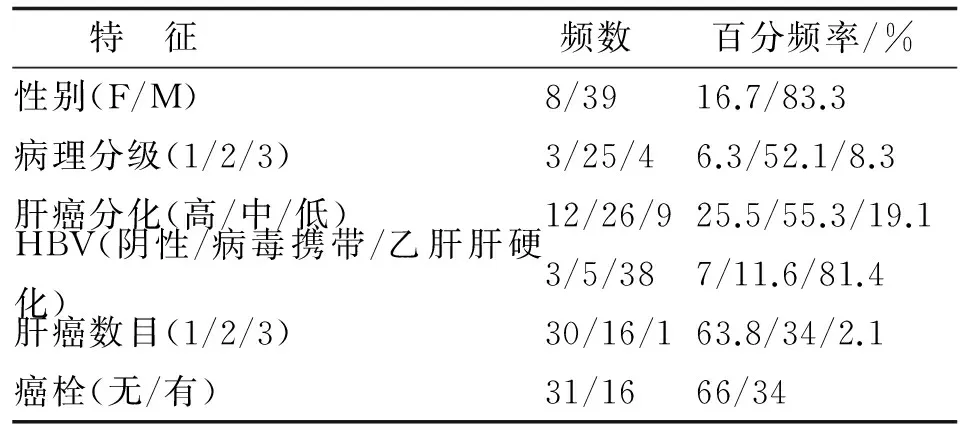
表2 临床样本资料
HBV:乙型肝炎病毒.
使用安捷伦1200 HPLC串联AB 3200 Q-Trap MS检测内源性大麻素含量,色谱柱为Agilent公司XDS-C18,4.6×5.0 mm,1.8 μm。梯度洗脱条件为:0~3 min,15% A相(纯水)和85% B相(甲醇);3~5 min,B相由85%匀速上升为100%;5~20 min,100% B相作为流动相;20~22 min,100% B相匀速下降为85%,A相由0上升为15%。多离子反应监控模式检测内源性脂质含量,离子对分别为:AEA(348.0,62.0),2-AG(379.3,287.3),OEA(326.1,62),PEA(300.2,62),17∶1 FAE(313.0,62)。
标准品加入至裂解液中稀释成终浓度为20,10,5,2.5,1.25,0.625和0.312 5 nmol/L共7个浓度点,和上述脂质提取分析方法一致,经过萃取,吹干,复溶等步骤,与样品同时检测,绘制标准曲线。
1.3.2 RT-PCR检测 称取20 mg左右的组织样本于2 mL EP管中,加入1 mL Trizol裂解液,在冰上匀浆为混悬液,于无核酶条件下采用RNA提取试剂盒提取总RNA。测定RNA浓度,按照TOYOBO逆转录试剂盒说明书进行操作。
利用Primerpremier 5.0软件设计相关受体及合成代谢酶的引物,由上海生工生物工程公司合成,引物序列:
h18S基因
上游:5’-GTGCATGGCCGTTCTTAGTT-3’
下游:5’-CGGACATCTAAGGGCATCAC-3’
hFAAH基因
上游:5’-GAACTGCAGCACGAGATCGA-3’
下游:5’-CCCTCCACTGGCAATCA-3’
hNAPE-PLD基因
上游:5’-AATCCGTGGCCAACATGGA-3’
下游:5’-TTGGACCCATGTACCTGCGATG-3’
hMAGL基因
上游:5’-CAAGGCCCTCATCTTTGTGT-3’
下游:5’-CAAGGCCCTCATCTTTGTGT-3’
hDGL基因
上游:5’-TGCTCTTCGGCCTGGTCTAT-3’
下游:5’-CGCATGCTCAGCCAGATGAT-3’
hCB1基因
上游:5’-CCACTCCCGCAGCCTCCG-3’
下游:5’--ATCAGGCAAAACGCCACCAC-3’
hCB2基因
上游:5’-GGTGACAGAGATAGCCAATG-3’
下游:5’-GCCAATGAACAGGTATGAGG-3’
1.3.3 蛋白检测 称取约50 mg左右的组织,放置于2 mL EP管,PBS清洗,加入RIPA裂解液500 μL(用时加入蛋白酶抑制剂),在冰上充分匀浆,4 ℃ 12 000 r/min离心15 min提取总蛋白。BCA法测定蛋白浓度。取20 μL蛋白样品,通过电转印法转膜,5%脱脂牛奶常温封闭1 h后加入1∶500~1∶1 000的一抗,4 ℃摇动孵育过夜;TBST洗膜后加入稀释浓度为1∶10 000的二抗,37 ℃摇床孵育1 h,加入ECL显色剂后,使用凝胶成像系统扫描光密度值,Quantity One软件分析不同蛋白的相对表达量。
2 结 果
2.1 内源性大麻素的表达 不同内源性大麻素在组织中含量相差很大,以每mg蛋白为单位,2-AG含量最高(约为100 pmol/mg),OEA和PEA的含量约为1 pmol/mg,而AEA在外周的含量最低,仅为0.1 pmol/mg。与癌旁组织比较,肿瘤组织中AEA的含量略有降低(P<0.05,图1),2-AG显著上升(P<0.01);而类内源性大麻素OEA和PEA表达无显著性差异(P>0.05,图1)。
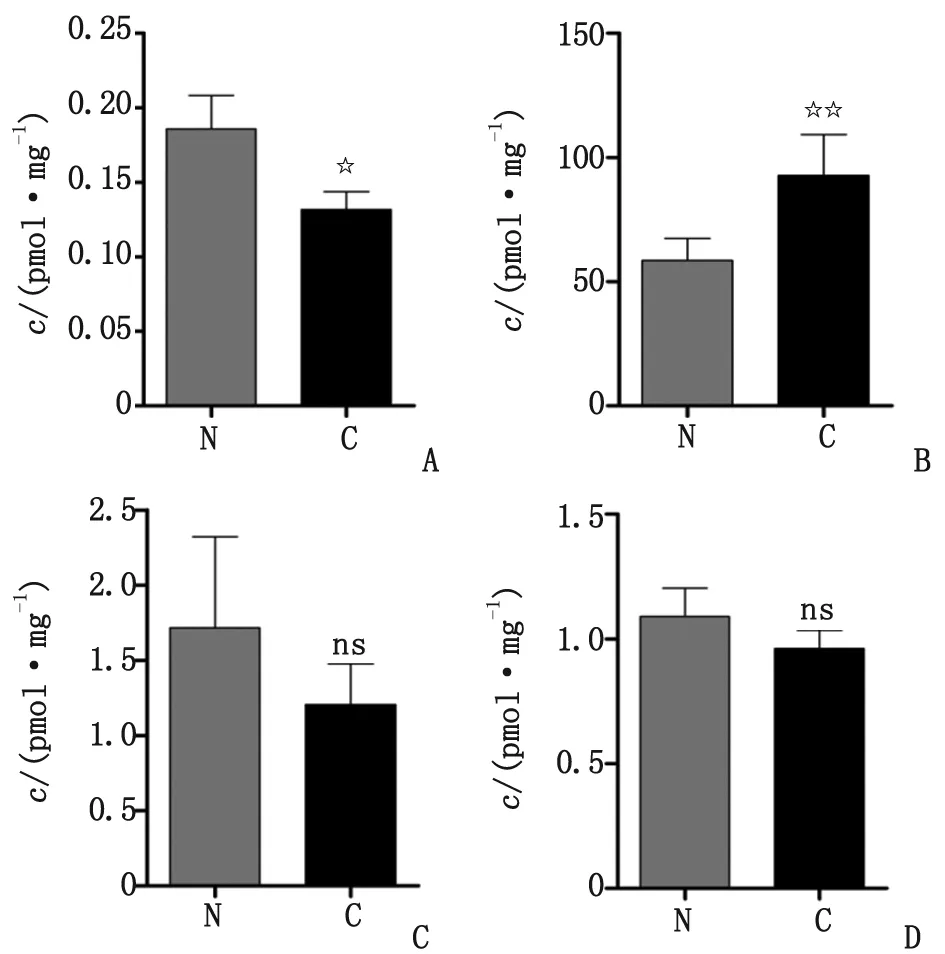
AEA:花生四烯酰乙醇胺; 2-AG:2-花生四烯酰基单甘油酯; OEA:油酰乙醇胺; PEA:棕榈酰乙醇胺. N:癌旁肝组织;C:原发性肝细胞癌组织. A:AEA; B:2-AG; C:OEA; D:PEA. 与癌旁肝组织比较,☆:P<0.05;☆☆:P<0.01.图1 HPLC-MS检测内源性脂质在原发性肝癌肿瘤组织和癌旁肝组织中的表达结果Fig 1 The expression of endogenous lipids in HCC tissues and adjacent tissues was detected by HPLC-MS
2.2 AEA和2-AG的合成、分解酶的表达 通过荧光实时定量PCR分别检测AEA和2-AG的合成、分解酶的表达,结果表明,AEA合成酶(N-acetylphosphatidylethanolamine-hydrolysing phospholipase D, NPLD)的mRNA表达无明显变化(P>0.05),而其降解酶(fatty acid amide hydrolase, FAAH)的mRNA表达明显上升(P<0.05,图2)。RT-PCR检测结果还显示,另一种重要的内源性大麻素2-AG合成酶(diacylglycerol lipase, DGL)的mRNA水平显著升高(P<0.001),而其水解酶(monoacylglycerol lipase, MAGL)的mRNA也略有升高(P<0.05,图2)。
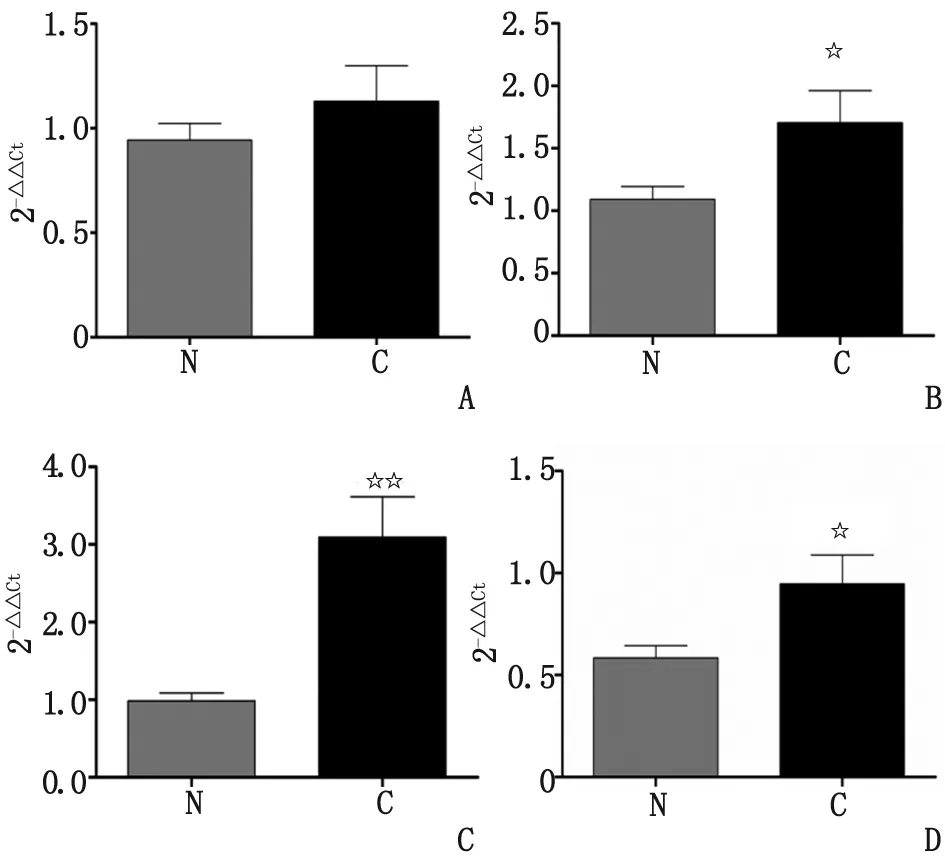
N:癌旁肝组织; C:原发性肝细胞癌组织; NPLD:N-乙酰磷脂酰乙醇胺水解磷脂酶D; FAAH:脂肪酰胺水解酶; DGL:二酰基甘油脂肪酶; MAGL:单酰基甘油脂肪酶. A:NPLD; B:FAAH; C:DGL; D:MAGL. 与癌旁肝组织比较,☆:P<0.05;☆☆:P<0.001.图2 内源性大麻素合成、代谢酶在原发性肝癌肿瘤组织和癌旁肝组织中的mRNA表达Fig 2 mRNA expression of endocannabinoids synthetase and hydrolase in HCC tissues and adjacent tissues
2.3 大麻素受体的表达 AEA在外周表达较低,其主要作用受体为CB1;而2-AG在外周表达较高,其主要作用受体为CB2。CB1在肿瘤组织中较癌旁组织略有下降(P<0.05),而CB2受体在肿瘤组织中有所上升(P<0.05,图3),说明在肿瘤组织中,2-AG可能通过激活CB2受体发挥作用,影响肿瘤组织的发生发展。
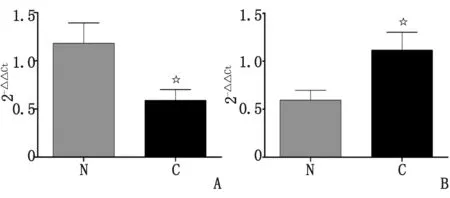
N:癌旁肝组织; C:原发性肝细胞癌组织; CB:大麻素受体.A:CB1; B:CB2. 与癌旁肝组织比较,☆:P<0.05.图3 内源性大麻素受体在原发性肝癌肿瘤组织和癌旁肝组织中的mRNA表达Fig 3 mRNA expression of cannabinoid receptors in HCC tissues and adjacent tissues
3 讨 论
在多种肿瘤组织中,都可观察到AEA和2-AG表达较对应的癌旁组织有较大幅度的提高,如胶质母细胞瘤、脑膜瘤、垂体腺瘤、前列腺癌、结肠癌和子宫内膜肉瘤等[5-9]。文献显示,在正常的肠癌组织中,AEA的含量约为75 nmol/L,但在结肠癌组织中,约提高2~3倍[9]。许国旺等通过HPLC/MS检测HCC患者血清中内源性脂质含量,提示HCC患者血清AEA水平较健康对照者显著升高[10]。本研究中,HCC患者肝癌样本中AEA水平较癌旁组织略有降低,与文献报道相反。笔者认为可能有以下原因:(1)样本来源不一致,文献使用的是HCC患者的血清。血清中的内源性脂质水平并不能完全代表肝脏的表达量。本研究使用的是肝癌组织样本,更能客观地反映肝癌病变过程中内源性脂质变化;(2)文献是HCC患者与健康人群进行对比,反映的是疾病发生过程中人体系统环境中AEA的改变,可能会受到其他并发症或者机体免疫系统的影响,而本研究所反映的结果显示局部病变环境AEA的改变,针对性更强。
AEA主要分布于中枢神经系统,在外周神经及身体各器官组织分布较少,多项研究均认可AEA主要通过激活CB1受体等发挥抗肿瘤的作用[3,11]。本研究结果显示,肝癌细胞可能通过诱导AEA和其受体CB1的表达下降,规避抗肿瘤作用。具体分析显示,在肝癌组织样本中,AEA的水解酶FAAH表达明显升高,而合成酶NPLD没有显著变化,说明AEA的分解速度大于合成速度,肝癌细胞可能通过提高FAAH表达,抑制AEA-CB1的抗肿瘤作用。与肝星状细胞比较,肝细胞通过高表达FAAH保护自身免受AEA诱导的伤害[12],肝细胞癌变过程中是否通过进一步促进FAAH表达逃避AEA诱导的凋亡?CB1受体在AEA水平下降的情况下为什么没有反馈性升高?上述问题值得进一步深入研究。抑制FAAH、激活CB1可能作为抑制HCC发生发展的新策略[13]。
另一种主要的内源性大麻素2-AG主要分布于外周组织中,因此肝癌组织样本中2-AG的水平明显高于AEA。本结果显示,在HCC患者肿瘤样本中,2-AG的表达较癌旁组织显著升高,这个发现与在脑胶质瘤、宫颈癌、子宫内膜癌等的研究一致[4,14-15]。在肝癌组织中,2-AG的合成和代谢速度均显著升高,但合成速度显著优于分解速度。
与2-AG显著升高相一致,肝癌组织中CB2受体的表达也呈上升趋势。2-AG可抑制前列腺癌细胞增殖和侵袭[8,16],CB2受体也被认为可以作为治疗慢性肝病如肝纤维化、脂肪肝等疾病的靶标[17-19],但尚未见对治疗肝癌的相关报道,这可能与2-AG能诱导活化的肝星状细胞凋亡,但不能诱导肝细胞凋亡有关[17]。2-AG/CB2体系在肝癌组织中表达显著升高的生理和病理意义,仍需要更多的研究进行探讨。
[1] Ligresti A,Bisogno T,Matias I,etal.Possible endocannabinoid control of colorectal cancer growth[J].Gastroenterology,2003,125(3):677-687.
[2] Nithipatikom K,Isbell M A,Endsley M P,etal. Anti-proliferative effect of a putative endocannabinoid, 2-arachidonylglyceryl ether in prostate carcinoma cells[J].Prostaglandins&OtherLipidMediators, 2011,94(1-2):34-43.
[3] Picardi P,Ciaglia E,Proto M C,etal.Anandamide inhibits breast tumor-induced angiogenesis[J].Translationalmedicine,2014,10(10):8-12.
[4] Wu X,Han L,Zhang X,etal.Alteration of endocannabinoid system in human gliomas[J].JNeurochemistry,2012,120(5):842-849.
[5] Petersen G,Moesgaard B,Schmidet P,etal.Endocannabinoid metabolism in human glioblastomas and meningiomas compared to human non-tumour brain tissue[J].JNeurochemistry,2005,93(2):299-309.
[6] Pagotto U,Marsicano G,Fezza F,etal.Normal human pituitary gland and pituitary adenomas express cannabinoid receptor type 1 and synthesize endogenous cannabinoids: first evidence for a direct role of cannabinoids on hormone modulation at the human pituitary level 1[J].JClinicalEndocrinology&Metabolism,2001,86(6):2687-2696.
[7] Schmid P C,Wold L E,Krebsbach R J,etal.Anandamide and other N-acylethanolamines in human tumors[J].Lipids,2002,37(9):907-912.
[8] Nithipatikom K,Endsley M P,Isbell M A,etal.2-Arachidonoylglycerol a novel inhibitor of androgen-independent prostate cancer cell invasion[J].CancerResearch,2004,64(24):8826-8830.
[9] Chen L,Chen H,Li Y,etal.Endocannabinoid and ceramide levels are altered in patients with colorectal cancer[J].OncologyReports,2015,34(1):447-454.
[10] Zhou L,Ding L,Yin P,etal.Serum metabolic profiling study of hepatocellular carcinoma infected with hepatitis B or hepatitis C virus by using liquid chromatography mass spectrometry[J].JProteomeResearch,2012,11(11):5433-5442.
[11] Soliman E,van Dross R. Anandamide-induced endoplasmic reticulum stress and apoptosis are mediated by oxidative stress in non-melanoma skin cancer: Receptor-independent endocannabinoid signaling[J].Molecularcarcinogenesis,2015,55(11):1807-1821.
[12] Siegmund S V,Wojtalla A,Schlosser M,etal.Fatty acid amide hydrolase but not monoacyl glycerol lipase controls cell death induced by the endocannabinoid 2-arachidonoyl glycerol in hepatic cell populations[J].BiochemicalandBiophysicalResearchCommunications,2013,437(1):48-54.
[13] Ravi J,Sneh A,Shilo K,etal.FAAH inhibition enhances anandamide mediated anti-tumorigenic effects in non-small cell lung cancer by downregulating the EGF/EGFR pathway[J].Oncotarget,2014,5(9):2475-2486.
[14] 张杏平,贺小红,刘 跃,等.大麻素2型受体在宫颈上皮内瘤变和宫颈癌中的表达[J]. 临床和实验医学杂志,2013,12(3):208-209.
[15] Guida M,Ligresti A,Filippis D D,etal.The levels of the endocannabinoid receptor CB2 and its ligand 2-arachidonoylglycerol are elevated in endometrial carcinoma[J].Endocrinology,2010,151(3):921-928.
[16] Nithipatikom K,Endsley M P,Isbell M A,etal.A new class of inhibitors of 2-arachidonoylglycerol hydrolysis and invasion of prostate cancer cells[J].BiochemicalandBiophysicalResearchCommunications,2005,332(4):1028-1033.
[17] Siegmund S V,Qian T,de Minicis S,etal.The endocannabinoid 2-arachidonoyl glycerol induces death of hepatic stellate cells via mitochondrial reactive oxygen species[J].TheFASEBJ,2007,21(11):2798-2806.
[18] Siegmund S V,Schwabe R F. Endocannabinoids and liver disease II Endocannabinoids in the pathogenesis and treatment of liver fibrosis[J].AmericanJPhysiology-GastrointestinalandLiverPhysiology,2008,294(2):357-362.
[19] Mallat A,Lotersztajn S. Endocannabinoids and liver disease I Endocannabinoids and their receptors in the liver[J].AmericanJPhysiology-GastrointestinalandLiverPhysiology,2008,294(1):9-12.
(编辑:张慧茹)
Alteration and Significance of Endogenous Cannabinoid System in Human Hepatocellular Carcinoma
QIU Funan1, LI Lei2, ZHANG Yibo2, LIN Tiansheng1, REN Jie2, TIAN Yifeng1
1. Department of Surgery, Provincial Clinic College of Fujian Medical University; Department of Hepatobiliary Surgery, Fujian Provincial Hospital, Fuzhou 350001, China; 2. Department of Medical Sciences, Medical College, Xiamen University, Xiamen 361102, China
Objective To detect and analyze endocannabinoids and its related enzymes and their receptors in hepatocellular carcinoma (HCC) tissue and adjacent tissues in order to identify new markers and therapeutic targets for hepatocellular carcinoma HCC. Methods Endocannabinoids levels were detected by HPLC-MS in 47 cases of HCC and adjacent tissues. RT-PCR and Western-blot were used to detect the expression of genes and proteins of the related metabolism enzymes and receptors. Results The content of 2-AG, one of the representative endocannabinoids, was the highest in HCC tissues and was significantly higher than that in the adjacent tissues (P<0.01), while the content of AEA ws the lowest and was significantly lower than that in the adjacent tissues (P<0.05). There were no significant difference in the levels of other fatty acyl ethanolamines, such as OEA and PEA, between HCC and adjacent tissues. The expression of CB2, a receptor of 2-AG, was significantly increased in HCC tissues (P<0.05), while the levels of CB1, a receptor of AEA, was observed at a decreased trend (P<0.05). Conclusion There was a notable change in endocannabinoid system in HCC, which suggests that high expression of 2-AG and low expression of AEA may play an important role in the formation and development of HCC.
carcinoma, hepatocellular;endocannabinoids;receptors, cannabinoid;hydrolases
2016-09-07
福建省自然科学基金(2013J01274;2015J01416)
1.福建医科大学 省立临床医学院,福建省立医院 肝胆外科,福州 350001; 2.厦门大学医学院 基础医学部,厦门 361102
邱福南,男,主任医师,副教授,医学硕士
田毅峰. Email:tianyifeng@medmail.com.cn
R392.114; R730.261; R735.7
A
1672-4194(2017)01-0030-05
