HBV全基因组1.3倍体HepG2细胞模型的构建与表达
2017-04-24高月求毛德文周振华龙富立王明刚
邱 华, 高月求, 毛德文, 周振华, 龙富立, 王明刚
(1 上海中医药大学附属曙光医院, 上海 200000; 2 广西中医药大学第一附属医院, 南宁 530023)
HBV全基因组1.3倍体HepG2细胞模型的构建与表达
邱 华1,2, 高月求1, 毛德文2, 周振华1, 龙富立2, 王明刚2
(1 上海中医药大学附属曙光医院, 上海 200000; 2 广西中医药大学第一附属医院, 南宁 530023)
目的 构建含HBV全基因组1.3倍体(1.3 ploid HBV, HBV 1.3P)的HepG2细胞模型,并观察HBV生物标志物的表达规律。方法 通过腺病毒将全基因组合成的1.3倍HBV序列转染入HepG2细胞中,构建HBV 1.3P-HepG2细胞模型,采用琼脂糖凝胶电泳鉴定HBV 1.3P重组腺病毒质粒,利用ABI 3730测序仪确定重组腺病毒质粒中含有正确的1.3倍HBV序列,荧光显微镜下鉴定HBV 1.3P腺病毒感染HepG2细胞的最佳感染复数(MOI),qRT-PCR测定0~9 d HBV 1.3P-HepG2细胞模型中HBV DNA、cccDNA的表达水平,化学发光法、免疫荧光法分别检测上清液及细胞内HBsAg、HBeAg的表达量。计量资料多组间比较采用方差分析,进一步两两比较采用SNK-q检验。结果 当MOI=40时,HepG2细胞被HBV 1.3P重组腺病毒感染的效率达到90%以上;在感染第2天即可分别在上清液和细胞内中检测出HBV DNA、ccc DNA、HBsAg及HBeAg等标志物的表达,在4~6 d达到峰值水平,7 d之后逐渐下降。结论 所构建的HBV全基因组1.3倍体HepG2细胞模型能稳定表达HBV标志物,为开展HBV的相关研究奠定了基础。
肝炎病毒, 乙型; 细胞模型; 腺病毒科
HBV是一种嗜肝性DNA病毒,具有严格的宿主和组织特异性,其感染的种属范围仅限于人和黑猩猩。因此,构建体外细胞模型对研究HBV生物学特征、发病机制及药物筛选等方面具有重要作用。传统的HBV体外研究方法是通过转染试剂(如脂质体等)在细胞中转染HBV的表达质粒,但该方法存在转染效率低和转染试剂对细胞毒性大的弊端。因此,寻找一种新的HBV在宿主中的表达方式变得尤为重要。HBV 1.3倍体(1.3 ploid HBV,HBV 1.3P)是在HBV 1.1倍体上游加入其自身启动子形成的,使其依赖自身启动子启动转录,这样可以充分反映病毒株的自身复制情况,便于研究HBV复制和转录调节的全过程。本实验室应用重组腺病毒转染系统构建HBV 1.3P-HepG2细胞模型,为开展HBV转录复制机制及有效中药筛选等相关研究奠定基础。
1 材料与方法
1.1 材料 包含HBV 1.3P的质粒pMD18-T-HBV DNA 1.3P(上海诺百生物有限公司),293A细胞(上海诺百生物有限公司),HepG2细胞(中国科学院上海细胞生物研究所),DH5α感受态细胞(TransGen Biotech),腺病毒入门载体pENTR-IRES-GFP(Invitrogen),腺病毒表达载体pAd-CMV-V5-DEST(Invitrogen),腺病毒阴性对照Ad-GFP(上海诺百生物有限公司),内切酶PacⅠ(ER2201,Fermentas),Taq DNA聚合酶(10966034,Invitrogen),凝胶回收试剂盒(AP-GX_250,Axygen),质粒抽提试剂盒(AP-MN-P-250,Axygen),SYBR Green PCR Master Mix(Q321,南京诺唯赞生物),ClonExpress Ⅱ One Step Cloning Kit(C112-01/02,Vazyme),GatewayTMLR ClonaseTMⅡ Enzyme Mix(12535019,Invitrogen),腺病毒纯化试剂盒Biomiga ViraTrap Adenovirus Purification Miniprep Kit(V1160,Biomiga),0.25% Trypsin(25200-072,Invitrogen),胎牛血清(S1810-500,Biowest),lipofectamine 2000(11668-019,Invitrogen),MEM培养基(41500034,GIBCO),Opti-MEM(31985,GIBCO),DMEM培养基(SH30023.01B,HyClone),Mouse Anti-HBsAg(H2F4)抗体(bsm-2024M,Gentaur),Anti-Mouse IgG H&L (PE/Cy5.5®) preadsorbed(ab130784,Gentaur),HBsAg、HBeAg化学发光法检测试剂盒(郑州安图生物工程股份有限公司),PCR引物合成和测序由金唯智生物科技有限公司完成。1.2 方法
1.2.1 HBV DNA 1.3P的扩增 以pMD18-T-HBV DNA 1.3P质粒为模板, 扩增HBV DNA 1.3P序列并通过酶切位点SalⅠ/BglⅡ克隆到pENTR-IRES-GFP载体。根据无缝克隆引物设计原则设计引物扩增HBV DNA 1.3P序列,其中上游引物(F)为: TTCTAGACTCAGATCTCTCGAGTTCAATCTAAGCAGGCT,下游引物(R)为:CCGCGGTACCGTCGACGCGGCCGCGATCTCG。扩增体系:10×PCR Buffer for KOD 5 μl、2 mmol/L dNTP 5 μl、25 mmol/L MgSO43 μl、引物F(10 mmol/L) 1.5 μl、引物R(10 mmol/L) 1.5 μl、模板1 ng、KOD 2.5 units,加ddH2O至50 μl;PCR反应条件:94 ℃预变性2 min、94 ℃变性15 s、60 ℃退火30 s、68 ℃延伸30 s,28个循环,68 ℃延伸10 min;PCR产物记为HBV DNA 1.3P(PCR)。
1.2.2 HBV DNA 1.3P PCR产物回收以及In-fusion连接 pENTR-IRES-GFP质粒在37 ℃进行双酶切,酶切条件:pENTR-IRES-GFP 2 μg、 10×Buffer 5 μl、SalⅠ 2 μl、BglⅡ 2 μl,加ddH2O至50 μl。酶切产物经0.8%琼脂糖凝胶电泳,切胶回收,回收产物记为pENTR-IRES-GFP(SalⅠ/ BglⅡ)。pENTR-IRES-GFP(SalⅠ/ BglⅡ)和HBV DNA 1.3P(PCR)通过In-fusion连接,连接产物记为pENTR-IRES-GFP-HBV DNA 1.3P。连接体系:5×CE Ⅱ Buffer4 μl、pENTR-IRES-GFP(SalⅠ/ BglⅡ)50 ng、HBV DNA 1.3P(PCR)150 ng、Exnase®Ⅱ 2 μl,加入ddH2O至20 μl,混匀。连接条件:37 ℃反应30 min后,立即将反应管置于冰水浴中冷却。
1.2.3 pENTR-IRES-GFP-HBV DNA 1.3P重组质粒鉴定 pENTR-IRES-GFP-HBV DNA 1.3P连接产物转化DH5α感受态细胞,37 ℃过夜培养,挑取阳性克隆经PCR鉴定,选取HBV DNA 1.3P 166 bp的序列设计引物(F:CTCGTGGTGGACTTCTCTC;R: CAGCAGGATGAAGAGGAA),PCR反应体系:10×PCR Buffer for KOD 5 μl、2 mmol/L dNTP 5 μl、25 mmol/L MgSO43 μl、引物F(10 mmol/L) 1.5 μl、引物R(10 mmol/L) 1.5 μl、模板1 ng、KOD 2.5 units,加ddH2O至50 μl,同时设置阴性对照(ddH2O作为模板)和阳性对照(pMD18-T-HBV DNA 1.3P质粒作为模板);PCR反应条件:94 ℃预变性2 min、94 ℃变性15 s、58 ℃退火30 s、68 ℃延伸30 s,28个循环,68 ℃延伸10 min。
1.2.4 质粒提取 挑取阳性转化子,接入含氨苄青霉素的LB培养基中。37 ℃ 250 r/min震荡培养过夜;离心获得菌体后,利用质粒抽提试剂盒抽取质粒。
1.2.5 腺病毒表达载体pAd-CMV-HBV DNA 1.3P-IRES-GFP制备 pENTR-IRES-GFP-HBV DNA 1.3P质粒和pAd-CMV-V5-DEST质粒通过LR重组,获得含有HBV DNA 1.3P的腺病毒表达载体pAd-CMV-HBV DNA 1.3P-IRES-GFP,重组产物转化DH5α感受态细胞,挑取阳性克隆进行PCR,PCR产物经0.8%琼脂糖凝胶电泳鉴定,PCR选取HBV DNA 1.3P 166 bp的序列设计引物(F:CTCGTGGTGGACTTCTCTC;R:CAGCAGGATGAAGAGGAA)。LR反应体系:pENTR-IRES-GFP-HBV DNA 1.3P 100 ng、pAd-CMV-V5-DEST 100 ng、LR ClonaseTMⅡ enzyme mix 2 μl,加TE Buffer pH 8.0 至10 μl,混匀;LR反应条件:25 ℃反应1 h后,加入1 μl蛋白酶K,37 ℃反应10 min,终止反应。PCR反应体系:10×PCR Buffer for KOD 5 μl、2mmol/L dNTP 5 μl、25 mmol/L MgSO43 μl、引物F(10 mmol/L) 1.5 μl、引物R(10 mmol/L) 1.5 μl、模板 1 ng、KOD 2.5 units,同时设置阴性对照(ddH2O作为模板)和阳性对照(pMD18-T-HBV DNA 1.3P质粒作为模板);加ddH2O至50 μl;PCR反应条件:94 ℃预变性2 min、94 ℃变性15 s、58 ℃退火30 s、68 ℃延伸30 s,28个循环,68 ℃延伸10 min。
1.2.6 pAd-CMV-HBV DNA 1.3P-IRES-GFP腺病毒包装 pAd-CMV-HBV DNA 1.3P-IRES-GFP质粒用Pac Ⅰ酶切,酚氯仿抽提法纯化获得线性化的腺病毒质粒,将其通过脂质体法转染293A细胞,转染24~48 h后(根据荧光情况,细胞荧光率达到80%以上),293A细胞用胰酶消化,并将细胞转移至直径10 cm的培养皿中继续培养,待细胞出现病变效应至80%以上,收集培养基和293A细胞, -80 ℃条件下反复冻融3次后离心收集上清液,用0.45 μm滤膜过滤,获得pAd-CMV-HBV DNA 1.3P-IRES-GFP腺病毒,用绿色荧光蛋白标记法计算重组腺病毒滴度[1]。1.2.7 pAd-CMV-HBV DNA 1.3P-IRES-GFP感染HepG2细胞 HepG2细胞用MEM完全培养基(含10%胎牛血清,1%青霉素,1%链霉素,0.11 g/L丙酮酸钠)培养,感染前更换为MEM基础培养基,加入病毒液,37 ℃培养4 h后再次更换为MEM完全培养基,37 ℃培养。HepG2 接种于96 孔板中,每孔接种1×104个细胞,用Ad-GFP 病毒按照感染复数(multiplication of infection,MOI)=0、5、10、20、40 和80 感染后在37 ℃,5%的CO2条件下培养48 h,荧光显微镜观察细胞的感染情况,根据感染效率和细胞状态确定最佳MOI。MOI值=感染时病毒与细胞的数量比值。1.2.8 qRT-PCR检测HBV DNA、cccDNA的表达
pAd-CMV-HBV 1.3P-IRES-GFP腺病毒感染HepG2细胞后,分别于感染0、1、2、3、4、5、6、7、8和9 d时收集细胞,抽提总DNA,采用qRT-PCR检测HBV DNA、cccDNA的表达水平,HBV DNA的检测引物为F:CTCGTGGTGGACTTCTCTC,R: CAGCAGGATGAAGAGGAA,cccDNA的检测引物为F:CTCCCCGTCTGTGCCTTCT,R:GCCCCAAAGCCACCCAAG;以18S rDNA为内参,检测引物为18S-F:GAATTGACGGAAGGGCACCAC,18S-R: AAGAACGGCCATGCACCACCA。实验组与对照组中基因的倍数关系通过公式R=2-ΔΔCt= 2-(△Ct待测样品 -△Ct 对照样品)= 2-[(MeanCt目- MeanCt内)待测样品-(MeanCt目- MeanCt内)对照样品]计算。反应体系:2×SYBR Green PCR Master Mix 10 μl、引物F(10 mmol/L)1 μl、引物R(10 mmol/L)1 μl、模板 1 μg、RNase-free H2O 5 μl;PCR反应条件:95 ℃ 30 s、60 ℃ 30 s、72 ℃ 30 s,40个循环,PCR数据采集。
1.2.9 化学发光法检测HBsAg、HBeAg的表达 pAd-CMV-HBV DNA 1.3P-IRES-GFP腺病毒感染HepG2细胞后培养,分别于感染0、1、2、3、4、5、6、7、8和9 d时收集细胞培养上清,按HBsAg和HBeAg试剂盒检测说明书检测HBsAg和HBeAg水平。由于检测时间跨度较大,为了减少因细胞数量对检测的影响,实验按4×105个细胞量计算发光强度,具体方法为:根据HepG2细胞的倍增时间3 d,24板最多培养4×105个细胞的培养经验铺板以及培养,收集上清时保证细胞数量约为4×105。
1.2.10 间接免疫荧光法检测细胞内HBsAg pAd-CMV-HBV 1.3P-IRES-GFP腺病毒感染HepG2细胞后,分别在 0、2、4、6 d消化细胞,将细胞爬片,爬片后的细胞用PBS洗涤3次, 4%多聚甲醛固定,PBS洗涤3次,0.25% TRITON X-100/PBS孵育5 min通透细胞,PBS洗涤2次; 10% BSA/PBS,37 ℃下孵育30 min,用3%BSA/PBS稀释第一抗体,37 ℃下孵育2 h,PBS洗涤3次,3%BSA/PBS稀释第二抗体,37 ℃下避光孵育45 min,PBS冼3次;荧光显微镜观察并拍照,每张玻片拍摄5张(4个边角及片中央),将荧光显微镜拍下的照片用Image-Pro Plus软件计算平均光密度,分析荧光的强弱。

较采用方差分析,进一步两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 HBV DNA 1.3P序列扩增 HBV DNA 1.3P扩增产物经0.8%琼脂糖凝胶电泳,在4100 bp处可见清晰的条带,其大小与理论大小一致(图1)。
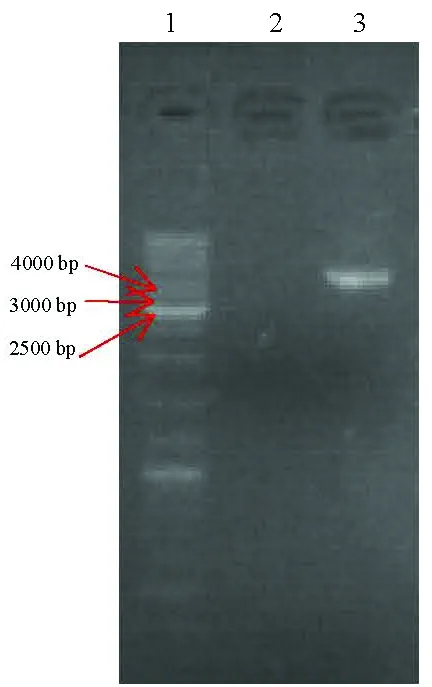
图1 HBV DNA 1.3P序列的琼脂糖凝胶电泳结果 1: Marker;
2.2 pENTR-IRES-GFP-HBV DNA 1.3P重组质粒鉴定 pENTR-IRES-GFP(SalⅠ/BglⅡ)和HBV DNA 1.3P(PCR)连接产物转化DH5α感受态细胞,挑取克隆进行PCR鉴定,PCR产物经0.8%琼脂糖凝胶电泳,产物大小约为160 bp(泳道2,5,6,7),其大小与目标序列大小一致并且和阳性对照处于相同的位置,阴性对照没有扩增产物(图2)。
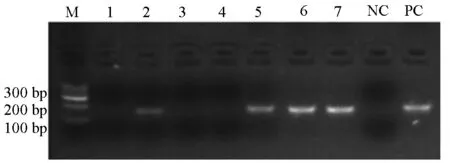
图2 PCR鉴定pENTR-IRES-GFP-HBV DNA 1.3PM: Marker;1~7:pENTR-IRES-GFP-HBV DNA 1.3P相关转
2.3 pAd-CMV-HBV DNA 1.3P-IRES-GFP腺病毒表达载体的鉴定 腺病毒入门载体pENTR-IRES-GFP-HBV DNA 1.3P和腺病毒表达载体pAd-CMV-V5-DEST载体LR重组,重组产物转化DH5α感受态细胞,转化产物挑取克隆进行PCR鉴定,扩增产物经0.8%琼脂糖凝胶电泳鉴定,产物大小约为160 bp(泳道2,3,5,6,7),其大小与目标序列大小一致并且和阳性对照处于相同的位置,阴性对照没有扩增产物(图3);选取阳性克隆进行测序,测序峰图为单一峰(图4),测序结果与目的序列比对一致,即获得构建正确的pAd-CMV-HBV 1.3P-IRES-GFP腺病毒表达载体。

图3 PCR鉴定pAd-CMV-HBV DNA 1.3P-IRES-GFP
M: Marker;1~7:pAd-CMV-HBV DNA 1.3P-IRES-GFP相关转化子;NC:阴性对照;PC:阳性对照(PCR扩增HBV DNA
1.3P)
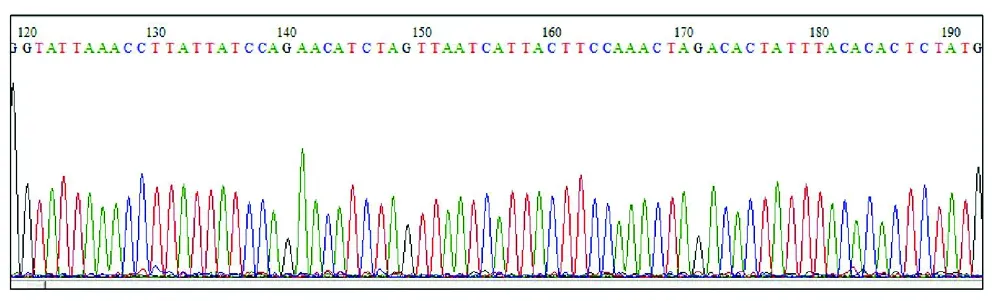
图4 pAd-CMV-HBV DNA 1.3P-IRES-GFP部分测序图谱
2.4 腺病毒滴度及感染HepG2细胞的MOI测定 制备pAd-CMV-HBV 1.3P-IRES-GFP腺病毒表达质粒,将质粒用Pac Ⅰ 酶切进行线性化,线性化质粒转染293A细胞以包装腺病毒,收集病毒初液并进行扩增、纯化和浓缩,测定病毒滴度为1.23×1012TU/ml。MOI=40时,HepG2细胞被腺病毒感染的效率达到90%以上,且细胞状态良好,满足后续实验要求(图5)。因此,后续实验中腺病毒感染HepG2细胞以MOI=40进行。

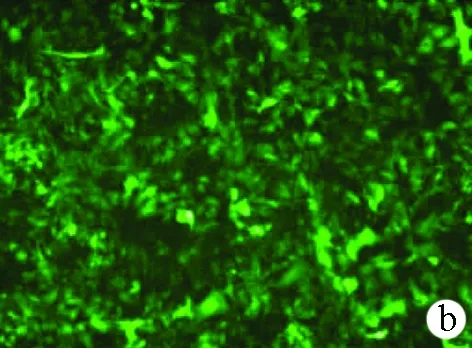

图5 MOI=40时,腺病毒感染HepG2细胞的感染效率(×100) a:白光;b:绿色荧光;
c:混合光
2.5 HBV DNA 和cccDNA的表达水平 腺病毒感染前2天HBV DNA的表达水平相对较低,在3 d时HBV DNA的表达水平快速增高,在4~6 d时达到峰值,6 d后表达水平下降(图6a);cccDNA水平与HBV DNA表达趋势基本一致,在3 d后快速增高,在4~6 d时达到峰值水平,6 d后逐渐下降(图6b)。

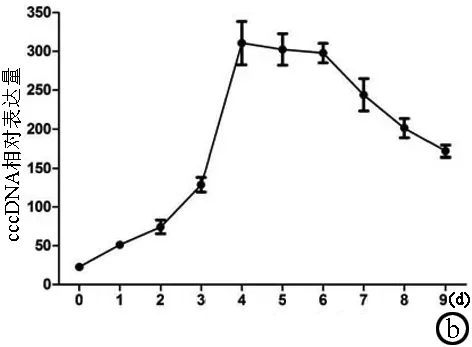
图6 HBV DNA和cccDNA不同时间点的相对表达量
2.6 HepG2细胞上清HBsAg、HBeAg的表达水平 检测4×105个HepG2细胞的发光强度,HBsAg、HBeAg的表达水平在4 d和5 d时最高,随后表达下降(图7)。

图7 HepG2细胞上清中HBsAg、HBeAg的表达量
2.7 免疫荧光法检测HepG2细胞内HBsAg的表达水平 4、6 d时HepG2细胞内HBsAg的表达水平高于2 d,差异具有统计学意义(P<0.01)(图8,表1)。
3 讨论
HBV感染呈世界性流行,据世界卫生组织报道,全球每年约有65万人死于HBV感染所致的肝硬化、肝衰竭和肝癌等疾病。而良好的疾病模型是开展相关研究的基础。人HBV感染的种属范围很窄,黑猩猩HBV感染模型是目前唯一的HBV自然感染的动物模型,但价格昂贵,受到伦理学的限制[2]。树鼩与灵长类动物亲缘关系很近,可被HBV感染,但感染率很低[3]。其他建立在啮齿动物上的HBV转基因小鼠模型、高压水注射HBV感染小鼠模型、嵌合小鼠HBV感染模型等与人体感染的病理特征仍有较大区别,且重复性、稳定性及经济性均尚待改进[4]。因此,体外细胞模型成为研究HBV生命周期、病理机制及药物筛选的重要手段,其中成熟的原代肝细胞、胚胎肝细胞和肝癌细胞是首选的靶细胞,主要采用感染与转染两种方式,各有优缺点,需根据不同研究目的进行选择[5]。


图8 免疫荧光检测HBsAg在HepG2细胞内表达(100 μm)

检测时间点(d)样本数荧光强度032344±590 2314356±1327 4344524±26941)6343276±18151)F值422.32P值<0.05
注:与感染2 d比较,1)q值分别为29.37、28.15,P<0.01
永生性的肝癌细胞系HepG2、Huh7、HepaRG、PLC/PRF/5等是目前构建HBV体外细胞模型应用最为广泛的细胞材料。通过基因转移技术,将HBV基因组与宿主细胞染色体整合,科学家们已经建立了HepG2.2.15、HepAD38等多种能稳定表达HBV标志物的细胞系。然而这些细胞株仍存在不足:(1)应用了包含异源启动子的构建物,如HepAD38采用了对四环素敏感的巨细胞病毒启动子,与自然感染条件下,HBV通过内源启动子作用下转录、复制的机制是不同的[6];(2)由于是通过人为手段将HBV基因整合至宿主细胞染色体中,因此HBV表达与复制是宿主染色体复制的结果,且不易改变,与自然感染以cccDNA为模板的复制机制亦不相同[7];(3)HBV复制水平较低,表达不稳定,随传代次数增加,HBV基因产生异质性几率升高[8]。因此构建一种高效、能以自身启动子启动转录、以cccDNA为复制模板的HBV体外细胞模型仍然非常必要。
HBV基因组是闭合环状双链DNA,在利用酶切获得线性HBV DNA 作为目的基因时,必然会破坏其开放阅读框,从而影响其转录与复制功能。因此,需要通过构建大于全长基因的HBV基因组,才能在转染的细胞中实现稳定复制。HBV 1.3P包含了5′末端Enh Ⅰ、Enh Ⅱ,复制起始区(DR1、DR2),前基因组转录起始位点X和前C区启动子,X开放阅读框等构件,能依赖自身启动子启动转录与复制,且复制和表达效率高于1.1和1.2倍体,逐渐成为HBV模型构建的主要形式[9]。
病毒载体是近年发展最为迅速的一种基因导入技术,主要包括慢病毒、腺病毒和逆转录病毒表达系统。其中腺病毒表达系统可将外源目的基因游离于宿主基因组外独立表达,不整合入宿主细胞的基因组中,能实现目的基因瞬时、高丰度表达,并避免因基因整合作用而引发的潜在基因突变和随机效应,具有更高的安全性和可控性[10]。本课题组通过腺病毒表达系统将HBV 1.3P 转染入HepG2细胞中,当MOI=40时HepG2细胞被腺病毒感染的效率达到90%以上,且对细胞的形态结构及生理功能未造成明显影响。该细胞模型在第2天即可在细胞内和上清液中检测到HBV DNA、cccDNA、HBsAg及HBeAg等标志物表达,在4~6 d达到峰值水平,之后逐渐下降。由于腺病毒的表达高峰期一般在7 d左右,因此该模型尚存在HBV高峰复制时间较短等不足,未来有必要应用慢病毒等技术,研究建立HBV长效表达的HBV 1.3P稳定转染HepG2细胞系模型。总之,该细胞模型为后续的研究奠定了良好的基础。
[1] SUN PY, ZHANG YL, JING YM, et al. A comparative analysis of the methods for tittering adenoviruses[J]. J South Med Univ, 2011, 31(2): 234-238. (in Chinese) 孙鹏宇, 张艳玲, 荆玉明, 等.腺病毒滴度不同测定方法比较[J]. 南方医科大学学报, 2011, 31(2): 234-238.
[2] WIELAND SF. The chimpanzee model for hepatitis B virus infection[J]. Cold Spring Harb Perspect Med, 2015, 5(6): a021469.
[3] WANG Q, SCHWARZENBERGER P, YANG F, et al. Experimental chronic hepatitis B infection of neonatal tree shrews (Tupaia belangeri chinensis): a model to study molecular causes for susceptibility and disease progression to chronic hepatitis in humans[J].Virol J, 2012, 9: 170.
[4] CHENG L, LI F, BILITY MT, et al. Modeling hepatitis B virus infection, immunopathology and therapy in mice[J]. Antiviral Res, 2015, 121: 1-8.
[5] WU J, ZHOU ZH, SUN XH, et al. Research advances in cell models of hepatitis B virus[J]. J Clin Hepatol, 2015, 31(7): 1168-1172. (in Chinese) 吴疆, 周振华, 孙学华, 等. HBV细胞模型研究进展[J]. 临床肝胆病杂志, 2015, 31(7): 1168-1172.
[6] GARCIA T, LI J, SUREAU C, et al. Drastic reduction in the production of subviral particles does not impair hepatitis B virus virion secretion[J]. J Virol, 2009, 83(21): 11152-11165.
[7] ZHAO R, WANG TZ, KONG D, et al. Hepatoma cell line HepG2.2.15 demonstrates distinct biological features compared with parental HepG2[J]. World J Gastroenterol, 2011, 17(9): 1152-1159.[8] WANG WF, ZHOU XD, ZHENG PF. Experiment study on the HBV gene heterogeneity in HepG2.2.15 cell[J]. Chin J Gastroenterol Hepatol, 2005, 14(3): 227-229. (in Chinese) 王卫峰, 周晓东, 郑培奋. HepG2 .2 .15细胞株中乙型肝炎病毒基因异质性的研究[J]. 胃肠病学和肝病学杂志, 2005, 14(3): 227-229.
[9] CAO YY, QU JL, YANG Q, et al. Construction of recombinant adenovirus hepatitis B virus1.3 and its expression[J]. J Chongqing Med Univ, 2014, 39(7): 947-951. (in Chinese) 曹漪伊, 曲嘉琳, 杨庆, 等. 乙型肝炎病毒全基因组1.3 倍体重组腺病毒的构建与表达[J]. 重庆医科大学学报, 2014, 39(7): 947-951.
[10] COTS D, BOSCH A, CHILLN M. Helper dependent adenovirus vectors: progress and future prospects[J]. Curr Gene Ther, 2013, 13(5): 370-381.
引证本文:QIU H, GAO YQ, MAO DW, et al. Construction of HBV whole-genome 1.3 ploid HepG2 cell model and expression of HBV biomarkers[J]. J Clin Hepatol, 2017, 33(4): 668-673. (in Chinese) 邱华, 高月求, 毛德文, 等. HBV全基因组1.3倍体HepG2细胞模型的构建与表达[J]. 临床肝胆病杂志, 2017, 33(4): 668-673.
(本文编辑:葛 俊)
Construction of HBV whole-genome 1.3 ploid HepG2 cell model and expression of HBV biomarkers
QIUHua,GAOYueqiu,MAODewen,etal.
(ShuguangHospitalAffiliatedtoShanghaiUniversityofTraditionalChineseMedicine,Shanghai200000,China)
Objective To construct an HepG2 cell model containing HBV whole-genome 1.3 ploid (HBV 1.3P), and to investigate the expression of HBV biomarkers. Methods HepG2 cells were transfected with the 1.3-ploid whole-genome HBV DNA sequence using the adenovirus vector to construct an HBV 1.3P-HepG2 cell model. Agarose gel electrophoresis was used to identify HBV 1.3P recombinant adenovirus plasmids, and the ABI 3730 sequencer was used to confirm whether the recombinant adenovirus plasmids had correct HBV 1.3P sequence. The optimal multiplicity of infection (MOI) of HepG2 cells infected by the HBV 1.3P adenovirus was determined under a fluorescence microscope. Quantitative real-time PCR was used to measure the expression of HBV DNA and cccDNA in the HBV 1.3P-HepG2 cell model at 0-9 days, and chemiluminescence and immunofluorescence assay were used to measure the expression of HBsAg and HBeAg, respectively, in supernatant and cells. An analysis of variance was used for comparison of continuous data between multiple groups, and the SNK-qtest was used for comparison between any two groups. Results When MOI was 40, the efficiency of HepG2 cells being infected by HBV 1.3P recombinant adenovirus reached above 90%. On the second day of infection, the expression of the biomarkers HBV DNA, cccDNA, HBsAg, and HBeAg was detected in supernatant and cells, and the levels of these biomarkers reached peak values at 4-6 days and gradually decreased after 7 days. Conclusion This HBV 1.3P-HepG2 cell model can express HBV biomarkers stably, which lays a foundation for future research on HBV.
hepatitis B virus; cell model; adenoviridae
10.3969/j.issn.1001-5256.2017.04.014
2016-12-01;
2016-12-16。
国家自然科学基金项目(81303066,81660827);广西自然科学基金青年基金(2013GXNSFBA019154);广西教育厅课题(2013YB121)
邱华(1980-),男,博士,副教授,副主任,主要从事中西医结合防治慢性病毒性肝炎的基础与临床研究。
高月求,电子信箱:gaoyueqiu@hotmail.com。
R512.62
A
1001-5256(2017)04-0668-06
