内生真菌MG-9的主物质麦角甾醇的分离鉴定及抗氧化活性分析
2017-04-21秦王阁阁孔玉珊薛艳红刘呈雄刘士平
秦王阁阁 孔玉珊 蒋 维 李 辉 薛艳红 刘呈雄 刘士平
(三峡大学 生物与制药学院, 湖北 宜昌 443002)
内生真菌MG-9的主物质麦角甾醇的分离鉴定及抗氧化活性分析
秦王阁阁 孔玉珊 蒋 维 李 辉 薛艳红 刘呈雄 刘士平
(三峡大学 生物与制药学院, 湖北 宜昌 443002)
从疏花水柏枝中的一株内生真菌MG-9的粗提物中重结晶出一种主物质,采用NMR、MS等现代波谱学技术鉴定这种主物质为麦角甾醇.以LDH(乳酸脱氢酶)、SOD(超氧化物歧化酶)、caspase 3、caspase 9的酶活表达情况为指标,研究了MG-9主物质对神经细胞SH-SY5Y的毒害作用及抗氧化保护作用机理.结果表明:麦角甾醇在6.25-25 μg/mL时对神经细胞SH-SY5Y毒性的量效关系不明显,而在6.25 μg/mL时对神经细胞SH-SY5Y的氧化损伤保护具有更好的效果,将神经细胞SH-SY5Y在H2O2(800 μmol/L)胁迫下的相对存活率提高了74.5%.并且麦角甾醇可通过抑制凋亡蛋白caspase 3的活性来达到对神经细胞SH-SY5Y的抗氧化保护作用.
内生真菌; 麦角甾醇; 神经细胞保护; 抗氧化活性
麦角甾醇(Ergosterol)别名麦角固醇,为白色或无色光亮的小叶晶或白色结晶粉末,是一种重要的植物甾醇,是甾类化合物之一[1].研究表明,麦角甾醇是微生物细胞膜的重要组成部份,对确保细胞活力、膜的流动性、膜结合酶的活性、膜的完整性以及细胞物质运输等起着重要作用[2].麦角甾醇也是脂溶性维生素D2的前体,当受到紫外线照射时可转化为维生素D2,维生素D2可用于预防和治疗儿童佝偻病、成人骨软化和老年人的骨质疏松,是一种重要的医药化工原料[3].除此之外,麦角甾醇还具有抗肿瘤的活性[4-7],其也可作为测量真菌生物量的检测指标[8],但鲜有麦角甾醇在抗氧化方面的探讨.
正常情况下,人体内自由基处于不断产生和不断清除的动态平衡中,如果自由基产生过多或是清除过少,过量的自由基会使细胞组织遭受氧化胁迫,造成机体氧化损伤,并可能导致许多疾病的发生[9].目前,抗氧化相关研究大多集中在多酚类[10]、维生素类[11]、生物碱类[12]、皂苷类[13]、多糖类[14]、多肽类[15]等,还未见抗氧化在麦角甾醇方面的相关报道.因此,研究麦角甾醇与抗氧化作用的相关性,有助于新型抗氧化剂的开发.本研究从特异分布在三峡河岸带地区常年受淹水胁迫(氧化胁迫)的疏花水柏枝(Myricarialaxiflora)中出发[16-17],筛选到了1株高产麦角甾醇的内生真菌MG-9,并以LDH(Lactic dehydrogenase)、SOD(Superoxide dismutase)、caspase 3、caspase 9的酶活表达情况为指标,研究麦角甾醇对神经细胞SH-SY5Y氧化损伤的保护作用机理,以期为麦角甾醇在抗氧化活性方面的开发与应用提供借鉴.
1 材料与仪器
1.1 疏花水柏枝内生真菌
实验所用的内生真菌MG-9分离自淹水后疏花水柏枝的根部位[18],所分离的菌株4℃石蜡保藏.
1.2 培养基
菌种保藏与活化培养基:马铃薯葡萄糖培养基(PDA):马铃薯200 g、葡萄糖20 g、琼脂15~20 g,加水至1 000 mL,pH 6~6.5,121 ℃灭菌20 min,即得.
液体发酵培养基:马丁氏培养基:葡萄糖10 g、蛋白胨5 g、KH2PO41 g、MgSO4·7H2O 0.5 g,加水至1 000 mL,pH自然,121 ℃灭菌20 min,即得.
神经细胞SH-SY5Y培养基:D-MEM/F-12完全培养基:D-MEM/F-12培养基粉末、2.2 mg/mL NaHCO3,100 U/mL青霉素,100 μg/mL链霉素,15%新生小牛血清;D-MEM/F-12基础培养基除了新生小牛血清降为3%外,其余成分与D-MEM/F-12完全培养基相同.0.45 μm微孔滤膜过滤灭菌,即得.
1.3 试剂
PBS缓冲液:分别取0.2 g KCl、8.0 g NaCl、0.2 g KH2PO4、2.89 g Na2HPO4·12H2O于1 L烧杯中,加蒸馏水定容至1 000 mL.乳酸脱氢酶(LDH)酶活检测试剂盒(碧云天生物技术有限公司),超氧化物歧化酶(SOD)酶活检测试剂盒(碧云天生物技术有限公司),凋亡蛋白caspase 3酶活检测试剂盒(碧云天生物技术有限公司),凋亡蛋白caspase 9酶活检测试剂盒(碧云天生物技术有限公司),高效液相用甲醇、乙腈均为色谱纯,水为三蒸水,其它试剂均为分析纯.
1.4 仪器
YM30F不锈钢智能型立式电热蒸汽消毒器(上海三申医疗器械有限公司),PH-030A干燥箱/培养箱(上海一恒科学仪器有限公司),SW-CJ-2FD型双人净化工作台(苏州净化设备厂),台式恒温振荡培养箱(上海知楚仪器有限公司),752(N)紫外可见光分光光度计(上海佑科),BC-R203型旋转蒸发器(上海贝凯生物化工设备有限公司),低温冷冻干燥机(美国Labconco公司),Bruker AV400核磁共振波谱仪(瑞士布鲁克公司),酶联免疫检测仪(Genios Tecan),CO2培养箱(日本三洋公司),TDZ5-WS台式多管自动平衡离心机(长沙平凡仪器仪表有限公司),ABSON板式振荡器(ABSON生命科学设备).
2 方 法
2.1 疏花水柏枝内生真菌MG-9的活化及发酵培养
挑取冰箱中保存的MG-9菌种于PDA固体培养基中,培养3~7 d,待生长得到表型单一的菌落时,用接种环挑取菌丝或孢子于发酵培养基(马丁氏液体培养基),500 mL锥形瓶装液量为150 mL,28℃、150 r/min培养7 d.
2.2 MG-9主物质的分离及结构鉴定
将MG-9发酵菌悬液通过真空抽滤装置过滤,得菌体与发酵液.菌体用等体积70%丙酮常温浸提24 h,浸提3次,超声1.5 h,过滤菌丝,浸提液于40℃条件减压浓缩;发酵液用等体积的乙酸乙酯萃取3次,合并萃取液,将萃取液于40℃条件下减压浓缩,与菌体浸提液混合,得MG-9粗提物.MG-9粗提物经乙酸乙酯萃取浓缩过后,用甲醇溶解保存在4℃冰箱,瓶底有晶体析出.将晶体用石油醚脱色,在甲醇中重结晶后,采用NMR、MS等现代波谱学技术鉴定其结构.
2.3 神经细胞SH-SY5Y的培养
将SH-SY5Y细胞用DMEM/F-12完全培养基于37℃,5% CO2饱和湿度孵箱中培养.待细胞80%~90%铺满瓶底时进行传代、转板.在传代时,弃掉旧培养基后,先用PBS缓冲液将细胞清洗两遍,倒掉PBS后,再加0.25%的胰蛋白酶置于CO2培养箱中进行消化约40 s.倒掉胰蛋白酶液,用新鲜培养基混匀细胞,然后转移到离心管中,1 200 rpm、4 min离心细胞,离心后按1∶3比例进行传代.
2.4 H2O2氧化损伤模型的建立
将对数生长期的神经细胞SH-SY5Y稀释后,接种于96孔板中,待神经细胞SH-SY5Y生长至80%汇合时,弃去旧培养液,加入浓度为800 μmol/L的H2O2溶液(D-MEM/F-12基础培养基稀释而成),空白对照组只加入D-MEM/F-12基础培养基,继续培养8 h后,每孔加MTT溶液20 μL,继续孵育4 h,终止培养.小心吸弃孔内培养上清液,每孔加入150 μL DMSO溶液,在800 r/min条件下震摇96孔板3 min,使MG-9主物质充分溶解,然后使用酶标仪于492 nm处测吸光值,计算细胞存活率.
2.5 细胞毒性实验
将处于对数生长期的神经细胞SH-SY5Y接种于96孔板,待孔内神经细胞SH-SY5Y生长到80%左右时,弃去旧培养基,加入不同浓度梯度(0~100 μg/mL)的MG-9主物质溶液(由DMEM/F-12基础培养基配制而成),继续孵育24 h,用MTT比色法测定不同浓度药物对神经细胞SH-SY5Y的存活率的影响.
2.6 MG-9主物质的抗氧化能力分析
待神经细胞SH-SY5Y在96孔板内的数量生长至80%左右时进行预给药,分别加入不同浓度梯度(0~100 μg/mL)的MG-9主物质(由DMEM/F-12基础培养基配制而成),每个浓度设5个复孔,培养24 h后弃去培养液.给药组加入相应浓度的MG-9主物质,模型组加入新鲜培养基,继续孵化24 h.弃去旧培养基,模型组和给药组分别加入浓度为800 μmol/L的H2O2溶液,继续培养8 h后用MTT法测吸光值,计算细胞存活率.
2.7 指标检测
凋亡蛋白caspase 3、caspase 9、SOD、LDH的活性检测使用碧云天生物技术公司试剂盒,具体方法见产品使用说明.
3 结果与分析
3.1 内生真菌MG-9
本实验所用的内生真菌MG-9分离自淹水后疏花水柏枝的根部位[18],所分离的菌株4℃石蜡保藏.其在固体PDA培养基中生长迅速,表面灰绿色,菌丝呈放射状生长,四周密集中间稀疏,边缘不整齐(图1A),背面无色(图1B),发酵液变成黄色(图1C).菌丝分枝复杂,有隔膜且大小不一,菌丝顶端形成成串的绿色或黄绿色球状节孢子(图1D).经分子鉴定及《真菌鉴定手册》[19]分析,菌株MG-9为一株黄曲霉(Aspergillusflavus).
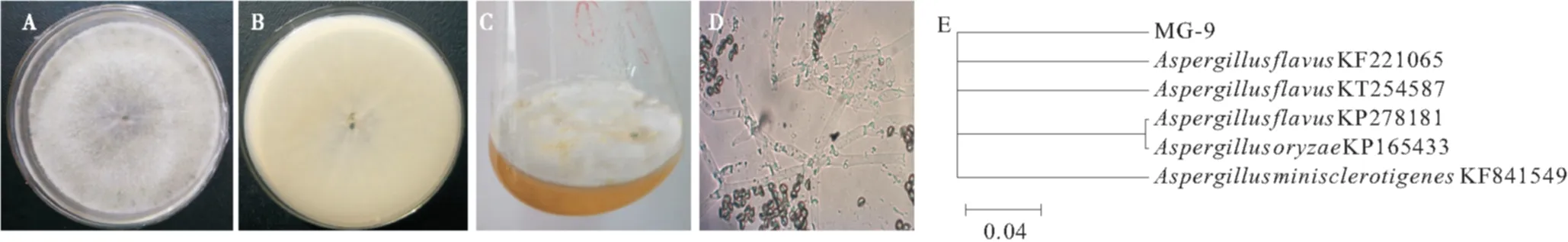
注:A:菌落形态;B:背面形态;C:发酵液;D:菌丝和分生孢子;E:系统发育树.图1 MG-9的菌落及显微形态及分子鉴定
3.2 麦角甾醇的分离及结构鉴定
MG-9粗提物经乙酸乙酯萃取浓缩过后,用甲醇溶解保存在4℃冰箱时,可观察到瓶底有无色针状晶体析出,晶体能溶于三氯甲烷,熔点:151-152℃,EI-MS质谱显示m/z:396[M]+.化合物的1H-NMR谱显示有6个甲基信号,分别为δ0.67 (3H, s, H-18),0.84 (3H, d,J=8.5 Hz, H-26),0.86 (3H, d,J=8.0 Hz, H-27),1.06 (3H, d,J=8.5 Hz, H-21),0.94 (3H, d,J=8.0 Hz, H-28),0.95 (3H, s, H-19),在高场区δ1.0-2.5之间出现堆积的质子峰信号,在低场区出现3个烯烃质子信号.13C-NMR 谱中显示28个碳信号,其中6个甲基碳信号,6个烯碳信号,1个连氧碳信号,其它信号在δ30-50之间,以上特征表明该化合物是甾醇类化合物,分子式:C28H44O,波谱数据与文献[20]对照一致,故判断该物质是一种麦角甾醇(如图2所示).
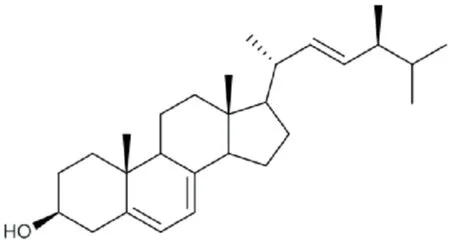
图2 麦角甾醇的结构
3.3 麦角甾醇的抗氧化能力分析
为判断麦角甾醇对神经细胞SH-SY5Y是否具有抗氧化保护作用,先进行了神经细胞SH-SY5Y毒性检测,以确定药物最适给药浓度,从而评价药物对神经细胞SH-SY5Y的毒害作用.结果表明该麦角甾醇在6.25~25 μg/mL时对神经细胞SH-SY5Y毒性的量效关系不明显,而在6.25 μg/mL时对神经细胞SH-SY5Y的氧化损伤具有更好的保护效果(表1),将神经细胞SH-SY5Y在H2O2(800 μmol/L)胁迫下的相对存活率提高了74.5%,因此将6.25 μg/mL确定为最适给药质量浓度.
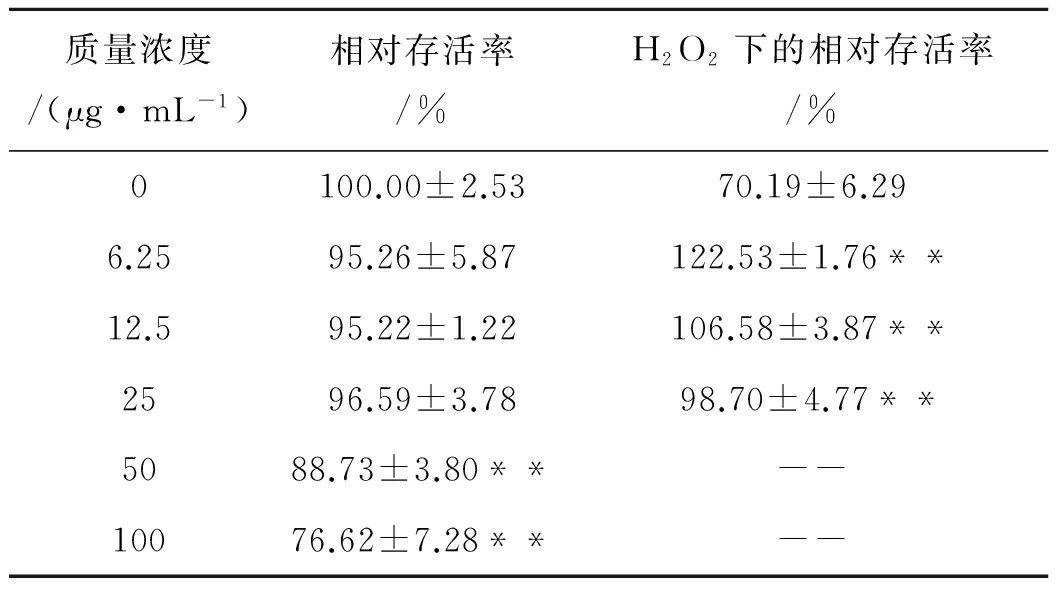
表1 麦角甾醇对神经细胞的毒性及抗氧化保护作用
注:**表示极显著差异(P<0.01,n=3).
3.4 麦角甾醇对神经细胞氧化损伤的保护作用机理
为进一步分析麦角甾醇对神经细胞SH-SY5Y氧化损伤的保护作用机理,实验分别测定了神经细胞SH-SY5Y在麦角甾醇6.25 μg/mL处理下的LDH、SOD、caspase 3、caspase 9的酶活表达情况.
实验结果表明,当神经细胞SH-SY5Y受到H2O2氧化损伤后,LDH渗出率升高、SOD酶活降低、凋亡蛋白caspase 3和caspase 9活性增高(如图3所示).但来自于MG-9的麦角甾醇对降低细胞的LDH渗出率、保护细胞膜完整性作用并不明显(如图3A所示),SOD抗氧化酶的酶活的增加也不显著(如图3B所示);可是麦角甾醇却可以极显著地抑制凋亡蛋白caspase 3的表达(如图3C所示),对caspase 9(如图3D所示)也具有部分抑制效应,说明麦角甾醇对神经细胞SH-SY5Y的抗氧化保护作用主要是通过抑制凋亡蛋白的表达来实现的.考虑到在神经细胞SH-SY5Y遭受H2O2氧化损伤后,caspase 3活性的增强程度明显高于caspase 9(如图3C和图3D所示),表明caspase 3在神经细胞氧化损伤时发挥着更大的作用,也说明来自于MG-9的麦角甾醇主要是通过抑制caspase 3的活性来达到抗氧化保护作用的.
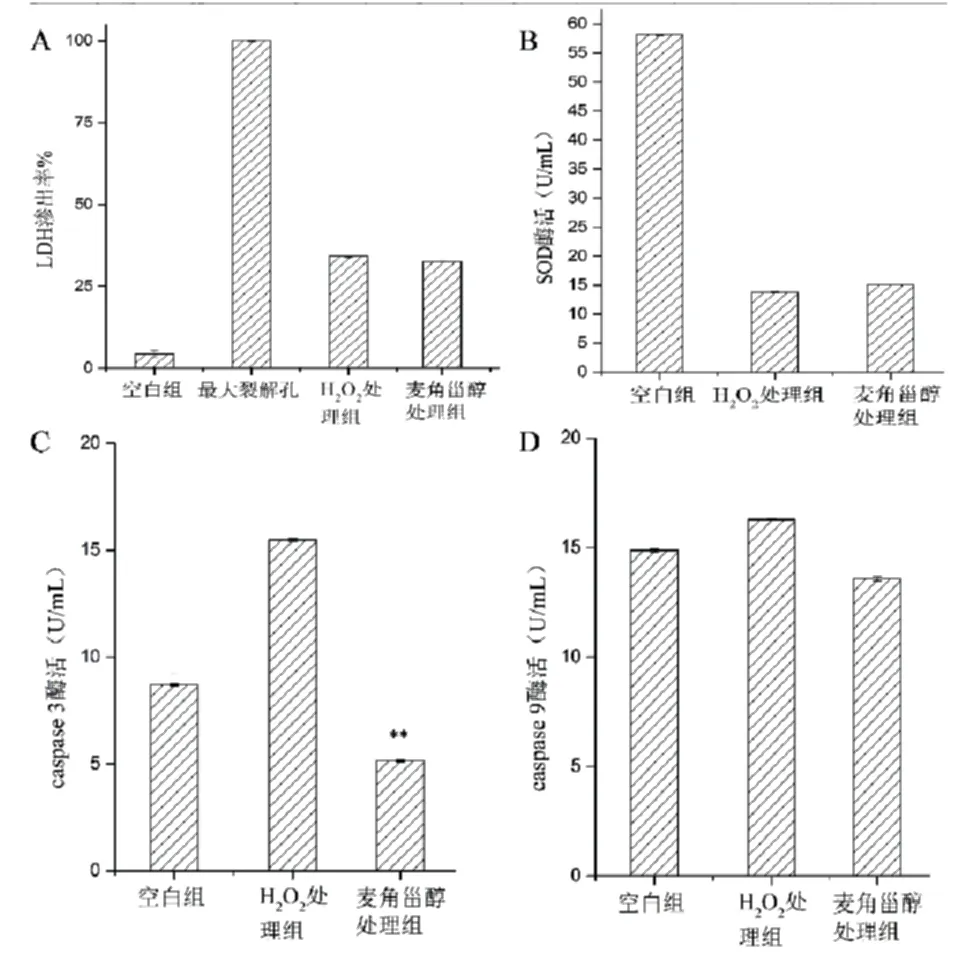
A:LDH渗出率;B:SOD酶活;C:Caspase 3酶活;D:Caspase 9酶活.图3 麦角甾醇对神经细胞抗氧化保护作用的可能机理
4 讨论与结论
本研究以能耐受低氧胁迫植物疏花水柏枝的内生真菌MG-9为研究对象,分析了其粗提物主物质麦角甾醇对神经细胞抗氧化保护的效果.尽管实验表明麦角甾醇有一定的抗氧化能力,但由于其仅仅为MG-9粗提物中多种成分中的一种化合物,而且也是真菌细胞壁中一种普遍的结构成分[20],因此并不能说明MG-9粗提物中发挥抗氧化作用的就是麦角甾醇,也可能还有一些其他未知的化合物在起作用.因此未来的实验还需要进一步明确其起抗氧化作用的物质基础,根据活性跟踪的方法分离得到高抗氧化活性的化合物,为进一步研发新型抗氧化剂奠定基础.
[1] 郭 玮,罗 琼,刘 帅,等.麦角甾醇对S180荷瘤小鼠抑瘤作用及机制[J].中国公共卫生,2015,31(12):1606-1608.
[2] 韩庆雪.麦角固醇提取工艺的中试放大研究[D].天津:天津大学,2007.
[3] 蒋 岚,于士军,张 莹,等.古尼拟青霉麦角甾醇高产液体培养条件及提取工艺的优化[J].菌物学报,2012,31(3):413-421.
[4] 高 虹,史德芳,杨 德,等.巴西菇麦角甾醇抗肿瘤活性及作用机理初探[J].中国食用菌,2011,30(6):35-39.
[5] 苏日古格,包海鹰,图力古尔,等.蒙古口蘑子实体的抗肿瘤活性[J].食品科学,2012,33(21):280-284.
[6] Zan L F,Bao H Y,Tolgor B,et al. An Antitumor Component fromFomitiporiaEllipsoidea[J].Journal of Microbiology and Biotechnology, 2012, 22(11):1482-1485.
[7] Ding Y, Bao H Y, Tolgor B, et al.Antitumor Components fromNaematolomaFasciculare[J].Journal of Microbiology and Biotechnology, 2009, 19(10):1135-1138.
[8] 曹龙辉,李晓珺,赵文红,等.麦角甾醇的研究进展[J].中国酿造,2014,33(4):9-12.
[9] 谭榀新,叶 涛,刘湘新,等.植物提取物抗氧化成分及机理研究进展[J].食品科学,2010,31(15):288-292.
[10] Gu H F,Li C M,Xu Y J, et al.Structural Features and Antioxidant Activity of Tannin from Persimmon Pulp [J].Food Research International, 2008, 41(2):208-217.
[11] 毛立科,高彦祥.番茄红素稳定性研究综述[J].中国食品添加剂,2008(2):57-60.
[12] Lucia R,Magdaléna M,Daniela K, et a1.Antiradical and Antioxidant Activities of Alkaloids Isolated fromMahoniaAquifolium, Structural Aspects [J].Bioorganic and Medicinal Chemistry, 2004, 12(17):4709-4715.
[13] Sparg S G, Light M E, Staden J V.Biological Activities and Distribution of Plant Saponins [J].Journal of Ethnopharmacology, 2004, 94(2):219-243.
[14] 俞慧红,竺巧玲,戴 飞,等.多糖抗氧化作用的研究现状[J].食品研究与开发,2008,29(3):172-176.
[15] 张 昊,任发政.天然抗氧化肽的研究进展[J].食品科学,2008,29(4):443-447.
[16] 高 媛,雷 旗,蒋 维,等.一株高抗氧化活性内生真菌的分子鉴定及产酚酸类物质研究[J].微生物学通报,2016,43(6):1235-1243.
[17] Zeng W,Qin W, Tian W, et al.Antioxidant Activity in Vitro of Endophytic Fungi fromMyricariaLaxiflora, a Riparian Plant with Strong Tolerance Ability of Fooding [J].Journal of Pure and Applied Microbiology, 2015, 9(1):87-95.
[18] Tian W, Bi Y H, Zeng W, et al.Diversity of Endophytic Fungi ofMyricariaLaxifloraGrown under Pre- and Post-flooding Conditions [J].Genetics and Molecular Research, 2015, 14(3):10849-10862.
[19] 魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979:90-121.
[20] 郦皆秀,李 进,徐丽珍,等.西藏产冬虫夏草化学成分研究[J].中国药学杂志,2003,38(7):499-501.
[责任编辑 周文凯]
Isolation and Identification of Main Substance Ergosterol from the Endophytic Fungus MG-9 and Its Antioxidant Activity Analysis
Qin Wanggege Kong Yushan Jiang Wei Li Hui Xue Yanhong Liu Chengxiong Liu Shiping
(College of Life Science & Pharmacy, China Three Gorges Univ., Yichang 443002, China)
A main substance was recrystallized from the crude extract of an endophytic fungus MG-9 inMyricarialaxiflora, and the main substance was identified as ergosterol by modern spectroscopy techniques such as NMR and MS. The toxic effects and antioxidant protection mechanism of MG-9 main substance on the neurotoxicity of nerve cell SH-SY5Y were studied by using LDH (Lactic dehydrogenase), SOD (Superoxide dismutase), caspase 3 and caspase 9 enzyme activity expression as indicators. The results showed that the dose-effect relationship of ergosterol to nerve cell SH-SY5Y neurotoxicity was not significant at 6.25-25 μg/mL, but it had better effect on oxidative damage protection of nerve cell SH-SY5Y at 6.25 μg/mL. The relative survival rate of nerve cell SH-SY5Y was increased by 74.5 % under H2O2(800 μmol/L). And ergosterol can inhibit the activity of apoptosis protein caspase 3 to achieve anti-oxidative protection effect of nerve cell SH-SY5Y.
endophytic fungi; ergosterol; nerve cell protection; antioxidant activity
2016-12-06
国家自然科学基金项目“三峡河岸带植物疏花水柏枝内生菌介导的酚酸类物质变化及抗涝害胁迫机理研究”(31270389);国家自然科学基金应急管理项目“疏花水柏枝内生真菌RX01调控细胞热激蛋白介导的抗氧化胁迫能力研究”(31540065)
刘士平(1974-),男,博士,教授,研究方向为生物防治.E-mail:462301586@qq.com
10.13393/j.cnki.issn.1672-948X.2017.02.023
R284.1
A
1672-948X(2017)02-0108-05
