氧含量及附着面积对海洋底栖硅藻生长和胞外多聚物的影响
2017-04-21武福源郑纪勇杨靖亚蔺存国1
陈 琪,武福源,郑纪勇*1,,杨靖亚,蔺存国1,
(1. 海洋腐蚀与防护重点实验室,山东 青岛 266101;2. 中国船舶重工集团公司 第七二五研究所,河南 洛阳 371000;3. 上海海洋大学 食品学院,上海 201306)
氧含量及附着面积对海洋底栖硅藻生长和胞外多聚物的影响
陈 琪1,3,武福源2,郑纪勇*1,2,杨靖亚3,蔺存国1,2
(1. 海洋腐蚀与防护重点实验室,山东 青岛 266101;2. 中国船舶重工集团公司 第七二五研究所,河南 洛阳 371000;3. 上海海洋大学 食品学院,上海 201306)
胞外多聚物(extracellular polymeric substance, EPS)是海洋底栖硅藻在水下表面附着时分泌的物质,环境因素对胞外多聚物的组成和分泌行为有直接影响,本文重点探讨了氧含量和附着面积对胞外多聚物的影响。采用热溶剂浸提法提取硅藻胞外多聚物,利用苯酚-硫酸法定量其中的多糖成分,利用考马斯亮蓝G-250法定量蛋白质成分,通过血球计数板法和紫外分光光度法计算细胞数量。结果表明,在氧含量高、可附着面积大的条件下,硅藻的生长繁殖速率快,且单个细胞的胞外多聚物分泌量大。氧含量对胞外多聚物主要成分中的水溶性多糖含量影响大,而对其余成分含量影响小。可附着面积对硅藻附着和生长的影响比氧含量影响小。
海洋底栖硅藻;氧含量;附着面积;胞外多聚物
0 引言
海洋底栖硅藻是海洋生态系统中最重要的一类微生物,在海洋初级生产者中,其贡献超过45%[1],在全球范围的硅循环、碳循环中发挥了重要作用[2]。然而,对于人类海洋工程设施而言,海洋底栖硅藻是一种典型的污损生物[3],作为海洋微观污损生物膜的主要组分,是引起后续宏观生物污损的重要奠基者[4]。防除底栖硅藻在人工设施表面的附着,有助于遏止生物污损的快速发展。通过考察外界因素对硅藻胞外多聚物(extracellular polymeric substance, EPS)的组成和分泌变化影响,可了解硅藻粘附的物质基础和粘附机理,有助于针对性地寻找抑制硅藻附着的方法。
外界环境因素对海洋底栖硅藻的附着和生长有很大影响[5-6]。目前对环境因素的研究主要集中在光照、温度、盐度、pH值等因子,对氮、磷、铁、硅等营养元素的研究也较多[7],而且研究大多以寻找硅藻扩增培养的最佳条件为目的,而以防除硅藻附着为目的的研究相对较少。虽然海洋人工设施所处的环境因素很多,如光照、温度、盐度等,不同海域和水深的环境条件存在差异,这些均会影响硅藻附着生长,但大多环境因素(如温度、盐度、光照、营养元素等)不会因固体设施的表面防护措施而发生改变,因此对于防除硅藻附着而言,众多的环境因素研究并没有可参考意义。而有些因素可通过防护涂层来实现局部控制,如微膜层中的氧含量及涂层表面积等。
海洋底栖硅藻依靠胞外多聚物进行附着和滑行,实现底栖生长[8]。通过对胞外多聚物进行定量研究,可更深入地分辨出影响硅藻附着的主要因素。本文从硅藻胞外多聚物中多糖和蛋白质定量分析的角度,探讨影响硅藻附着生长的环境因素,重点研究海水中氧含量和附着面积对硅藻胞外多聚物分泌的影响。
1 材料与方法
1.1 实验材料
本实验所用海洋底栖硅藻为小型舟形藻Naviculaparva,各类水体均有分布。实验样品取自山东省青岛市太平角海域(36°03′N,120°21′E),由海洋腐蚀与防护国家级重点实验室(中国船舶重工集团公司第七二五研究所)取种、分离、纯化和培育。
1.2 实验方法
1.2.1 海洋底栖硅藻的培养
向灭菌后的15 mL试管中加入细胞浓度为1.14×105cells/mL的小型舟形藻悬浮液5 mL,再加入灭菌后的f/2营养液5 mL。按照图1所示的实验组培养硅藻:SK组试管竖直放置,纱布封口;SF组试管竖直放置,充氮气2 min后,橡胶塞封口;XK组试管倾斜45°放置,纱布封口;XF组试管倾斜45°放置,充氮气2 min后,橡胶塞封口。注意斜放时试管向下的位置始终不变。恒温光照培养箱中培养14 d,温度为25 ℃,光照强度为3 000 lx。每组实验均培养12支试管,每4支试管培养的硅藻作为1次实验用,即每组实验3次平行。(注意:纱布组和橡胶塞组主要体现硅藻生长过程中氧含量的不同,竖直放置组和倾斜放置组主要体现硅藻生长过程中附着面积的不同)。
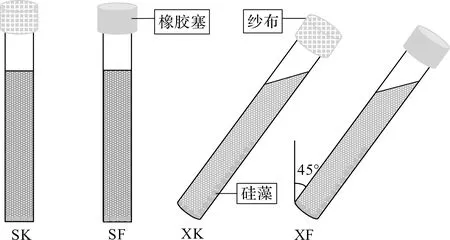
图1 硅藻附着生长实验组示意图Fig.1 Sketch map of the experimental groups for diatom attachment
1.2.2 硅藻的观察
硅藻在培养14 d的过程中,每天用数码相机对4组实验的硅藻进行观察拍照,记录硅藻在试管中的生长外观。
1.2.3 硅藻胞外多聚物的提取
海洋底栖硅藻EPS的提取采用WUSTMAN et al[9]和王大志 等[10]文献中的热溶剂浸提方法。硅藻培养14 d后,将上层培养液倒掉,并用少量灭菌海水洗涤附着于管底及管壁的藻体3次。用毛刷将藻体刷出,每组实验的藻体收集至50 mL离心管中,加入15 mL灭菌蒸馏水,缓慢摇动离心管使藻体分散,取2.5 mL用于硅藻细胞数量的测定(见1.2.4测定方法),然后离心10 min(12 000 r/min),弃上清液,沉淀用灭菌蒸馏水冲洗,离心。沉淀中加入90%的酒精10 mL,提取10 min,离心,重复3次,再用灭菌蒸馏水冲洗3次,离心。离心后的固体沉淀悬浮于15 mL灭菌蒸馏水,加热至90 ℃,提取1 h,离心,取上清液,即为硅藻EPS的水溶性组分(Mw);再将离心得到的沉淀悬浮于15 mL 0.5 mol/L碳酸氢钠溶液,加热至95 ℃,提取5 h,离心,取上清液,即为硅藻EPS的水不溶性组分(Mwi)。将Mw和Mwi两种组分分别放在蒸馏水中透析24 h,每隔6 h换一次蒸馏水。量取透析后提取液体积(V1),并将其收集至离心管中。
1.2.4 硅藻细胞数量的测定
(1)显微计数法:取1.2.3中所取的2.5 mL硅藻悬浮液0.5 mL,用灭菌蒸馏水稀释5倍,取稀释液在光学显微镜下,于20倍物镜视野下,用血球计数板的方法记录硅藻细胞数量,计算出每组实验用硅藻细胞总数(N)。硅藻细胞的计数结果取3个平行实验的平均值。
(2)紫外分光光度测试法:取1.2.3中所取的2.5 mL硅藻悬浮液2 mL于比色皿中,在紫外分光光度计中进行测试,以蒸馏水为空白对照组,扫描波长为300~800 nm,记录紫外扫描曲线。
1.2.5 海洋底栖硅藻胞外多聚物成分的测定
实验以葡萄糖为标准糖类作出葡萄糖标准曲线:Ys=0.042 2Xs,R2=0.992 8(Ys:待测液中葡萄糖吸光度值,Xs:待测液中葡萄糖质量浓度,μg/mL);以牛血清蛋白为标准蛋白质作出蛋白质标准曲线:Yp=0.047 2Xp,R2=0.995 8(Yp:待测液中牛血清蛋白吸光度值,Xp:待测液中牛血清蛋白质量浓度,μg/mL)。
多糖的测定采用苯酚-硫酸法[11-12],可见光吸收光谱测试范围为400~600 nm波长,取波长485 nm的吸光度值(As)进行计算,每个样品测量3次吸光度值,求平均值。根据吸光度标准曲线拟合公式,单个细胞胞外多聚物各组分中的多糖含量计算公式如下:
(1)
式中:Gs为单个细胞胞外多聚物组分中的多糖含量,μg/cell;As为485 nm处多糖的吸光度值;V1为透析后总体积,mL;V2s为紫外测量所用透析液的体积,mL,本实验为2 mL;V3s为显色后混合液总体积,mL,本实验为8 mL;N为实验用细胞总数目,cells。
蛋白质的测定采用考马斯亮蓝G-250法[13-14],可见光吸收光谱测试范围为500~800 nm波长,取波长595 nm的吸光度值(Ap)进行计算,每个样品测量3次吸光度值,求平均值。根据吸光度标准曲线拟合公式,单个细胞胞外多聚物各组分中的蛋白质含量计算公式如下:
(2)
式中:Gp为单个细胞胞外多聚物组分中的蛋白质含量,μg/cell;Ap为595 nm处蛋白质的吸光度值;V1为透析后总体积,mL;V2p为紫外测量所用透析液的体积,mL,本实验为1 mL;V3p为显色后混合液总体积,mL,本实验为6 mL;N为实验用细胞总数目,cells。
1.2.6 统计分析方法
各实验均进行3次平行实验,定量数据为3次平行实验的平均值,并计算方差。使用SPSS 19.0统计分析软件对实验结果进行方差分析,当P<0.05时为显著差异,当P<0.01时为极显著差异。
2 结果与讨论
2.1 硅藻的附着生长状况
4组实验组的小型舟形藻在相同温度和光照条件下培养14 d,经过连续观察拍照,得到小型舟形藻生长图片,如图2~图5所示。

图2 SK组小型舟形藻生长图Fig.2 The growth picture of Navicula parva for SK group

图5 XF组小型舟形藻生长图Fig.5 The growth picture of Navicula parva for XF group
由图2~图5可以看出,1~2 d有硅藻生长附着的位置,试管颜色较浅,说明该时间段内细胞生长速率较缓慢,细胞数目较少;3~7 d,试管颜色随培养时间的增加明显变暗,说明硅藻细胞生长速率较大,细胞数目较多;7 d后,试管颜色基本保持不变,细胞数目达到稳定。海洋底栖硅藻在1~2 d属于生长繁殖的对数期,3~7 d属于生长繁殖过程中的指数生长期,7 d后属于生长的稳定时期。
同时可以发现,同一时间点,SK组硅藻生长的位置试管颜色比SF组试管颜色深,XK组试管颜色比XF实验组颜色深。说明开口培养的实验组(SK和XK)细胞生长速率高于闭口培养的实验组(SF和XF),因此生长繁殖的细胞数目较多。由此可见,虽然海洋底栖硅藻可以通过光合作用产生氧气,但环境中含氧量的高低对硅藻细胞的生长速率和生长数量仍然有影响,氧含量小可降低硅藻细胞的分裂增殖速度。
另一方面,竖直放置组(SK和SF)的硅藻主要集中在试管底部,试管底部以上的表面很少有硅藻生长附着,而倾斜放置组(XK和XF)的硅藻不仅在试管底部生长,在向下的管壁也有生长,并且从试管底部向上,颜色逐渐变浅。由于底栖硅藻自身不能在水中自主游动[15-16],只能被动趋近并降落在基底的表面上[17-18],竖直放置组的硅藻只能降落到试管底部,由于不存在水平作用力,硅藻难以到达竖直的试管壁;而倾斜放置组的硅藻则可以降落到管壁形成的斜面,细胞得到更多的降落空间,而且只要降落到管壁上即可附着生长,而不必完全滑落到试管底部。该实验证明,硅藻由浮游状态到附着状态的转变过程属于完全被动状态,在静态海水中为自由落体运动,而在实海状态则随波运动,当接触到固体表面时才会附着。
2.2 氧含量和附着面积对硅藻生长繁殖数量的影响
本文采用两种计数方式记录硅藻生长数量。其中显微计数是利用血球计数板在显微镜下直接计数。通过对培养14 d的小型舟形藻悬浮液进行显微观察计数,计算得到硅藻细胞浓度,见图6。
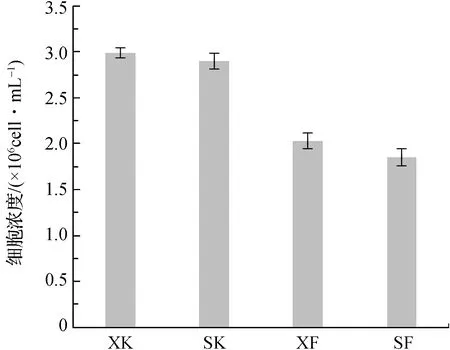
图6 4组实验14 d后的硅藻细胞浓度Fig.6 The cell concentration of diatoms after 14 d from four experimental groups
紫外分光光度法是利用可见光、紫外线照射某些物质,基于物质对光选择性吸收的特性进行的定量分析。本实验通过对培养14 d后的硅藻悬浮液在300~800 nm的波长范围内进行紫外测量,获得吸光度曲线,用吸光度值大小来表征4组实验的硅藻细胞生长数目,见图7。
从图6和图7可见,两种定量方法的结果一致。开口实验组硅藻细胞浓度和吸光度值均大于闭口实验组,可见氧含量高的实验组细胞生长速率大于氧含量低的实验组,表明海洋底栖硅藻在生长繁殖的过程中,环境中氧含量减少对硅藻生长繁殖有抑制作用,氧含量高的环境中硅藻生命活动旺盛,生长繁殖速率较快。
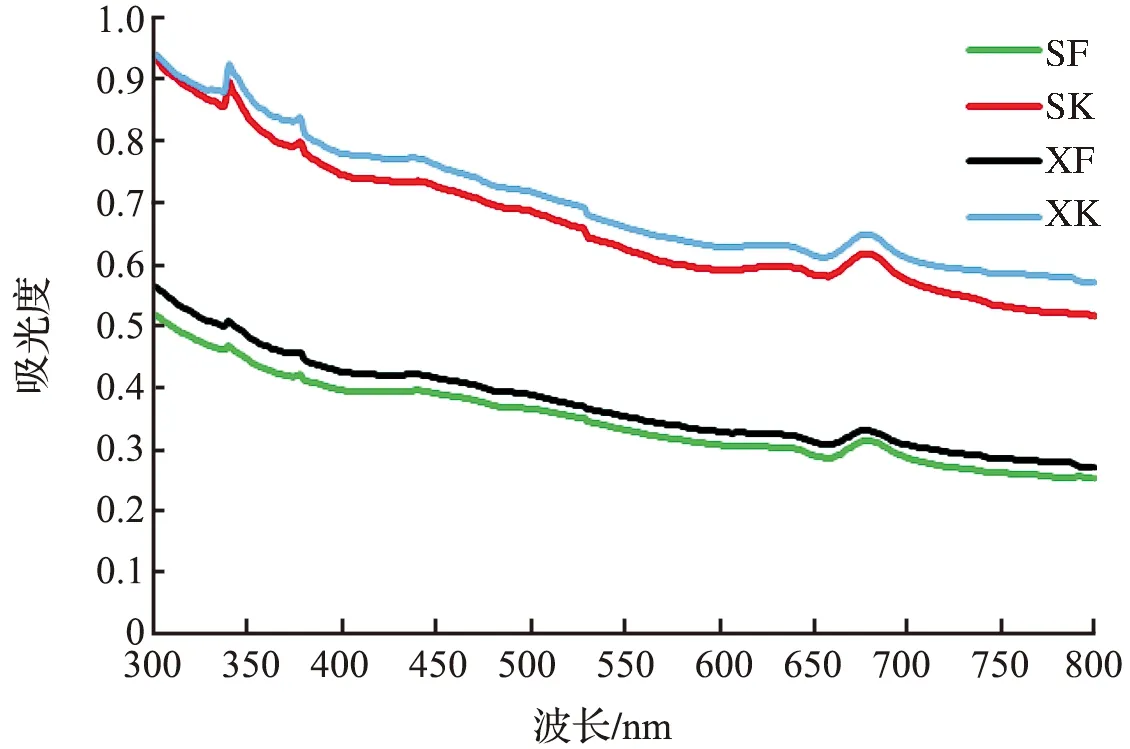
图7 4组实验14 d后硅藻紫外可见吸光度曲线Fig.7 The UV scanning curve of diatoms after 14 d from four experimental groups
从倾斜放置实验组与竖直放置实验组的对比来看,倾斜放置实验组细胞浓度和吸光度值均大于竖直放置实验组,可见生长附着空间大的实验组细胞生长速率大于生长附着空间小的实验组。由于海洋底栖硅藻生长附着过程中,通过自由落体运动到达附着区域,面积越大,可容纳细胞生长的数目越多,更多的“居住空间”更有利于硅藻分裂繁殖,因而在同样光照和温度培养条件下,最终的硅藻数量更多。同时,硅藻附着生长过程中,存在沿表面的滑行运动,以到达更适宜的生长区域,因此,附着基底面积越大,硅藻可选择的生长空间越大,细胞生长繁殖越快,导致最终的细胞数量越多。
同时,虽然海水中氧含量的高低和硅藻附着基底面积的大小均对硅藻附着生长有影响,但两种影响因素对比发现,氧含量的影响作用远大于附着面积的影响作用,差异较显著(P<0.01)。
2.3 氧含量和附着面积对硅藻胞外多聚物中多糖和蛋白质的影响
对4组实验14 d后小型舟形藻EPS提取液Mw和Mwi两组分中的多糖和蛋白质进行光谱测量。根据1.2.5中的计算公式,利用标准曲线、吸光度值计算得到4组实验硅藻EPS中多糖和蛋白质的含量,见图8和图9。
由图8和图9可以看出,4组实验单个硅藻细胞胞外多聚物中的多糖和蛋白质两种物质的含量各不相同。竖直放置实验组的多糖和蛋白质的含量均低于倾斜放置实验组。由于硅藻是以自身分泌的胞外多聚物为介质,在材料表面上爬行。因此,硅藻附着生长面积越大,单个硅藻细胞爬行活动范围相对越大,导致单个细胞分泌的胞外多聚物越多,相应的单个细胞分泌的多聚物中多糖和蛋白质成分的含量比在附着面积小的环境中生长的硅藻胞外多聚物分泌的量高。
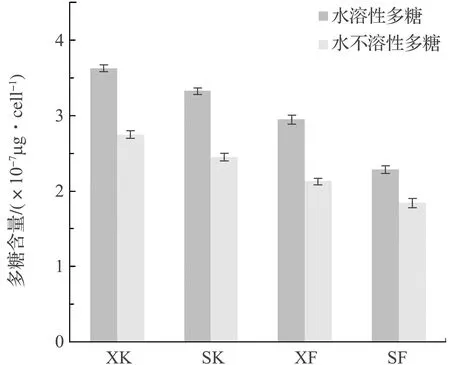
图8 4组实验硅藻胞外多聚物中多糖含量Fig.8 The contents of polysaccharide in EPS from four experimental groups
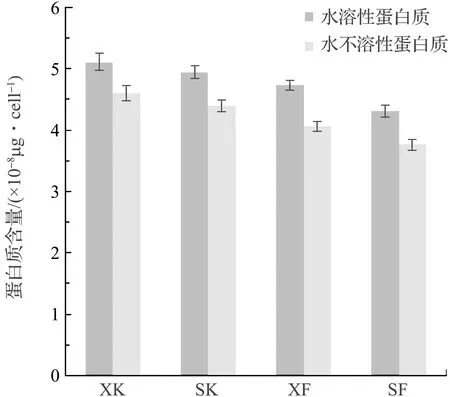
图9 4组实验硅藻胞外多聚物中蛋白质含量Fig.9 The contents of protein in EPS from four experimental groups
开口实验组单个细胞分泌的胞外多聚物中多糖和蛋白质含量均高于闭口实验组,这说明硅藻附着生长周围环境中的氧含量越高,硅藻生命代谢活动越旺盛,单个硅藻细胞分泌的胞外多聚物就越多,相应的单个细胞分泌的多聚物中的多糖和蛋白质含量比在氧含量低的环境中生长的硅藻胞外多聚物分泌的量高。
硅藻胞外多聚物中的多糖成分是硅藻胞外附着粘性物质,具有高附着力和长作用距离的特点[19-21]。由图8可知,硅藻胞外多聚物中水溶性多糖含量高于水不溶性多糖含量。硅藻胞外多聚物中的蛋白质成分与多糖成分聚合形成蛋白聚糖聚合物,可以使附着粘性物质的粘性更强[22]。由图9可以看出,硅藻胞外多聚物中水溶性蛋白质含量高于水不溶性蛋白质含量。
总之,硅藻在附着生长的过程中,4组实验硅藻胞外多聚物成分以水溶性组分作用为主,多聚物中多糖含量高于蛋白质。在氧含量高、附着面积大的环境中生长的硅藻,胞外多聚物的分泌量较多。
2.4 氧含量和附着面积对硅藻胞外多聚物组成成分影响的综合对比
硅藻胞外多聚物的水溶性和水不溶性部分皆以多糖类为主,达总量的70%以上,蛋白质含量次之,不含脂类物质[9],本实验通过光谱定量测试,得到了硅藻胞外多聚物的各组分含量,其中水溶性多糖和蛋白质,水不溶性多糖和蛋白质作为整体计算,各组分所占百分含量见图10。
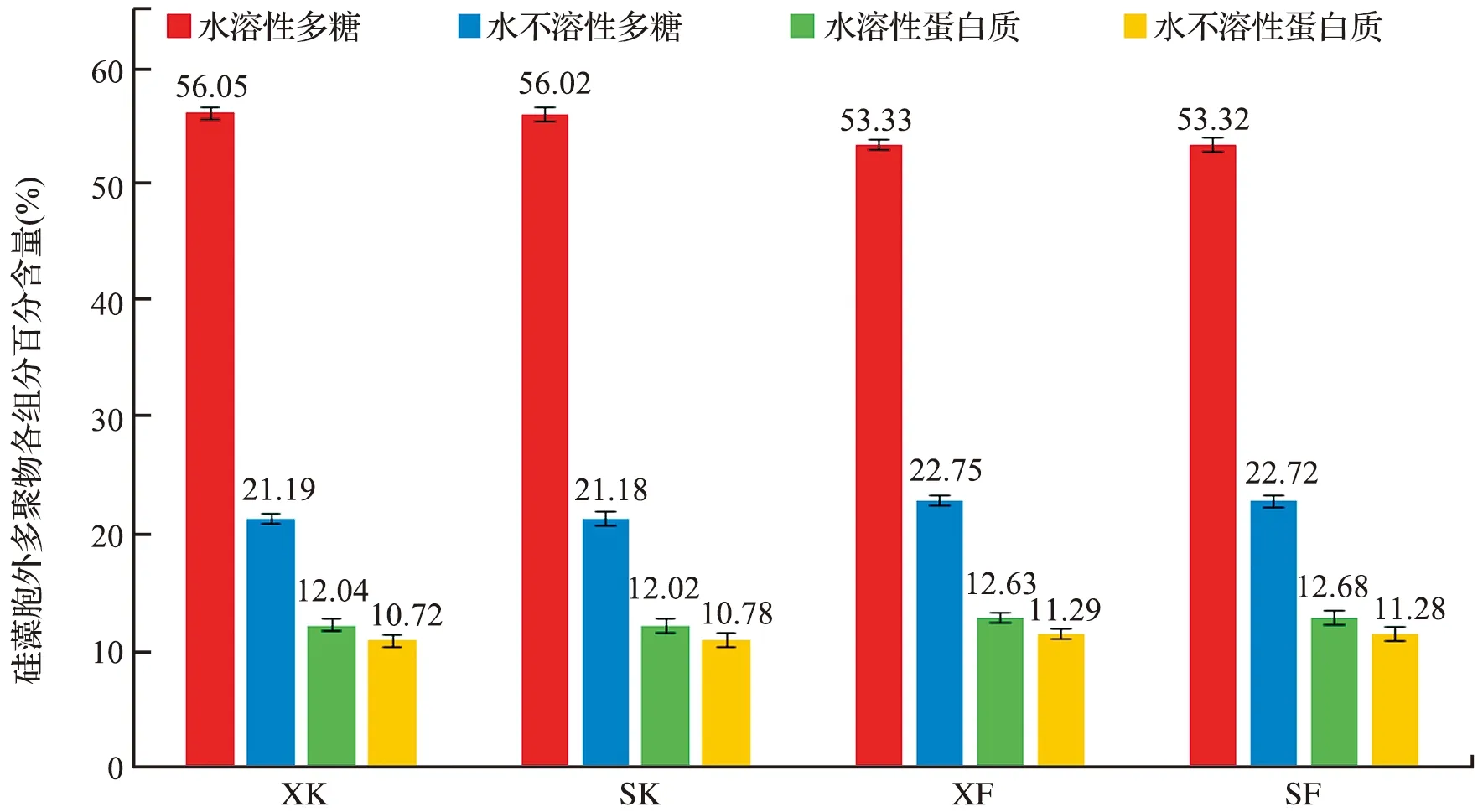
图10 4组实验硅藻胞外多聚物不同组分百分含量Fig.10 The percentage of different compositions in EPS from four experimental groups
由图10可以看出,4组实验硅藻胞外多聚物均以水溶性组分为主,占整个多聚物组分的66%以上,多聚物中的主要化学成分为多糖类,占多聚物组分的75%以上,而蛋白质含量在胞外多聚物组分中所占比例较少。可见氧含量和附着面积这两个因素的改变,并没有影响胞外多聚物成分的组成。
4组实验条件下,硅藻胞外多聚物中水溶性多糖所占比例的变化差异显著(P<0.05),开口组达到56%,闭口组为53%,可见氧含量对硅藻胞外多聚物中水溶性多糖成分有较大影响。而其它成分的百分比无明显差异(P>0.05),不溶性多糖占总量的22%左右,水溶性蛋白质占12%左右,不溶性蛋白质占11%左右。而附着面积对胞外多聚物成分的影响相对较小,无显著差异(P>0.05)。综合前面的实验结果来看,氧含量不但影响硅藻的繁殖数量,而且影响硅藻多聚物中水溶性多糖成分的含量。氧含量降低,一方面减少了硅藻多聚物中水溶性多糖成分的分泌量,另一方面也使硅藻的繁殖数量降低。
由此可以得到启示,改变固体表面积对硅藻附着有影响,但影响较小,即试图通过减少硅藻接触面积的方法来防除硅藻附着,并不一定收到理想的效果。而改变局部环境的氧含量对硅藻附着有更大影响。按此思路,在硅藻接触到的表面涂层中如果加入可降低环境氧含量的物质,如强还原剂等,可使硅藻接触的表面微环境氧含量减少,从而抑制硅藻胞外多聚物的分泌,减小永久性附着几率,同时可降低硅藻繁殖速率。该研究结果对今后防污材料的开发有启发意义。
3 结论
(1)氧含量高和较大的生长附着面积的环境条件下,硅藻生长繁殖较快。
(2)氧含量高和较大的生长附着面积的环境条件下,硅藻胞外多聚物分泌量会增加,相应的硅藻胞外多聚物中的各组分含量也会增加。
(3)氧含量对硅藻附着生长的影响远大于附着面积的影响。
(4)氧含量降低不但减少了硅藻多聚物中水溶性多糖的分泌量,也使硅藻的繁殖数量降低。
[1] GAO Ya-hui, JING Hong-mei, HUANG De-qiang, et al. Advances in studies on the extracellular production of marine microalgae[J]. Marine Science,2002,26(3):35-38.
高亚辉,荆红梅,黄德强,等.海洋微藻胞外产物研究进展[J].海洋科学,2002,26(3):35-38.
[2] MARTIN J V, HILDER M, BRZEN M A. Silicon metabolism in diatoms: implications for growth[J]. Phycol,2003,36(8):821-840.
[3] HUANG Zong-guo, CAI Ru-xing. The marine biofouling organisms and prevention[M].Beijing: China Ocean Press,1984.
黄宗国,蔡如星.海洋污损生物及其防除[M].北京:海洋出版社,1984.
[4] ROUND F E, CRAWFORD R M, MANN D G. The Diatoms: Biology and morphology of the genera[M].Cambridge: Cambridge University Press,1990.
[5] CAO Shan. Research on adhesion mechanism and antifouling technologies of a marine benthic diatom[D]. Beijing: Tsinghua University,2013.
曹彬.海洋底栖硅藻附着机理及其防污技术研究[D].北京:清华大学,2013.
[6] CAO Shan, WANG Jia-dao, CHEN Hao-sheng, et al. Progress of marine biofouling and antifouling technologies [J]. Materials Science,2011,56(7):598-612.
[7] JING Hong-mei. Experimental studies on the extracellular products of marine microalgae[D]. Xiamen: Xiamen University,2001.
荆红梅.海洋微藻胞外产物的实验研究[D].厦门:厦门大学,2001.
[8] EGGE J, AKSNESK D. Silicate as regulating nutrient in phytoplankton competition[J]. Mar Ecol Prog Ser,1992,83(3):281-289.
[9] WUSTMAN B A, GERTZ M R, HOGLAND K D. Extracellular matrix assembly in diatoms(B)acillariophyceae, II. A model of adhesives based on chemical characterization and localization of polysaccharides from the marine diatom Achnantheslongipes[J]. Plant Physiology,1997,113(4):1 051-1 069.
[10] WANG Da-zhi, HUANG Shi-yu, CHENG Zhao-di. Studies on morphology,microstructure and component of extracellular polymeric substance from three species marine diatoms[J]. Oceanologia et Limnologia Sinica,2004,35(3):273-278.
王大志,黄世玉,程兆第.三种海洋硅藻胞外多聚物形态、微细结构及组成的初步研究[J].海洋与湖沼,2004,35(3):273-278.
[11] XU Gung-yu, YAN Jun, GUO Xiao-qiang. et al. The betterment and apply of Phenol-Sulphate Acid method[J]. Food Science,2005,26(8):342-346.
徐光域,颜军,郭晓强,等.硫酸-苯酚定糖法的改进与初步应用[J].食品科学,2005,26(8):342-346.
[12] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding [J]. Anal Biochem,1976,72(1):248.
[13] WANG Xiao-ping, XING Shu-li. Determination of protein content by Coomassie Brilliant Blue method[J]. Chemical industry of Tianjin,2009,23(3):40-41.
王孝平,邢树礼.考马斯亮蓝法测定蛋白质含量的研究[J].天津化工,2009,23(3):40-41.
[14] ZOU Ning, SUN Dong-hong, GUO Xiao-yan. Effects of environmental and nutritional conditions on growth of marine benthic diatoms[J]. Journal of Aquaculture,2005,26(5):004.
邹宁,孙东红,郭小燕.培养条件对底栖硅藻生长的影响[J].水产养殖,2005,26(5):004.
[15] ALBERT R S, SNYDR S, ZAHURANEC B J, et al. Biofouling research needs for the United State Navy: Progam history and goals[J]. Biofouling,1992,6(2):91-95.
[16] DUBOIS M, GILLES K A, HAMILTON J K, et al. Colorimetric method for determination of sugars and related substances[J]. Anla Chem,1956,28(3):350-356.
[17] ZHANG Shao-yun. Studies on the mechanism and prevention properties of Ceramide for marine fouling organisms[D]. Qingdao: Ocean University of China,2012.
张少云.神经酰胺类物质对海洋污损生物的防除性能及其作用原理研究[D].青岛:中国海洋大学,2012.
[18] ZHAO Shou-huan. Studies on the inhibited effects of paeonol and four types of microstructure silica gel on Navicula minima[D]. Shanghai: Shanghai Ocean University,2015.
赵守涣.丹皮酚和四种微结构硅胶材料对小舟形藻的抑制作用研究[D].上海:上海海洋大学,2015.
[19] HOAGLAND K D, ROSOWSKI J R, GRETZ M R, et al. Diatom extracellular polymeric substances: function, fine structure chemistry, and physiology[J]. Journal of Phycology,2003,29(5):537-566.
[20] CHIOVITTI T M, WETHERBEE R. Diatom adhesives: molecular and mechanical properties[M]//SMITH A M, CALLOW J A. Biological adhesives[M]. Heidelberg: Springer,2006:79-103.
[21] UNDERWOOD G J C, PATERSON D M. The importance of extracellular carbohydrate production by marine epipelicdiatoms[J].Advances in Botanical Research,2003,40:183-240.
[22] MOLINOP J, WETHERBEE R. The biology of biofouling diatoms and their role in the development of microbial slimes[J]. Biofouling,2008,24(5):365-379.
Effects of oxygen content and attachment area on extracellular polymeric substance from marine benthic diatom
CHEN Qi1,3, WU Fu-yuan2, ZHENG Ji-yong*1,2, YANG Jing-ya2, LIN Cun-guo1,2
(1.StateKeyLaboratoryforMarineCorrosionandProtection,Qingdao266101,China; 2.LuoyangShipMaterialResearchInstitute,Luoyang, 371000,China; 3.FoodScienceandTechnologyCollege,ShanghaiOceanUniversity,Shanghai201306,China)
The extracellular polymeric substance (EPS) was secreted when marine benthic diatom attached on submerged surfaces, the environment factors had a directly impact on the composition and secretion action of EPS. The effects of the oxygen content and the attachment area on EPS were studied. The EPS from marine benthic diatoms were extracted by hot solvent method. The phenol-sulfuric acid method was employed to measure the content of polysaccharide and the Coomassie Brilliant Blue G-250 method was employed to measure the content of protein in the extractions. The cell number of diatoms was measured through the method of blood cell counting plate and UV spectrophotometry. The results show that the growth rate of diatoms is fast and the secretion amounts of EPS in a single cell are great under the higher oxygen content and larger attachment area conditions. The oxygen content has a great impact on the content of water-soluble polysaccharide as the main composition in EPS, while it has little impact on the else components. Compared to the oxygen content, the attachment area has little impact on the attachment and growth of diatoms.
marine benthic diatom; oxygen content; attachment area; extracellular polymeric substance
10.3969/j.issn.1001-909X.2017.01.008.CHEN Qi, WU Fu-yuan, ZHENG Ji-yong, et al. Effects of oxygen content and attachment area on extracellular polymeric substance from marine benthic diatom[J].Journal of Marine Sciences,2017,35(1):66-72, doi:10.3969/j.issn.1001-909X.2017.01.008.
2016-02-24
2016-07-09
国家重点基础研究发展计划项目资助(2014CB643305);国家自然科学基金项目资助(21301161)
陈琪(1990-),女,山东青岛市人,主要从事海洋生物污损机理方面的研究。E-mail:13176511201@163.com
*通讯作者:郑纪勇(1978-),男,高级工程师,主要从事生物材料方面的研究。E-mail:zhengjy@sunrui.net
U672.7+2
A
1001-909X(2017)01-0066-07
10.3969/j.issn.1001-909X.2017.01.008
陈琪,武福源,郑纪勇,等.氧含量及附着面积对海洋底栖硅藻生长和胞外多聚物的影响[J].海洋学研究,2017,35(1):66-72,
