脱氮硫杆菌的筛选及其对锶离子的矿化作用
2017-04-21邬琴琴代群威韩林宝赵玉连NazarMuhammad
邬琴琴,代群威,韩林宝,王 岩,党 政,赵玉连,Nazar Muhammad
西南科技大学 环境与资源学院,四川 绵阳 621000
脱氮硫杆菌的筛选及其对锶离子的矿化作用
邬琴琴,代群威*,韩林宝,王 岩,党 政,赵玉连,Nazar Muhammad
西南科技大学 环境与资源学院,四川 绵阳 621000
放射性污染日益严重,其中锶污染作为土壤典型污染之一成为研究热点。土壤中存在着一些矿化菌,能够对锶离子进行矿化固定。本实验对从土壤中分离的3株脱氮硫杆菌的特性及其对Sr2+的矿化行为进行了研究,发现该菌对1.0 g/L模拟Sr2+污染的去除率可达80%。扫描电子显微镜(SEM)、能谱分析(EDS)、X射线衍射(XRD)、傅里叶变换红外光谱(FTIR)等结果显示,矿化产物为硫酸锶。可见,利用脱氮硫杆菌治理土壤中Sr2+污染具有可行性,该方法将会有一定应用前景。
脱氮硫杆菌;筛选;锶;矿化
放射性污染已经成为倍受关注的公共问题之一[1]。放射性核素对人体的危害主要是辐射伤害,辐射不仅可扰乱和破坏机体细胞组织的正常代谢活动,而且可直接破坏细胞和组织结构,对人体产生躯体损伤效应(如白血病、恶性肿瘤、生育力降低、寿命缩短等)和遗传损伤效应(如流产、遗传性死亡和先天畸形等)。锶作为一种放射性核素,具有较长的半衰期和极强的毒性[2]。稳定的锶,即+2价氧化态的锶,主要以天青石 (SrSO4)和菱锶矿(SrCO3)分布在自然界中[3]。放射性核素的去除一直受到人们的密切关注,目前放射性污染的治理技术包括物理修复、化学修复、植物修复和微生物修复等。传统的物理和化学修复技术的最大弊端是污染物去除不彻底,容易产生二次污染。植物修复技术不会破坏土壤结构,修复费用较低,但其修复周期长且超积累植物难以找到。与以上几种修复技术相比,微生物修复具有处理效果好、不会造成二次污染、操作简单、可就地处理等优势[4-5]。
土壤中存在着大量的微生物[6],其中有些土著细菌因其可与放射性核素进行生物矿化作用已经成为研究热点。竹文坤等[7]利用碳酸盐矿化菌对模拟放射性Sr2+进行诱导成矿,对Sr2+固结率可达98.32%。Li等[8]利用尿素分解菌对镍、铜、铅、钴、锌和镉等重金属离子进行去除,去除率可达88%以上。许凤琴等[9]利用碳酸盐矿化菌去除锶,去除率可达98%~99%。徐卫华等[10]利用硫酸盐还原菌去除铬,去除率达99.8%。王婷等[11]利用蜡状芽孢杆菌修复铅锌污染,去除率达89%。
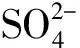
1 实验部分
1.1 实验材料和仪器
本实验菌株脱氮硫杆菌提取于西南科技大学污水处理厂附近土壤及污泥,采用平板划线法将土壤中提取的细菌纯化,获得3株脱氮硫杆菌。
脱氮硫杆菌培养基:液体培养基Na2S2O3·5H2O 5 g,KNO32 g,KH2PO41 g,NaHCO30.5 g,MgCl2·6H2O 0.25 g,蒸馏水1 000 mL,用NaOH调pH至7.0~7.6,121 ℃高温灭菌20 min;上述试剂均为市售分析纯(富集培养基按照2×基本培养基组成配制)。固体培养基:向基本培养基中加入18 g/L琼脂粉,加热溶解后121 ℃灭菌20 min, 制作分离平板培养基。1 g/L锶溶液:取2.415 g Sr(NO3)2溶于1 L水中(其他浓度按比例配制)。
ICS900型离子色谱仪器,美国Varian公司;S40 Seven Multi pH/电导率仪,瑞士梅特勒公司;Bioscreen C型全自动生长曲线分析仪, 芬兰Bioscreen C公司;VG9000质谱仪及电感耦合等离子质谱仪(ICP),美国PE公司;Ultra55型场发射扫描电子显微镜系统(SEM/EDS),日本精工;X’Pert PR0 多功能 X 射线衍射仪(XRD),荷兰PANalytical公司;Nico-let5700傅里叶变换红外光谱仪(FTIR),日本岛津,光谱范围4 000~400 cm-1, 最高分辨率0.4 cm-1, 波数精度0.01 cm-1, 扫描速率0.158 1~3.164 7 cm/DWDs。
1.2 实验方法
1.2.1 菌种的分离鉴定 从西南科技大学污水处理厂取污泥和土壤,用脱氮硫杆菌选择培养基分离出菌种,采用平板划线法将提取的细菌纯化,获得3株菌株(分别命名为T1、T2和T3)。采用生化反应管测定菌株的生理生化指标,并参照文献[13]进行鉴定。
1.2.2 脱氮硫杆菌的生长特性和产生硫酸根特性 接入菌液后的培养基使用漩涡振荡器振荡1 min后,用移液器移取0.2 mL菌液于蜂窝板内,放置于Bioscreen C型全自动生长曲线分析仪测定其生长曲线。接入菌种后的培养基放置在35 ℃、150 r/min的条件下振荡培养,对细菌进行定期取样,用离子色谱仪测定培养基中硫酸根浓度,分别于1、2、3、4、5、6、7 d同一时刻取样,每次5 mL,使用pH/电导率仪测定培养基的pH。分别配制含锶质量浓度为0、50、500、1 000、1 500 mg/L的培养基,分别接入同一种株菌种,并且每组做两组平行实验,进行生长曲线测试。结合菌株在400~700 nm波长之间对应的透过率全谱测试结果:随着波长增加,透过率略有下降趋势,但波长较小时细菌数目较少;综合考虑,选择波长450 nm作为生长曲线测试波长,此时细菌数目和透过率相对适宜。
1.2.3 脱氮硫杆菌固化Sr2+实验 配制Sr2+质量浓度1 000 mg/L的培养基,将筛选出的脱氮硫杆菌接入灭菌后的液体培养基,于30 ℃恒温培养箱中150 r/min下培养,分别于1、2、3、4、5、6、7 d取样,在4 000 r/min下离心10 min,取上清液1 mL,稀释后用于ICP测试。当看到培养基有絮凝状物质后,将细菌液取出,在高速离心机上以10 000 r/min离心10 min,取上清液制成细菌分泌物液。Sr2+质量浓度为0.5 g/L的矿化沉淀物用去离子水洗涤3次,60 ℃下烘干碾磨后,放置干燥皿中作为样品备用,对沉淀物进行SEM/EDS、FTIR以及XRD分析。
2 结果与讨论
2.1 分离菌株的生理生化鉴定结果
实验筛选出几株在脱氮硫杆菌选择培养基中生长状况良好的菌株T1、T2、T3(图1)。镜检发现其中T1、T2和T3菌为革兰氏阴性自养细菌,硫杆菌科,呈短杆状,单个或对生,有中生芽孢。在好氧条件下生长缓慢,菌落很小,呈乳白色。在厌氧下菌落呈小圆透明状,能利用麦芽糖乳糖、葡萄糖和淀粉,能还原硝酸盐,能产生硫酸根,但不产生硫化氢,最适生长 pH为7.02,适宜在中性以及偏碱性条件下生长。根据形态、生理生化特征,参照伯杰恩细菌学鉴定手册[13]以及已有的关于脱氮硫杆菌的研究进一步确定T1、T2和T3为脱氮硫杆菌。
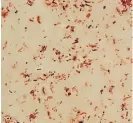
图1 脱氮硫杆菌革兰氏染色图Fig.1 Thiobacillus denitrificans
2.2 分离菌株的特性研究
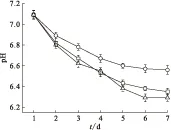
2.2.1 菌株的生长特性研究 根据土壤分离菌生长状况和革兰氏染色结果,选取T1、T2和T3菌株进行生长曲线测试。图 2为根据吸光度值在波长540 nm处随时间变化所绘制的脱氮硫杆菌生长曲线图。由图2可以看出,前30 h内,T1、T2和T3处于延滞期,均无明显的生长。在36 h后T1、T2和T3菌株开始进入对数生长期,检测到的吸光度值急剧增大,此时细菌以几何级数增长,酶系最为活跃,代谢最为旺盛,此阶段的菌液最适合用于接种。之后T1、T2和T3菌种分别在82 h、98 h和100 h进入稳定期,其代谢产物也将不断积累,逐渐不适宜其生长,导致细菌生长速率逐渐减小。而在100 h后,检测到T2菌的吸光度有所降低,代表细菌数量的下降,此阶段新增细菌减少,死亡细菌增多,细菌数量下降,出现“负增长”,细菌群的生长进入了衰亡期。T2菌种进入衰亡期。110 h后,T1和T3菌株也进入衰亡期。T2生长情况较T1、T3差。
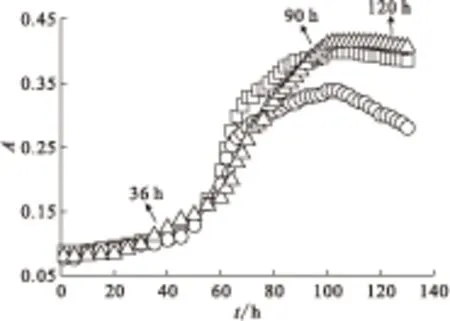
λ=540 nm□——T1,○——T2,△——T3图2 脱氮硫杆菌的生长曲线Fig.2 Growth curves of Thiobacillus denitrificans
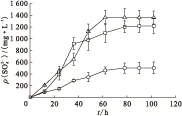
□——T1,○——T2,△——T3图3 脱氮硫杆菌产量Fig.production of Thiobacillus denitrificans
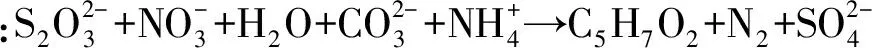
□——T1,○——T2,△——T3图4 脱氮硫杆菌菌液pH变化趋势Fig.4 Changes of pH in Thiobacillus denitrificans bacterial liquid
2.2.4 脱氮硫杆菌在含锶培养基中的生长曲线 将细菌接入含锶培养基中进行培养,测其生长曲线,结果示于图5。由图5可以看出,在含锶质量浓度为1 000 mg/L的培养液中,0~30 h内,脱氮硫杆菌生长缓慢,细菌数目变化很少,处于生长延滞期。30 h后细菌开始快速生长,30~90 h期间细菌数目快速增加,处于对数期,大约90 h开始,细菌数目开始趋向于稳定,120 h以后逐渐开始有下降趋势,细菌进入衰亡期。其生长曲线大致趋势与细菌在不含锶培养基中一致,但生长状况受到抑制。图6为不同初始锶离子浓度培养液中脱氮硫杆菌的生长曲线。由图6可知,脱氮硫杆菌生长曲线大致趋势与不含锶培养基中一致,在含锶培养基中能正常生长,菌种在低浓度锶下生长受到刺激反而促进生长,在高浓度锶培养液中菌种生长受到抑制,这与文献[16-17]报道结果一致。
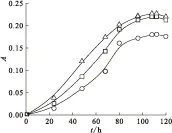
ρ0(Sr2+)=1 000 mg/L□——T1,○——T2,△——T3图5 脱氮硫杆菌在含锶培养基中的生长曲线Fig.5 Growth curves of Thiobacillus denitrificans in medium with strontium
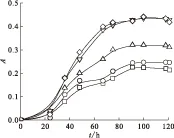
ρ0(Sr2+),mg/L:□——1 500,○——500,△——100,◇——50,▽——0图6 脱氮硫杆菌在不同初始锶离子浓度下的生长曲线Fig.6 Growth curves of Thiobacillus denitrificans at different initial Sr2+ mass concentrations
2.3 菌对Sr2+的去除率
图7为脱氮硫杆菌去除Sr2+的去除率。由图7可以看出,脱氮硫杆菌对锶离子的去除率随时间增加而增加,在第4 d以后逐渐趋向稳定,T1和T3去除率达到80%左右,T2去除率较低,不到60%。随着脱氮硫杆菌的生长,其代谢过程中产生的硫酸根浓度逐渐增大,同时硫酸根与锶离子结合产生沉淀。在细菌达到稳定期后期衰亡期初期时,硫酸根产量减少直至不再产生,此时去除率达到最高并趋向稳定。根据三株菌株对Sr2+的去除率,最终筛选出两株去除效果较好的菌种T1和T3。
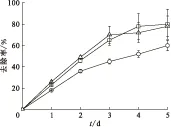
ρ0(Sr2+)=1 000 mg/L□——T1,○——T2,△——T3图7 脱氮硫杆菌去除Sr2+的去除率Fig.7 Removal rates of Sr2+by Thiobacillus denitrificans
2.4 矿化产物特性
图8(a)为脱氮硫杆菌矿化产物晶体的表面微观形态扫描电镜图。经能谱扫描后可以看出矿化产物为硫酸锶,晶体发育良好,晶体粒径大小分布不均匀。脱氮硫杆菌的锶矿化产物能谱分析示于图8(b)。由图8(b)可以看出,脱氮硫杆菌诱导产生的锶离子矿物沉淀图谱显示S、O、Sr三种元素的峰相比其他峰较强,说明其元素含量较高。对S、O、Sr三种元素的峰强进行归一化处理之后,得出各个元素定量或者半定量的分析结果,S、O、Sr相对含量(质量分数)分别是19.79%、64.41%、15.80%,其化学组成主要为SrSO4。
图8(d)为矿化产物晶体的XRD图谱,结合红外结果可知脱氮硫杆菌与硝酸锶作用后的矿化产物其化学组成主要为硫酸锶,矿物相为天青石。
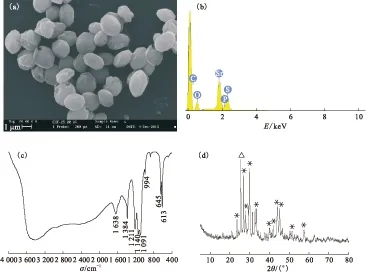
(a)——SEM图;(b)——EDS图;(c)——红外谱图;(d)——XRD图,×-代表硫酸锶,Δ代表磷酸氢锶图8 脱氮硫杆菌矿化产物特性分析图Fig.8 Properties analysis of Thiobacillus denitrificans bacteria and mineralized products
且其特征衍射峰尖锐,结晶度高,游离态锶离子被矿化成团聚态产物,证明了微生物矿化修复锶离子污染体系的可能性,初步实现了矿化修复的目的。
3 结 论
(1) 从土壤中分离并筛选得到的高活性3株自养型菌株,经鉴定菌株为硫杆菌属的脱氮硫杆菌(Thiobacillusdenitrificans)。该菌的生长周期约为120 h,生长过程中菌液pH从7.1左右降低到6.3左右。
(2) 脱氮硫杆菌对锶离子的去除率随时间增加而增加,在第4 d以后逐渐趋向稳定,去除率达到80%左右。结合去除率,最终筛选出两株菌种T1和T3。
(3) 利用XRD/FTIR/SEM手段检测到,脱氮硫杆菌与锶作用后的矿化产物为硫酸锶晶体,矿物相为天青石。利用碳酸盐矿化菌固化去除 Sr2+,去除率较高,这种方法可在Sr2+污染废水和土壤治理方面提供一定的参考。
致谢:西南科技大学分析测试中心的马国华老师和张伟老师分别在扫描电子显微镜使用和ICP测试方面提供了很大帮助,在此向上述两位老师表示衷心的感谢。
[1] Thakur P, Ballard S, Nelson R. An overview of Fukushima radionuclides measured in the northern hemisphere[J]. Sci Total Environ, 2013, 458: 577-613.
[2] Falciglia P P, Cannata S, Romano S, et al. Stabilisation/solidification of radionuclide polluted soils: part Ⅰ: assessment of setting time, mechanical resistance, γ-radiation shielding and leachate γ-radiation[J]. J Geochem Explor, 2014, 142: 104-111.
[3] Wang D, Wen F, Xu C, et al. The uptake of Cs and Sr from soil to radish (Raphanus sativus L.)-potential for phytoextraction and remediation of contaminated soils[J]. J Environ Radioact, 2012, 110: 78-83.
[4] Govarthanan M, Lee K J, Cho M, et al. Significance of autochthonous Bacillus sp. KK1 on biomineralization of lead in mine tailings[J]. Chemosphere, 2012, 90(8): 2267-2272.
[5] Kim G N, Shon D B, Park H M, et al. Development of pilot-scale electrokinetic remediationtech-nology for uranium removal[J]. Sep Purif Technol, 2011, 80(1): 67-72.
[6] Addadi L, Raz S,Weiner S. Taking advantage of disorder: amorphous calcium carbonate and its roles in bio-mineralization[J]. Adv Mater, 2003, 15: 959-970.
[7] 竹文坤,牟涛,段涛,等.碳酸盐矿化菌对模拟放射性Sr2+的成矿作用[J].环境科学研究,2015,28(1):157-162.
[8] Li M, Cheng X H, Guo H X. Heavy metal removal by biomineralization of urease producing bacteria isolated from soil[J].International Biodeterioration & Biodegradation, 2013, 76: 81-85.
[9] 许凤琴,代群威,侯丽华,等.碳酸盐矿化菌的分纯及其对Sr2+的矿化特性研究[J].高校地质学报,2015,21(3):376-381.
[10]徐卫华,刘云国,曾光明,等.硫酸盐还原菌及其还原解毒Cr(Ⅵ)的研究进展[J].微生物学通报,2009,36(7):1040-1045.
[11]王婷.蜡状芽孢杆菌修复重金属及多溴联苯醚复合污染的研究[D].广州:暨南大学,2007.
[12]刘明学,董发勤,李姝,等.固定化耐辐射奇球菌对锶柱吸附与减量化研究[J].环境科学与技术,2014,6:32-37.
[13]Buchan R E,Gibbens N E.中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组译.伯杰细菌鉴定手册[M].第八版.北京:科学出版社,1984:643-650.
[14]车轩,罗国芝,谭洪新,等.脱氮硫杆菌的分离鉴定和反硝化特性研究[J].环境科学,2008,29(10):2931-2937.
[15]Bisogni J J, Driscoll C T. Dentirfication using thiosulfate and sulfide[J]. J Environ Eng Div Am Soc Civ Eng, 1977, 1039(10): 593-604.
[16]韩桂琪,王彬,徐卫红,等.重金属Cd、Zn、Cu、Pb复合污染对土壤微生物和酶活性的影响[J].水土保持学报,2010,24(5):238-242.
[17]李淑英,马玉琪,苏亚丽,等.重金属胁迫培养对微生物生长的影响[J].贵州农业科学,2012,40(2):90-94.
Isolation and Strontium Mineralization ofThiobacillusDenitrificans
WU Qin-qin, DAI Qun-wei*, HAN Lin-bao, WANG Yan, DANG Zheng, ZHAO Yu-lian, Nazar Muhammad
School of Environment and Resource, Southwest University of Science and Technology, Mianyang 621000, China
Radioactive pollution is increasingly serious, and strontium contamination is a research hot point as one of the typical radioactive pollution. There are some mineralization bacteria in soil which can immobilize the heavy metal ion in the soil. 3 strains was isolated from soil and its characterization and mineralization to Sr2+was carried on. Results show that the removal rate of strains to 1.0 g/L simulated Sr2+is up to 80%. Scanning electron microscope(SEM), energy spectrum analysis(EDS), X-ray diffraction(XRD), Fourier transform infrared spectroscopy(FTIR) results show that mineral products is strontium sulfate. This study demonstrate that usingThiobacillusdenitrificansfor Sr2+pollution removal in the soil is feasible, and the method will have some application prospect.
Thiobacillusdenitrificans; select; strontium; mineralization
2016-10-17;
2017-02-21
国家自然科学基金青年基金资助项目(41102212);四川省科技厅应用基础研究项目(重点)(2016JY0213);西南科技大学博士基金资助项目(12zx7121)
邬琴琴(1989—),女,湖北黄冈人,硕士研究生,从事新生污染物安全与控制研究,E-mail: wuqinqin577577@163.com
*通信联系人:代群威(1978—),男,河南漯河人,教授,从事新生污染物安全与控制研究,E-mail: qw_dai@163.com
X172
A
0253-9950(2017)02-0187-06
10.7538/hhx.2017.39.02.0187
