急性白血病患者血清PDGF、HMGB1及相关血管内皮生长因子表达水平研究*
2017-04-20何春玲刘晶晶田林涛董昌虎
田 淼,晁 旭,何春玲,刘晶晶,田林涛,董昌虎△
1.陕西中医药大学 (咸阳 712046),2.陕西中医药大学第二附属医院(咸阳 712046)
急性白血病患者血清PDGF、HMGB1及相关血管内皮生长因子表达水平研究*
田 淼1,2,晁 旭1,2,何春玲2,刘晶晶2,田林涛2,董昌虎1,2△
1.陕西中医药大学 (咸阳 712046),2.陕西中医药大学第二附属医院(咸阳 712046)
目的:探究急性白血病患者血清血小板衍生因子(PDGF)、高迁移率族蛋白1(HMGB1)及相关血管内皮生长因子表达水平。方法:选择46例急性白血病患者为观察组,且选择同期健康体检者30例为对照组,再测定对观察组、对照组血清PDGF、HMGB1及相关血管内皮生长因子表达水平,并给予统计分析。结果:初诊组、复发组的PDGF、HMGB1水平均显著高于完全缓解组(P<0.05)。完全缓释组PDGF、HMGB1水平较初诊组显著降低,与对照组对比无显著差异(P>0.05)。在急性白血病患者中,VEGF-C在初诊组、完全缓解组及对照组中均不表达。初诊组VEGF-A、VEGF-R1、VEGF-R3均显著高于完全缓解组(P<0.05),完全缓解组与对照组对比(P>0.05);初诊组、完全缓解组VEGF-R2均显著高于对照组(P<0.05)。初诊患者血清PDGF与VEGF-A、VEGF-R1、VEGF-R2、VEGF-R3相关分析,结果无相关;血清HMGB1与VEGF-A、VEGF-R1、VEGF-R2、VEGF-R3相关分析,结果无相关。结论:急性白血病进展与血清PDGF、HMGB1及相关血管内皮生长因子表达水平密切相关,可通过检测血清PDGF、HMGB1及相关血管内皮生长因子水平评估患者预后效果。
白血病表现为机体造血组织中白血病细胞不断恶性增殖,且浸润到组织与各脏器进而阻碍正常造血细胞发挥作用,其属于造血干细胞恶性克隆性疾病[1-2]。患者通常表现为发热、贫血、淋巴结肿大。目前针对白血病发病机制尚未明确,但相关研究指出,血清血小板衍生因子(PDGF)、高迁移率族蛋白1(HMGB1)及相关血管内皮生长因子等在其发生、发展中发挥重要作用[3-4]。随临床深入研究,逐渐采用现代分子生物学、遗传学检测方法从基因、细胞分子水平上有效抑制以有效治疗白血病[5]。本研究旨在探究急性白血病患者血清PDGF、HMGB1及相关血管内皮生长因子表达水平,现报告如下。
资料与方法
1 一般资料 选择2014年9月至2016年9月我院收治46例急性白血病患者为观察组,其中男25例,女21例,年龄15~77岁,平均年龄为(51.4±4.2)岁,26例为初诊患者, 10例完全缓解,10例为复发患者。全部患者均符合《血液病诊断及疗效标准》,排除伴有其他恶性肿瘤、感染性疾病、相关免疫性疾病等患者。再选择同期20例我院健康体检者为对照组,其中男12例,女8例,年龄16~78岁,平均年龄为(52.4±6.7)岁。两组在一般资料上无统计学差异(P>0.05),具有可比性。
2 仪器与试剂 PDGF-ABELISA 试剂盒(厂家:上海西唐公司)、HMGB1ELISA试剂盒(厂家:武汉优尔生公司生产)、血管内皮生长因子-A(VEGF-A) ELISA试剂盒(厂家:深圳达科为生物技术有限公司)、VEGF-C ELISA试剂盒(厂家:武汉优尔生公司生产)、VEGF-R1试剂盒(厂家:武汉优尔生公司生产)、VEGF-R2试剂盒(厂家:武汉优尔生公司生产)、VEGF-R3试剂盒(厂家:武汉优尔生公司生产)。检验中所需离心管、量筒、烧杯、移液器头均经灭菌,避免污染。主要仪器:低速离心机、37℃孵育箱、超低温冰箱、酶标仪。
3 标本收集 清晨抽取患者2 ml肘静脉空腹血,以9∶1经129 mmol/L枸缘酸钠抗凝,行10 min 2000 r/min离心,分离血清至EP管,后在-80℃冷藏备用。
4 检验方法 采用双抗体夹心酶联免疫吸附法(ELISA)对血清中PDGF、HMGB1、VEGF-A、VEGF-C、VEGF-R1、VEGF-R2、VEGF-R3进行测定。所有标本均需按试剂盒说明进行操作。ELISA基础即为抗体固相化与酶标记,在固相载体表面抗体上结合,且能够保持免疫学活性。酶标记抗体一方面可保留免疫学活性,又可保障酶活性。测定期间,受检标本、固相载体表面抗体发生反应。采用洗涤方式分离固相载体上抗原抗体复合物及液体中其他物质。这时固相酶量、标本中受检物质量存在比例关系。再加入酶反应底物,其会在酶的催化下生成有色产物,其产物量和标本受检物量存在直接关系,因此能够通过呈色深浅给予的定性或定量分析。
5 统计学方法 采用SPSS 17.0统计学软件,计量资料经均数±标准差表示,且经t检验,P<0.05表明差异具有统计学意义。
结 果
1 急性白血病患者血清中PDGF、HMGB1表达水平 初诊组、复发组的PDGF、HMGB1水平均显著高于完全缓解组,具有统计学差异(P<0.05)。完全缓释组PDGF、HMGB1水平较初诊组显著降低,与对照组对比无统计学差异(P>0.05),见表1。
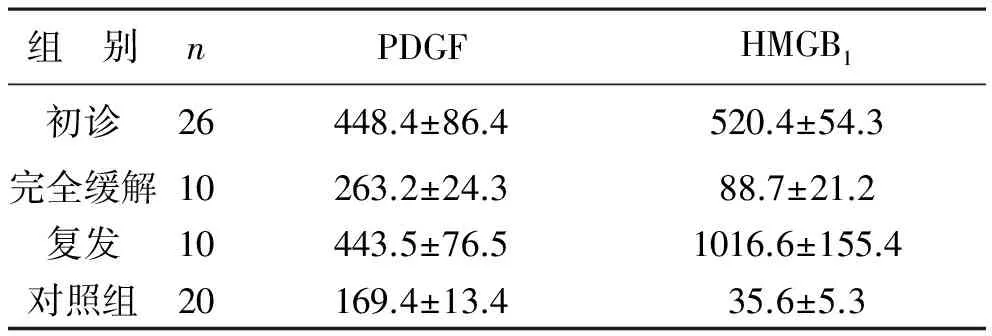
表1 急性白血病患者血清中PDGF、HMGB1含量(pg/ml)
2 急性白血病患者血清中VEGF-A、VEGF-C、VEGF-R1、VEGF-R2、VEGF-R3表达水平 在急性白血病患者中,VEGF-C在初诊组、完全缓解组及对照组中均不表达。初诊组VEGF-A均显著高于完全缓解组,具有统计学差异(P<0.05),完全缓解组与对照组对比,无统计学差异(P>0.05);初诊组、完全缓解组VEGF-R2均显著高于对照组,具有统计学差异(P<0.05),见表2。

表2 急性白血病患者血清中VEGF-A、VEGF-R1、VEGF-R2、VEGF-R3表达水平(pg/ml)
3 急性白血病初诊患者血清中PDGF、HMGB1与VEGF-A、VEGF-R1、VEGF-R2、VEGF-R3相关性分析 初诊患者血清PDGF与VEGF-A、VEGF-R1、VEGF-R2、VEGF-R3相关分析,结果无相关(r=-0.342,r=-0.089,r=-0.053;r=0.078,P>0.05);血清HMGB1与VEGF-A、VEGF-R1、VEGF-R2、VEGF-R3相关分析,结果无相关(r=-0.530,r=-0.079,r=-0.047;r=0.094,P>0.05)。
讨 论
急性白血病发生、发展具有一定连续性,步骤与环节较为繁琐。近些年研究指出高迁移率族蛋白I能够在未成熟细胞与实体肿瘤组中丰富表达,是重要炎症因子[6]。其能够对肿瘤细胞发生发展起到调节作用,参与到肿瘤转移与扩散中,此外还可对炎症反应、细胞免疫等进行调控[7]。
在恶性肿瘤发生发展期间血管新生发挥着重要作用,对于原发肿瘤或转移性肿瘤在生长、扩散期间均依赖血管生成,若未生成新生血管,则肿瘤所需营养物质与氧只由细胞外基质通过弥散的方式基于,因此导致控制其生长。但当血管形成前期到达血管形成期后肿瘤则会表现为不可控制生长。多数研究[8]表明,肿瘤血管生成与恶性肿瘤侵袭性紧密相关,其中生长、转移均对血管生成存在依赖性。肿瘤血管生成过程受到正负调控因子调控的过程。
在肿瘤新生血管生成的过程中VEGF发挥着重要作用。大量研究显示,对于急性白血病、多发性骨髓瘤、骨髓异常增生等疾病中均伴有血管新生,HMGB1可在血液恶性肿瘤中表达,其还能够经旁分泌引发淋巴瘤细胞增殖侵袭与转移。HMGB1高表达状态下,可导致白血病细胞凋亡,增强细胞侵袭、转移的能力[9]。此外还在肿瘤浸润、转移期间发挥着重要作用,可对肿瘤转移潜能、生物学行为产生严重影响,且与预后相关。因此的推测HMGB1与血管新生相关因子间具有一定关联,可促进急性白血病发生与发展。PDGF属血管生成因子,其与的肿瘤发生、发展有着密切联系。当肿瘤细胞释放PDGF后即可使得平滑肌细胞、血管内皮细胞迁移,此外还能够促进该类细胞增殖,直接影响到肿瘤血管的发生。同时PDGF还能提高VEGF表达水平,间接诱导生成血管,表明肿瘤中PDGF可通过自分泌、旁分泌加快肿瘤细胞生长,浸润周围基质,刺激血管再生。PDGF激活能够显著增强组织间压力,继而对组织吸收抗癌药物产生影响,进而影响疗效[10]。
本研究中,选择46例急性白血病患者为观察组,健康体检者30例为对照组,结果显示,初诊组、复发组PDGF、HMGB1水平均显著高于完全缓解组。完全缓释组PDGF、HMGB1水平较初诊组显著降低。表明PDGF、HMGB1在急性白血病患者中表达水平较高。在急性白血病患者中,VEGF-C在初诊组、完全缓解组及对照组中均不表达。初诊组VEGF-A、VEGF-R1、VEGF-R3均显著高于完全缓解组;初诊组、完全缓解组VEGF-R2均显著高于对照组。表明VEGF-A、VEGF-R1、VEGF-R3在急性白血病患者中表达水平较高。初诊患者血清PDGF与VEGF-A、VEGF-R1、VEGF-R2、VEGF-R3相关分析,结果无相关;血清HMGB1与VEGF-A、VEGF-R1、VEGF-R2、VEGF-R3相关分析,结果无相关。
综上所述,急性白血病进展与血清PDGF、HMGB1及相关血管内皮生长因子表达水平密切相关,可通过检测血清PDGF、HMGB1及相关血管内皮生长因子水平评估患者预后效果,为临床靶向治疗急性白血病提供了新方向。
[1] 王 燕,吴广胜.急性白血病患者血清血小板衍生生长因子检测及临床意义[J].临床荟萃,2012,27(19):1663-1666.
[2] Jin P, Zhou Q, Song S,etal.Elevated preoperative HMGB1 as predictor of myocardial injury post-percutaneous coronary intervention[J].Medicine (Baltimore),2016,95(46):5149-5152.
[3] 刘现民.临床分析急性白血病血小板衍生生长因子的测定[J].中国实用医药,2015,17(4):80-80,81.
[4] 张晨光,牛志国,王 辉,等.HTLV-1 Tax 蛋白对T细胞中HMGB1调控的影响[J].中华微生物学和免疫学杂志,2013,13(7):501-506.
[5] Assimos DG.Re: HMGB1/TLR4 Signaling Induces an Inflammatory Response following High-Pressure Renal Pelvic Perfusion in a Porcine Model[J].J Urol,2016,196(6):1818-1819.
[6] 张 文,宋冠华,张之勇,等.HMGB1与白血病细胞分化的关系及其作用的实验研究[J].医学信息(下旬刊),2013,26(8):393-394.
[7] Zhang J, Xia J, Zhang Y,etal.HMGB1-TLR4 signaling participates in renal ischemia reperfusion injury and could be attenuated by dexamethasone-mediated inhibition of the ERK/NF-κB pathway[J].Am J Transl Res,2016,8(10):4054-4067.
[8] 胡亚会,杨 璐,张晨光,等.HMGB1-血液恶性肿瘤治疗的潜在靶点[J].中国实验血液学杂志,2014,22(2):560-564.
[9] 李向平,牛志国,韩静贤,等.rhHMGB1对HTLV-1+MT2细胞中HMGB1相关受体表达的影响[J].中华微生物学和免疫学杂志,2014,34(1):47-50.
[10] 王国川,周晓璐,谭安超,等.急性白血病血小板衍生生长因子的测定[J].吉林医学,2015,36(5):906-908.
(收稿:2016-10-17)
*陕西省中医药管理局中医药科研课题(15-SCJH018)
白血病 @血小板衍生因子 @高迁移率族蛋白1 血管内皮生长因子
R557
A
10.3969/j.issn.1000-7377.2017.04.044
△通讯作者
