Osborne分级法提取藜麦清蛋白的响应面分析
2017-04-20田旭静张婧婷陈文超叶铮范三红
田旭静,张婧婷,陈文超,叶铮,范三红
(山西大学生命科学学院,山西太原030006)
Osborne分级法提取藜麦清蛋白的响应面分析
田旭静,张婧婷,陈文超,叶铮,范三红
(山西大学生命科学学院,山西太原030006)
以藜麦为研究对象,采用超声辅助Osborne分级法对藜麦中清蛋白的提取条件进行优化,确定其最佳提取方案。在单因素试验的基础上,以提取温度、料液比、提取时间为影响因子,以清蛋白提取率为响应值;利用Box-Behnken中心组合原理和响应面分析法优化提取条件,并作了响应面和等高线图。结果显示,藜麦清蛋白的最优提取条件为:提取温度45℃,料液比1∶25(g/mL),提取时间17 min,此条件下,藜麦清蛋白提取率为63.91%;与理论预测值64.72%相比,其相对误差约为1.25%,说明通过响应面分析优化后,得到的多元回归方程可以指导实践操作;各因素对清蛋白提取率的影响先后顺序为:提取温度>提取时间>料液比。
藜麦;清蛋白;Osborne分级法;响应面分析法
藜麦(Chenopodium quinoa)亦称南美藜、奎奴亚藜、藜谷、印第安麦等,原产地在“喀喀湖”(Lake Titicaca)沿岸[1],位于南美洲安第斯山区秘鲁和玻利亚境内。在5 000 a以前,古代印加人称藜麦为“粮食之母”[2]。藜麦作为一种超级谷物,还被国际营养学家称为“未来食品”、丢失的远古“营养黄金”[3]。藜麦是未来最具发展潜力的农作物之一[4],我国自1987年由西藏开始引种试验研究,现在陕西、山西、青海、四川等地区已经实现了种植的规模化[5]。藜麦中含有大量的优质蛋白[6],其蛋白质含量远高于水稻、大麦和玉米等作物,与小麦蛋白质含量相当[7],而且特别容易被人体吸收[8]。藜麦的蛋白质主要由清蛋白和球蛋白组成,醇溶蛋白和谷蛋白含量较低[9],其中,藜麦清蛋白由于二硫键的作用稳定性较好[10],有研究表明,清蛋白有减肥和辅助降血脂作用。对藜麦加工后可以使其蛋白质功效得以提高[11]。藜麦含有比例均衡且人体容易吸收的9种必需氨基酸,其中,一般谷物中缺乏的赖氨酸含量尤其高[12-13]。
目前,国内只对藜麦蛋白质进行氨基酸分析,研究其组成和结构,而对于藜麦的种植及产品的开发研究仍处在初级阶段,对蛋白提取工艺优化少有报道。
本研究以藜麦为原料,通过响应面分析对超声辅助Osborne分级法提取藜麦清蛋白的最佳条件进行优化,旨在为进一步开发藜麦提供理论依据。
1 材料和方法
1.1 材料
藜麦由山西省忻州市静乐县娑婆迎朝阳藜麦农业合作社提供。
1.2 试剂与仪器设备
所用试剂均为分析纯。SP-2000UV型紫外可见分光光度计(上海光谱仪器有限公司);TDL-5离心机(上海安亭科学仪器制造);HRHS24型电热恒温水浴锅(青岛海尔医用低温科技有限公司);868型pH测试仪(美国奥立龙公司);其他仪器均为常规。
1.3 试验方法
1.3.1 材料预处理筛选藜麦饱满种子,粉碎过0.5 mm筛,置35℃鼓风干燥箱烘干,冷却后密封干燥,备用。
1.3.2 标准曲线的制作横坐标为牛血清白蛋白浓度,纵坐标为吸光值,得到标准曲线方程为Y=0.007 3X+0.010 9(R2=0.998 1)。具有良好的线性相关性[14]。
1.3.3 原料成分含量的测定水分含量测定采用105℃烘箱恒重法[15](GB/T20264—2006);脂肪含量测定采用索氏抽提法[16](GB/T 5009.6—2003);蛋白质含量测定采用微量凯氏定氮法[17](GB 5009.5—2010),考马斯亮蓝法比色法;灰分含量测定采用600℃灰化法(GB5009.4—2010)。
1.3.4 藜麦分级蛋白提取的工艺流程[18]藜麦中加入一定比例的蒸馏水,均匀搅拌,在40℃超声辅助提取15 min,4 000 r/min离心20 min,得到上清液A和残渣A;上清液A经过沉淀、洗涤、干燥等处理步骤得到清蛋白。向所得的残渣A中加入同比例2% NaCl溶液,提取过程同清蛋白,离心后得到上清液B和残渣B;上清液B经过同上处理得到球蛋白。向所得残渣B中加入同比例70%乙醇溶液,提取过程同清蛋白,离心后得到上清液C和残渣C;上清液C经过同上处理得到醇溶蛋白。向所得残渣C中加入同比例0.05 mol/L NaOH溶液,提取过程同清蛋白,离心后得到上清液D和残渣D。上清液D经过同上处理得到谷蛋白。采用考马斯亮蓝法测定藜麦中4种蛋白质组分质量分数。
1.3.5 清蛋白等电点的测定[19]取藜麦水溶性蛋白提取液7份,用磷酸盐缓冲溶液调节pH值分别为3.1,3.4,3.7,4.0,4.3,4.6,4.9,静置后,蛋白质发生沉淀,离心后取上清液进行吸光度值测定。蛋白质的等电点为吸光度值最小的点。
1.3.6 单因素试验采用控制变量法[20]对藜麦中提取清蛋白的工艺进行单因素试验设计,分别考察料液比、提取温度、提取时间对清蛋白提取率的影响。固定提取温度40℃,提取时间15 min,在料液比为1∶20,1∶25,1∶30,1∶35,1∶40(g/mL)条件下测定清蛋白提取率;固定料液比为1∶25(g/mL),提取温度40℃,在提取时间为5,15,25,35,45 min条件下测定清蛋白提取率;固定料液比为1∶25(g/mL),提取时间为15 min,在提取温度为20,30,40,50,60℃条件下测定清蛋白提取率[21]。
蛋白质提取率=(提取液蛋白质含量×提取液体积)/(样品蛋白质含量×样品取样量)×100%。
1.3.7 响应面试验根据单因素试验结果进行响应面试验,Box-Behnken中心组合试验[22]因素水平设计列于表1。

表1 Box-Behnken试验设计因素水平
1.4 数据处理
采用Origin 7.0软件绘制单因素试验图表,采用Design Expert 8.0.6软件进行Box-Behnken设计及分析。
2 结果与分析
2.1 原料成分分析
由表2可知,藜麦中蛋白质含量最多,其次依次是水分和脂肪,灰分含量相对较少。此测定结果为研究藜麦蛋白的理化性质打下了良好的基础。
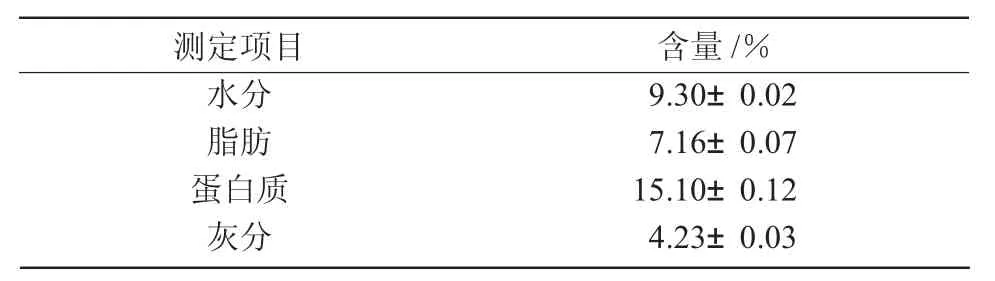
表2 藜麦基本成分分析
2.2 藜麦中4种蛋白的含量分析
由图1可知,藜麦蛋白经过Osborne分级法提取后,分为清蛋白、球蛋白、醇溶蛋白、谷蛋白,其中,藜麦中清蛋白占蛋白总量的48.21%,4种蛋白中含量最多;藜麦球蛋白占27.37%,仅次于清蛋白;藜麦谷蛋白占7.43%;而醇溶蛋白含量最少,只占3.56%。
2.3 清蛋白等电点的测定
由图2可知,pH值为3.4时,其吸光度值最小,此时蛋白沉淀最多,所以,pH值3.4为藜麦清蛋白的等电点。

2.4 单因素试验结果
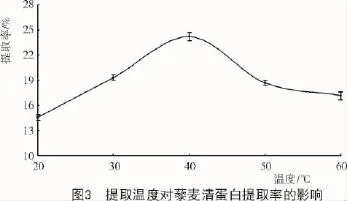
2.4.1 提取温度对藜麦清蛋白提取率的影响由图3可知,随提取温度增加,清蛋白提取率先上升后下降,温度在40℃时提取率最大,温度继续升高提取率开始下降,可能是因为清蛋白是热敏性较强的蛋白质,温度继续上升,部分蛋白质的结构可能被破坏而无法溶出,使得溶出量下降,导致提取率降低。根据试验结果,确定最佳提取温度为40℃。
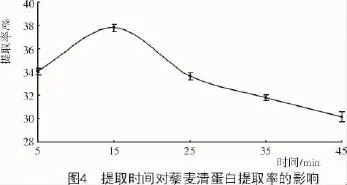
2.4.2 提取时间对藜麦清蛋白提取率的影响由图4可知,藜麦清蛋白提取率随着提取时间的增加先逐渐提高后大幅下降,这是因为在一定时间内,随着时间的延长,浸入提取液的蛋白质也会随之增多,15 min时提取率达到最大,为37.9%;浸提时间过长,会使蛋白质部分分解和变性,使得提取率降低。因此,确定15 min为最适提取时间[23]。
2.4.3 料液比对藜麦清蛋白提取率的影响由图5可知,随着料液比的减小,清蛋白提取率呈先上升再下降的趋势,在1∶25(g/mL)时达到最大,清蛋白提取比较彻底;随着料液比继续减小,反而降低了提取液中的可溶性清蛋白的含量。因此,确定1∶25(g/mL)时为最适料液比。

2.5 响应面试验结果
响应面试验方案及结果列于表3。
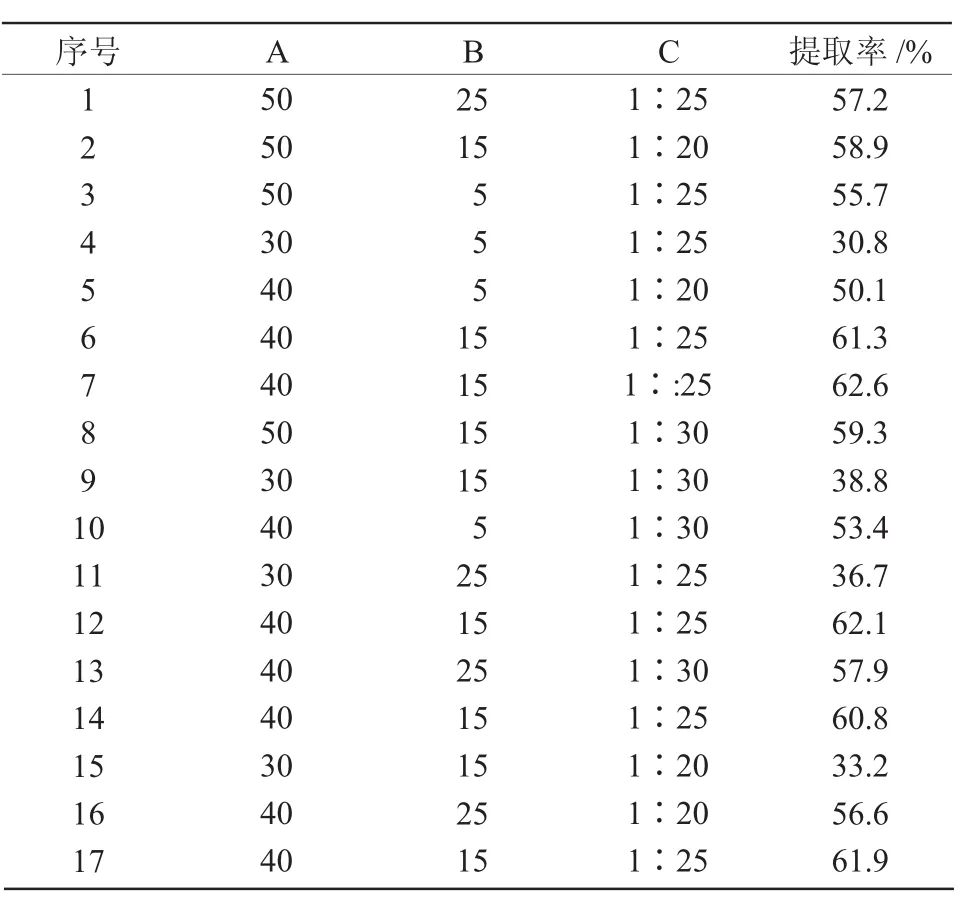
表3 响应面试验设计及结果
2.5.1 回归方程的建立与方差分析利用Design Expert 8.0.6软件对表3数据进行多元回归拟合,建立提取工艺参数回归模型,回归方程为Y=61.74+11.45A+2.30B-1.32C-1.10AB+1.30AC+0.50BC-11.80A2-4.84B2-2.40C2。该方程中各项系数的绝对值越大,说明该因素对响应值的影响程度越深,系数的正、负反映了影响的方向[23]。由方程的一次项系数可以得出,影响藜麦清蛋白提取率的因素先后顺序为提取温度>提取时间>料液比。对模型进行方差分析,结果列于表4。

表4 回归方程方差分析
从表4可以看出,A,B,C,A2,B2,C2对响应值的影响达到极显著,三因素两两交互中AB,AC项对响应值的影响显著,而BC项P>0.05,提取时间和料液比两因素的交互作用影响不显著。从整体分析,模型P<0.000 1,表明该二次多项回归模型达到极显著;失拟项P=0.385 9>0.05,说明失拟项差异不显著,失拟因素在试验中不存在,可以充分反映实际情况,回归模型是适合的[24];R2=0.997 9,说明预测值和实测值之间具有高度的相关性[25],模型方程能够很好地反映真实的试验值;R2adj=0.995 2,说明未控制因素对试验结果影响较小。所以,该模型可以用于藜麦中清蛋白提取率的分析和预测。
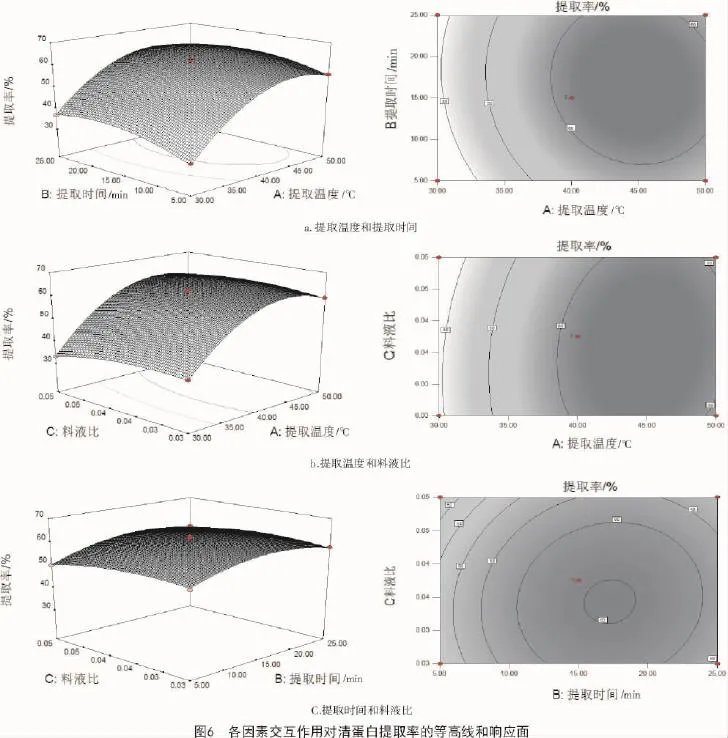
2.5.2 响应面分析响应面坡度陡峭程度越高,表明控制条件发生改变,响应值越敏感,该控制因素对清蛋白提取率的影响越大;反之则影响较小。由图6可知,提取温度(A)曲线最陡,而料液比(C)和提取时间(B)曲线相对比较平缓,响应值变化随其数值的变化不是很大,说明这2个因素对清蛋白提取率的影响程度相对于提取温度(A)较弱,这与方差分析的结果一致。交互作用的强弱也可从等高线的形状体现出来,越接近椭圆形交互作用越强,越接近圆形交互作用越不强,分析可知,提取温度(A)和提取时间(C)交互作用最显著,其后是提取温度(A)和料液比(B)交互作用较显著,而提取时间(B)和料液比(C)的交互作用不显著。
从图6-a可以看出,料液比处于0水平时,提取温度和提取时间的交互作用较强,当固定提取时间时,随着提取温度的增加,清蛋白提取率也增大,但增大到一个峰值后又开始缓慢下降;清蛋白提取率在提取温度40~45℃水平和提取时间15~17 min水平之间有最大值。图6-b显示,提取时间处于0水平时,提取温度与料液比的交互作用极强,由等高线图可知,料液比对清蛋白提取率影响相对较小,提取温度对清蛋白提取率影响较大。由图6-c可知,提取时间和料液比的交互作用最不显著。比较图6-b和图6-c可知,提取温度对清蛋白提取率影响比提取时间更高,再比较图6-a与图6-c可知,提取温度对清蛋白提取率的影响较料液比显著。
由Design Expert 8.0.6软件得出,清蛋白的最佳提取条件为:提取温度44.70℃,提取时间16.78min,料液比1∶25(g/mL)。此条件下,模型预测的最大提取率为64.72%。考虑到操作的实际可行性,将理论值修正为提取温度45℃,提取时间17 min,料液比1∶25(g/mL),再进行验证试验,可得清蛋白提取率为63.91%,与理论值64.72%接近,说明该模型预测实际提取率较好。
3 结论
本研究藜麦通过Osborne分级法进行蛋白提取后,得到4种蛋白,其中,清蛋白占蛋白总量的48.21%,含量最多;球蛋白占27.37%,仅次于清蛋白;谷蛋白占7.43%;而醇溶蛋白含量最少,只占3.56%。
对藜麦中清蛋白采用水提的方法进行提取,通过单因素试验和响应面分析法相结合,确定的最优工艺条件为提取温度45℃,料液比1∶25(g/mL),提取时间17 min,在该条件下,藜麦清蛋白提取率为63.91%。方差分析得到因素的主效应关系为:提取温度>提取时间>料液比。
目前,国内外对藜麦中蛋白的研究尚未见报道,藜麦在其蛋白开发利用方面还具有很大的潜力。因此,进一步完善藜麦中蛋白提取的理论和方法,加大科研力度,充分开发利用藜麦蛋白,对实现工业产业化生产具有重要意义。
[1]ALBERTO ESTRADA,BING L,BERNARD LAARVELD.Adjuvantaction ofChenopodium quinoa saponins on the induction ofantibodyresponses tointragastric and intranasal administered antigens in mice[J].Immun Microbiol&Infect,1998,21:225-236.
[2]刘洋,熊国富,闫殿海,等.“粮食之母”,“超级食物”——藜麦“落户”青海[J].青海农林科技,2014(4):95-98.
[3]郭晓凤.试论藜麦的推广前景及栽培技术[J].现代农业,2015(2):61-63.
[4]ATULB,SUDHIR S,DEEPAKO.Chenopodium quinoa—An Indian perspective[J].Industrial Crops and Products,2006,23:73-87.
[5]肖正春,张广伦.藜麦及其资源开发利用[J].中国野生植物资源,2014,33(2):62-66.
[6]ABUGOCH L E,ROMERO N,TAPIA C A,et al.Study of some physicochemical and functional properties of quinoa(Chenopodium quinoa Willd.)protein isolates[J].Journal of Agricultural and Food Chemistry,2008,56:4745-4750.
[7]WRIGHT K H,PIKE O A,FAIRBANKS D J,et al.Composition of Atriplex hort ensis,sweet and bitter Chenopodium quinoa seeds[J]. Journal ofFood Science,2002,67(4):1383-1385.
[8]王黎明,马宁,李颂,等.藜麦的营养价值及其应用前景[J].食品工业科技,2014,35(1):381-384.
[9]LINDEBOOM N,CHANG P R,FALK K C,et al.Characteristics of starch from eight quinoa lines[J].Cereal Chemistry,2005,82(2):216-222.
[10]BRINEGAR C,SINE B,NWOKOCHA L.High-cysteine 2S seed storage proteins from quinoa(Chenopodium quinoa)[J].Journal of Agricultural and Food Chemistry,1996,44(7):1621-1623.
[11]STIKIC R,GLAMOCLIJA D,DEMIN M,et al.Agronomical and nurtional evaluation of quinoa seed(Chenopodium quinoa Willd.)as an ingredient in bread formulations[J].Journal of Cereal Science,2012,55:132-138.
[12]KARYOTIS T,ILIADIS C,NOULAS C,et al.Preliminary research on seed production and nutrient content for certain quinoa varieties in a saline-sodic[J].Journal of Agronomy and Crop Science,2003,189:402-408.
[13]胡小静,郑大川,黄凤勤.高温压榨对花生蛋白功能性质的影响[J].文山学院学报,2010,23(3):9.
[14]柳荫,吴凤智,陈龙,等.考马斯亮蓝法测定核桃水溶性蛋白含量的研究[J].中国酿造,2013,32(12):131-132.
[15]张建新,郭倩,何桂梅,等.大麦虫水溶蛋白的分离纯化及抗氧化性研究[J].食品科学,2011,32(18):31-33.
[16]谢音,屈小英.食品分析[M].北京:科学技术文献出版社,2006:99-113.
[17]卫生部.GB/T5009.5—2003食品中蛋白质的测定[S].北京:中国标准出版社,2003.
[18]全越,王长远.Osborne分级法提取燕麦麸球蛋白的响应面分析[J].粮食加工,2015,40(5):34-35.
[19]訾艳,王常青,陈晓萌,等.白芸豆清蛋白提取工艺及分子组成研究[J].食品工业科技,2014,35(15):121-122.
[20]和法涛,刘光鹏,朱风涛,等.响应面法优化热水法浸提猴头菇多糖工艺提高多糖得率[J].食品科技,2015,40(1):210-215.
[21]张素斌,张欣,李敏,等.龙利叶多酚提取条件优化及其抗氧化活性研究[J].河南农业科学,2017,46(2):148-152.
[22]张瑶,李啸,潘冬瑞,等.Box-Benhnken设计优化植物乳杆菌培养基[J].天津农业科学,2013,19(7):1-5.
[23]肖卫华,韩鲁佳,杨增玲,等.响应面法优化黄芪黄酮提取工艺的研究[J].中国农业大学学报,2007,12(5):52-56.
[24]陈红梅,谢翎.响应面法优化半枝莲黄酮提取工艺及体外抗氧化性分析[J].食品科学,2016,37(2):48-49.
[25]鞠兴荣,税丹,何荣,等.响应面分析法优化菜籽多糖酸法提取工艺的研究[J].中国粮油学报,2012,27(3):89-93.
Osborne Classification Method to Extract the Quinoa Albumin Response Surface Analysis
TIANXujing,ZHANGJingting,CHENWenchao,YE Zheng,FANSanhong
(College ofLife Science,Shanxi University,Taiyuan 030006,China)
Taking quinoa as the research object,albumin extraction conditions from quinoa were optimized by ultrasonic auxiliary Osborne classification method,to determine the best extraction solution.Three extraction parameters including solid-liquid ratio,extraction temperature and extraction time were optimized using central composite design and response surface methodology based on single factor investigations for achievingmaximumthe protein extraction rate.Based on the response surface and contour plots established with protein extraction ratioas the response value.The results showed that optimal extraction conditions were determined as a solid-liquid ratio of 1∶25(g/mL),an extraction temperature of 45℃,and an extraction time of 17 min.Under these optimized conditions,quinoa albumin extraction yield was 63.91%,compared to the theoretical value 64.72%,the relative error was 1.25%.The multiple regression equation by response surface analysis optimization derived some practical significance.The sequence of factors that worked on the extraction rate ofalbumin was as follows:extractingtemperature>extractingtime>solid-liquid ratio.
quinoa;albumin;Osborne classification method;response surface analysis
TS201.1
A
1002-2481(2017)04-0621-06
10.3969/j.issn.1002-2481.2017.04.33
2016-12-02
山西省自然科学基金项目(2012011031-4);2016年山西省高等学校教学改革创新项目(J2016003);2016年山西省研究生教育改革研究课题(2016JG26);山西省重点研发计划(一般项目)(201603D221004-4)
田旭静(1992-),女,山西汾阳人,在读硕士,研究方向:农产品综合利用开发。范三红为通信作者。
