新型疫苗研发与下一代技术
2017-04-20杨益隆徐俊杰
杨益隆,徐俊杰
军事医学科学院生物工程研究所疫苗与抗体工程研究室,北京 100071
新型疫苗研发与下一代技术
杨益隆,徐俊杰
军事医学科学院生物工程研究所疫苗与抗体工程研究室,北京 100071

徐俊杰,军事医学科学院生物工程研究所研究员,疫苗与抗体工程研究室主任,博士生导师。主要从事新型疫苗及特需生物药物研究,在炭疽杆菌等高致病病原体感染与免疫机制、基因工程疫苗、抗体药物等领域开展了系列工作。主持国家科技重大专项、国家自然科学基金、军队后勤科研计划等国家级和省部级课题10项;获国家技术发明二等奖1项,军队科技进步一等奖1项、二等奖1项,国家发明专利授权6项,军队特需药品新药证书2个;以第一作者或通讯作者在Molecular Microbiology、Vaccine、Toxins等领域内学术期刊发表SCI论文19篇。“生物危害防控”国家创新团队核心成员,中华医学会微生物学与免疫学分会青年委员,国家发展和改革委员会药品价格评审专家,军队及北京市科技奖励评审专家。E-mail:xujunjie@sina.com
疫苗接种是人类历史上最为成功的医疗干预措施。近年来,疫苗研发出现了突破性进展,国内外上市了多种针对重要传染病的新型疫苗。尽管如此,疫苗研发仍面临很大挑战,传统的疫苗设计存在诸多技术缺陷,目前仍没有疫苗能够用于防控诸如艾滋病、疟疾、寨卡病毒等对人类健康具有重大威胁的传染病。随着生物信息学和结构生物学等技术的发展,疫苗设计领域出现了保护组学分析、结构疫苗学和合成生物学等新的研究方向,这些新的技术平台为今后新型疫苗的设计提供了全新的研究思路。
新型疫苗;疫苗设计;保护组学分析;结构疫苗学;合成生物学
传染病疫情大规模暴发时,疫苗是人类最有效的抵御手段。2014年西非暴发了有史以来最为严重的埃博拉疫情。2015年寨卡病毒的流行也成为全球紧急公共卫生事件。人类与传染病的斗争此消彼长,近年来国内外上市了针对流感、登革热、手足口病和侵袭性脑膜炎球菌病等传染病的新型疫苗,在面对今后的潜在疫情时也有了更多的防御手段。
在对病原体分子致病机制深入了解的基础上,疫苗设计对于疫苗的成功研发具有重要意义。随着全基因组高通量测序、生物信息学和结构生物学等技术的进步,疫苗设计领域也有了突破性进展,出现了包括保护组学分析、结构疫苗学和合成生物学在内的研究方向,使得在研发针对B群脑膜炎奈瑟球菌(MenB)、流感病毒、人类免疫缺陷病毒(HIV)和呼吸道合胞病毒(RSV)等病原体的疫苗方面有了新的对策。
1 新型疫苗研发进展
1.1 埃博拉病毒疫苗
2014年3月,西非暴发了有史以来最为严重的埃博拉疫情,截至2016年4月13日,共有28 616例感染病例,导致11 310人死亡(WHO)。虽然埃博拉疫苗尚未上市,但其研发过程集中展现了疫苗技术的最新成果,并为今后突发传染病防治提供了宝贵的借鉴意义。表1列举了目前临床试验进展较好的候选疫苗。其中,Ad5-EBOV[3]由我国自主研发,以重组复制缺陷型人5型腺病毒为载体,是目前唯一针对2014年流行的埃博拉病毒的疫苗,也是唯一采用冻干制剂的埃博拉疫苗。另外,rVSV-ZEBOV为首个完成Ⅲ期临床试验的埃博拉疫苗,结果显示该疫苗的保护率为100%[1]。HPIV3-EBOVZ GP[2]的病毒载体为人副流感病毒3型(HPIV3),是目前唯一通过鼻腔接种的埃博拉疫苗。
1.2 寨卡病毒疫苗
寨卡病毒属于黄热病毒属,主要由伊蚊属蚊虫传播,在人际间也可通过母婴和性途径传播[6]。寨卡病毒可由孕妇传递到婴儿,怀孕期间的感染可能导致婴儿出现小头症(microcephaly)[7]及其他严重的出生缺陷[8]。自2015年寨卡病毒在中南美洲暴发流行,截至2016年12月,已有29个国家或地区出现小头症病例,其中巴西共报道2211例(WHO)。2016年2月,WHO宣布寨卡病毒感染为全球紧急公共卫生事件。
目前还没有寨卡疫苗上市,但已有超过15个机构在进行相关研究[9],其中4个候选疫苗已进入Ⅰ期临床试验阶段,分别为2个灭活疫苗(NCT02952833和NCT02937233)和2个针对prM和E结构蛋白的DNA疫苗(NCT02840487和NCT02887482)。已有报道针对登革病毒的抗体会与寨卡病毒交叉反应,并通过抗体依赖途径导致寨卡病毒毒力增强[10]。因此,后续临床试验有必要考虑登革病毒和其他黄病毒的预存免疫对寨卡病毒安全性和有效性的影响。
1.3 重组HA亚单位流感疫苗
每年流感约造成全球范围内300万~500万例严重疾病并导致约25万~50万人死亡(WHO)。1918年西班牙的流感大暴发曾导致2000万~1亿人死亡[11]。目前已上市的流感疫苗大部分为灭活病毒疫苗,技术上还存在若干缺陷:①由于在鸡胚内增殖培养,流感病毒在适应鸡胚宿主的过程中可能引起血凝素(HA)的突变,导致成品疫苗无法提供预期保护[12];②疫苗含有的痕量鸡胚成分和化学试剂可能导致过敏或严重副反应;③灭活病毒疫苗的生产周期较长(6~8个月),对流感疫情不能做出及时响应。
2013年1月16日,美国FDA批准了世界上首个3价重组亚单位流感疫苗的上市。该疫苗活性成分为重组HA,由昆虫细胞-杆状病毒系统表达,具有正确的蛋白折叠和翻译后糖基化修饰。Flublok®生产周期为6~8周,技术工艺和实效性都优于传统的灭活流感疫苗。临床试验结果显示,Flublok®能够提供比灭活流感疫苗更广谱的保护性[13],因而更具有临床使用价值。

表1 进入临床试验阶段的埃博拉候选疫苗
1.4 登革病毒疫苗
在全球范围内,每年有3.9亿人感染登革病毒,9600万人出现严重临床症状[14]。登革病毒共有4种血清型[15],首次感染会对同种血清型病毒产生终身免疫,而异种血清型病毒的二次感染可能会导致比首次感染更严重的疾病[16]。登革病毒多种血清型的流行及其预存免疫的影响加大了登革热疫苗研制的难度。
2015年末,墨西哥、菲律宾和巴西批准了世界首个登革热疫苗CYD-TDV(商品名Dengvaxia®)。该疫苗为基于黄热病毒株YFV17D的重组4价减毒活疫苗,分别针对登革病毒4种血清型的prM和E蛋白[17]。CYD-TDV分别在亚洲和拉丁美洲进行了Ⅲ期临床试验,总体有效率为56.5%[18]和60.8%[19],并且能够降低登革热住院和严重病症的发生率。CYD-TDV的有效性与受试者登革热的感染历史也有较大关系,结果显示疫苗对有过感染史的受试者有效性显著高于未感染过的受试者。
1.5 肠道病毒71型疫苗
肠道病毒71型(EV71)是引起婴幼儿手足口病的主要病原体之一[20]。1998~2009年,EV71在世界范围内共引起超过600万例手足口病和2000例死亡(WHO)。我国是EV71手足口病疫情的重灾区,2008年暴发的疫情共导致49万婴幼儿感染和126例死亡[21]。
2016年上半年,由国内自主研发的全球首个EV71手足口病疫苗获批上市,该疫苗为灭活病毒疫苗。其Ⅲ期临床试验结果显示,疫苗注射组的EV71感染率为0.3%(13/5041),安慰剂组感染率为2.1%(106/5028)。疫苗对于EV71引起的手足口病保护率为94.6%[22]。另外,对疫苗注射组和安慰剂注射组间严重副反应的发生无统计差异,表明该EV71疫苗安全有效。
1.6 B型脑膜炎奈瑟菌疫苗
脑膜炎奈瑟菌会诱发致命的侵袭性脑膜炎球菌病[23],即使在早期确诊并进行药物治疗,仍有5%~10%的患者会在24~48h内死亡[24]。脑膜炎奈瑟菌至少有12种血清型,其中6种血清型(A、B、C、W、X和Y)为主要的流行株[25]。多糖结合疫苗已广泛用于A、C、W和Y血清型脑膜炎奈瑟菌的防控[23]。然而由于B型脑膜炎奈瑟菌(MenB)的荚膜多糖结构与人神经细胞的聚唾液酸同源性较高,MenB的多糖结合疫苗没有免疫原性[26]。
2014年10月,美国FDA批准了第一个针对MenB的疫苗rLP2086(商品名Trumenba®)上市,其活性成分为重组人H因子结合蛋白(fHBP)[27],fHBP在所有MenB菌株几乎都有表达。rLP2086两次免疫后,75.6%~100.0%的受试者检测到强免疫应答[28]。2015年1月,美国FDA又批准了第2个MenB疫苗4CMenB上市,共包含fHBP、奈瑟菌黏附A蛋白和奈瑟菌肝素结合抗原3个重组蛋白以及外膜囊泡(OMV)[29]。该疫苗具有较理想的安全性和免疫原性[30]。
2 疫苗设计下一代技术
2.1 保护组学分析:保护性抗原的筛选
伴随着微生物全基因组测序技术的发展,疫苗研究进入了反向疫苗学(reverse vaccinology)时代,即通过分析全基因组序列筛选疫苗候选抗原,这一策略已经成功应用于上述MenB疫苗的研发。然而,反向疫苗学筛选候选抗原工作量巨大。以MenB疫苗研发[31]为例,MenB基因组编码2000多个蛋白质,生物信息学分析找出570个表面或分泌蛋白作为候选抗原,分别重组表达再通过体外和体内试验进行筛选,最终找到了3个保护性蛋白抗原。
候选抗原筛选的繁重工作量已成为限制反向疫苗学发展的重要瓶颈。针对这一问题,近年来提出一种新的筛选策略——保护组学分析[32](图1),能够极大地缩小候选抗原的筛选范围。其核心假设是具有免疫保护性的抗原在结构和功能上具有共性特征。通过生物信息学工具(Blast、ClustalW、Smart、Pfam和PfamClans),以已知的人类病原体保护性抗原作为数据集(目前为38个病原体,245个抗原)进行序列和功能分析,构建出一个抗原保护组的特征库。结果显示,85%的保护性抗原在多个细菌中都具有保守的同源结构域或重复序列,在功能上共构成了41个主要类别,而另外15%的抗原结构域是菌种特异的。如果将目标病原体的保守性抗原在这一库中进行比对分析,即可得到对应的候选抗原。
保护组分析筛选到的候选抗原仅为病原体全部蛋白数量的3%左右,远小于传统反向疫苗学30%的比率[32]。另外,由于基于抗原的结构与功能,而并不局限抗原的定位(反向疫苗学仅关注表面或分泌蛋白),保护组学分析能够发现一些传统方法不关注的胞内抗原。将这一方法应用于金黄色葡萄球菌和B族链球菌,分别筛选到89个和59个候选抗原,其中包含了所有已报道的保护性抗原。对其余候选抗原进行后续鉴定,又发现了针对这两种病原体的全新保护性抗原。从便捷性和预测准确性两个方面,保护组学分析对于疫苗保护性抗原的筛选都具有巨大优势。
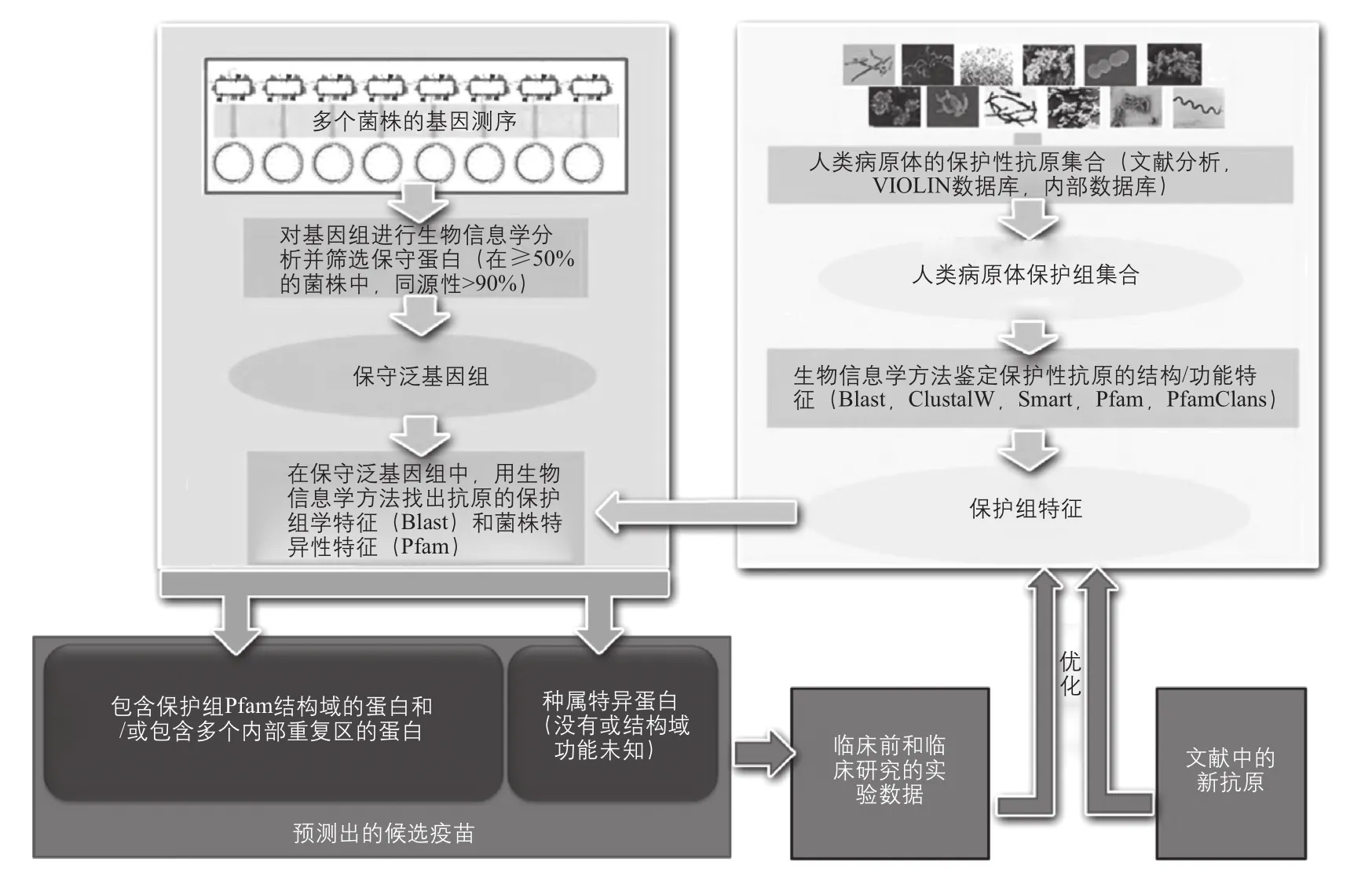
图1 保护组学分析[32]
2.2 结构疫苗学:结构生物学指导的疫苗设计
近年来,随着结构生物学技术的发展,绝大部分的蛋白抗原都能够被在原子水平上解析出三维结构,这一信息为研究人员在原子层面改造抗原提供了蓝图。此外,抗原与保护性单抗复合物的三维结构也能够揭示抗原的关键表位[33],促进人们对宿主保护性免疫应答机制的理解,从而指导疫苗的反向设计。目前已经出现了以结构生物学为指导的疫苗设计新方向——结构疫苗学[34](structural vaccinology)。下面以流感HA疫苗为例,对结构疫苗学的研究思路进行梳理。
研究表明,针对流感的抗体反应主要集中在HA的N端球形区域(HA head),但这一区域抗原序列高度可变,因此每个流行季需制备不同亚型的流感疫苗。流感疫苗的最终目标是研发出一种能够提供广谱保护性的通用疫苗。近年来,随着流感广谱中和抗体(bnAbs)的发现[35-36],这一目标开始变得可行。多数bnAbs识别的是HA的C端保守性茎部区域(HA stem)[36],因此选择这一区域作为流感通用疫苗的候选抗原已成为学术界的共识。然而,HA分子是流感病毒表面的亚稳态三聚体,仅简单的去除HA的跨膜区和HA head,会不可避免地影响HA stem的天然构象并导致bnAbs结合活性的降低[37]。
在对HA三维结构充分认识的基础上,Yassine等[38]以HA的晶体结构、HA的胞外结构域和Foldon蛋白三聚结构域为设计起点,通过计算机辅助技术,对HA进行了6代定向改造(图2a)。关键步骤包括蛋白酶切位点突变,GSG连接肽替换HA head,HIV-1 gp41三聚体结构域分子对接,HA stem截短与核心区定点突变等。最终制备出的HA stem(HA-SS)具有三聚体的空间构象,结构稳定并保留了与bnAbs的高亲和力。为进一步提高免疫源性,将HA-SS与幽门螺杆菌的铁蛋白亚基融合,自组织形成了6价HA-SS的纳米粒子(HA-SS-np)(图2b)。在小鼠和雪貂动物模型中,免疫HA-SS-np能够产生bnAbs,并对异种亚型流感病毒的致死攻毒具有防御性。
除了改造保护性抗原的保守结构域,结构疫苗学指导广谱通用的疫苗设计的另一个方向是“表位移植”,即将不同亚型抗原的保护性表位进行拼接。fHBP为MenB的保护性抗原,其3个亚型(共超过300个变体)仅有65%的同源性,Scarselli等[39]根据fHBP的结构和表位信息,以1亚型的保守区域为骨架,将2、3亚型的非重叠表位整体移植到1亚型fHBP表面。经此设计的fHBP嵌合分子在小鼠体内能够同时激活针对3个亚型的抗体反应。
此外,根据强效广谱中和性抗体与抗原复合物的结构信息,研究人员已鉴定出RSV[40]和HIV[41]病毒的关键抗原性位点。由此设计并制备的RSV融合前F蛋白能够在体内刺激产生广谱中和性抗体[40]。而HIV的bnAbs的产生机制复杂,需要免疫系统与不断突变的HIV病毒长期共进化,虽然目前设计出的HIV免疫原已有了一定的进步,但要达到理想的免疫效果还有很大挑战[42]。
2.3 合成生物学:新型减毒活病毒疫苗
制备减毒活疫苗最大的挑战是如何尽可能使其无毒,同时又完全保持其感染性以在体内引起足够的免疫反应。传统技术制备的减毒活疫苗病毒株需要在安全性和有效性上做出取舍,而合成生物学有望真正实现两者的兼顾。合成生物学是近年来快速发展的生物学交叉学科,在工程学理性设计的指导下,其目标是重组乃至从头合成具有特定功能的人工生物系统。目前主要有两种合成生物学策略制备减毒活病毒疫苗,即引入非天然氨基酸和在基因组水平重编码密码子。

图2 HA stem从头设计[38]
北京大学周德敏课题组[43]近期采用合成生物学工具,开发出一种制备选择性复制缺陷流感减毒活疫苗的新技术,涉及对流感病毒和细胞系的双向改造(图3)。首先对野生型流感病毒进行了终止密码子点突变,改构后的流感病毒无法在正常细胞中表达全长的蛋白从而失去了感染能力。而人为改造的细胞能够将终止密码子翻译为非天然氨基酸,流感病毒得以正常组装复制。研究表明,PCT引入位点和数量会影响病毒组装效率和逃逸概率。当引入超过3个PCT时流感病毒在正常细胞的逃逸概率已低于检测下限,表明安全性高于目前临床使用的流感减毒活疫苗。对PCT位点和数量进行优化后的流感疫苗在小鼠、豚鼠和雪貂模型中都能刺激产生强烈的体液、黏膜和细胞免疫。其保护性高于传统方法制备的流感活疫苗和灭活疫苗,甚至对于已感染的野生型流感病毒具有治疗功效。

图3 利用非天然氨基酸翻译系统制备选择性复制缺陷病毒[43]
另一项研究采用了密码子去优化(CPD)策略。通过一种计算机算法,将野生型病毒的密码子在基因组水平上同义替换为使用概率较低的密码子。由于不改变氨基酸序列,病毒的抗原性不受影响。在小鼠与非洲绿猴模型中,CPD改造的RSV[44]与临床使用的减毒疫苗具有相当的复制受限水平。使用同样策略对流感病毒的神经氨酸酶(NA)和HA进行CPD改造[45],制备出的减毒活疫苗在小鼠体内能够诱导保护性免疫。
3 展 望
疫苗是人类防控传染病的重要武器,接种疫苗估计每年可避免超过250万例死亡[46]。虽然疫苗接种计划已经根除了包括天花和脊髓灰质炎在内的几种疾病,但目前仍没有防控艾滋病、疟疾等对人类健康具有重大威胁传染病的疫苗。另外,全球气候变暖可能加快新发传染病的出现和已有病原体的突变频率,导致需要开发更多的新型疫苗以应对潜在挑战。埃博拉和寨卡病毒疫情就为全球的公共卫生敲响了警钟,提示研究人员需要未雨绸缪,提前进行候选疫苗的战略布局和技术储备。
灭活或减毒的病原体是最简单的疫苗形式,这仍然是防控许多疾病如麻疹、腮腺炎和水痘的最佳策略。但灭活的病原体并不总是具有保护性,减毒的病原体也有可能逆转突变并引发安全性问题。对于传统疫苗设计技术难以突破的病原体,诸如保护组学分析、结构疫苗学和合成生物学等在内的新技术有望开发出下一代的新型疫苗。以上提到的疫苗设计新技术并不局限于文中所述的病原体,这些设计理念对于其他的病原体同样具有借鉴意义。
[1] HENAO-RESTREPO A M,LONGINI I M,EGGER M,et al. Efficacy and effectiveness of an rVSV-vectored vaccine expressing Ebola surface glycoprotein:interim results from the Guinea ring vaccination cluster-randomised trial[J]. The Lancet,2015,386:857-866.
[2] BUKREYEV A A,DINAPOLI J M,YANG L,et al. Mucosal parainf uenza virus-vectored vaccine against Ebola virus replicates in the respiratory tract of vector-immune monkeys and is immunogenic[J]. Virology,2010,399(2):290-298.
[3] ZHU F C,HOU L H,LI J X,et al. Safety and immunogenicity of a novel recombinant adenovirus type-5 vector-based Ebola vaccine in healthy adults in China:preliminary report of a randomised,double-blind,placebo-controlled,phase 1 trial[J]. The Lancet,2015,385(9984):2272-2279.
[4] EWER K,RAMPLING T,VENKATRAMAN N,et al. A monovalent chimpanzee adenovirus Ebola vaccine boosted with MVA[J]. The NewEngland Journal of Medicine,2016,374(17):1635-1646.
[5] MILLIGAN I D,GIBANI M M,SEWELL R,et al. Safety and immunogenicity of novel adenovirus type 26- and modif ed vaccinia ankara-vectored Ebola vaccines:a randomized clinical trial[J]. JAMA,2016,315(15):1610-1623.
[6] MAHARAJAN M K,RANJAN A,CHU J F,et al. Zika virus infection:current concerns and perspectives[J]. Clinical Reviews in Allergy & Immunology,2016,51(3):383-394.
[7] MLAKAR J,KORVA M,TUL N,et al. Zika virus associated with microcephaly[J]. The New England Journal of Medicine,2016,374(10):951-958.
[8] RASMUSSEN S A,JAMIESON D J,HONEIN M A,et al. Zika virus and birth defects—reviewing the evidence for causality[J]. The New England Journal of Medicine,2016,374(20):1981-1987.
[9] DURBIN A P. Vaccine development for zika virus-timelines and strategies[J]. Seminars in Reproductive Medicine,2016,34(5):299-304.
[10] DEJNIRATTISAI W,SUPASA P,WONGWIWAT W,et al. Dengue virus sero-cross-reactivity drives antibody-dependent enhancement of infection with zika virus[J]. Nature Immunology,2016,17(9):1102-1108.
[11] MILLS C E,ROBINS J M,LIPSITCH M. Transmissibility of 1918 pandemic inf uenza[J]. Nature,2004,432(7019):904-906.
[12] SKOWRONSKI D M,JANJUA N Z,DE SERRES G,et al. Low 2012-13 inf uenza vaccine effectiveness associated with mutation in the egg-adapted H3N2 vaccine strain not antigenic drift in circulating viruses[J]. PLoS One,2014,9(3):e92153.
[13] IZIKSON R,LEFFELL D J,BOCK S A,et al. Randomized comparison of the safety of Flublok®versus licensed inactivated inf uenza vaccine in healthy,medically stable adults ≥ 50 years of age[J]. Vaccine,2015,33(48):6622-6628.
[14] BHATT S,GETHING P W,BRADY O J,et al. The global distribution and burden of dengue[J]. Nature,2013,496(7446):504-507.
[15] MESSINA J P,BRADY O J,SCOTT T W,et al. Global spread of dengue virus types:mapping the 70 year history[J]. Trends in Microbiology,2014,22(3):138-146.
[16] REICH N G,SHRESTHA S,KING A A,et al. Interactions between serotypes of dengue highlight epidemiological impact of cross-immunity[J]. Journal of the Royal Society Interface,2013,10(86):20130414.
[17] GUY B,BARRERE B,MALINOWSKI C,et al. From research to phase Ⅲ:preclinical,industrial and clinical development of the Sanof Pasteur tetravalent dengue vaccine[J]. Vaccine,2011,29(42):7229-7241.
[18] CAPEDING M R,TRAN N H,HADINEGORO S R,et al. Clinical eff cacy and safety of a novel tetravalent dengue vaccine in healthy children in Asia:a phase 3,randomised,observer-masked,placebo-controlled trial[J]. The Lancet,2014,384(9951):1358-1365.
[19] VILLAR L,DAYAN G H,ARREDONDO-GARCIA J L,et al. Efficacy of a tetravalent dengue vaccine in children in Latin America[J]. The New England Journal of Medicine,2015,372(2):113-123.
[20] SOLOMON T,LEWTHWAITE P,PERERA D,et al. Virology,epidemiology,pathogenesis,and control of enterovirus 71[J]. The Lancet Infectious Diseases,2010,10(11):778-790.
[21] ZHANG Y,ZHU Z,YANG W,et al. An emerging recombinant human enterovirus 71 responsible for the 2008 outbreak of hand foot and mouth disease in Fuyang city of China[J]. Virology Journal,2010,7:94.
[22] ZHU F C,MENG F Y,LI J X,et al. Efficacy,safety,and immunology of an inactivated alum-adjuvant enterovirus 71 vaccine in children in China:a multicentre,randomised,double-blind,placebo-controlled,phase 3 trial[J]. The Lancet,2013,381(9882):2024-2032.
[23] COHN A C,MACNEIL J R,CLARK T A,et al. Prevention and control of meningococcal disease:recommendations of the advisory committee on immunization practices(ACIP)[J]. MMWR Recommendations and Reports,2013,62(RR02):1-22.
[24] PORRAS M C. Meningococcal disease[J]. The New England Journal of Medicine,2001,345(9):700.
[25] HALPERIN S A,BETTINGER J A,GREENWOOD B,et al. The changing and dynamic epidemiology of meningococcal disease[J]. Vaccine,2012,30(Suppl 2):B26-B36.
[26] FINNE J,LEINONEN M,MAKELA P H. Antigenic similarities between brain components and bacteria causing meningitis. Implications for Vaccine Development and Pathogenesis[J]. The Lancet,1983,2(8346):355-357.
[27] FLETCHER L D,BERNFIELD L,BARNIAK V,et al. Vaccine potential of the Neisseria meningitidis 2086 lipoprotein[J]. Infection and Immunity,2004,72(4):2088-2100.
[28] RICHMOND P C,MARSHALL H S,NISSEN M D,et al. Safety,immunogenicity,and tolerability of meningococcal serogroup B bivalent recombinant lipoprotein 2086 vaccine in healthy adolescents:a randomised,single-blind,placebo-controlled,phase 2 trial[J]. The Lancet Infectious Diseases,2012,12(8):597-607.
[29] SERRUTO D,BOTTOMLEY M J,RAM S,et al. The new multicomponent vaccine against meningococcal serogroup B,4CMenB:immunological,functional and structural characterization of the antigens[J]. Vaccine,2012,30(Suppl 2):B87-B97.
[30] PERRETT K P,MCVERNON J,RICHMOND P C,et al. Immune responses to a recombinant,four-component,meningococcal serogroup B vaccine (4CMenB) in adolescents:a phaseⅢ,randomized,multicentre,lot-to-lot consistency study[J]. Vaccine,2015,33(39):5217-5224.
[31] PIZZA M,SCARLATO V,MASIGNANI V,et al. Identif cation ofvaccine candidates against serogroup B meningococcus by wholegenome sequencing[J]. Science,2000,287(5459):1816-1820.
[32] ALTINDIS E,COZZI R,DI PALO B,et al. Protectome analysis:a new selective bioinformatics tool for bacterial vaccine candidate discovery[J]. Molecular & Cellular Proteomics,2015,14(2):418-429.
[33] LANZAVECCHIA A,FRUHWIRTH A,PEREZ L,et al. Antibodyguided vaccine design:identification of protective epitopes[J]. Current Opinion in Immunology,2016,41:62-67.
[34] MCLELLAN J S,CHEN M,JOYCE M G,et al. Structure-based design of a fusion glycoprotein vaccine for respiratory syncytial virus[J]. Science,2013,342(6158):592-598.
[35] CORTI D,VOSS J,GAMBLIN S J,et al. A neutralizing antibody selected from plasma cells that binds to group 1 and group 2 inf uenza A hemagglutinins[J]. Science,2011,333(6044):850-856.
[36] EKIERT D C,FRIESEN R H,BHABHA G,et al. A highly conserved neutralizing epitope on group 2 influenza A viruses[J]. Science,2011,333(6044):843-850.
[37] COHEN J. Immunology. A once-in-a-lifetime f u shot?[J]. Science,2013,341(6151):1171.
[38] YASSINE H M,BOYINGTON J C,MCTAMNEY P M,et al. Hemagglutinin-stem nanoparticles generate heterosubtypic inf uenza protection[J]. Nature Medicine,2015,21(9):1065-1070.
[39] SCARSELLI M,ARICO B,BRUNELLI B,et al. Rational design of a meningococcal antigen inducing broad protective immunity[J]. Science Translational Medicine,2011,3(91):91ra62.
[40] CORREIA B E,BATES J T,LOOMIS R J,et al. Proof of principle for epitope-focused vaccine design[J]. Nature,2014,507(7491):201-206.
[41] JARDINE J,JULIEN J P,MENIS S,et al. Rational HIV immunogen design to target specif c germline B cell receptors[J]. Science,2013,340(6133):711-716.
[42] BURTON D R,HANGARTNER L. Broadly neutralizing antibodies to HIV and their role in vaccine design[J]. Annual Review of Immunology,2016,34:635-659.
[43] SI L,XU H,ZHOU X,et al. Generation of inf uenza A viruses as live but replication-incompetent virus vaccines[J]. Science,2016,354(6316):1170-1173.
[44] LE NOUEN C,BROCK L G,LUONGO C,et al. Attenuation of human respiratory syncytial virus by genome-scale codon-pair deoptimization[J]. Proceedings of the National Academy of Sciences of the United States of America,2014,111(36):13169-13174.
[45] YANG C,SKIENA S,FUTCHER B,et al. Deliberate reduction of hemagglutinin and neuraminidase expression of influenza virus leads to an ultraprotective live vaccine in mice[J]. Proceedings of the National Academy of Sciences of the United States of America,2013,110(23):9481-9486.
[46] DE GREGORIO E,RAPPUOLI R. From empiricism to rational design:a personal perspective of the evolution of vaccine development[J]. Nature Reviews Immunology,2014,14(7):505-514.
Novel vaccines and next generation technologies of vaccine design
YANG Yilong,XU Junjie
Laboratory of Vaccine and Antibody Engineering, Beijing Institute of Biotechnology, Academy of Military Medical Sciences, Beijing 100071, China
Vaccination is one of the most successful medical interventions in human history. In recent years, vaccine research and development(R&D)has made signif cant progress. A variety of novel vaccines against major infectious diseases were licensed in domestic and international markets. However, vaccine R&D still face great challenges. There are many shortcomings in the traditional vaccine design technologies. So far, no vaccines can be used to prevent and control infectious diseases such as AIDS, malaria, and Zika virus which pose major threats to human health. With the advancement of bioinformatics and structural biology, new research directions such as protectome analysis, structural vaccinology and synthetic biology have emerged in the f eld of vaccine design, which provide novel platforms for the design of new vaccines in the future.
novel vaccines; vaccine design; protectome analysis; structural vaccinology; synthetic biology
10.3969/j.issn.1674-0319.2017.02.006
杨益隆,博士,助理研究员,主要从事疫苗设计新技术研究。E-mail:yyl_pku@126.com
国家传染病防治科技重大专项资助(2016ZX10004001)
