抑癌基因ARHI在三阴性乳腺癌中的表达及临床意义
2017-04-20张海燕李铁军
张海燕 李铁军 陈 亮 姜 伟
抑癌基因ARHI在三阴性乳腺癌中的表达及临床意义
张海燕①李铁军②陈 亮③*姜 伟②
目的:探讨抑癌基因ARHI在三阴性乳腺癌(TNBC)中的表达及临床意义。方法:选择150例TNBC患者及135例非TNBC患者,用免疫组织化学SP法检测癌组织中ARHI的表达,观察ARHI在两种乳腺癌中表达的差异。结果:抑癌基因ARHI蛋白在TNBC组织中的表达率为32.0%,在非TNBC组织中的表达率为47.4%,两者比较差异有统计学意义(x2=4.444,P<0.05)。抑癌基因ARHI在TNBC中的表达与肿瘤大小、临床分期及腋下淋巴结转移均显著相关,其表达率差异有统计学意义(x2=8.326,x2=9.382,x2=5.259;P<0.05);ARHI的表达与乳腺癌家族史及组织学分级无显著相关性,其表达率差异无统计学意义(x2=0.172,x2=4.584;P>0.05)。ARHI在非TNBC中的表达与临床分期相关,其表达率差异无统计学意义(x2=6.155,P<0.05);ARHI在非TNBC的表达与年龄、肿瘤大小、乳腺癌家族史、腋下淋巴结转移及组织学分级无显著相关性,其表达率差异无统计学意义(x2=0.002,x2=0.946,x2=0.653,x2=0.031,x2=0.991;P>0.05)。结论:抑癌基因ARHI在TNBC中的表达缺失更为显著,提示ARHI的表达可能成为判断TNBC浸润进展及预后的指标之一。
三阴性乳腺癌;非三阴性乳腺癌;抑癌基因;ARHI;免疫组织化学
张海燕,女,(1980- ),硕士,副教授、副主任护师。沧州医学高等专科学校护理系,研究方向:护理教育及临床护理。
三阴性乳腺癌 (triple-negative breast cancer,TNBC)属于乳腺癌中恶性程度最高的类型,即雌激素受体、孕激素受体和人表皮生长因子受体2(human epidermalgrowth factor recepto,Her-2)均不表达[1]。TNBC对于内分泌治疗和Her-2的靶向治疗无效,化疗是目前唯一有效的治疗手段。TNBC与非TNBC比较尚无更好的治疗手段,因此预后差,且易转移复发。近年来,新型的靶向药物层出不穷,针对乳腺癌的新型靶向药物的研究成为目前研究的热点。一种新的肿瘤抑制基因ARHI(aplasia ras homologue member I)/NOEY2参与细胞周期调控和信号通路的传导,负向调节细胞生长,诱发自噬及促进细胞休眠和凋亡。有研究发现,其在乳腺癌、卵巢癌、胰腺癌、肝细胞癌及胃癌等多种肿瘤组织中表达下调或缺失,提示抑癌基因ARHI可能参与了上述肿瘤的发生发展过程[2]。本研究将非TNBC作为对照,探讨ARHI蛋白在TNBC中的表达,分析两者之间表达的差异,并探讨ARHI蛋白与TNBC临床病理特征之间的关系。
1 资料与方法
1.1 一般资料
收集2010年10月至2016年8月于河北省沧州市中心医院住院治疗的150例TNBC患者及135例非TNBC患者的细胞蜡块。TNBC患者均为女性;年龄29~76岁,平均年龄44.6岁;组织学分级为Ⅰ级48例,Ⅱ级50例,Ⅲ级52例;临床肿瘤TNM分期为Ⅰ期40例,Ⅱ期53例,Ⅲ期57例;乳腺癌家族史44例;腋下淋巴结转移患者64例。非TNBC患者均为女性;年龄25~70岁,平均年龄45.2岁;组织学分级为Ⅰ级35例,Ⅱ级54例,Ⅲ级46例;临床肿瘤TNM分期为Ⅰ期38例,Ⅱ期60例,Ⅲ期37例;腋下淋巴结转移患者58例;乳腺癌家族史48例。所有患者均接受规范的治疗。
1.2 纳入与排除标准
(1)纳入标准:经病理检测雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)及Her-2均为阴性的TNBC女性患者。
(2)排除标准:经病理检测ER、PR及Her-2其中任意一项为阳性的非TNBC女性患者。
1.3 免疫组织化学检测
标本进行常规10﹪甲醛固定、常规脱水、浸蜡、包埋及切片。切片厚度为4 μm。采用免疫组织化学SP法进行检测,依据说明书操作。ARHI兔多克隆单克隆抗体试剂盒购自美国SANTA CRUZ公司。
1.4 ARHI的判断指标
采用每一切片中随机选取10个高倍镜视野、每个高倍镜视野计数为100个细胞的方法判定。染色强度等级:浅黄染为1分,中度黄染为2分,强度黄染为3分;阳性细胞的百分率:阳性细胞≤5﹪为0分,5﹪~25﹪为1分,26﹪~50﹪为2分,>50﹪为3分;将两者的结果综合分析:0分计为阴性(-),1~2分计为弱阳性(+),3~4分计为中度阳性(++),5~6分计为强阳性(+++);将CD55蛋白的(-)、(+)组计为低表达组,将CD55蛋白的(++)、(+++)组计为高表达组。
1.5 统计学方法
采用SPSS 16.0统计学软件包进行数据统计学处理。计数资料应用x2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 ARHI蛋白在TNBC与非TNBC中的表达比较
ARHI蛋白在TNBC组织中的表达率为32.0﹪,在非TNBC组织中的表达率为47.4﹪,两者比较差异有统计学意义(x2=4.444,P<0.05),见表1。
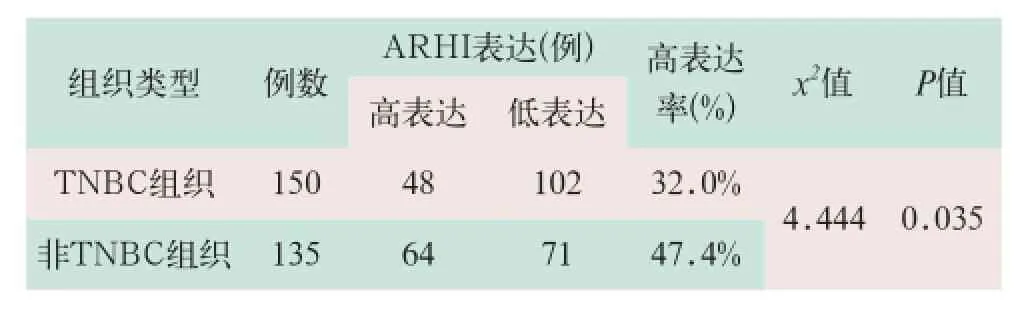
表1 ARHI蛋白在不同乳腺癌组织类型中的表达比较
2.2 ARHI蛋白表达与TNBC临床病理特征的关系
在TNBC患者的临床病理特征中,ARHI的表达与肿瘤大小、临床分期及腋下淋巴结转移均显著相关,其表达率比较差异有统计学意义(x2=8.326,x2=9.382,x2=5.259;P<0.05);ARHI的表达与患者的乳腺癌家族史及组织学分级无显著相关性,其表达率比较差异无统计学意义(x2=0.172,x2=4.584;P>0.05),见表2。
2.3 ARHI蛋白表达与非TNBC临床病理特征的关系
在非TNBC患者的临床病理特征中,ARHI的表达与临床分期相关性,其表达率比较差异有统计学意义(x2=6.155;P<0.05);ARHI的表达与年龄、肿瘤大小、乳腺癌家族史、腋下淋巴结转移及组织学分级无显著相关性,其表达率比较差异无统计学意义(x2=0.002,x2=0.946,x2=0.653,x2=0.031,x2=0.991;P>0.05),见表3。
3 讨论
TNBC是乳腺癌的特殊类型,侵袭性强,预后较差,且缺乏针对性的有效治疗策略,内分泌治疗及针对Her-2基因的分子靶向治疗无效。近年来对TNBC的基础与临床等方面的研究越来越多,已经成为国内外学者关注的重点。因此,针对ARHI基因的研究有助于恶性肿瘤的预防和治疗。无论是在TNBC还是在非TNBC中均存在ARHI的表达缺失,而有关ARHI在TNBC与非TNBC中表达的差异以及与临床病理特征的区别,未见临床报道。
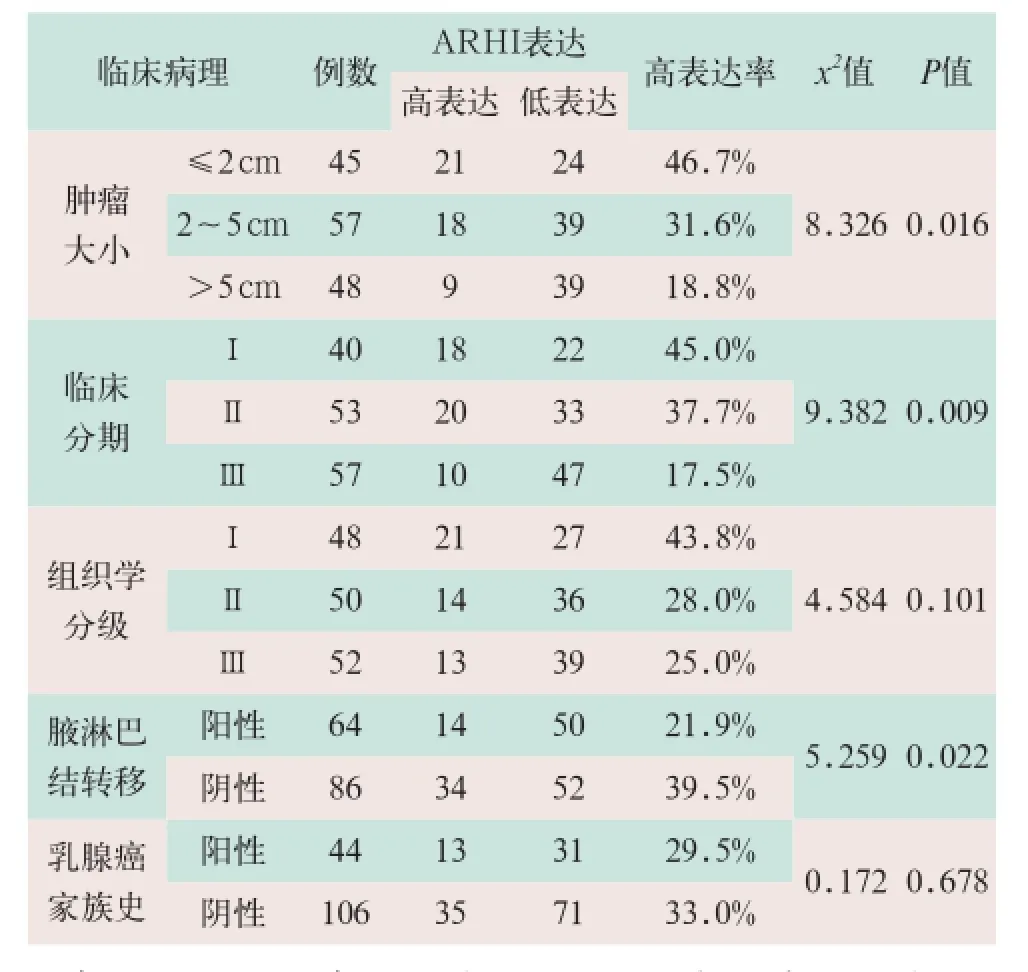
表2 ARHI蛋白表达与TNBC临床病理特征的关系

表3 ARHI蛋白表达与非TNBC临床病理特征的关系
Yu等[1]利用差异显示PCR,确定了ARHI在正常卵巢和乳腺上皮细胞持续表达,而在卵巢癌和乳腺癌表达缺失,通过转染重新表达ARHI后能抑制乳腺癌和卵巢癌细胞的生长。41﹪的卵巢癌和乳腺癌被发现存在杂合性丧失的基因。Bao等[2]使用双腺病毒的系统,在已经失去ARHI表达的卵巢癌和乳腺癌细胞中重新表达ARHI,ARHI的再表达癌细胞的抑制生长,侵袭力下降,并诱导其凋亡。Hisatomi等[3]通过实时PCR分析发现,所有非癌乳腺组织中均检测到ARHI/NOEY2,而在26例乳腺癌组织中,其中有2例没有检测到,10例乳腺癌组织ARHI/NOEY2 mRNA的显着减少,12例ARHI/ NOEY2表达丢失或明显减少。提示ARHI/NOEY2 mRNA表达的减少可能在乳腺癌的发病机制中起重要作用。白雪等[4]收集临床80例乳腺癌患者癌组织、40例癌旁乳腺组织和20例正常乳腺组织,采用免疫组织化学法和RT-PCR法检测ARHI基因在乳腺癌组织、癌旁乳腺组织及正常组织中的表达,显示与正常组织和癌旁组织相比较,ARHI蛋白和ARHImRNA水平在乳腺癌组织中的表达均明显降低,并且两者随组织病理分级的升高而降低,有淋巴结转移的低于无淋巴结转移者,但在不同组织学类型中的表达差异无统计学意义。Wang等[5]采用免疫组织化学法和原位杂交ARHI在乳腺导管原位癌,浸润性乳腺癌和邻近的正常乳腺上皮细胞中的表达,得出ARHI mRNA和蛋白在所有的正常乳腺上皮细胞中检测到,ARHI的表达主要是在细胞质和很少存在于细胞核。通过组织化学分析,DCIS中ARHI表达下调41%,浸润性癌下调70%,表明ARHI表达在DCIS中是显著下调,并且ARHI的表达进一步降低与乳腺癌进展相关。本研究显示,ARHI蛋白在TNBC组织中的阳性表达率明显高于非TNBC组织,提示无论TNBC还是非TNBC中均存在着ARHI蛋白的表达缺失;并且TNBC中ARHI的表达缺失明显高于非TNBC,说明ARHI的表达缺失在参与TNBC的发生发展过程中较非TNBC发挥着更加重要的作用。本组还显示:无论是在TNBC还是在非TNBC中,ARHI的蛋白表达均与年龄、肿瘤大小、乳腺癌家族史及组织学分级无显著相关,而与腋下淋巴结转移有相关性,表明随着恶性度的增加,ARHI的蛋白表达逐渐下降,并且在TNBC中,ARHI蛋白表达缺失又与临床分期有相关性,提示ARHI的表达缺失可能在TNBC的恶性演变过程中较非TNBC扮演着更为重要的角色。此外,在其他恶性肿瘤中同样见到ARHI的异常表达。陈若琨等[6]脑组织切片的免疫组织化学染色显示,高级别胶质瘤ARHI阳性表达率(35.34%和30.16%)明显低于正常脑组织(94.07%)及低级别胶质瘤(93.08%和82.11%,P<0.01),提示ARHI蛋白的阳性率与脑胶质瘤的恶性程度成反比。彭丽等[7]采用免疫组织化学检测72例甲状腺癌组织和癌旁组织以及40例正常组织中ARHI蛋白表达水平,并比较其表达水平和甲状腺癌分级、预后等病理参数关系。结果显示甲状腺癌组织中ARHI阳性率为48.6%,显著低于癌旁组织中的69.4%和正常组织中的95.0%,差异有统计学意义。路新卿等[8]分别应用反转录聚合酶链反应(RT-PCR)和免疫印迹法证实ARHI可明显的诱导胰腺癌细胞发生凋亡,ARHI表达下调可能在胰腺癌的发生发展中起了重要的作用。毛冲冲等[9]采用免疫组织化学SP法检测10例正常脑组织、30例低级别胶质瘤(Ⅰ级、Ⅱ级)和39例高级别胶质瘤(Ⅲ级、Ⅳ级) ARHI的表达情况,证实 ARHI可能成为判断星形胶质细胞瘤恶性程度、侵袭性及预后的有效指标。
张再兴等[10]研究得出喉鳞癌组织ARHI蛋白阳性表达率低于癌旁组织,临床分期Ⅰ~Ⅱ期喉鳞癌患者ARHI蛋白阳性表达率高于Ⅲ~Ⅳ期者,有淋巴结转移喉鳞癌患者ARHI蛋白阳性表达率低于无淋巴结转移者,病理分级高中分化喉鳞癌患者ARHI蛋白阳性表达率高于低分化者。李黎博等[11]通过构建pEGFP-ARHI表达载体,实验表明在ARHI低表达的胃癌细胞系MKN-28中表达重组质粒pEGFPARHI能够抑制细胞的增殖、侵袭和迁移能力。Chen等[12]试验表明,ARHI在胶质瘤组织以及在4种恶性神经胶质瘤细胞系被显著下调。Lu等[13]通过免疫组化和原位杂交法检测57例细胞石蜡包埋手术切除肿瘤标本和患者相应正常胰腺组织中ARHI的表达,结果发现,ARHI mRNA在正常对照胰腺组织中的阳性率和蛋白表达率分别为84.2%和82.5%,而在癌组织中均为52.6%;mRNA在肿瘤组织中的阳性率和蛋白表达率显著降低。胡珊珊等[14]研究表明,ARHI在78.3﹪胰腺癌组织中表达缺失或下调,ARHI基因抑制胰腺癌细胞株增殖,抑制胰腺癌裸鼠荷瘤的生长,抑制胰腺癌裸鼠荷瘤中血管生成和相关蛋白VEGF和CXCL8的表达。Huang等[15]通过实时RT-PCR分析HCC样本ARHI的基因表达,与癌旁非癌组织比较,HCC中ARHI的基因表达下调78.6%。上述研究均表明ARHI在喉鳞癌、胃癌、胶质瘤、胰腺癌以及肝癌也存在明显缺失,肿瘤可能与乳腺癌有着类似的发病机制,ARHI蛋白可能在肿瘤的发生、发展过程中发挥着重要作用。
ARHI的表达缺失可能与TNBC及非TNBC的发生及发展均有相关性,而与TNBC的相关性更强;ARHI可能是影响TNBC及非TNBC预后的因素,而影响TNBC的作用更加明显。因此,ARHI有可能成为判断TNBC浸润进展及预后的指标之一,在乳腺癌中发挥着重要的作用。对于ARHI的研究会进一步深入,为肿瘤的诊断和治疗提供新思路和方法。
[1]Yu Y,Xu F,Peng H,et al.NOEY2(ARHI),an imprinted putative tumor suppressor gene in ovarian and breast carcinomas[J].Proc Natl Acad Sci USA,1999,96(1):214-219.
[2]Bao JJ,Le XF,Wang RY,et al.Reexpression of the tumor suppressor gene ARHI induces apoptosis in ovarian and breast cancer cells through a caspase-independent calpaindependent pathway[J].Cancer Res,2002,62(24): 7264-7272.
[3]Hisatomi H,Nagao K,Wakita K,et al.ARHI/ NOEY2 inactivation may be important in breast tumor pathogenesis[J].Oncology,2002, 62(2):136-140.
[4]白雪,李冬梅,李锐,等.ARHI基因在乳腺癌组织中的表达及其意义[J].中国妇幼保健,2013,28(25): 4233-4235.
[5]Wang L,Hoque A,Luo RZ,et al.Loss of the expression of the tumor suppressor gene ARHI is associated with progression of breast cancer[J].Clin Cancer Res,2003,9(10):3660-3666.
[6]陈若琨,薛亚轲,杨凤东,等.抑癌基因ARHI与胶质瘤病理级别相关性及促凋亡功能研究[J].中华实验外科杂志,2016,33(8):2047-2049.
[7]彭丽,张华.ARHI与Beclin1表达水平对甲状腺癌的分期和分化的影响分析[J].中华普外科手术学杂志(电子版),2016,10(3):259-261.
[8]路新卿,李桂英,王德峰,等.ARHI基因对胰腺癌细胞凋亡的影响[J].临床荟萃,2011,26(24):2145-2148.
[9]毛冲冲,辛艳超,翟广,等.ARHI和突变型P53在人脑星形胶质细胞瘤中的表达及与恶性程度的相关性[J].第三军医大学学报,2013,35(20):2240-2242.
[10]张再兴.ARHI蛋白在喉鳞癌组织中的表达及其临床意义[J].中国全科医学,2013,16(33):3205-3207.
[11]李黎博,唐秋琳,李明星,等.ARHI真核表达质粒对胃癌恶性表型的影响[J].四川大学学报(医学版),2013,44(1):10-14,20.
[12]Chen J,Shi S,Yang W,et al.Over-expression of ARHI decreases tumor growth,migration, and invasion in human glioma[J].Med Oncol,2014,31(3):846.
[13]Lu ZH,Chen J,Gu LJ,et al.[ARHI mRNA and protein expression in pancreatic cancers][J].Zhongguo Yi Xue Ke Xue Yuan Xue Bao,2001,23(4):324-327.
[14]胡珊珊.ARHI基因对胰腺癌微环境血管生成的影响及相关分子机制的研究[D].北京:北京协和医学院,2014.
[15]Huang J,Lin Y,Li L,et al.ARHI,as a novel suppressor of cell growth and downregulated in human hepatocellular carcinoma,could contribute to hepatocarcinogenesis[J].Mol Carcinog,2009,48(2):130-140.
Expressions and clinical significances of tumor suppressor gene ARHI in triple-negative breast cancer(TNBC)
ZHANG Hai-yan, LI Tie-jun, CHEN Liang, et al//
China Medical Equipment,2017,14(4):120-123.
Objective: To investigate the expressions and significances of tumor suppressor gene aplasia ras homologue member I (ARHI) in triple-negative breast cancer (TNBC). Methods: To select 150 patients with triple-negative breast cancer and 135 patients with non-triple-negative breast cancer as the research cases. The expressions of ARHI was detected by immunohistochemistry Streptavidin-Peroxidase (SP) method for 150 cases TNBC and 135 cases non-TNBC, and the different expressions of ARHI in two types of breast cancer were observed and compared. Results: The positive expression of ARHI was 32.0% in the TNBC tissues and was 47.4% in non-TNBC tissues, and the difference between them indicated statistical significance (x2=4.444, P<0.05). The expression of ARHI in TNBC was significantly related with tumor size, clinical stage and axillary lymph node metastasis (x2=8.326, x2=9.382, x2=5.259; P<0.05), while its expression did not show significant correlation with family history of breast cancer and histologic grade (x2=0.172, x2=4.584; P>0.05). The expression of ARHI was significantly related with clinical stage of non-TNBC (x2=6.155, P<0.05), while it did not show correlation with age, tumor size, family history of breast cancer, axillary lymph node metastases and histologic grade (x2=0.002, x2=0.946, x2=0.653, x2=0.031, x2=0.991; P>0.05). Conclusion: The expression deletion of ARHI has more significant in triplenegative breast cancer, and this result suggests that expression of ARHI may be used as one of the indicators in determining the invasive progress and prognosis of TNBC.
Triple-negative breast cancer; Non-triple-negative breast cancer; ARHI; Immunohistochemistry
10.3969/J.ISSN.1672-8270.2017.04.032
1672-8270(2017)04-0120-04
R737.9
A

2016-12-02
①沧州医学高等专科学校护理系 河北 沧州 061001
②沧州市中心医院教学处 河北 沧州 061001
③沧州市中心医院肿瘤外二科 河北 沧州 061001
*通讯作者:chenliangsy@sina.com
[First-author’s address] The Department of Nursing, Cangzhou Medical College, Cangzhou 061001, China.
