TOMO高剂量少分次放射治疗胰腺癌血清胃蛋白酶原水平变化评估及其临床意义*
2017-04-20何子杰夏廷毅
何子杰 任 刚 常 远 王 勇 夏廷毅*
TOMO高剂量少分次放射治疗胰腺癌血清胃蛋白酶原水平变化评估及其临床意义*
何子杰①②任 刚②常 远②王 勇②夏廷毅①②*
目的:评估螺旋断层放射治疗(TOMO)系统高剂量少分次治疗胰腺癌患者前后血清胃蛋白酶原(PG)水平变化及其临床意义。方法:选取在医院接受TOMO系统治疗的31例胰腺癌患者。放射治疗剂量分别给予计划靶区(PTV)50 Gy,临床靶区(CTV)60 Gy,肿瘤体积(GTV)70 Gy,每周治疗5次,共治疗15次。采用化学发光微粒子免疫检测法测定患者放射治疗前后血清胃蛋白酶原水平,评估其变化,并分析其与患者一般资料的相关性。结果:①放射治疗前后患者血清PGⅠ水平无差异;放射治疗前后患者血清PGⅡ水平以及PGⅠ与PGⅡ比值相比较,其差异有统计学意义(t=-2.908,t=2.749,P<0.01);②放射治疗前后PGⅠ和(或)PGⅡ值与患者年龄具有相关性(r=-0.359,P<0.05),PGⅠ和PGⅡ水平与患者一般资料间均无相关性。结论:①血清PG水平是评估胃黏膜形态及功能状态的有效指标,可反映出放射治疗后胃黏膜介于浅表性胃炎与轻中度胃炎之间,不良反应可接受;②血清PG水平变化可指导临床使用药物保护放射治疗后胃黏膜。
胰腺癌;放射治疗;高剂量少分次;胃蛋白酶原;TOMO
何子杰,男,(1993- ),硕士研究生,医师。安徽医科大学空军临床学院、空军总医院肿瘤放疗科,从事肿瘤放射治疗研究工作。
胰腺癌是消化系统的恶性肿瘤之一,近年来发病率逐渐提高。根据2015中国癌症统计报告,2015年新增胰腺癌患者90 100例,在所有新发恶性肿瘤中占第10位;死亡胰腺癌患者79 400例,在所有导致死亡的恶性肿瘤中占第7位[1]。放射治疗是胰腺癌主要治疗手段之一,因胰腺周围临近胃肠道,以往常规放射治疗技术照射剂量难以提高,放射治疗仅起辅助或减症治疗作用。近年来,随着螺旋断层调强放射治疗(tomotherapy,TOMO)、射波刀及伽马刀等先进放疗设备和技术不断发展,放射治疗模式不断改进,胰腺病灶可接受高剂量少分次放射治疗,明显提高病灶照射剂量,使治疗疗效显著提高,常可使症状明显改善,存活期延长[2]。但由于胃位于胰腺癌放射治疗靶区的区域内,在提高剂量更好杀伤肿瘤细胞的同时,不可避免会增加放射线对胃的损伤。临床上评估放射治疗后胃肠道反应的主要手段是胃镜检查,但胰腺癌患者因肿瘤和放射治疗双重打击,多数可能无法耐受,因此需要一种安全、无创的检查手段对放射治疗后胃黏膜生理状态进行早期筛查和评估。胃蛋白酶原(pepsinogen,PG)是由胃黏膜腺体分泌的胃蛋白酶前体多肽,已有明确的流行病学证据表明,血清PG水平与胃黏膜形态或者功能改变具有良好的相关性[3-7]。为此,本研究拟通过测定放射治疗前后患者血清PGⅠ、PGⅡ以及PGⅠ与PGⅡ比值评估放疗前后胃黏膜生理状态,探讨TOMO高剂量少分次放射治疗胰腺癌对胃分泌功能的影响。
1 材料和方法
1.1 一般资料
收集2015年8月至2016年12月在空军总医院接受TOMO设备治疗的31例胰腺癌患者的病例资料。其中男性21例,女性10例;年龄47~85岁,中位年龄60岁。所有患者有明确组织病理学诊断19例,无病理12例;胰头颈部肿瘤20例,胰体尾部肿瘤11例;有黄疸并行减黄手术者10例,无黄疸且未行减黄手术者21例。根据美国癌症联合委员会(American Joint Committee on Cancer,AJCC)肿瘤TNM分期第7版,Ⅰ期5例,Ⅱ期2例,Ⅲ期16例,Ⅳ期8例。同步放化疗者17例,单纯放射治疗者14例。31例患者全部采用螺旋断层调强放射治疗。
1.2 纳入与排除标准
(1)纳入标准:①组织穿刺活检病理学确诊或临床诊断为胰腺腺癌,临床诊断包括胰腺癌症状和体征、肿瘤标志物升高以及影像学PET-CT、增强CT、MRI和B超诊断为胰腺癌;②功能状态评分(karnofsky performance scale,KPS)≥60分;③年龄≤85岁;④所有患者均签署知情同意书。
(2)排除标准:①存在严重器质性合并症,无法配合者;②患者既往接受过针对胰腺癌的全身或局部治疗;③存在其他疾病可导致PG水平变化,如胃十二指肠溃疡、萎缩性胃炎、肠化生及胃癌等;④检测前1周内服用如质子泵抑制剂等可影响血清PG水平的药物。
1.3 仪器与材料
定位采用西门子SomAToM Emotion 16层螺旋CT(德国西门子公司);放射治疗采用Tomotherapy Hi-Art系统(美国Accuray公司);血清PG检测采用ARCHITECT Plus检测系统及试剂盒(德国Abbott GmbH &Co.KG公司)。
1.4 放射治疗方案
(1)定位。患者定位及治疗时仰卧位,双手上举紧握定位棒,热塑体网固定体位。定位前15 min口服3﹪碘帕醇250 ml行胃肠造影,自主呼吸下,使用西门子16排75 cm孔径螺旋CT扫描,扫描范围自膈顶上3~5 cm至髂骨水平。平静呼吸状态下自然扫描,层厚5 mm,重建4 cm后传输至医生工作站。
(2)靶区勾画。根据之前腹部增强MR、PET-CT在定位CT上勾画肿瘤体积(gross tumor volume,GTV),GTV外扩5 mm形成临床靶体积(clinical tumor volume,CTV),根据肿瘤与胃、十二指肠关系适当调整CTV范围。计划靶区体积(planning target volume,PTV)为CTV于头脚方向外扩10 mm,其余方向外扩5 mm(如图1所示)。危及器官包括胃、肠道、肾脏、肝脏和脊髓。
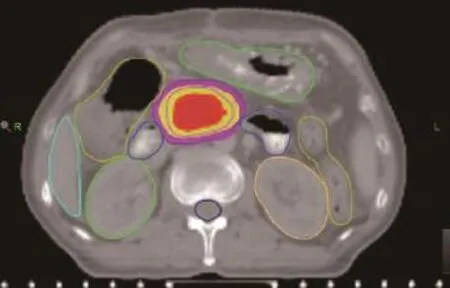
图1 胰腺癌靶区勾画图
(3)设计计划。在TOMO计划系统(Version4.0.4.17)设计治疗计划,放疗剂量分别给PTV 50 Gy,CTV 60 Gy,GTV 70 Gy,15次,每周5次;中位处方剂量70 Gy,中位单次剂量4.66 Gy。计划要求处方剂量至少覆盖95﹪的靶区体积。正常器官剂量容积性限制:胃肠道为55 Gy≤1 cc、50 Gy≤3 cc、45 Gy≤5 cc和40 Gy≤10 cc;脊髓为40 Gy≤1 cc和30 Gy≤10 cc;肾脏为V20≤30﹪;肝脏为V30≤30﹪。射野宽度为2.5 cm,螺距比为0.287。根据分次剂量、靶区及危及器官(organs at risk,OAR)的剂量容积直方图(dose volume histogram,DVH)评估确定治疗计划。在每次治疗前均行图像引导治疗。
1.5 血清PG检测方法
患者接受螺旋断层调强放射治疗前、后3日内,抽取清晨空腹血5 ml,使用化学发光微粒子免疫检测法定量检测PGⅠ和PGⅡ,并计算PGⅠ与PGⅡ的比值。采用ARCHITECT PGⅠ测定试剂盒8D07(1×100测试/盒;1×500测试/盒)和ARCHITECT PGⅡ测定试剂盒9D65(1×100测试/盒;1×500测试/盒)。
1.6 评价指标
血清PG评价标准:根据PG测定试剂盒,PGⅠ<70 ng/mL和PGⅠ与PGⅡ比值<3.0时,胃底腺粘膜萎缩性疾病的诊断率最高。胰腺癌分期:参照美国癌症联合委员会肿瘤TNM分期第7版。
1.7 统计学方法
采用SPSS20.0统计学软件对数据进行分析,计量变量采用均数±标准差(x-±s)表示,放射治疗前后PG水平变化比较采用配对t检验。血清PG水平与患者性别、肿瘤部位、分期、等采用单因素方差分析,检验水准α=0.05,以P<0.05为有统计学意义。
2 结果
2.1 放射治疗前、后患者血清PG水平变化
放射治疗前、后31例患者血清PGⅠ水平均值分别为(121.66±142.56)ng/ml、(131.30±81.44)ng/ml,差异无统计学意义(t=-0.426,P>0.05)。放射治疗前、后患者血清PGⅡ水平均值分别为(19.51±18.79) ng/ml、(27.03±20.69)ng/ml,差异有统计学意义(t=-2.908,P<0.05)。放射治疗前、后PGⅠ与PGⅡ比值分别为7.28±3.42、6.04±3.69,差异有统计学意义(t=2.749,P<0.05),见表1。
表1 放射治疗前、后31例患者血清PG水平变化(±s)
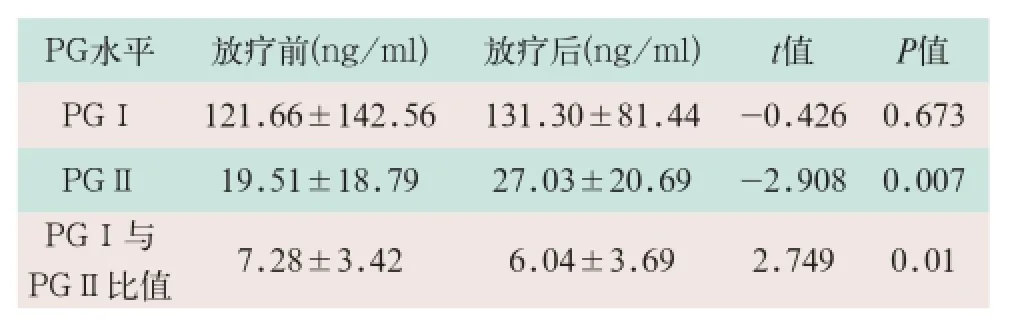
表1 放射治疗前、后31例患者血清PG水平变化(±s)
2.2 胰腺癌患者血清PG水平与其一般资料的相关性
(1)年龄。将所有31例患者放射治疗前PGⅠ、PGⅡ水平及PGⅠ与PGⅡ比值与年龄的相关性分析结果:①PGⅠ、PGⅡ水平与年龄无相关性,PGⅠ与PGⅡ比值与年龄在0.05水平(双侧)上显著相关,具有统计学意义(r=-0.359,P<0.05)。
(2)性别。21例男性患者放射治疗前PGⅠ、PGⅡ水平分别为(134.20±170.23)ng/ml、(19.50±21.26) ng/ml,PGⅠ与PGⅡ比值为7.54±3.00;10例女性患者放疗前PGⅠ、PGⅡ水平分别为(95.35±47.00) ng/ml、(19.53±13.11)ng/ml,PGⅠ与PGⅡ比值为6.74±4.30;两组之间无差异。
(3)肿瘤部位。20例胰头癌患者放射治疗前PGⅠ、PGⅡ均值分别为(106.24±60.02)ng/ ml、(18.90±13.36)ng/ml,PGⅠ与PGⅡ的比值为7.39±3.64;11例胰体尾癌患者放射治疗前PGⅠ、PGⅡ均值分别为(149.71±229.75)ng/ml、(20.62±26.79)ng/ml,PGⅠ与PGⅡ的比值为7.08±3.13,两组之间无差异。
(4)分期。5例Ⅰ期胰腺患者,放射治疗前PGⅠ、PGⅡ均值分别为(106.16±88.16)ng/ml、(20.06±15.94)ng/ml,PGⅠ与PGⅡ的比值为5.50±2.81;2例Ⅱ期胰腺癌患者,放射治疗前PGⅠ、PGⅡ均值分别为(126.25±104.02)ng/ ml、(21.50±21.92)ng/ml,PGⅠ与PGⅡ的比值为7.09±2.39;16例Ⅲ期胰腺癌患者,放射治疗前PGⅠ、PGⅡ均值分别为(142.14±187.11)ng/ ml、(22.71±22.23)ng/ml,PGⅠ与PGⅡ的比值为6.61±2.89;8例Ⅳ期胰腺癌患者,放射治疗前PGⅠ、PGⅡ均值分别为(89.26±61.27)ng/ml、(12.28±12.45)ng/ml,PGⅠ与PGⅡ的比值为9.78±4.07,各组之间无差异。
(5)是否减黄。22例无黄疸未行减黄手术的胰腺癌患者,放射治疗前PGⅠ、PGⅡ均值分别为 (128.01±165.06)ng/ml、(21.02±20.51)ng/ ml、PGⅠ与PGⅡ的比值为6.7307±3.4020;9例有黄疸已行减黄手术的胰腺癌患者,放射治疗前PGⅠ、PGⅡ均值分别为(106.16±65.67)ng/ml、(15.81±14.07)ng/ml,PGⅠ与PGⅡ的比值为8.63±3.25;两组之间无差异。
3 讨论
胰腺癌恶性程度高、预后差,确诊时大部分患者已处于晚期,手术、化疗及常规放射治疗的疗效有限。放射治疗作为治疗胰腺癌的重要手段之一,可提高局控率,延长生存期。但由于胰腺临近胃肠道,传统放疗技术难以给予肿瘤高剂量照射,周边危及器官较多,限制了其局部剂量的提高,超过40~50 Gy的放射治疗剂量便可能导致放射性胃肠炎的发生[8]。TOMO是一种特殊的调强放射治疗系统,有治疗精度高,剂量分布聚焦性和适形性好,对正常组织保护佳的优势[9-10]。本研究中心提出GTV为70 Gy、CTV为60 Gy和PTV为50 Gy的新型剂量模式,提高了胰腺病灶局部剂量,较传统放疗取得更好的局控率和生存率[11]。尽管如此,周围胃肠道也不免接受到额外的照射剂量,带来一定的消化道不良反应。胰腺癌患者体质较弱,部分高龄,对检查耐受性低,无法均接受胃镜检查,因此需要一种简单、安全、经济的手段对放疗后患者胃黏膜状态进行评估。
PG属于天冬氨酸蛋白水解酶,是胃蛋白酶的前体。按照其免疫活性、分泌细胞及生化特征的不同,分为PGⅠ和PGⅡ。分泌入胃腔内的PG在胃酸和已激活胃蛋白酶的作用下,从分子中分离出小分子的多肽,转变为具有活性的胃蛋白酶,少量吸收入血并在血液中稳定存在[12]。因此,血清PG水平可反映胃黏膜生理状态,任何导致胃黏膜腺体损伤的因素均有可能导致PG水平变化。
3.1 TOMO治疗胰腺癌患者前后血清PG水平变化
本研究中心较早提出放疗高剂量少分次靶区内加量模式治疗胰腺癌患者,I期、II期临床试验已证实该剂量分割模式治疗胰腺癌近期疗效好[11]。但局部剂量增加的同时,也相应改变了危及器官剂量模式。本研究显示,TOMO高剂量少分次模式治疗胰腺癌患者短期内,患者血清PGI水平无明显变化;PGⅡ放疗后较放疗前增高,差异有统计学意义;PGⅠ与PGⅡ的比值较放射治疗前降低,差异有统计学意义。陈智周等[13]报道,浅表性胃炎患者的血清PGⅠ、PGⅡ水平均升高,且PGⅡ较PGⅠ升高的多,PGⅠ与PGⅡ的比值下降。而轻至中度胃炎表现为血清PGⅠ水平下降,PGⅡ水平持续升高,PGⅠ与PGⅡ的比值进一步下降。重度慢性萎缩性胃炎患者则表现为血清PGⅠ水平严重下降,PGⅡ水平保持不变,PGⅠ与PGⅡ的比值更大幅度降低。由此可以表明,本研究中的胰腺癌患者放疗后胃黏膜状态可能介于浅表性胃炎与轻中度胃炎之间,所以出现PGⅠ无明显变化,PGⅡ升高,PGⅠ与PGⅡ的比值下降的表现。在下一步的随访中可行胃镜检查,明确结果。
3.2 胰腺癌患者血清PG水平与其一般资料的相关性
正常人血清PG水平受多种外在因素影响,在不同地域、不同性别、不同年龄段人群的表达均不一致。赵缜等[14]入组8432例健康体检者,探讨性别、年龄对血清PG水平影响,其结果显示,男性组血清PG水平均高于女性组,且随着年龄增长PGⅠ、PGⅡ逐渐升高,PGⅠ与PGⅡ的比值逐渐降低。李晔等[15]研究纳入22 270例健康体检者,研究PG与年龄、性别及幽门螺杆菌(Hp)感染等因素的关系,其结果显示,Hp阳性组中男性PGⅠ和PGⅠ与PGⅡ的比值高于女性,PGⅡ低于女性;Hp阴性组中男性PGⅠ、PGⅡ和PGⅠ与PGⅡ的比值均高于女性;Hp阳性组PGⅠ、PGⅡ高于Hp阴性组,PGⅠ与PGⅡ的比值低于Hp阴性组,差异有统计学意义。且随着年龄增长PGⅠ、PGⅡ逐渐升高,PGⅠ与PGⅡ的比值于70岁以上者显著降低。Huang等[16]入组6596例健康志愿者,研究其年龄、性别与血清PG水平的相关性。本结果表明,健康人血清PGⅠ、PGⅡ和PGⅠ与PGⅡ的比值与性别、年龄是相关的,男性血清PG明显高于女性,差异有统计学意义,且随着年龄增长,PGⅠ、PGⅡ水平逐渐升高,PGⅡ升高幅度大于PGⅠ,PGⅠ与PGⅡ比值降低。
本研究结果显示,PGⅠ与PGⅡ的比值与年龄间有负相关性,随着年龄增长,PGⅠ与PGⅡ的比值逐渐下降,此结果健康人群研究相符,表明PGⅠ与PGⅡ的比值是可用于评估高剂量少分次放疗影响下胃黏膜形态及功能状态的重要指标。但并未发现患者血清PGⅠ、PGⅡ和PGⅠ与PGⅡ的比值与性别、肿瘤部位、肿瘤分期、是否减黄以及是否进行化疗在统计学上拥有相关性。这与上述健康人群研究结果有所不符,考虑本研究对象为胰腺癌患者,正常胰腺组织也能分泌少量PGⅡ,肿瘤引起胰腺实质破坏导致胰腺外分泌功能不全,可能影响血清PG水平。此外,因入组条件限制,本研究病例数较少,也影响结果的判定。
4 结论
本研究结果表明:①血清PG水平是评估胃黏膜形态及功能状态的有效指标,TOM高剂量少分次模式治疗胰腺癌患者前后短期内血清PGⅠ无明显变化,PGⅡ升高,PGⅠ与PGⅡ的比值降低,反映出放射治疗后胃黏膜介于浅表性胃炎与轻中度胃炎之间,不良反应可接受;②血清PG水平变化可指导临床使用药物保护放疗后胃黏膜;③TOMO高剂量少分次模式治疗胰腺癌患者前后血清PG变化与其一般资料间无相关性,有待进一步研究。
参考文献
[1]Chen W,Zheng R,Baade PD,et al.Cancer Statistics in China 2015[J].CA CANCER J CLIN,2016,66(2):115-132.
[2]Hugueta F,Mornexb F,Orthuond A.Radiation t herapy of pancreatic cancer[J].Cancer Radiother, 2016(20):169-173.
[3]Yoshihara M,Sumii K,Haruma K,et al.Correlation of ratio of serum pepsinogen I and II with prevalence of gastric cancer and adenoma in Japanese subjects[J].Am J Gastroenterol, 1998,93(7):1090-1096.
[4]Dinis-Ribeiro M,da Costa-Pereira A,Lopes C, et al.Validity of serum pepsinogen I/II ratio for the diagnosis of gastric epithelial dysplasia and intestinal metaplasia during the follow-up of patients at risk for intestinal-type gastric adenocarcinoma[J].Neoplasia,2004,6(5):449-456. [5]Abnet CC,Zheng W,Ye W,et al.Plasma pepsinogens, antibodies against Helicobacter pylori, and risk of gastric cancer in the Shanghai Women's Health Study Cohort[J].Br J Cancer,2011,104(9):1511-1516.
[6]Haneda M,Kato M,Ishigaki S,et al.Identification of a high risk gastric cancer group using serum pepsinogen after successful eradication of Helicobacter pylori[J].J Gastroenterol Hepatol,2013,28(1):78-83.
[7]Kim N,Jung HC.The role of serum pepsinogen in the detection of gastric cancer[J].Gut Liver,2010,4(3):307-319.
[8]McGinn CJ,Zalupski MM,Shureiqi I.Phase I trial of radiation dose escalation with concurrent weekly full-dose gemcitabine in patients with advanced pancreatic cancer[J].J Clin Oncol,2001,19(22):4202-4208.
[9]Mackie TR,Holmes T,Swerdloff S,et al.Tomotherapy:a new concept for the delivery of dynamic conformal radiotherapy[J].Med Phys,1993,20(6):1709-1719.
[10]张晖,任刚,夏廷毅,等.18F-FDG PET/CT标准摄取值对胰腺癌螺旋断层调强放射治疗预后的评估[J].中国医学装备,2016,13(4):57-60.
[11]Xia T,Chang D,Wang Y,et al.Dose Escalation t o Target Volumes of Helical Tomotherapy for[J]. Int J Radiat Oncol Biol Phys,2013,87(2):303.
[12]Konturek SJ,Konturek PC,Bielanski W,et al. Serum progastrin and its products, gastric acid secretion and serum pepsinogen I in gastric cancer[J].Digestion,2003,68(4):169-177.
[13]陈智周,范振符.胃蛋白酶原Ⅰ、Ⅱ在早期胃癌普查中的意义[J].中华肿瘤杂志,2002,24(1):101-013.
[14]赵缜,廉伟,潘惠芬.性别和年龄对血清胃蛋白酶原水平的影响[J].临床内科杂志,2016,33(3):185-187.
[15]李晔.胃蛋白酶原相关影响因素分析[J].标记免疫分析与临床,2016,23(3):312-315.
[16]Huang RG,Xiao HL,Zhou B,et al.Serum Pepsinogen Levels Are Correlated With Age, Sex and the Level of Helicobacter pylori Infection in Healthy Individuals[J].Am J Med Sci,2016,352(5):481-486.
Objective: To evaluate the change and clinical value for serum pepsinogen (PG)of patients with pancreatic carcinoma before and after they were treated by tomotherapy (TOMO) hypofractionated radiotherapy. Methods: 31 patients with pancreatic cancer treated by TOMO hypofractionated radiotherapy were selected and their planning target volume(PTV), clinical target volume(CTV) and gross tumor volume (GTV), respectively, were radiated 50 Gy, 60 Gy and 70 Gy. They were treated as this plan 5 fractions per week, and total of treatments were 15 times. The chemiluminiscence microparticle immunodetection was used to detect serum PG before and after patients were treated by tomotherapy (TOMO) hypofractionated radiotherapy, respectively. To evaluate the change of serum PG and analyze the correlation between serum PG and general documents of patients. Results: For PG I, the difference between before and after patients were treated by tomotherapy (TOMO) hypofractionated radiotherapy was no significant. For PG II, both of the differences between before and after treatment and between it and PGI were significant(t=-2.908, t=2.749, P<0.01). The value of PG I/PG II before and after radiotherapy existed negative correlation with the age(r=-0.359, P=0.047), and there were no correlations between PG I and general data of patients and between PG II and that of patients, respectively. Conclusions: Serum PG is a effective indicator for evaluating the function and morphology of gastric mucosa and it can reflect whether the gastric mucosa existed between superficial gastritis and mild-moderate gastritis, and indicate the adverse reaction can be accepted. Therefore, serum PG can guide how to use clinical medicine to protect gastritis after radiotherapy.
Pancreatic cancer; Radiotherapy; Hypofractionated radiotherapy; Pepsinogen; TOMO
10.3969/J.ISSN.1672-8270.2017.04.023
1672-8270(2017)04-0087-05
R730.55
A

2017-01-05
首都卫生发展科研专项(2014-1-5124)“以放疗为主的综合治疗不能手术局限期和(或)局部晚期胰腺癌的临床系列研究”;空军总医院面上课题(KZ2014037)“高剂量少分次放疗治疗局部晚期胰腺癌的前瞻性、随机对照研究”
①安徽医科大学空军临床学院 北京 100142
②空军总医院肿瘤放疗科 北京 100142
*通讯作者:68434886@163.com
A research of evaluation and clinical value for change of serum pepsinogen of patient with pancreatic carcinoma treated by TOMO hypofractionated radiotherapy/HE Zi-jie, REN Gang, CHANG Yuan, et al//China Medical Equipment,2017,14(4):87-91.
[First-author’s address] Air Force Clinical College, Anhui Medical University. Tumor Radiotherapy, Air Force General Hospital, PLA, Beijing 100142, China.
