生物质炭对盆栽黑麦草生长的影响及机理*
2017-04-19冯歌林陈俊辉徐秋芳梁辰飞
吴 涛 冯歌林 曾 珍 陈俊辉徐秋芳 梁辰飞
(浙江农林大学环境与资源学院,浙江省森林生态系统碳循环与固碳减排重点实验室,浙江临安 311300)
生物质炭对盆栽黑麦草生长的影响及机理*
吴 涛 冯歌林 曾 珍 陈俊辉†徐秋芳 梁辰飞
(浙江农林大学环境与资源学院,浙江省森林生态系统碳循环与固碳减排重点实验室,浙江临安 311300)
通过盆栽试验,采用实时定量PCR和微孔板荧光法,分别研究了生物质炭添加对太湖地区农田土壤黑麦草生长、微生物群落丰度和酶活性的影响。结果表明:生物质炭添加量为4%(炭/土质量比)处理显著提高了土壤pH、有机碳、全氮、碳氮比、速效钾含量及黑麦草生物量;提高了土壤细菌、古菌和固氮菌nifH基因拷贝数,而对真菌无影响;提高了β-葡萄糖苷酶、纤维二糖水解酶、木糖苷酶、β-N-乙酰氨基葡萄糖苷酶和酸性磷酸酶的活性。微生物丰度(除真菌外)与多数土壤酶活性(除亮氨酸氨基肽酶)均成显著正相关。因此,生物质炭可增加土壤矿质养分,提高主要微生物类群和功能菌的丰度及土壤碳、氮和磷转化酶活性,这可能是施用生物质炭提升农田土壤养分转化功能和生产力的主要原因。
生物质炭;定量PCR;土壤酶;微孔板荧光法;土壤微生物
大气温室气体浓度升高导致的全球变暖日益威胁人类社会。农田土壤固碳减排是应对全球变化的重要措施之一。在促进土壤固碳的同时,如何有效保持和提升土壤功能,尤其是提高土壤生产力和生物活性,是农业可持续发展的关键,也是固碳土壤学研究的新问题[1]。将生物质废弃物热解成生物质炭应用于土壤较好地解决了上述问题,尽管还存在一些争议[2]。
国内外较多研究表明,生物质炭施用土壤后增加了土壤碳库,一定程度上提高了作物的生产力(产量和生物量)。据Kimetu和Lehmann[3]报道,在贫瘠土壤中添加7 t hm-2生物质炭,2年内连续施用3次后玉米产量翻倍增长。施用氮肥的同时添加生物质炭可使小白菜产量较单独施氮肥时增加70%以上[4]。Major等[5]在热带草原氧化土中连续4年施加生物质炭,发现施用生物质炭第一年未增加玉米产量,而后续3年分别增产8%、30%和 140%。然而,在作物增产方面还存在一些不同的观点:将生物质炭施加到酸性土壤中能够显著增加小麦和萝卜产量,而在碱性土壤中却降低了其产量[6]。黄超等[7]研究发现生物质炭有效改善了低肥力酸性红壤,促进黑麦草的生长,但在高肥力土壤上出现抑制作用。刘园等[8]报道低用量生物质炭对潮土作物产量无影响,中、高用量处理可以提高小麦、玉米和四季总产量4.54%~4.92%。学者认为出现相反结果可能与不同植物对生物质炭引起的pH敏感性不同,抑或高水平生物质炭可能引发氮固定,导致作物减产[6]。由此可见,生物质炭对促进植物生长效果还存在分歧,这种分歧取决于土壤肥力和性质、作物类型以及生物炭的特性和施用量等因素[9],有待于进一步验证。
生物质炭对植物生长促进作用主要归结为其改善了土壤结构和养分供应能力[5,9]。例如,生物质炭施用增加了土壤有机质含量,提高了土壤肥力,提高土壤pH,直接促进磷(P)、钾(K)、镁(Mg)和钙(Ca)的生物有效性[7];改善了土壤质地,提高土壤持水性能和养分截留[8-9]。土壤微生物和土壤酶调控土壤物质转化和养分循环,是土壤质量的重要生物指标[10]。研究发现,生物质炭增加了土壤中菌根真菌侵染,使得作物对养分和水分的吸收加强[11];有利于促进植物根际促生菌,提高辣椒病害抵抗力[12];提高红壤性水稻土微生物数量[13]和滨海盐碱土固氮功能微生物的丰度[14];提高蔗糖酶、脲酶和碱性磷酸酶等活性,促进糜子产量提高[15]。由此,推测生物质炭促进作物增产的潜在动力可能是土壤微生物与酶活性介导下的土壤养分供应能力的提高。生物质炭施用一方面增加土壤养分含量和生物有效性,另一方面可能通过提高土壤微生物数量和土壤酶活性改善土壤养分供给能力,从而间接促进植物生长。
为验证以上科学假设,本研究通过采集太湖地区典型稻/麦轮作农田土壤,以小麦秸秆生物质炭为材料,通过盆栽试验,采用定量PCR技术和微孔板荧光法,研究生物质炭添加对黑麦草生长和土壤微生物数量及相关土壤酶活性的影响,探讨潜在的微生物学机理,以期为太湖地区农田土壤增汇减排和稻/麦轮作系统地力提升提供理论参考。
1 材料与方法
1.1 供试材料
供试土壤采自江苏省宜兴市宜丰镇鲸塘村(31°24′10″ N,119°41′28″ E),土壤类型属于太湖地区第四纪湖积物发育的脱潜型水稻土。该地区属亚热带季风气候,为典型的稻麦轮作区,年平均气温15.7℃,年平均降水量1177 mm。0~20cm土壤基本理化性质为:pH(H2O)6.80,有机碳23.5 g kg-1,全氮2.33 g kg-1,有效磷12.36 mg kg-1,速效钾71.62 mg kg-1。于小麦季采集土壤样品,风干后过2mm筛备用。
1.2 盆栽试验
试验设3个处理,分别为C0(不添加生物质炭)、C1(生物质炭添加量2%,炭/土质量比)和C2(生物质炭添加量4%,炭/土质量比),每处理3个重复。将土壤样品与生物质炭充分混合后装盆,每盆重量500 g。每盆播种20粒大小均匀饱满的种子,等黑麦草种子萌发一周后,每盆间苗至10株,整个培养期间均保持无杂草生长。调节土壤含水量至田间最大持水量的65%。试验在温室内进行,培养期间不添加肥料,盆的位置随机摆放,定期补充去离子水。盆栽90 d后剪取黑麦草地上部分,置于60℃烘箱中烘干至恒重,称重。
盆栽结束后进行破坏性取样,土壤过2 mm筛,混匀,分成2份。一份自然风干,用于土壤基本性质测定;另一份冷冻干燥后保存至-70℃冰箱,备用。
1.3 土壤化学分析
土壤化学性质分析参照文献[16]进行。土壤pH用无CO2蒸馏水浸提(土水比为1∶2.5),pH计测定。有机碳和全氮(土壤过0.25 mm筛)分别采用重铬酸钾容量法和凯氏定氮法测定。碱解氮采用碱解扩散法测定;有效磷采用盐酸-氟化铵溶液浸提,钼锑抗比色法测定;速效钾采用醋酸铵提取,火焰光度计(FP6410,上海)测定。
1.4 土壤总DNA提取
采用MATLAB对本文算法进行了仿真和验证,并与ADM+CGA算法结果进行比较。两个锚节点布置在钻井井筒中固定位置,传感器节点随机散布在裂缝中,裂缝内部没有锚节点。如前所述水力压裂工艺产生的裂缝宽度很小,混在携砂液(起支撑裂缝作用)进入裂缝内部的传感器节点定位问题等效为平面内节点定位问题。为了研究噪声引起的磁场测量误差对定位的影响,利用距离测量误差取代磁场测量误差,观察相对定位误差随距离测量误差的变化。引入噪声因子nf∈[0,1]反映距离测量噪声方差大小,包含测量误差的距离估计可表示为
称取0.25 g冷冻干燥后的土壤样品,采用MOBIO公司生产的土壤DNA提取试剂盒(Power-Soil DNA Isolation Kit,美国),按试剂盒说明书进行土壤总DNA提取。提取后的DNA经 1.0%的琼脂糖凝胶电泳检测,并用微量分光光度计(ND-1000,NanoDrop Technologies,美国)测定其浓度和纯度。提取后的DNA 样品保存于-20℃。
1.5 荧光定量PCR
本试验选用细菌和古菌的16S rRNA基因、真菌18S rRNA基因和固氮微生物nifH基因进行定量分析。质粒及标准曲线的制作参照文献[17]进行。以10倍梯度将获得的质粒进行梯度稀释,得到10-2~10-76个梯度备用。反应在实时定量PCR 仪CFX96TMReal-Time System (Bio-Rad,美国)上进行,反应体系组成如下:2 × 预混反应液SYBR Premix Ex Taq 10 μl(TaKaRa,日本),10 μmolL-1上游和下游引物各0.5 μl,模板DNA1.0 μl,无菌双蒸水8 μl。标准曲线及每个样品3次重复,同时设置空白。荧光定量PCR反应所用的引物和反应条件见表1。
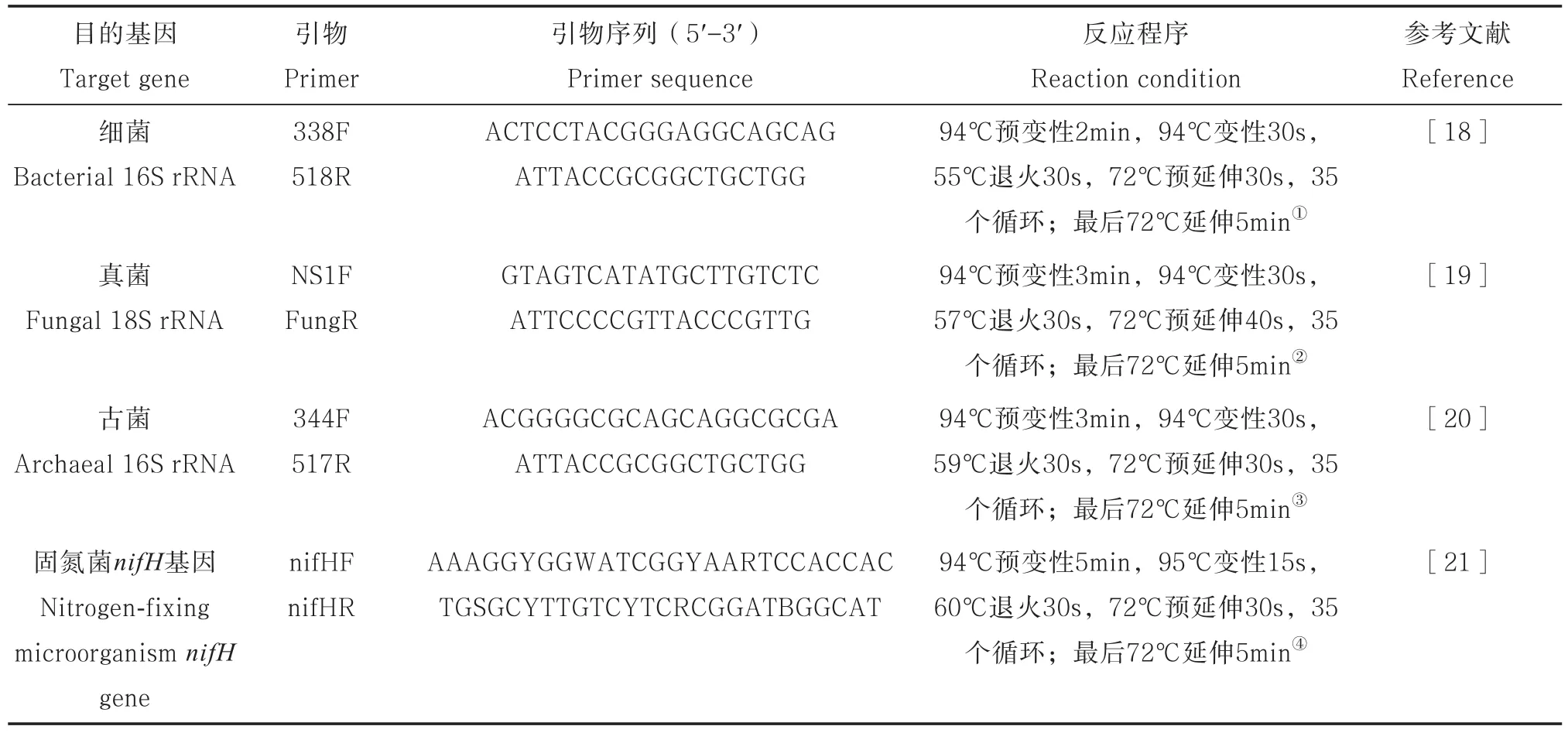
表1 定量PCR扩增引物和反应条件Table 1 Primers for quantitative real time PCR and reaction conditions
1.6 土壤酶活性测定方法
土壤酶活性分析采用微孔板荧光法,其原理为利用底物与酶水解释放4-甲基伞形酮酰(4-MUB)或7-氨基-4-甲基香豆素(MUC)进行荧光检测,通过荧光强度的变化反映酶活性。选取的6种胞外酶分别为:β-葡萄糖苷酶(3.2.1.21,4-MUB-β-D-葡萄糖苷)、纤维二糖水解酶(3.2.1.91,4-MUB-纤维二糖苷)、木糖苷酶(3.2.1.37,4-MUB-β-D-木糖苷)、β-N-乙酰基氨基葡萄糖苷酶(3.2.1.30,4-MUB-β-D-乙酰基氨基葡萄糖苷)、酸性磷酸酶(3.1.3.2,4-MUB-磷酸酯)和亮氨酸氨基肽酶(3.4.11.1,L-亮氨酸-7-氨基-4-甲基香豆素盐酸)。括号中的文字分别表示酶学委员会编码和底物。微孔板荧光法分析参考文献[22],并作了少量修改:称取2 g冷冻干燥后的土壤样品加入盛有40 ml 50 mmol L-1醋酸缓冲液(pH 5.0)的100 ml离心管中,置于摇床上25℃,200 r min-1震荡 20 min,使土壤样品充分破碎。用60 ml的50 mmol L-1醋酸缓冲液少量多次地将土壤悬液全部洗入1 L的烧杯中,制成土壤均质悬浊液。试验每个样品测定3次重复,同时设置不加标准物质的对照。用多功能酶标仪(SynergyTMH1,Biotek,美国)在荧光激发光365 nm和检测光波长450 nm下测定反应液荧光值。根据标准曲线浓度梯度,本试验所有样品的标准曲线R2值均大于0.98。
1.7 数据处理
试验数据使用SPSS 18.0(IBM Co.,Armonk,NY,美国)进行统计分析,采用单因素方差分析(one-way ANOVA)和邓肯(Duncan)法多重比较检验各处理间的差异显著性(p< 0.05)。相关性分析采用皮尔逊(Pearson)相关分析法进行双尾检验确定显著性。
2 结 果
2.1 生物质炭对土壤化学性质和黑麦草生物量的影响
如表2所示,与对照土壤相比,添加2% (C1)生物质炭的土壤,pH、有机碳(SOC)、全氮(TN)、碳氮比(C/N)和速效钾分别提高了9%、45%、19%、20%和104%(均达显著水平);添加4%(C2)生物质炭的土壤,上述指标分别提高了13%、99%、32%、50%和187%;但2%和4%生物质炭处理下碱解氮分别减少了17%和18%,而对有效磷含量无影响。添加低量生物质炭对黑麦草生物量无影响,而添加高量生物质炭(4%),黑麦草生物量提高了68%。
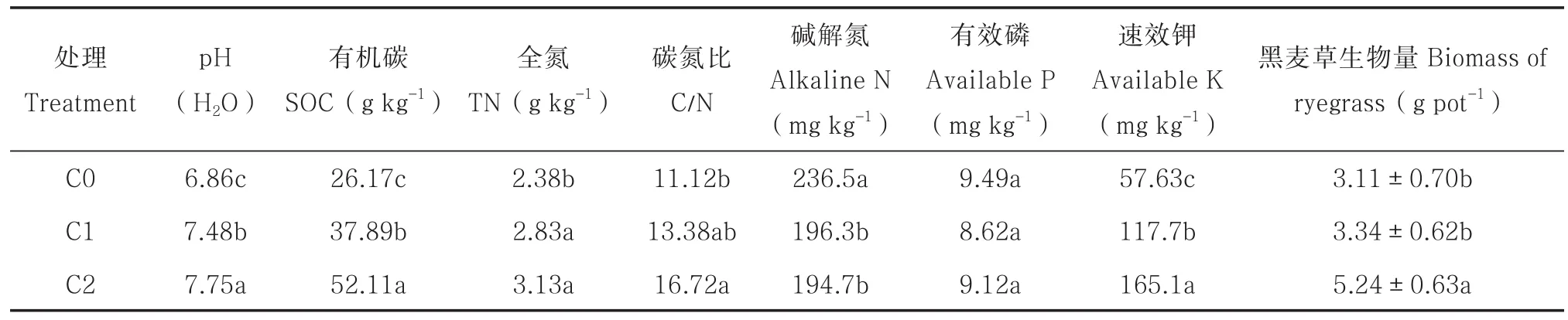
表2 培养结束后不同处理的土壤性质和黑麦草生物量Table 2 Properties of the soils after incubation relative to treatment and biomass of ryegrass
2.2 生物质炭对土壤微生物丰度的影响
与对照相比,C1处理使细菌、古菌和固氮菌基因丰度分别提高了30%、36%和72%,而对真菌基因丰度无影响(图1);C2处理使上述指标分别提高了50%、83%和116%。生物质炭处理显著降低了真菌/细菌比(F/B),提高了古菌/细菌比(A/B)。C2处理对细菌、古菌和固氮菌基因丰度的影响较C1更大。
2.3 生物质炭对土壤酶活性的影响
由图2可知,C1处理下β-葡萄糖苷酶、纤维二糖水解酶、木糖苷酶、β-N-乙酰基氨基葡萄糖苷酶和酸性磷酸酶的活性分别较对照提高了25%、118%、123%、112%和14%。C2处理下上述指标分别较对照提高了61%、215%、148%、114%和20%。生物质炭处理对亮氨酸氨基肽酶无影响。C2处理下的β-葡萄糖苷酶和纤维二糖水解酶活性显著高于C1,而其他酶活性在C1和C2处理之间均无显著差异。
2.4 微生物丰度与土壤化学性质、酶活性间的相关性
依据变量之间的内在联系,选择性地提取了若干变量进行了相关性分析。土壤微生物丰度与土壤化学性质(pH、SOC、TN和C/N)及6种酶活性的相关性表明,细菌和固氮菌丰度均与pH、SOC、TN、C/N、β-葡萄糖苷酶、纤维二糖水解酶、木糖苷酶、β-N-乙酰基氨基葡萄糖苷酶和酸性磷酸酶呈显著正相关,而与亮氨酸氨基肽酶无相关性(表3)。古菌除了与木糖苷酶和亮氨酸氨基肽酶无相关性外,其余相关性均与细菌一致。真菌丰度与土壤化学性质和所测酶均无相关性。
3 讨 论

图1 生物质炭添加处理下土壤微生物丰度Fig. 1 Soil microbial abundances relative to treatment of biochar addition
本试验结果表明,高用量(4%)的小麦秸秆生物质炭添加至太湖地区农田土壤中可以显著提高黑麦草生物量,与Zhang等[23]报道的田间试验下生物质炭提高该地区水稻产量相一致。无疑,黑麦草生物量提高与土壤pH、有机碳、全氮和速效钾含量提高有密切关系。如前所述,特别是在酸性土壤中,pH的提高可以直接促进P、K、Mg和Ca等养分的生物有效性,降低活性铝和重金属元素对植物生长的抑制作用[7]。尽管本研究所用土壤为中性土,生物质炭添加仍然提高了土壤pH 0.62~0.89个单位,土壤有机碳和全氮含量也得到了成倍提高。这主要是因为本研究所用生物质炭具有较高的pH(10.4)、有机碳、全氮和灰分含量,与土壤充分混匀后能短期内迅速中和土壤酸性物质,提高土壤pH和碳氮含量。生物质炭添加显著提高了土壤速效钾含量,与黄超等[7]和李松昊等[24]报道的结果相似。显然,速效钾含量的提高对促进植物光合作用、多糖合成和增加植物抗逆性等均有积极作用。碱解氮含量降低可能与生物质炭具有较强的有机物和矿质态氮吸附能力有关[25]。Taghizadeh-Toosi等[25]研究表明,生物质炭能吸附土壤中的铵态氮和硝态氮,且吸附的这些氮素是生物可利用的。低用量(2%)的生物质炭添加未显著提高黑麦草生物量,可能是因为生物质炭对土壤养分等的改善作用还不够充分。
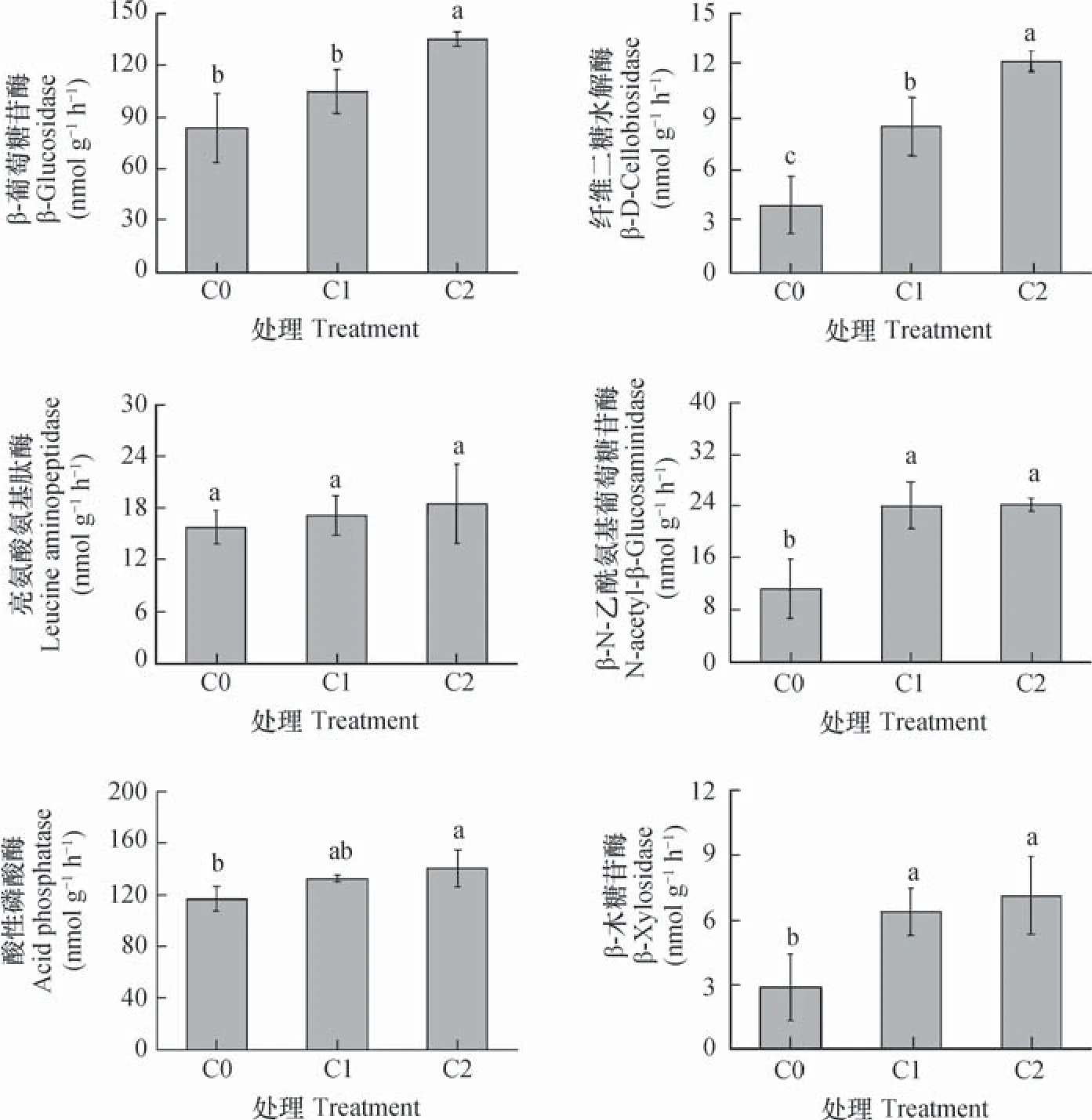
图2 生物质炭添加处理下的土壤酶活性Fig. 2 Soil enzyme activities relative to treatment of biochar addition

表3 微生物丰度与土壤化学性质、酶活性的相关性Table 3 Correlations between soil microbial abundances,soil properties and enzyme activities
土壤养分含量和生物有效性提高对促进植物生长有着重要作用。保持土壤具有较高的养分水平有赖于微生物和土壤酶介导的有机质矿化过程,在土壤环境适宜的条件下,土壤微生物群落数量、活性和土壤酶功能的提高可以调控养分转化和释放,促进有机质矿质化。本研究表明,生物质炭添加可以不同程度地提高细菌和古菌丰度,与Chen等[17]报道的生物质炭施用提高稻田土壤细菌16S rRNA基因丰度较为一致。细菌在土壤中数量最大,类群最多,参与土壤有机质转化和养分循环等多种重要功能。古菌也是土壤中一类重要的类群,且其数量和活性受土壤可利用有机质影响[26]。生物质炭对土壤细菌丰度的提高可能与土壤微生物可利用碳增加有关,生物质炭为土壤微生物的繁殖创造了有利的生境[27]。Luo等[27]运用13C稳定同位素技术表明草本植物生物质炭较大一部分可以作为底物被微生物利用,从而促进微生物生长。生物质炭巨大比表面积和多孔特性有利于减少微生物被天敌(如食细菌线虫)捕食的机会,为土壤微生物生存提供了充足的水分和养分[28]。因此,生物质炭添加所营造的优良微环境,有利于细菌和古菌丰度的提高,从而促进土壤有机质和生物质炭矿化、养分释放,促进植物生长。本研究中细菌和古菌丰度与土壤有机碳和全氮均呈显著正相关,也说明土壤细菌和古菌与土壤养分之间具有密切联系。添加生物质炭未改变真菌群落丰度,降低了真菌/细菌比,这可能由于真菌具有较大的土壤pH变异耐性,能适应较大的酸碱变化范围[17]。固氮菌通过自身固氮酶系统将空气中的氮气转化为氨,对土壤生物固氮具有重要贡献,也是农田土壤中重要的功能微生物类群[29]。本研究结果与宋延静等[14]报道的添加生物质炭显著促进滨海盐碱土固氮菌丰度较为一致。固氮菌丰度的显著提高暗示着土壤生物固氮作用的增强,可能是生物质炭极高的C/N和土壤中较低的碱解氮含量促进了土壤依靠固氮菌来补偿氮素供应的不足。因此,作为土壤中物质转化和养分循环的核心驱动力,土壤微生物在生物质炭的促进作用下,对增进土壤养分转化和物质循环具有积极意义。
土壤酶源于植物、动物和微生物及其分泌物,但主要来源于微生物,一定程度上反映了微生物的活性及其在土壤养分循环过程中的作用[30]。本研究土壤微生物丰度与多数土壤酶活性具有较好的正相关性印证了两者之间的联系。多数研究发现,土壤酶活性与作物产量具有密切的相关性,是衡量土壤生产力的良好指标[31]。本研究中所检测的6种酶与土壤C、N、P循环密切相关,其活性随着生物质炭添加量的提高而提高(除了亮氨酸氨基肽酶),表明生物质炭促进了有机质的矿化和养分转化的周转速率。因此,生物质炭提高土壤相关酶活性可能是促进黑麦草生长的另一个重要因素。尽管如此,生物质炭添加对酶活性影响变异较大,既可增加也可抑制相关土壤酶活性。Wang等[32]通过微孔板荧光法发现低浓度(0.5%质量比)的生物质炭添加量可以促进β-葡萄糖苷酶、α-葡萄糖苷酶和纤维二糖水解酶活性,而高浓度(2.5%和5%质量比)反而抑制其活性。尚杰等[15]发现低用量生物质炭可以提高蔗糖酶、脲酶和碱性磷酸酶等活性,促进糜子产量,而高用量生物质炭却降低了其活性。Chen等[17]研究发现秸秆生物质炭可以提高土壤脱氢酶和碱性磷酸酶活性,但降低了β-葡萄糖苷酶活性。Bailey等[33]认为酶活性变异取决于生物质炭的孔隙结构和活性表面对酶和底物的吸附能力,并受土壤和生物质炭颗粒类型影响,酶活性测定方法差异也会导致截然不同的结果。因此,在以后的研究中有必要综合考虑生物质炭特征、土壤类型和测定方法,开展更多此类研究。
4 结 论
盆栽实验中,短期的小麦秸秆生物质炭添加提高了黑麦草生物量,主要归因于生物质炭改善了土壤养分水平,并显著增加了细菌、古菌和固氮菌等土壤主要类群功能菌的丰度,增强了与土壤C、N 和P转化相关的酶活性。然而,这种改善效果的持续性和土壤微生物变化的机制还不明确,在开展大规模生物质炭农田施用之前迫切需要开展更多长期定位试验。
致 谢感谢浙江农林大学动物与科技学院杨梦华教授和南京农业大学农业资源与生态环境研究所李子川博士生对微孔板荧光分析法的技术指导。
[1]潘根兴,陆海飞,李恋卿,等. 土壤碳固定与生物活性:面向可持续土壤管理的新前沿. 地球科学进展,2015,30(8):940—951
Pan G X,Lu H F,Li L Q,et al. Soil carbon sequestration with bioactivity:A new emerging frontier forsustainable soil management(In Chinese). Advances in Earth Science,2015,30(8):940—951
[2]Sohi S P. Carbon storage with benefits. Science,2012,338(6110):1034—1035
[3]Kimetu J M,Lehmann J. Stability and stabilisation of biochar and green manure in soil with different organic carbon contents. Australian Journal of Soil Research,2010,48(7):577—585
[4]俞映倞,薛利红,杨林章,等. 生物炭添加对酸化土壤中小白菜氮素利用的影响. 土壤学报,2015,52 (4):759—767
Yu Y L,Xue L H,Yang L Z,et al. Effect of biochar application on pakchoi(Brassica chinensis L.)utilizing nitrogen in acid soil(In Chinese). Acta Pedologica Sinica,2015,52(4):759—767
[5]Major J,Rondon M,Molina D,et al. Maize yield and nutrition during 4 years after biochar application to a Colombian savanna oxisol. Plant and Soil,2010,333 (1):117—128
[6]van Zwieten L,Kimber S,Morris S,et al. Effects of biochar from slow pyrolysis of papermill waste on agronomic performance and soil fertility. Plant and Soil,2010,327(1):235—246
[7]黄超,刘丽君,章明奎. 生物质炭对红壤性质和黑麦草生长的影响. 浙江大学学报(农业与生命科学版),2011,37(4):439—445
Huang C,Liu L J,Zhang M K. Effects of biochar on properties of red soil and ryegrass growth(In Chinese). Journal of Zhejiang University(Agriculture&Life Science),2011,37(4):439—445
[8]刘园,Khan M J,靳海洋,等. 秸秆生物炭对潮土作物产量和土壤性状的影响. 土壤学报,2015,52(4):849—858
Liu Y,Khan M J,Jin H Y,et al. Effects of successive application of rice crop-straw biochar on crop yield and soil properties in Cambosols(In Chinese).Acta Pedologica Sinica,2015,52(4):849—858
[9]Liu X,Zhang A,Ji C,et al. Biochar’s effect on crop productivity and the dependence on experimental conditions—Ameta-analysis of literature data. Plant and Soil,2013,373(1):583—594
[10]林先贵,胡君利. 土壤微生物多样性的科学内涵及其生态服务功能. 土壤学报,2008,45(5):892—900
Lin X G,Hu J L. Science connotation and ecological service function of soil microbial diversity(In Chinese). Acta Pedologica Sinica,2008,45(5):892—900
[11]Blackwell P,Krull E,Butler G,et al. Effect of banded biochar on dryland wheat production and fertiliser use in south-western Australia:An agronomic and economic perspective. Australian Journal of Soil Research,2010,48(7):531—545
[12]Graber E R,Harel Y M,Kolton M,et al. Biochar impact on development and productivity of pepper and tomato grown in fertigated soilless media. Plant and Soil,2010,337(1):481—496
[13]李明,李忠佩,刘明,等. 不同秸秆生物炭对红壤性水稻土养分及微生物群落结构的影响. 中国农业科学,2015,48(7):1361—1369
Li M,Li Z P,Liu M,et al. Effects of different straw biochar on nutrient and microbial community structure of a red paddy soil(In Chinese). Scientia Agricultura Sinica,2015,48(7):1361—1369
[14]宋延静,张晓黎,龚骏. 添加生物质炭对滨海盐碱土固氮菌丰度及群落结构的影响. 生态学杂志,2014,33 (8):2168—2175
Song Y J,Zhang X L,Gong J. Effects of biochar amendment on the abundance and community structure of nitrogen-fixing microbes in a coastal alkaline soil (In Chinese).Chinese Journal of Ecology,2014,33 (8):2168—2175
[15]尚杰,耿增超,王月玲,等. 施用生物炭对塿土微生物量碳、氮及酶活性的影响. 中国农业科学,2016,49 (6):1142—1151
Shang J,Geng Z C,Wang Y L,et al. Effect of biochar amendment on soil microbial biomass carbon and nitrogen and enzyme activity in tier soils(In Chinese). Scientia Agricultura Sinica,2016,49(6):1142—1151
[16]鲁如坤. 土壤农业化学分析方法. 北京:中国农业科技出版社,2000
Lu R K. Analytical methods for soil and agro-chemistry (In Chinese). Beijing:China Agricultural Science and Technology Press,2000
[17]Chen J,Liu X,Zheng J,et al. Biochar soil amendment increased bacterial but decreased fungal gene abundance with shifts in community structure in a slightly acid rice paddy from southwest China. Applied Soil Ecology,2013,71:33—44
[18]Fierer N,Jackson J A,Vilgalys R,et al. Assessment of soil microbial community structure by use of taxon-specific quantitative PCR assays. Applied and Environmental Microbiology,2005,71(7):4117—4120
[19]May L A,Smiley B,Schmidt M G. Comparative denaturing gradient gel electrophoresis analysis of fungal communities associated with whole plant corn silage. Canadian Journal of Microbiology,2001,47 (9):829—841
[20]Bano N,Ruffin S,Ransom B,et al. Phylogenetic composition of arctic ocean archaeal assemblages and comparison with Antarctic assemblages. Applied and Environmental Microbiology,2004,70(2):781—789
[21]Reardon C L,Gollany H T,Wuest S B. Diazotroph community structure and abundance in wheatfallow and wheat-pea crop rotations. Soil Biology & Biochemistry,2014,69:406—412
[22]Bell C W,Fricks B E,Rocca J D,et al. Highthroughput fluorometric measurement of potential soil extracellular enzyme activities. Journal of Visualized Experiments,2013(81):e50961
[23]Zhang A,Cui L,Pan G,et al. Effect of biochar amendment on yield and methane and nitrous oxide emissions from a rice paddy from Tai Lake Plain,China. Agriculture,Ecosystems & Environment,2010,139(4):469—475
[24]李松昊,何冬华,沈秋兰,等. 竹炭对三叶草生长及土壤细菌群落的影响. 应用生态学报,2014,25(8):2334—2340
Li S H,He D H,Shen Q L,et al. Effects of bamboocharcoal on the growth of Trifolium repens and soil bacterial communitystructure(In Chinese). Chinese Journal of Applied Ecology,2014,25(8):2334—2340
[25]Taghizadeh-Toosi A,Clough T,Sherlock R,et al. Biochar adsorbed ammonia is bioavailable. Plant and Soil,2012,350(1):57—69
[26]Marschner P,Kandeler E,Marschner B. Structure and function of the soil microbial community in a long-term fertilizer experiment. Soil Biology & Biochemistry,2003,35(3):453—461
[27]Luo Y,Durenkamp M,De Nobili M,et al. Microbial biomass growth,following incorporation of biochars produced at 350℃ or 700℃,in a silty-clay loam soil of high and low pH. Soil Biology & Biochemistry,2013,57:513—523
[28]Lehmann J,Rillig M C,Thies J,et al. Biochar effects on soil biota-Areview. Soil Biology & Biochemistry,2011,43(9):1812—1836
[29]Ueda T,Suga Y,Yahiro N,et al. Remarkable N2-fixing bacterial diversity detected in rice roots by molecular evolutionary analysis of nifH gene sequences. Journal of Bacteriology,1995,177(5):1414—1417
[30]Burns R G,DeForest J L,Marxsen J,et al. Soil enzymes in a changing environment:Current knowledge and future directions. Soil Biology & Biochemistry,2013,58:216—234
[31]Edmeades D C. The long-term effects of manures and fertilisers on soil productivity and quality:A review. Nutrient Cycling in Agroecosystems,2003,66(2):165—180
[32]Wang X,Song D,Liang G,et al. Maize biochar addition rate influences soil enzyme activity and microbial community composition in a fluvo-aquic soil. Applied Soil Ecology,2015,96:265—272
[33]Bailey V L,Fansler S J,Smith J L,et al. Reconciling apparent variability in effects of biochar amendment on soil enzyme activities by assay optimization. Soil Biology & Biochemistry,2011,43(2):296—301
Effect of Biochar Addition on Ryegrass Growth in a Pot Experiment and Its Mechanism
WU Tao FENG Gelin ZENG Zhen CHEN Junhui†XU Qiufang LIANG Chenfei
(Zhejiang Provincial Key Laboratory of Carbon Cycling in Forest Ecosystems and Carbon Sequestration,School of Environmental and Resources,Zhejiang Agriculture and Forestry University,Lin’an,Zhejiang 311300,China)
【Objective】Biochar amendment to soil has recently been considered as a promising strategy to improve soil carbon sequestration and soil fertility. The aim of this work was to investigate effect of biochar on plant growth and its potential mechanism behind,so as to provide a theoretical reference for the use of biochar as a soil amendment in agricultural soils to improve soil fertility and enhance soil carbon sequestration. 【Method】For this study a pot experiment was performed to investigate changes in ryegrass growth,soil microbial community abundance and soil enzyme activities involved in C,N and P recycling as affected by biochar addition. The biochar used in the pot experiment was prepared out of wheat straw through pyrolysis at 350~550℃ with limited oxygen,and the soil in the pots was collected from farmlands in the Tai Lake Region. Biochar was amended into the pots,separately,at a rate of 0% for Treatment C0 or control(biochar / soil in weight),2% for Treatment C1(low rate)and 4% for Treatment C2(high rate)and each treatment had 3 replicates. Ryegrass(Loliump erenne)was planted in each pot and let grow for 90 days. At the end of the period of growth,ryegrass was analyzed for biomass and soils for properties,microbial community abundances and soil enzyme activities with the quantitative real-time PCR and microplate fluorimetric assay,respectively. 【Result】Results show that biochar at a low rate did not increase ryegrass biomass,but at a high rate it did significantly or by 68%. Biochar addition,low and high significantly increased soil pH,soil organic carbon(SOC),total nitrogen(TN),C/N ratio and available K content by 9%,45% ,19%,20%,and 104% and by 13%,99%,32%,50%,and 187%,respectively,as compared with the control,whereas it decreased available N content by 17% and 18%,respectively.Besides,biochar addition,low and high also increased bacterial and archaeal 16S rRNAand nifH gene copies by 30%,36%,and 72%,and by 50%,83%,and 116%,respectively,and also significantly increased β-glucosidase(BG),β-D-cellobiosidase(CB),β-xylosidase(XYL),N-acetyl-β-glucosaminidase(NAG)andphosphatase (PHOS)by 25%,118%,123%,112% and 14%,andby 61%,215%,148%,114%,and 20%,respectively,but had no effect on leucine aminopeptidase. In most cases,no significant differences were observed in chemical and biological properties between the treatments high and low in addition rate. Correlation analysis demonstrates that abundances of all soil microbes(except for fungi)were positively related to pH,SOC,TN,C/N and activities of most soil enzyme(except for leucine aminopeptidase). 【Conclusion】In summary,all the findings in this study suggest that biochar addition can improve soil fertility,key microbial communities in abundances and enzymes in activity,which may be the major causes of biochar enhancing soil nutrient transformation functions and plant productivity.
Biochar;Quantitative PCR;Soil enzyme;Microplate fluorimetric assay;Soil microorganisms
S154
A
10.11766/trxb201606030204
(责任编辑:陈荣府)
* 国家自然科学基金项目(41401318)、浙江农林大学学生科研训练项目(112-2013200018)和浙江农林大学环境与资源学院大学生科研训练项目(20150117)资助 Supported by the National Natural Science Foundation of China(No. 41401318),Students Research Trainingsof Zhejiang A&F University(No. 112-2013200018)and of School of Environmental and Resource Sciences of Zhejiang A&F University(No. 20150117)
† 通讯作者 Corresponding author,E-mail:junhui5@126.com
吴 涛(1997—),男,安徽歙县人,农业资源与环境专业。E-mail:17816897546@163.com
2016-06-03;
2016-09-28;优先数字出版日期(www.cnki.net):2016-10-27
