星点设计-响应面法优化布地奈德缓释片处方
2017-04-19任远志刘秀洁周劲松重庆医科大学药剂学研究室重庆400016福安药业集团重庆礼邦药物开发有限公司重庆40111
任远志,张 涛,黄 华,刘秀洁,周劲松(1.重庆医科大学药剂学研究室,重庆 400016;.福安药业集团重庆礼邦药物开发有限公司,重庆 40111)
星点设计-响应面法优化布地奈德缓释片处方
任远志1*,张 涛2,黄 华1#,刘秀洁2,周劲松2(1.重庆医科大学药剂学研究室,重庆 400016;2.福安药业集团重庆礼邦药物开发有限公司,重庆 401121)
目的:优化布地奈德缓释片处方。方法:以2、4、8 h的累积释放度为考察指标,采用星点设计-响应面法优化布地奈德缓释片处方中羟丙基纤维素L(HPC-L)用量、大豆磷脂用量、填充剂(固定总量200 mg)乳糖-微晶纤维素质量比,并进行验证。比较所制缓释片与原研制剂在pH 7.2、7.0、6.8的磷酸盐缓冲液中的释药行为。结果:最优处方为布地奈德9 mg、HPC-L 46.49 mg、大豆磷脂9.23 mg、填充剂乳糖-微晶纤维素质量比为1∶2.9;所制缓释片在2、4、8 h的累积释放度分别为21.9%、50.1%、99.5%,与预测值(22.0%、50.0%、98.5%)的相对误差分别为0.45%、0.20%、1.02%(n=3),与原研制剂的累积释放度比较相似因子f2均大于50。结论:成功制得布地奈德缓释片,其释药行为与原研制剂相似。
布地奈德;缓释片;星点设计-响应面法;处方筛选
溃疡性结肠炎(Ulcerative colitis,UC)是一种发病原因及致病机制至今尚未明确的慢性炎症性疾病,其发病率和患病率都呈明显增加趋势,尤其是在发展中国家,严重影响了人们的生活质量[1]。布地奈德缓释片作为一种新型糖皮质激素,由意大利Santarus公司开发,2013年首次在美国批准上市,用于轻、中度活动性溃疡性结肠炎的缓解治疗,疗效和安全性均较好[2]。但是此类新型制剂价格昂贵,临床应用受限,若能成功开发原研制剂的可替代品,不失为一种治疗UC的新选择。原研专利采用了热熔挤出技术[3],本实验直接采用湿法制粒,并对处方进行了优化,优化后的处方与原研制剂进行了体外一致性评价,以期为产品的后续开发奠定基础。
1 材料
1.1 仪器
YD-35智能片剂硬度仪和RC12A溶出试验仪(天津市天大天发科技有限公司);Mini G湿法混合制粒机(深圳市信宜特科技有限公司)。
1.2 药品与试剂
布地奈德缓释片(原研制剂,意大利Santarus公司,批号:417615,规格:每片9 mg);布地奈德原料药(湖北葛店人福药业有限责任公司,批号:BD151101,纯度:99.4%);微晶纤维素、硬脂酸镁、二氧化硅(安徽山河药用辅料股份有限公司,批号:140707、150101、150211);甲基丙烯酸共聚物A型(尤特奇L100)、B型(尤特奇S100)(上海昌为医药辅料技术有限公司,批号:B140403001、B140705004);大豆磷脂(上海太伟药业有限公司,批号:20150403);柠檬酸三乙酯(蚌埠丰原涂山制药有限公司,批号:140731);二氧化钛(湖南九典制药有限公司,批号:F24150701);羟丙基纤维素L(HPC-L)、羟丙基纤维素M(HPC-M)(日本曹达株式会社,批号:NCG-2911、NCH-0801);其余试剂均为分析纯。
2 方法与结果
2.1 布地奈德缓释片的制备
2.1.1 片芯的制备 将处方量的布地奈德、硬脂酸镁(过80目筛)、微晶纤维素,内加HPC-M与乳糖混合均匀,加入湿法制粒机中;将大豆磷脂加入适量乙醇中溶解,加入到湿法制粒机中,再加适量纯化水制软材,制粒,干燥,整粒;外加HPC-L、二氧化硅、硬脂酸镁,混匀,压片。
2.1.2 肠溶包衣片的制备 将尤特奇L100和尤特奇S100溶于乙醇中,加入处方量柠檬酸三乙酯,搅拌均匀,再加入二氧化钛和滑石粉搅拌均匀后过80目筛,即得肠溶包衣液。采用高效包衣机以此肠溶包衣液对“2.1.1”项下制备的片芯进行包衣,制得布地奈德缓释片。
2.2 布地奈德的含量测定
2.2.1 色谱条件 色谱柱:Thermo ODS C18(150 mm× 4.6 mm,3.0 μm);流动相:乙腈-pH 3.2磷酸盐缓冲液(37∶63);流速:1.0 mL/min;柱温:30℃;检测波长:240 nm;进样量:20 μL。
2.2.2 方法学考察 按方法学相关方法进行考察时发现,由于布地奈德为异构体,10 min后色谱出现双峰,辅料对其测定无干扰。布地奈德峰面积(A)与质量浓度(c)的回归方程为A=40 217.65c+1 952.34(r=0.999 9),检测质量浓度的线性范围为1.812~9.060 μg/mL;精密度的RSD为0.09%(n=6);高、中、低水平布地奈德溶液的回收率分别为100.74%、99.65%、100.16%(RSD=0.32%、0.13%、0.40%,n=3);稳定性的RSD为1.21%(n=7)。色谱图见图1。

图1 高效液相色谱图Fig 1 HPLC chromatograms
2.3 释放度的测定
参照2015年版《中国药典》(四部)肠溶制剂释放度测定方法[4]进行释放度测定。
2.3.1 酸性介质 为了证明本品在胃中没有释放、肠溶衣膜完整,本试验以500 mL含5%鲸蜡硬脂醇聚氧乙烯醚的pH 1.0的盐酸溶液为释放介质,转速为100 r/min,温度为(37±0.5)℃。于2 h取样5 mL,过滤,弃去初滤液,取续滤液注入液相色谱仪,检测释放度。
2.3.2 中性、弱碱性介质 在“2.3.1”项下试验基础上,将酸性介质更换掉,以1 000 mL含5%鲸蜡硬脂醇聚氧乙烯醚的pH 7.2、7.0、6.8的磷酸盐缓冲液为释放介质,转速为100 r/min,温度为(37±0.5)℃。分别于2、4、8 h取样5 mL(同时补加等量释放介质),过滤,弃去初滤液,取续滤液注入液相色谱仪,检测释放度。
2.4 处方优化
前期单因素试验结果表明,缓释基质HPC-L、大豆磷脂、填充剂(乳糖-微晶纤维素质量比)为影响释放度的主要因素。本文采用星点设计-响应面法,以HPC-L用量(X1)、大豆磷脂用量(X2)以及填充剂(固定总量200 mg)乳糖-微晶纤维素质量比(X3)为因素,设定其范围分别为X1:36~61 mg,X2:5~15 mg,X3:1∶4~1∶2,制备规格为9 mg的布地奈德缓释片。根据星点设计原理,各因素设置5个水平,用代码值±α、±1、0来表示。对于3因素的星点设计α=1.682,以中性、弱碱性介质中2、4、8 h的累积释放度(Q2h、Q4h、Q8h)为指标进行处方优化。星点设计因素与水平见表1,设计与结果见表2。
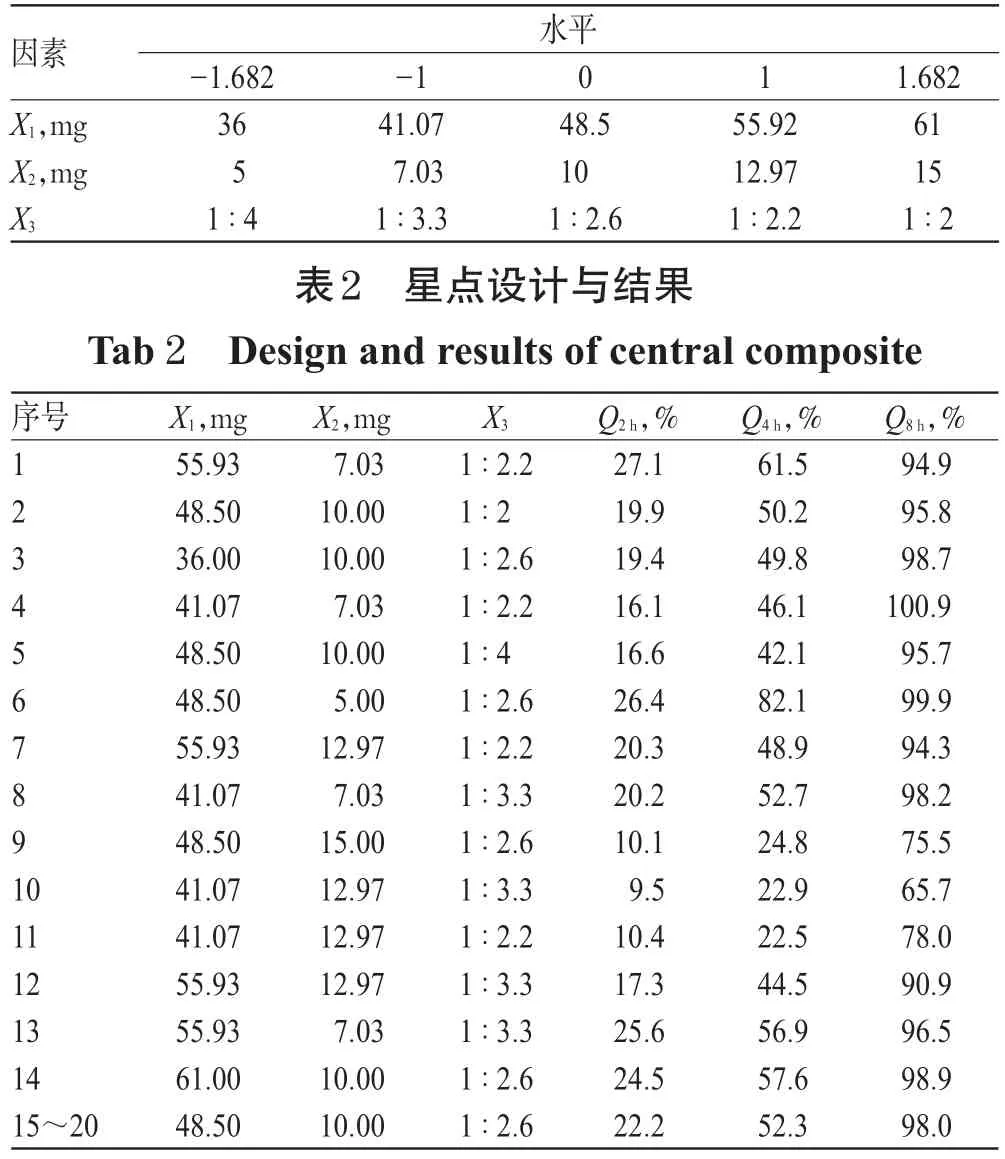
表1 星点设计因素与水平Tab 1 Factors and levels of central composite design
2.4.1 模型拟合 根据表2结果,采用Design-Expert 8.0统计软件,分别以Q2h、Q4h、Q8h为指标对各因素进行线性、交互项和二项式回归分析。根据相关系数R2尽可能大和P尽可能小作为判定标准[5],得最佳拟合模型:Q2h= 22.23+3.12X1-4.31X2+0.5X3+0.16X1X2+0.96X1X3+ 0.81X2X3-0.3X12-1.61X22-1.61X32(R2=0.931 5,P=0.000 1);Q4h=48.82+5.91X1-12.8X2+1.14X3(R2=0.777 3,P<0.000 1);Q8h=98.13+2.5X1-7.52X2+1.24X3+ 6.15X1X2-1.65X1X3+1.83X2X3-0.54X12-4.47X22-1.62X32(R2=0.925 3,P=0.000 2)。模型方差分析结果显示,X3在3个模型中的P值均大于0.05,而X1、X2的P值均小于0.05,表明X1、X2对释放度具有显著影响。
2.4.2 响应面优化 绘制了X1、X2与累积释放度的响应面图(X3设置为中心点),结果见图2。

图2 X1、X2与Q的响应面图Fig 2 Response surface diagrams of X1,X2and Q
根据拟合方程和图2结果,对比前期试验中片芯和缓释片释放度差别,现拟定Q2h、Q4h、Q8h的目标值分别为22.0%、50.0%、90%~100%。绘制X1、X2优化的等高线图见图3。

图3 X1、X2优化的等高线图Fig 3 Contour chart of optimized X1and X2
由图3可知,中间长条带区域为最优区域,由此确定最优处方为布地奈德9 mg,HPC-L用量(X1)为46.49 mg,大豆磷脂用量(X2)为9.23 mg,填充剂(固定总量200 mg)乳糖-微晶纤维素质量比(X3)为1∶2.9。
2.4.3 验证试验 按最优处方制备3批布地奈德缓释片片芯,分别考察其在弱碱性介质(pH 7.2磷酸盐缓冲液)中的释放度,计算相对误差[(预测值-实测平均值)/预测值×100%],结果见表3。

表3 验证试验结果Tab 3 Results of verification test
2.5 布地奈德缓释片的体外释放度测定
按最优处方制备3批布地奈德缓释片片芯后,按“2.1.2”项下方法进行包衣,考察包衣片在酸性介质和中性、弱碱性介质中的释放度,并与原研制剂进行比较。结果发现,自制制剂与原研制剂在酸性介质中的释放度均为0,表明自制制剂抗酸能力好,能够防止药物在胃中释放;二者在中性、弱碱性介质中的释放曲线见图4。

图4 自制制剂与原研制剂在中性、弱碱性介质中的释放曲线Fig 4 Release curves of self-made preparation and original preparation in neutral,weakly alkaline medium
由图4可知,在pH 7.2、7.0、6.8磷酸盐缓冲液中,对自制制剂与原研制剂的Q2h、Q4h、Q8h进行比较,结果相似因子f2分别为71、78、56,均大于50,表明2条曲线具有相似性,由此表明自制制剂与原研制剂具有等效性。
3 讨论
本文通过最常用的湿法制粒技术,对布地奈德缓释片进行处方优化,与原研热熔挤出技术比较,工艺更加简单,常规设备即可满足制备需求。
近年来,药品质量源于设计(Quality by design,QbD)的理念已逐渐被整个工业界所认可并实施[6],因此本文采用数学及统计学于一体的方法对处方优化进行试验设计。常用的试验设计方法有正交设计、均匀设计和星点设计-响应面法[7],前两者虽然试验次数少,但是精密度不够、预测性较差,而析因设计试验次数较多、试验周期较长。综合比较之下,本试验选择了星点设计-响应面法对布地奈德缓释片的处方进行优化,该方法具有精密度高、预测性好、实验次数少的特点。
采用多条释放曲线的自制制剂与原研制剂对比研究,是目前仿制制剂与原研制剂一致性评价的常用方法[8]。本文通过星点设计-响应面法对布地奈德缓释片进行处方优化,并与原研制剂进行3种不同介质中的释放曲线对比研究发现,自制制剂与原研制剂的释放行为相似因子f2均大于50,表明本试验所建立的模型具有较好的预测能力,星点设计-响应面法可较好地运用于该制剂的处方设计。
[1] FDA.Approved drug products label[EB/OL].[2016-05-15].https://www.fda.gov/downloads/Drugs/DevelopmentApprovalProcess/UCM071436.pdf.
[2]R·维拉,M·帕德拉尼,M·阿加尼.控制释放与掩蔽味道的口服药物组合物,意大利:CN1355693[P].2002-06-26.
[3] 陈锋,严常开.治疗溃疡性结肠炎药物的最新进展[J].世界华人消化杂志,2016,24(12):1840-1845.
[4] 国家药典委员会.中华人民共和国药典:四部[S].2015
年版.北京:中国医药科技出版社,2015:通则122-123.
[5] 高凯,钟昌茂,邝少轶.星点设计-效应面法优化复方氯
雷伪麻缓释片的缓释片芯处方[J].中国药房,2014,25(37):3499-3501.
[6] 张小飞,邢传峰,果秋婷.基于质量源于设计(QbD)理念优化穿心莲内酯固体脂质纳米粒[J].中草药,2015,46(2):194-200.
[7] 施昶,沈诗偲,黄海飞,等.星点设计-效应面优化法在处方筛选和优化中的应用[J].机电信息,2014(32):41-46.
[8] 谢沐风.解读“口服固体制剂仿制药一致性评价技术手段:多条溶出曲线”[J].中国医药工业杂志,2013,44(4):411-414.
(编辑:邹丽娟)
Formulation Optimization of Budesonide Sustained-release Tablet by Central Composite Design-response Surface Method
REN Yuanzhi1,ZHANG Tao2,HUANG Hua1,LIU Xiujie2,ZHOU Jingsong2(1.Pharmaceutics Laboratory,Chongqing Medical University,Chongqing 400016,China;2.Chongqing Lybon Pharm-tech Co.,Ltd.,Fuan Pharmaceutical Group,Chongqing 401121,China)
OBJECTIVE:To optimize the formulation of Budesonide sustained-release tablet.METHODS:Using the cumulative releases in 2,4,8 h as investigation indexes,central composite design-response surface method was used to optimize the amount of hydroxypropylcellulose L(HPC-L),amount of soybean phosphatides,and filler(fixed total 200 mg)lactose-microcrystalline cellulose mass ratio in the formulation of Budesonide sustained-release tablet,and the verification test was conducted. The release behaviors of prepared sustained-release tablet and original preparation in pH 7.2,7.0,6.8 phosphate buffer were com-pared.RESULTS:The optimal formulation was as follow as budesonide of 9 mg,HPC-L of 46.49 mg,soybean phosphatides of 9.23 mg,filler lactose-microcrystalline cellulose mass ratio of 1∶2.9;the cumulative releases in 2,4,8 h were 21.9%,50.1%,99.5%,the relative errors with predicted values(22.0%,50.0%,98.5%)were 0.45%,0.20%,1.02%(n=3),respectively. Compared with cumulative release of original preparation,the f2was higher than 50.CONCLUSIONS:Budesonide sustained-release tablet is successfully prepared,which shows similar release behavior to original preparations.
Budesonide;Sustained-release tablet;Central composite design-response surface method;Formulation screening
R944.4;Q577
A
1001-0408(2017)10-1395-04
2016-07-07
2016-09-01)
*硕士研究生。研究方向:药剂学。电话:023-86502492。E-mail:413949346@qq.com
#通信作者:教授。研究方向:药物新剂型与新技术。电话:023-86502492。E-mail:huangh6001@163.com
DOI10.6039/j.issn.1001-0408.2017.10.27
