疫苗中试车间工艺设计分析
2017-04-18杨勇张暴学奇
杨勇 张暴学奇
(中国航空规划设计研究总院有限公司,北京 100120)
疫苗中试车间工艺设计分析
(中国航空规划设计研究总院有限公司,北京 100120)
根据疫苗分类和特点,对疫苗中试车间设计的工艺流程、工艺平面布置、人物流、生物安全等方面进行工艺设计分析。
疫苗;中试车间;工艺设计
用人工免疫方法预防和控制传染病,是人类在同传染病作斗争中所取得的最为突出的成就[1]。近年来,国内外制药公司纷纷大力进行新疫苗的研发,取得了不少成绩。从研发到产业化生产,中间需要进行中试放大研究,摸索参数,积累经验,降低企业产业化生产风险,缩短产品上市周期。
本文将依据长期以来对国内外疫苗工程设计的研究,以及我公司对于疫苗中试已有数个成功的工程化案例的经验,分析疫苗中试车间设计中需要考虑的工艺流程、工艺平面布置、人物流设计、生物安全、通用性和灵活性的要求,对中试车间的设计进行归纳,和大家分享。
1 疫苗的分类和生物安全要求
1.1 疫苗的分类
国内疫苗中试涉及的疫苗从工程设计上通常包括病毒性疫苗、细菌性疫苗、基因工程疫苗等。病毒性疫苗代表的有麻风腮系列疫苗、水痘疫苗、狂犬疫苗、轮状病毒疫苗、流感疫苗、脊髓灰质炎疫苗等;细菌性疫苗代表有百白破系列疫苗、肺炎、卡介苗、多糖疫苗、各种结合疫苗等;基因工程疫苗代表有乙肝疫苗、丙肝疫苗、戊肝疫苗等。
1.2 疫苗的生物安全要求
根据美国国立卫生研究院(NIH)与《微生物学和生物医学实验室的生物安全》(BMBL)定级及我国《人间传染的病原微生物名录》进行分类,上述的疫苗大部分为生物安全二级的,因此其中试车间有毒(菌)功能间设计为生物安全二级,虽然目前规范,如《实验室生物安全手册》(WHO,第三版)对于生物安全二级无论从空调的排风过滤、空气循环、压差等均无特殊要求[2],但是考虑到中试产品不确定性以及中试多产品共厂房等特点,其相应的配套设施需要提高标准进行设计。
2 疫苗中试涉及的工艺流程
2.1 工艺流程
以病毒性灭活疫苗为例,中试研究是指研究者在完成了病毒死疫苗、亚单位疫苗小量工艺研究的基础上,以15 L或3 L转瓶、生物反应器为细胞培养容器对小型实验规模进行50~100倍的中试放大。主要工序由细胞复苏、孵室、细胞操作室、毒种复苏室、病毒罐培养、病毒灭活前纯化、病毒灭活后及精纯等工序组成。
2.2 流程分析
病毒性灭活疫苗的流程从图1中可以看到,病毒性灭活疫苗可以分为无毒的细胞复苏区、有毒的疫苗培养和收获区域、有毒的纯化区域、无毒的灭活后纯化区域和无毒的分装、冻干和包装区域的。病毒性活苗、细菌性疫苗和基因工程疫苗有相应的流程划分,只是有毒(菌)区域在流程中不同阶段而已,处理其操作的单元均可归纳为有毒(菌)操作区、无毒操作区和配套的无毒清洗区等。不同的操作区域设置相应的净化级别功能间。

图1 病毒性灭活疫苗工艺流程Fig. 1 Manufacturing process flow diagram of inactivated vaccine
3 疫苗中试的工艺设计和生物安全控制
3.1 设计理念
WHO 生物安全手册制订了生物安全实验室的相应操作规范,但是实验过程检测的体积很小,而且大部分涉及到开放处理危害介质的工作都是在生物安全柜(BSC)中进行的[2]。
对于疫苗中试车间,生物安全性的危害风险与实验室相比来说要高一些,因为实际处理的体积较大,并非所有的工艺步骤都是在密闭系统或生物安全柜中进行操作的。因此,与二级生物安全实验室相比,生物安全二级的中试车间设施需要额外的保护。设计遵从如下原则:
(1)有毒无毒严格分区;
(2)仅通过气闸进入有毒区;
(3)有毒区和无毒区之间人员的走动须更衣;
(4)有毒间的送风和排风通过高效空气过滤器;
(5)与大气压相比,有毒间禁止超压(有毒间的压差应≤大气压);
(6)各种废弃物的灭活处理(包括废水)。
3.2 工艺平面概念布置
企业对于疫苗中试车间具有多品种的要求以及中试产品的不确定性等。具体工艺布置设计时,采用国际上常用的“模块化”设计模式,即按照工艺流程的特点分成若干生产制作区域[3]。对于疫苗中试车间设计,可以布置为图2的模式,依次并列布置若干的无毒(菌)生产区、有毒(菌)生产区等,各区可以共用清洗辅助区、配液区等。这种设置的各个功能单元都是独立的人、物流控制,独立的空调分区设置,便于灵活运行使用。其内部设备基本都是一次性的或可移动的,固定的设备如发酵罐均可以CIP/SIP等,如果更换中试研究的产品则将不适合的设备推出即可,这种柔性化的设置,极大便利了疫苗产品的中试使用。

图2 中试车间布置Fig. 2 Pilot facility layout philosophy
3.3 工艺人、物流的设置
工艺人、物流设计时,有毒区域设计采用“单向流”的模式,有毒区域的人、物先进入洁净走廊,然后进入生产区。退出时,人通过更衣后从污染走廊退出,物品经过高压后退出至污染走廊。无毒区域的人、物先进入洁净走廊,然后进入生产区,退出时人从洁净走廊退出,物品从污染走廊退出。这样的人、物流流向在工程设计上实现较为简洁,尤其是多个产品模块进行组合建设时至关重要,可以有效防止各模块之间的交叉污染,见图3。
3.4 生物安全的设置
有毒(菌)废气排放处理:有毒区域的空调系统排风均需要加装高效过滤器以防止有毒空气外泄,这种高效可采用袋进袋出的高效过滤器,符合生物安全的要求,保证多产品时不同产品生产的安全。同时为了保证疫苗中试的生物安全和洁净要求,有毒(菌)区域独立设置空调系统[4],并将有毒(菌)的生产区域设置为绝对负压(-15 Pa)的洁净房间,如图4所示,其进出的人物通道均有相应的气锁设置,当然其采用的墙板材料必须具有很好的密封性能,这样既防止有毒区域的空气外泄至其他区域(包括顶棚上)又保证其生产的净化环境要求。
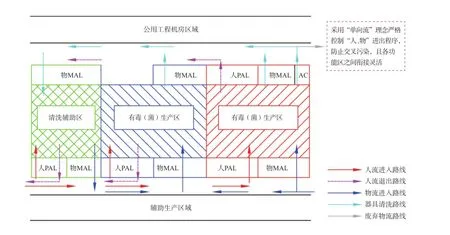
图3 中试车间人、物流Fig. 3 Personnel & Material flow of pilot facility
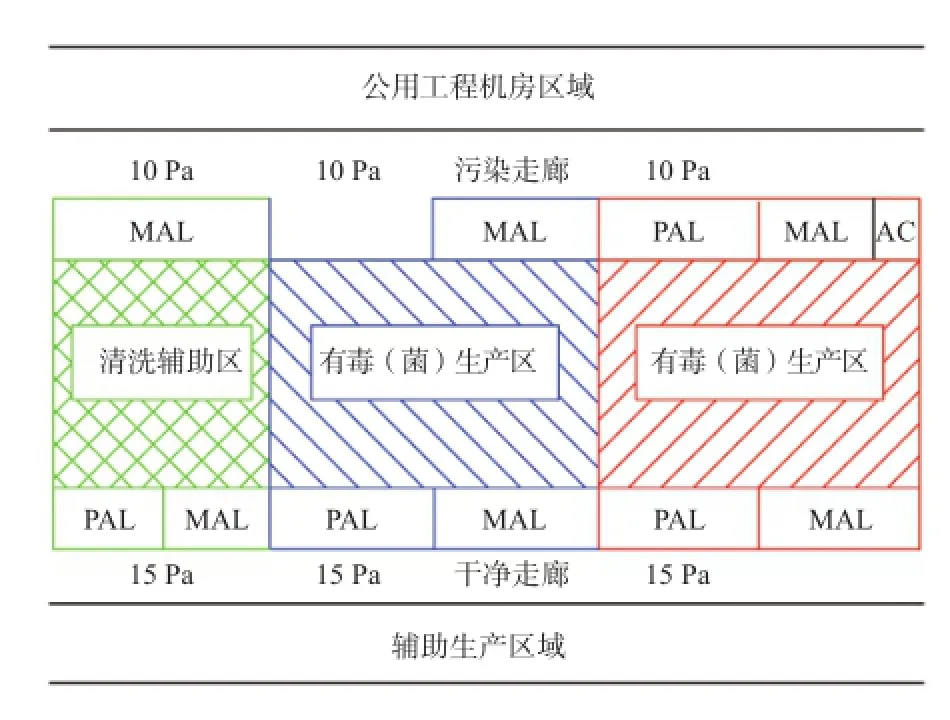
图4 中试车间压差示意图Fig. 4 Pressure cascade concept of pilot facility
有毒(菌)固废、废液处理:有毒(菌)区域产生的固体废弃物和少量液体废弃物,可以通过用高压蒸汽灭菌器灭活的方式进行无害化处理。大量的废液则需要先收集到大罐中,然后进行蒸汽灭活处理。上述方法均符合生物安全控制要求,同时也是国家环保所要求。
3.5 工程案例
图5为我公司按照上述理念设计的某疫苗的中试车间案例,中试车间的布局主要由清洗配液区、若干个疫苗的发酵培养区和疫苗的纯化区组成,各个区在相似的设计理念下可以实现拼接组合,设计流线清晰、生产使用高度灵活。疫苗中试功能间内的设备可以根据疫苗研究需求柔性化配备,并且发酵区设计为C级别的,就是考虑实际中试研究中可能在本车间内研究不同疫苗产品的需求。
4 结束语
(1)疫苗中试车间的“模块化”设计方式,即按照工艺流程的特点分成若干生产制作区域。这种方式既能保证生物安全的要求,又能兼顾中试研究的灵活性。极大节省工程建设的投资。
(2)有毒(菌)区域人、物流采用“单向流”设计方式,可以有效避免有毒(菌)区域的人、物对于其他区域的污染风险。
(3)所有从有毒区出来的物品均需要考虑使用灭活设备处理后离开(除了操作者)[3]。
(4)有毒(菌)区域的空调绝对负压的设置和袋进袋出高效过滤器的采用是实现该生产区域生物安全的保障。
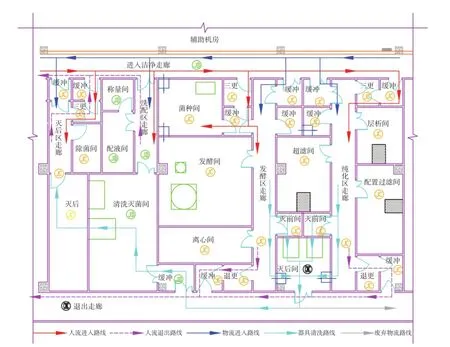
图5 疫苗中试布局Fig. 5 Layout of vaccine pilot facility
[1]徐国章,等.实用免疫预防[M].复旦大学出版社,2006摘要.
[2]实验室生物安全手册(WHO,第三版),9-19,47-64.
[3]Paul Thomas, Living the Biopharma Dream in Lincoln. pharmaceutical Manufacturing, Nov/Dec 2008.
[4]药品生产质量管理规范(2010年修订),附录3[S].
Analysis of Process Design for Vaccine Pilot Facility
Yang Yong, Zhang Yao, Bao Xueqi
(China Aviation Planning and Design Institute (Group) Co., Ltd, Beijing 100120)
Based on the classif i cation and characteristics of vaccine, the process design of vaccine pilot facility, including process procedure, facility layout, biological safety, was analyzed.
vaccine; pilot facility; process design
TQ 460.8
A
2095-817X(2017)01-0029-004
2016-07-25
杨勇(1977—),男,高级工程师,从事医药工程设计工作。
