蝎毒多肽逆转白血病干细胞多药耐药作用的研究
2017-04-18杨向东王兴丽杨文华赵磊颜田赅
杨向东+王兴丽+杨文华+赵磊+颜田赅
[摘要] 该实验采用BALB/c小鼠多药耐药(MDR)白血病模型,观察蝎毒多肽(PESV)对小鼠瘤体MDR白血病干细胞(LSC)P-gp(P-gp)蛋白上游信号的影响,研究PESV逆转白血病干细胞(LSC)多药耐药的效果及机制;同时通过流式细胞术,RT-PCR,Western blot,Elisa法分别检测 P-gp,MDR1 mRNA,PI3-K,NF-κB表达,并通过组织病理学方法检测小鼠肝脏、脾脏等。结果显示,正常对照组小鼠无明显变化,其余6组小鼠均出现弓背、消瘦等表现,肝脏肿大,肝内均出现炎症坏死;PESV下调小鼠瘤块中LSC细胞膜P-gp,PI3K蛋白表达下调;胞浆中MDR1 mRNA表达在PESV低剂量组显著下降,在中、高剂量组出现不同程度的升高;PESV显著降低LSC细胞核内NF-κB因子水平。PESV具有明显下调P-gp上游信号PI3K/NF-κB/MDR1的作用,在一定程度上增强了LSC对化疗药物阿霉素(ADM)的敏感度,从而闡述了PESV逆转LSC多药耐药的可能机制之一,为PESV联合抗肿瘤作用的进一步研究提供了基础。
[关键词] 蝎毒多肽;多药耐药;BALB/c小鼠模型;P-gp上游信号
[Abstract] Using the BALB/c mouse multidrug resistance model of leukemia,the effect of peptide extract from scorpion venom (PESV) to the upstream signal factors of P-gp of MDR leukemia stem cells on the mouse tumor block was observed,and the mechanism of PESV to reverse the MDR of LSC was studied. At the same time,the expression of P-gp,MDR1 mRNA and PI3-K,NF-κB were respectively detected through flow cytometry,RT-PCR,Western blot and Elisa,and the mouse liver,spleen were examined via histopathological methods. The results of the experiment were as follows: mice of the control group didnt show any obvious changes,while mice of the other six groups all showed arched back,emaciation,liver swell,and inflammation was found in all liver tissue. The expression level of P-gp and PI3K on the LSC membrane of mouse tumor block was down-regulated;the expression of MDR1 mRNA in the cytoplasm was obviously down in the PESV low dose group,and which was inordinately up in the middle dose group and the high dose group. The expression level of NF-κB in the leukemia stem cell nucleus remarkably decreased. PESV had a outstanding role of down-regulating PI3K,NF-κb,MDR1 which were all upstream factors of P-gp,and to a certain degree enhanced the sensitivity of LSC to ADM. Therefore,this experiment explained one of the mighty mechanism of PESV to reverse MDR of LSC,and provided a foundation to further study of combinational anti-cancer effects of PESV.
[Key words] peptide extract from scorpion venom (PESV);MDR;BALB/c mouse model;upstream signal factors of P-gp
doi:10.4268/cjcmm20162426
白血病细胞对化疗药物产生多药耐药(multidrug resistance,MDR)现象是急性白血病(acute leukemia,AL)化疗失败及复发的主要原因之一[1]。MDR是指肿瘤细胞接触一种化疗药物产生耐药的同时,对多种结构不同、作用机制各异的其他化疗药物也产生交叉耐受性。白血病细胞产生MDR现象较常见的机制是磷脂酰肌醇3激酶(phosphoinositide 3-kinase,PI3K)受到细胞因子、药物等配体活化后,促使生成磷脂酰肌醇(phosphatidylinositol,PI),PI作为细胞内的第二信使活化蛋白激酶B(protein kinase,PKB又称AKT)[2],AKT磷酸化下游核转录因子(nuclear facter,NF-κB),活化的NF-κB启动多药耐药基因(multidrug resistance 1,MDR1),MDR1转录后的mRNA表达其编码的P-糖蛋白(P-glycoprotien,P-gp),P-gp可以利用水解ATP的能量将各种药物从细胞内转运到细胞外,降低药物在细胞内的浓度,并使其细胞毒作用减弱直至消失[3],这样形成以P-gp上游信号PI3K/AKT/NF-κB/MDR1介导为主的白血病细胞MDR通路。所以迫切需要模拟MDR的LSC(leukemia stem cells)在体内生物学特征,课题组系统回顾文献,从实验的实用性、可操作性角度出发比较尾静脉、腹腔、皮下注射和瘤块包埋4种成模MDR白血病模型方法,以便同道参考。课题组前期研究发现蝎毒多肽(peptide extract from scorpion venom,PESV)可以通过上调DNR(daunorubicin)损伤细胞的PTEN基因、tie-2基因表达改变KG1α干细胞凋亡与分化[4],也有研究表明PTEN基因上调Bax等多种信号分子逆转K562/ADM细胞的MDR现象[5],这提示PESV有逆转白血病细胞耐药的可能,因此探讨PESV是否是通过调节P-gp 上游信号PI3K/NK-κB/MDR1实现逆转白血病干细胞MDR。
1 材料
台式高速离心机(LG16-W,北京京立离心机有限公司);CO2培养箱(NAPCO MODEI 5410);倒置显微镜(OLYMPUS IM);流式细胞仪(C6,美国BD公司);莱卡石蜡包埋机EG1150(北京长恒荣创科技有限公司);全波长扫描酶标仪(Thermo Scientific公司)。
采用电刺激东亚蝎尾采集新鲜毒液,经高速离心分离,真空干燥制成蝎毒干粉,-20 ℃保存。从蝎毒冻干粉中按文献[7]方法提取蝎毒多肽,含50~60氨基酸的多肽混合物,相对分子质量6 000~7 000,纯度89.1%,耐热,pH稳定,使用前用0.9%氯化钠溶液溶解稀释到所需浓度。
细胞株采用经典髓系白血病耐ADM的K562/A02细胞株[6],由中国医学科学院血液病研究所提供。BALB/c小鼠,雌性,6~7周齡,体重18~22 g,共计40只,购自北京华阜康动物公司,动物许可证号SCXK(京)2014-0004,在SPF级环境下饲养,采用滤膜饲养笼,裸鼠所需饲料、饮水及其他物品均高压灭菌。
RPMI-1640培养基(HyClone公司);10%胎牛血清(Gibco公司);PE Mouse Anti-Human CD34 Antibody(美国BD公司);FITC Mouse Anti-Human CD38 Antibody(美国BD公司);CD34 Micro Bead Kit-Human(MiltenyiBiotec公司);CD38 Micro Bead Kit-Human(MiltenyiBiotec公司);MACS分选架及 LD、MS柱(MiltenyiBiotec公司);CCK-8试剂盒(索罗门生物科技有限公司);Elisa检测试剂盒(美国BD公司);Western blot检测试剂盒(北京世纪康为公司);RT-PCR试剂盒(北京康为世纪公司),MDR1基因引物序列[8]:上游引物5′-CCCATCATTGCAATAGCAGG-3′,下游引物5′-GTTCAAACTTCTGCTCCTGA-3′;内参照β-actin引物序列:上游引物5′-TGACGGGGTCACCCACACTGTGCCCATCTA-3′,下游引物5′-CTAGAAGCATTTGCGGTGGACGATGGAGGG-3′。
2 方法
2.1 K562/A02干细胞分选培养 常规复苏液氮冻存K562/A02细胞,置于含15%胎牛血清的RPMI-1640(100 U·mL-1青霉素和100 g·L-1链霉素)培养基中常规培养,每3~4 d传代1次。培养条件:5% CO2,37 ℃恒温培养箱。采用免疫磁珠法分选K562/A02干细胞,收集1×108个对数生长期的K562/A02细胞,严格按照 MACS 磁珠分选说明书进行,经流式细胞仪分析样本中1×104个细胞中的阳性细胞数,鉴定后实验备用。
2.2 动物造模建立及分组给药 实验先选取5只雌性BALB/c小鼠,经皮下注射K562/A02干细胞,每次间隔3 d,每次注射0.2 mL(5×107个/mL),形成皮下瘤块备用。再将35只BALB/c小鼠随机分为正常对照组,模型组,ADM组,PESV组,ADM+PESV高、中、低剂量组。除正常对照组外各组照射后,经包埋穿刺针接种0.2 cm×0.2 cm大小瘤块1处。成模后,对照组予0.9%氯化钠溶液腹腔注射,其余各组予腹腔注射ADM和(或)PESV。ADM腹腔注射0.05 mg(按成人40 mg·m-2·d-1换算)隔日1次,第1,3,5,7,9,11,13天,PESV按高、中、低(5,1,0.2 μg)剂量腹腔注射每天1次,给药14 d,PESV组PESV剂量同中剂量组。第21天颈椎脱臼处死小鼠。
2.3 白血病多药耐药小鼠模型鉴定 BALB/c小鼠颈椎脱臼处死,抽吸复冲骨髓制备骨髓细胞悬液,取1×106个细胞分别加入CD34,CD117,CD45抗体,常温孵育15 min;离心,弃上清,上机检测白血病抗原,计数小鼠骨髓内白血病干细胞。剪取瘤组织,加入100 μL胶原酶消化(37 ℃,30 min),过滤,离心洗涤。收集小鼠骨髓细胞梯度接种于96孔板(A~H,1~3),每梯度设3个平行孔。培养72 h后向每孔加入8 μL CCK-8溶液,37 ℃孵育20 min后,用酶标仪测定在450 nm处的吸光度(A)及计算细胞IC50。颈椎脱臼法处死BALB/c小鼠,应用无菌手术器械解剖,取肝脏放入10%甲醛中固定;梯度乙醇脱水,二甲苯浸泡,石蜡包埋,切片,中性树胶加盖玻片封片,镜检。
2.4 流式细胞术P-gp检测 剪取1 g中心部位的瘤组织,PBS(0.01 mol·L-1,pH 7.0~7.2)冲洗3次,同组标本混合。将组织充分剪碎,加入100 μL胶原酶消化(37 ℃,30 min),过滤。加1 mL PBS,混匀,过滤,离心洗涤2遍(2 000 r·min-1,5 min),计数。取1×106个细胞,加入5 μL FITC M-H P-gp抗体,避光,4 ℃孵育30 min。加1 mL PBS洗涤(2 000 r·min-1,5 min),上机检测。
2.5 RT-PCR检测MDR1 mRNA表达 剪取1 g中心部位的瘤组织,PBS冲洗3次,同组标本混合。用Trizol法提取移植瘤总RNA,然后按第一链合成试剂盒逆转录为cDNA。将得到的cDNA模板用去离子水稀释5~10倍后用于Real-time PCR,反应体系50 μL(PCR Master Mix 25 μL,Forward Primer 2 μL,Reverse Primer 2 μL,Template cDNA 1 μL,PCR Enhancer 10 μL,RNase-Free Water up to 10 μL);反应条件为95 ℃预变性5 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,40个循环;72 ℃终延伸5 min。设β-actin为管家基因,同时检测。
2.6 Western blot法检测PI3K蛋白 剪取1 g中心部位的瘤组织,加1 mL液氮研磨,200 μL蛋白裂解液,吹打混匀,取上清总蛋白,采用BCA方法测蛋白浓度。样本煮沸转移蛋白至PVDF,0.5%脱脂牛奶室温封闭PVDF膜1 h,分别加入一抗40 ℃孵育过夜,0.1% TEST洗膜3次,室温孵育加入二抗1 h,TBST洗膜3次,加ECL发光剂后显影。
2.7 Elisa法检测NF-κB含量 剪取1 g中心部位的瘤组织,预冷研磨,5 000×g离心5 min,留取上清。严格按照试剂盒说明书步骤,在酶标板分别设标准孔、待测样品孔、空白孔,依次加A液、B液。终止反应后用酶标仪在450 nm 波长测量各孔的吸光度(A),通过标准曲线计算NF-κB浓度。
2.8 统计学方法 采用SPSS 16.0统计软件进行分析,计量资料用±s表示,先行方差齐性检验和正态性检验,再行组间均数F检验,检验水准α=0.05。组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
3 结果
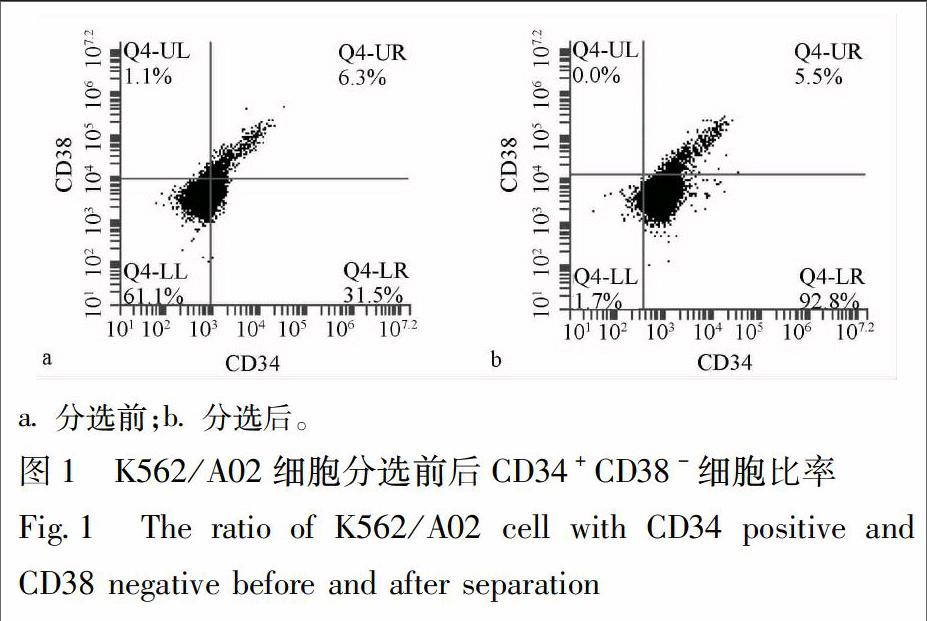
3.1 K562/A02干细胞耐药性 对数生长期K562/A02细胞,流式细胞仪检测CD34+CD38-细胞占31.5%,见图1a,经免疫磁珠分选后CD34+CD38-细胞比例为92.8%,见图1b,分选后K562/A02细胞干性显著性提高。
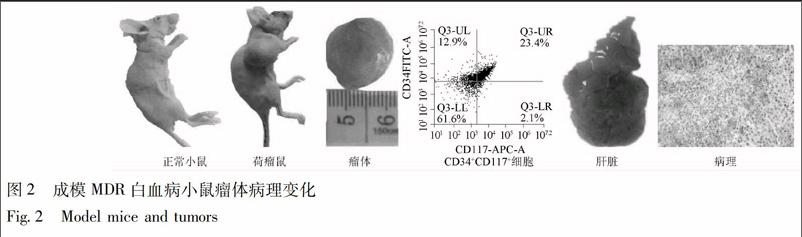
3.2 BALB/c小鼠成模情况 BALB/c小鼠接种K562/A02细胞21 d后,正常组无白血病表现,其他各组100%出现不同程度白血病表现:消瘦、弓背症状、皮下包块。检测小鼠骨髓单个核细胞中CD34+CD117+表达23.4%,小鼠肿瘤包块细胞耐ADM的IC50为(25.32±10.77)mg·L-1,耐药指数17.83。小鼠肝脏肿大,肝内均出现炎症坏死,见图2。
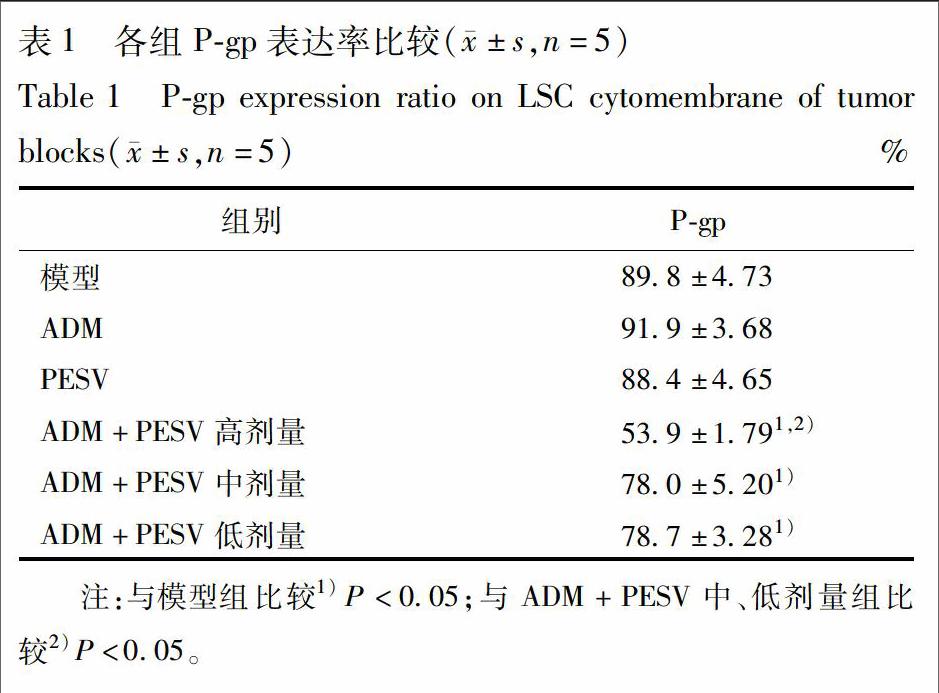
3.3 P-gp检测LSC细胞膜上P-gp表达 给药后,BALB/c小鼠瘤块细胞膜上P-gp表达比较见表1,图3,与模型组比较,ADM+PESV高、中、低剂量组P-gp降低,差异有统计学意义(P<0.05);分别与ADM组和PESV组比较,ADM+PESV高剂量组P-gp均明显降低,差异有统计学意义(P<0.05)。
3.4 多药耐药基因MDR1 mRNA表达情况 本次相对定量RT-PCR检测将各组2-ΔΔCt测定值相对模型组的结果比较,设2-ΔΔCt测定值≥5的定为高表达标准。测得K562/A02干细胞的MDR1 mRNA基因表达量PESV组>低剂量组>高剂量组>中剂量组>ADM组,其中PESV组、中剂量组、低剂量组高表达,见表2。
3.5 BALB/c小鼠瘤块细胞PI3K蛋白水平 PI3K蛋白在ADM组、PESV组表达上调,在ADM+PESV組表达下调,下调强度从高到低依次为高剂量组>中剂量组>低剂量组,见图4。
3.6 BALB/c小鼠瘤块细胞NF-κB因子水平比较 标准曲线:使用专业制作曲线软件curve expert 1.30进行分析,以标准品的浓度为纵坐标(Y),A为横坐标(X),依据回归方程R2绘出标准曲线。用标准物的浓度与A计算出标准曲线的回归方程式,将样品的A代入方程式,计算出样品浓度。R2=0.999 6,绘制标准曲线为Y=25.992X-0.189 8。根据标准曲线求出NF-κB分析结果,与模型组比较,PESV组、ADM+PESV高剂量组NF-κB水平下调,差异有统计学意义(P<0.05);ADM组及ADM+PESV中、低剂量组NF-κB水平比较,差异无统计学意义;与ADM组和PESV组比较,ADM+PESV高剂量组NF-κB水平均下调,差异有统计学意义(P<0.05),见表3。
4 讨论
目前研究表明白血病化疗缓解率低、短期内复发是因为白血病细胞对化疗药物不敏感,尤其白血病细胞产生MDR阻碍了化疗治愈白血病。尽管MDR机制极其复杂[9],但P-gp是 MDR效应的终末活性主要蛋白,编码在人类MDR1基因,MDR1 cDNA位于人类7号染色体的q21.1带上,编码4.5~5.0 kb mRNA,长4 669 bp,其第179~3 840 bp为可读区,起始密码为ATG,共编码1 280个氨基酸残基,经折叠修饰后形成定位于细胞质和高尔基体的P-gp[10]。两者是P-gp转运药物的重要场所,整个分子由几乎完全相同的2个亚基构成,每部分具有6个跨膜区和1个ATP结合位点,构成ABC超家族中P-gp药物泵降低细胞内化疗药物浓度[11]。白血病细胞表面的酪氨酸蛋白激酶受体(receptor tyrosine kinases,RTK)通过接收胞外多种生长因子如胰岛素(insulin)、成纤维细胞生长因子(FGF)、人生长因子(HGF)、血管内皮生长因子(VEGF) 等配体信号刺激而被激活,激活的RTK通过PI3K将信号传递到细胞内激活AKT。AKT属于PI3K重要的下游分子,包括AKT1,AKT2和AKT3至少3种形式[12],其中AKT1促进细胞增殖和存活;AKT2参与胰岛素调节的糖类物质代谢;AKT3则对细胞的数目以及大小起着关键的调节作用。ATK激活IκB激酶(IKKα)进而导致NF-κB的抑制剂IκB的降解,使NF-κB从细胞质中释放出来进行核转位,NF-κB与MDR1基因启动子结合,MDR1的DNA完成mRNA转录,这样白血病MDR的PI3K/NF-κB/MDR1细胞信号通路激活。
PESV是蝎毒多肽提取物的简称,是由蝎毒冻干粉经葡聚糖凝胶,收集蝎毒Ⅲ~Ⅳ蛋白峰,再进行阳离子交换色谱而成。PESV组分Ⅲ通过下调bcl-2基因和激活caspase-3途径促进人肝癌细胞株Hep G2的凋亡[13],PESV组分Ⅳ作用及机制尚未明确。实验中发现PESV和ADM能够独立同步上调上游信号通路中PI3-K蛋白、NF-κB因子、MDR1 mRNA表达;当PESV和ADM联合应用时能够同步下调上游信号通路中PI3-K蛋白、NF-κB因子、MDR1 mRNA表达,表达水平与PESV剂量呈正相关;提示了PESV对ADM作用后的白血病细胞的PI3-K蛋白、NF-κB因子、MDR1 mRNA表达具有下调作用,换而言之,PESV提高白血病细胞对ADM的敏感性,或是PESV逆转白血病细胞的MDR。大黄蛰虫丸含药血清可能通过抑制PI3K/AKT信号通路激活实现了对白血病K562细胞抑制的增殖,诱导凋亡且将细胞阻滞于G0/G1期,呈浓度依赖性[14]。植物雌激素毛蕊异黄酮处理T24细胞后,P-Akt/Akt比值下降,提示毛蕊异黄酮可以抑制PI3K/Akt通路的活性,当采用不同浓度毛蕊异黄酮作用时P-Akt/Akt比值下降显著性差异 [15]。本研究与以上学者的研究结果是一致的,但多药耐药信号通路PI3K/NF-κB/MDR1所涉及细胞因子多,蛋白磷酸化、基因甲基化等方面细节尚需进一步研究探讨。
[参考文献]
[1] Mattern J,Volm M. Multiple pathway drug-resistance(review)[J]. Int J Oncol,1993,2(4):557.
[2] O saki M,O shinura M,Ito H. P13K-Akt pathway its functions and alterations in human cancer[J].Apoptosis,2004,9(6):667.
[3] Juliano R L,Ling V. A surface glycoprotein modulating drug permeability in Chinese hamster ovary cell mutants[J].Biochem Biophys Acta,1976,455(1):152.
[4] 杨向东,李红玉,李德冠,等. 蝎毒多肽对白血病细胞株KG1a干细胞活性的影响[J].中华中医药杂志,2015,30(4):101.
[5] 成志勇,李琳,王亚丽,等.PTEN基因逆转白血病多因素多药耐药机制探讨[J].第二军医大学学报,2013,34(2):142.
[6] 栾凤君,杨纯正,马建国,等.一株人红白血病多药耐药细胞系(K562/AO2)的建立及其耐药特性的研究[J].中华肿瘤杂志,1993,15:101.
[7] 郝征,杨文华.蝎毒多肤干预急性白血病髓外浸润传变的机制[J].中华中医药杂志,2012,27(4):1106.
[8] Xu Yan,Zhi Feng,Xu Guangming,et al. Overcoming multidrug-resistance in vitro and in vivo using the novel P-glycoprotein inhibitor1416[J]. Biosci Rep,2012(32): 559.
[9] Zunino S J,Storms D H,Ducore J M.Novel in vivo model of inducible multi-drug resistance in acute lymphoblastic leukemia with chromosomal translocation t(4;11)[J].Cancer Lett,2010,296(1):49.
[10] Perrin L,Gatouillat G,Balasse E,et al. lnduction of autoantibodies to murine P-glycoprotein: consequences on drug sensitivity in MDR cancer cells and on the expression of MDR genes[J].Biochem Biophys Res Commun,2007,358(1):325.
[11] Tian K,Wang Y,Huang Y. Methylation of WTH3,a possible drug resistant gene,inhibits p53 regulated expression[J].BMC Cancer,2008,8:327.
[12] Mackay H J,Eisenhauer E A,Kamel-Reid S,et al. Molecular determinantks of outcome with mammalian target of rapamycin inhibition in endometrial cancer[J]. Cancer,2013,25(3):123.
[13] 李建偉,胡静,张桂荣,等. 东亚钳蝎蝎毒多肽组分Ⅲ对肝癌细胞凋亡的影响[J].吉林大学学报,2006,32(4):625.
[14] 秦宝宁,滕文静,刘瑞娟,等.大黄蛰虫丸对慢性粒细胞白血病K562细胞增殖凋亡及PI3K/AKT信号传导通路的影响[J].时珍国医国药,2015,26(3):522.
[15] 辛敏,陈健,郭艳红. 毛蕊异黄酮对膀胱癌细胞凋亡和PI3K/Akt信号通路的影响[J].广东医学,2015,36(5):690.
[责任编辑 马超一]
