八角莲愈伤组织中开环异落叶松脂素脱氢酶基因克隆、表达及功能鉴定
2017-04-18沈云陈日道解可波邹建华戴均贵
沈云+陈日道+解可波+邹建华+戴均贵
[摘要] 开环异落叶松脂素脱氢酶(secoisolariciresinol dehydrogenase,SDH)是鬼臼毒素(podophyllotoxin)生物合成途径中的关键酶。该研究通过基于SDH基因保守性序列的同源PCR方法,结合快速扩增cDNA末端(RACE)技术从八角莲Dysosma versipellis愈伤组织中克隆得到2个SDH候选基因SO282和SO1223,并实现了以上基因在大肠杆菌中的可溶性表达。体外酶活性分析表明重组SO282具有SDH活性,为后续研究八角莲中鬼臼毒素的生物合成奠定了基础。
[关键词] 八角莲;开环异落叶松脂素脱氢酶;鬼臼毒素;生物合成
[Abstract] Secoisolariciresinol dehydrogenase (SDH) is a key enzyme involved in the biosynthetic pathway of podophyllotoxin.In this study,two SDH candidate genes,SO282 and SO1223,were cloned from callus of Dysosma versipellis by homology-based PCR and rapid amplification of cDNA end (RACE).The SDH candidate genes were expressed in Escherichia coli and the subsequent enzyme assay in vitro showed that recombinant SO282 had the SDH activity. These results pave the way to the follow-up investigation of the biosynthetic of podophyllotoxin.
[Key words] Dysosma versipellis;podophyllotoxin;SDH;biosynthesis
doi:10.4268/cjcmm20162414
八角莲Dysosma versipellis是小檗科八角莲属多年生草本植物,其以根茎入药,主要用于治疗毒蛇咬伤、跌打肿痛、风湿性关节痛、淋巴结炎、乳腺癌、食道癌等疾病[1-2]。研究表明,八角莲根茎中主要含有鬼臼毒素(podophyllotoxin)、去氧鬼臼毒素(deoxypodophllotoxin)、山柰酚(kaempferol)以及槲皮素(quercetin)等多種有效成分[3],其中鬼臼毒素对于肿瘤以及细胞癌变具有显著的抑制作用[4]。然而,由于野生八角莲生长缓慢,分布区域局限且繁殖力低,加之过度采挖,八角莲野生资源已不能满足医药市场的需求[5-6]。另外,鬼臼毒素化学合成路线长、效率低,难以实现商业化。因此,解析鬼臼毒素的生物合成途径,有利于实现八角莲优质种源的筛选、株系的改良、栽培和培养条件的优化以及体内生物合成体系的调控,从而快速大量得到所需目的产物,更为重要的是获得的生物合成相关基因可在微生物中重新构建其生物合成途径,绿色、可持续、高效率生产鬼臼毒素,解决其药源不足的问题。
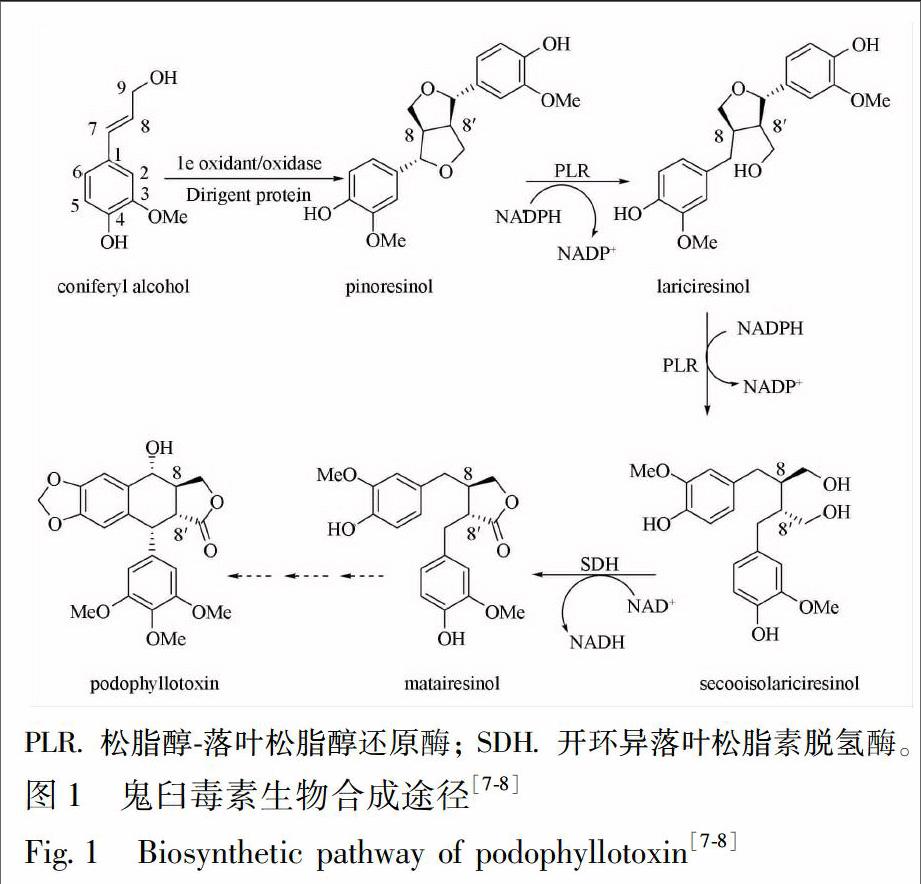
开环异落叶松脂素脱氢酶是鬼臼毒素生物合成途径中的关键酶(图1),负责将开环异落叶松脂素(secoisolariciresinol)进行氧化脱氢生成重要中间体马台树脂醇(matairesinol)。研究表明,在桃儿七Sinopodophyllum hexandrum、美国金钟连翘Forsythia intermedia以及盾叶鬼臼Podophyllum peltatum中,均克隆得到开环异落叶松脂素脱氢酶(secoisolariciresinol dehydrogenase,SDH)相关基因[7-8],而对于八角莲中SDH基因的研究还未见报道。本研究的目的在于克隆、表达并功能鉴定八角莲SDH基因,为后续研究八角莲中鬼臼毒素的生物合成奠定基础。
1 材料
1.1 仪器与试剂 S1000 Thermal Cycer PCR仪(Bio-Rad,美国);NanoDrop2000C微量分光光度计(Thermo Scientific,美国);DYY-6C电泳仪(北京六一仪器厂);DYCP-31DN电泳槽(北京六一仪器厂);Biospectrum AV凝胶成像系统(UVP,美国);Sigma 3K-15高速离心机(Sigma,德国);电热恒温培养箱(上海一恒仪器厂);培英HYG-A恒温摇床(太仓仪器厂,中国);Cyberscan 510型pH计(Eutech Instrument,新加坡);Tauto纯水仪(同田科技有限公司,中国);ZX-TJS无菌操作台(上海整新电子设备,中国);BSA124S分析天平(Sartorius,德国);Agilent 1200高效液相色谱仪(Agilent Technologies,美国);Shiseido capcellpak C18 MGIII色谱柱(Shiseido,日本)。
RNA提取采用E.Z.N.A. Plant RNA Kit(Omega Bio-Tek,美国);RACE反应采用Smarter RACE cDNA amplification Kit(Clontech,美国);基因克隆采用KOD-Plus-Neo DNA聚合酶(TOYOBO,日本)、pEASY Blunt Simple克隆载体(TransGen,中国)和Trans1-T1 Phage Resistant化学感受态细胞(TransGen,中国);基因外源表达采用pET28a(+)表达载体(Novagen,德国)和Transsetta Phage Resistant化学感受态细胞(TransGen,中国)。
1.2 样品 野生八角莲植株采自广西壮族自治区龙州县,由广西药用植物园袁经权副研究员鉴定为小檗科八角莲属植物八角莲D. versipellis,标本存放于中国医学科学院药物研究所标本室(ID-26856)。八角莲培养细胞诱导自野生八角莲的叶片,培养细胞的诱导采用附加α-萘乙酸(α-NAA,0.5 mg·L-1)、2,4-二氯苯氧乙酸(2,4-D,1.0 mg·L-1)、蔗糖(30 g·L-1)和琼脂(7 g·L-1)的MS固体培养基,灭菌前调pH为5.8。继代培养采用附加α-NAA(0.2 mg·L-1)、6-BA(6-苄基嘌呤,0.2 mg·L-1)、2,4-D(0.5 mg·L-1)、蔗糖(30 g·L-1)和琼脂(7 g·L-1)的6,7-V固体培养基,于黑暗(25±2) ℃静止培养[9]。
2 方法与结果
2.1 SDH候选基因的克隆及生物信息学分析 取鲜重0.5 g的八角莲愈伤组织,按照E.Z.N.A. Plant RNA Kit实验操作步骤进行总RNA制备,1%琼脂糖凝胶电泳检测RNA完整性,分光光度计测定RNA浓度。采用Smarter RACE cDNA amplification Kit将八角莲愈伤组织总RNA反转录成cDNA,得到3′-ready cDNA以及5′-ready cDNA模板。
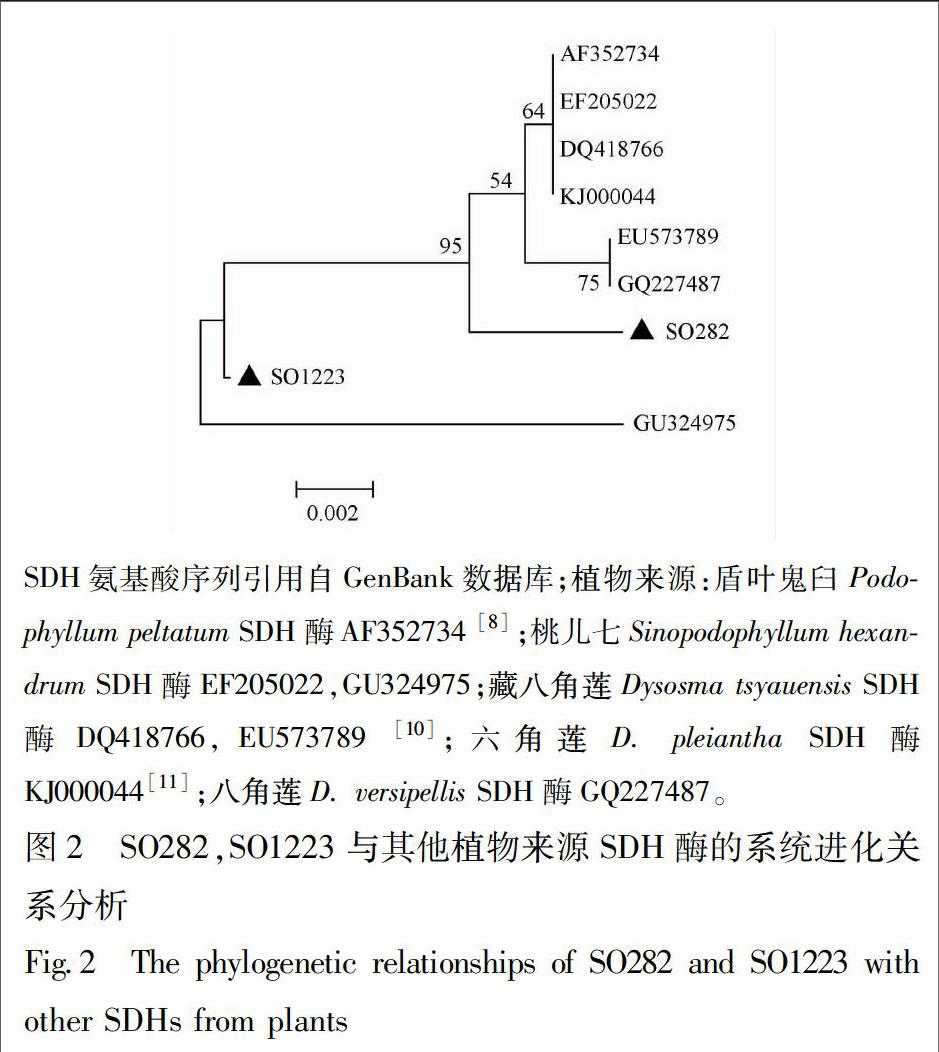
根据GenBank (http://www.ncbi.nlm.nih.gov)中报道的植物SDH的保守性核苷酸序列设计简并引物SDH-F(GCGGCCGCTYCAYTGYGATGTSAC)和SDH-R(CCRCTCACATACTTGGAMTC),分别以3′-ready cDNA和5′-ready cDNA为模板进行SDH基因3′-端和5′-端序列的扩增。3′-端序列PCR扩增反应程序为:94 ℃,2 min;98 ℃,10 s,55 ℃,30 s,68 ℃,60 s,重复35个循环;68 ℃,7 min。5′-端序列扩增反应程序为:94 ℃,2 min;98 ℃,10 s,58 ℃,30 s,68 ℃,60 s,重复35个循环;68 ℃,7 min。切胶回收PCR产物,回收产物与pEASY Blunt simple vector连接并转化大肠杆菌Trans1-T1感受态细胞,结合蓝白斑和菌落PCR筛选阳性转化子并测序。采用BioEdit软件对测序结果进行比对拼接,得到2个完整的cDNA,分别命名为SO1223,SO282,其开放阅读框(open reading frame)长度分别为831,822 bp,经NCBI进行Blast分析,另外选择与SO282,SO1223同源性较高的来源于5种高等植物的7个SDH基因一起使用MEGA5.0软件通过Neighbor-joining法构建以上基因所编码蛋白的系统进化树(图2)。从系统进化树可见,候选基因SO1223和SO282所编码蛋白与鬼臼属植物盾叶鬼臼、六角莲以及藏八角莲中的SDH基因所编码蛋白具有较高的同源性,其中SO282所编码蛋白与这些植物SDH亲缘关系最近。
采用primer premier软件进行引物设计扩增候选基因SO1223和SO282的完整开放阅读框,并在两端引入Nde Ⅰ和Hind Ⅲ限制性酶切位点,所用引物对分别为:SO1223-F/R(ggaattccatATGGGGAGCACTTCAC/cccaagctTCAGGACTCAGGATACT)和SO 282-F/R(ggaattccatATGGAAACCTCTTGTAC/cccaagc tTCAAGCTAATCCATGT)。
胶回收PCR产物后将带有酶切位点的目的DNA与pEASY Blunt载体连接转化Trans1-T1感受态细胞,筛选出阳性转化子提取质粒并进行双酶切。利用T4连接酶将酶切所得DNA片段与pET28a(+)载体连接构建表达质粒,所得重组质粒转化Trans1-T1感受态细胞进行测序验证。
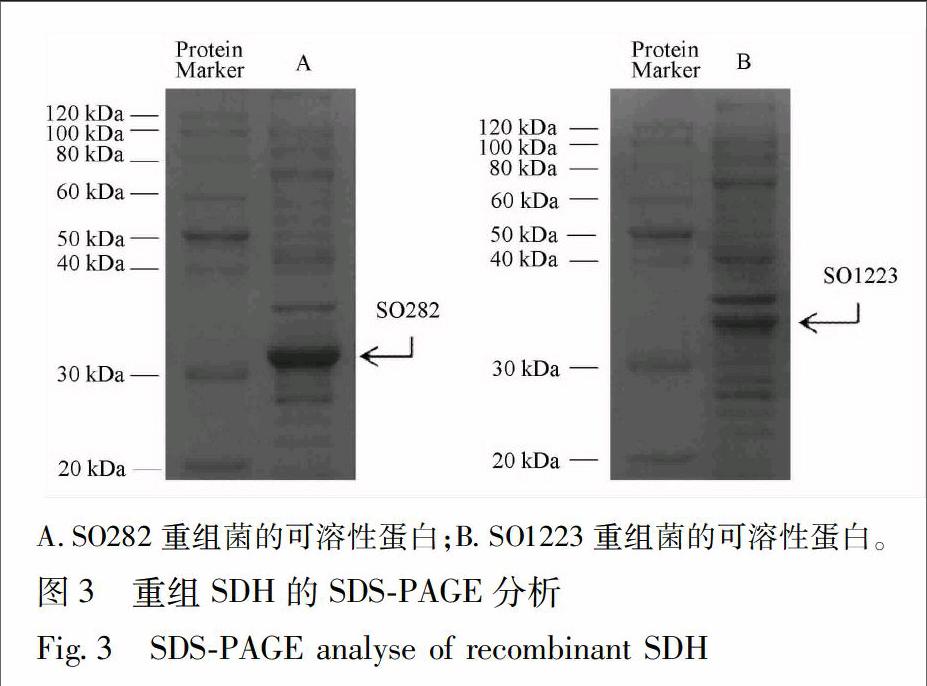
2.2 SDH候选基因的外源表达 提取构建成功的SO1223以及SO282基因表达质粒,转化Transetta DE3表达感受态细胞。将重组菌于含有卡那霉素(50 mg·L-1)和氯霉素(34 mg·L-1)的LB培养基中摇瓶旋转震荡培养,分别使用终浓度为0.25,0.5,1.0 mmol·L-1的IPTG诱导表达16 h,并设置一组空白对照,进行诱导表达条件的摸索。通过SDS-PAGE分析目的蛋白的表达情况。根据电泳结果可知,克隆所得SDH候选基因实现了可溶性表达,并且当使用0.5 mmol·L-1的IPTG诱导时重组SDH可溶蛋白的表达量最大。因此最终采用0.5 mmol·L-1的IPTG进行目的蛋白的诱导表达,提取粗酶并进行SDS-PAGE分析(图3)。
2.3 SDH候选基因的功能鉴定 对含有SO282,SO1223基因表达质粒以及含有pET28a(+)空载体质粒的重组菌分别培养50 mL并采用终浓度为0.5 mmol·L-1的IPTG誘导16 h,离心收集菌体,加入裂解缓冲液(50 mmol·L-1Tris-HCl,含有20%的甘油和10 mmol·L-1 2-巯基乙醇,pH 8.0)超声破碎细胞,12 000×g离心30 min,获得上清粗酶液用于SDH酶活性分析。100 μL酶反应体系含89 μL粗酶液,1 μL的secoisolariciresinol(母液浓度50 mmol·L-1)和10 μL的NAD+(母液浓度10 mmol·L-1)。将配制好的反应体系于30 ℃水浴中反应2 h后,加入2倍体积甲醇终止反应。将反应液15 000×g离心30 min,取上清采用高效液相色谱仪进行分析。分析条件为Shiseido capcellpak C18 MG Ⅲ色谱柱(4.6 mm×250 mm,5 μm),以0.1%甲酸溶液为流动相A,甲醇为流动相B,梯度洗脱(0~10 min,30%~58%B;10~25 min,58%~65%B;25~25.5 min,65%~100%B;25.5~30.5 min,100%B),流速1 mL·min-1,检测波长290 nm,柱温30 ℃(图4)。
经HPLC-MS对比分析酶反应产物及马台树脂醇标准品可知,重组SO282酶具有催化开环异落叶松脂素氧化脱氢的活性,而基因SO1223的表达产物未显示有SDH催化活性。
3 结论及讨论
在鬼臼毒素的生物合成途径中,马台树脂醇是包括鬼臼毒素及其衍生物在内的一系列8-8′木脂素类化合物的重要前体化合物[11]。SDH是鬼臼毒素生物合成途径中的一个关键酶,它能够特异性的催化反式构型的开环异落叶松脂素氧化脱氢生成相同构型的马台树脂醇,从而进行下一步的生物合成[8,11-13]。本研究从八角莲愈伤组织中成功获取2个候选基因SO1223,SO282,体外功能鉴定结果表明基因SO282所编码的蛋白具有SDH催化活性,为后续研究八角莲中鬼臼毒素的生物合成奠定了基础。目前,对于鬼臼毒素的生物合成途径的研究还处于起步阶段,其后续的催化过程仍未完全明确,还需进行进一步的探索研究,这对于解决鬼臼毒素及其活性衍生物自然资源不足的问题具有重要意义。
[参考文献]
[1] 唐凤鸾,李锋,黄宁珍,等. 八角莲组织培养研究[J]. 广西植物,2008,28(6): 819.
[2] 陈士云,侯嵩生. 植物细胞培养生产抗癌药物研究进展[J]. 天然产物研究与开发,1993,5(1): 61.
[3] 万明香,张丽艳,何顺志. 八角莲属(小檗科)药用植物的研究进展[J]. 贵阳中医学院学报,2007,29(1): 51.
[4] 尚明英,徐珞珊. 鬼臼类中药及其木脂素类成分的药效学研究[J]. 中草药,2002,33(8): 722.
[5] 徐铮奎. 国外抗癌植化产品研究开发新进展[J]. 中国制药信息,2005,21(8): 23.
[6] 陆志科,余江帆,谢碧霞. 抗肿瘤活性鬼臼毒素类似物的资源研究[J]. 中南林业科技大学学报: 自然科学版,2008,27(5): 117.
[7] Marques J V,Kim K W,Lee C,et al. Next generation sequencing in predicting gene function in podophyllotoxin biosynthesis [J]. J Biol Chem,2013,288(1): 466.
[8] Xia Z Q,Costa M A,Pélissier H C,et al. Secoisolariciresinol dehydrogenase purification,cloning,and functional expression [J]. J Biol Chem,2001,276(16):12614.
[9] 陈日道,段瑞刚,邹建华,等. 八角莲愈伤组织中黄酮苷类化学成分研究[J]. 中国中药杂志,2016,41(1):13.
[10] 徐莉,丁志山,周云凯,等. 八角莲内闭联异松树脂醇二酯脱氢酶全基因的克隆及分析[J]. 中药材,2009,32(6):852.
[11] Kuo H J,Wei Z Y,Lu P C,et al. Bioconversion of pinoresinol into matairesinol by use of recombinant Escherichia coli [J]. Appl Environ Microb,2014,80(9): 2687.
[12] Youn B,Moinuddin S G,Davin L B,et al. Crystal structures of apo-form and binary/ternary complexes of Podophyllum secoisolariciresinol dehydrogenase,an enzyme involved in formation of health-protecting and plant defense lignans[J]. J Biol Chem,2005,280:12917.
[13] Moinuddin S G,Youn B,Bedgar D L,et al. Secoisolariciresinol dehydrogenase: mode of catalysis and stereospecificity of hydride transfer in Podophyllum peltatum[J]. Org Biomol Chem,2006,4(5):808.
[責任编辑 吕冬梅]
