人参根际拮抗细菌RS—3的鉴定及其对人参常见病原菌的抑制作用
2017-04-18王铁霖赵东岳陈美兰马忠华郭兰萍
王铁霖+赵东岳+陈美兰+马忠华+郭兰萍
[摘要] 从吉林健康人参根中筛选到一株广谱根际菌RS-3。经形态学特征及16SrDNA 序列同源性分析,鉴定该菌株为解淀粉芽孢杆菌。平板对峙实验及带毒平板法鉴定,该菌株对常见的5种人参病原菌有一定的拮抗作用,对灰霉病菌的抑菌率达54.4%。说明根际细菌RS-3可作为人参常见病害的潜在广谱生防菌进一步开发利用。
[关键词] 人参;根际细菌;抑菌活性
[Abstract] A rhizobacteria strain named RS-3 exhibited inhibitory activity against all five Panax ginseng pathogens was isolated from the root of P. ginseng. This strain was identified as Bacillus amyloliquefaciens based on its morphological character and 16S rDNA sequence. Antagonistic activity experiments indicated that the strain could strongly suppress Botrytis cinerea Pers with an inhibitory rate of 54.4%,suggesting the potentialities of biocontrol agent against diseases that frequently happen on ginseng.
[Key words] Panax ginseng;rhizobacteria;antibacterial activity
doi:10.4268/cjcmm20162413
人参Panax ginseng C. A. Mey为五加科人参属多年生草本植物,主要分布于东北吉林、辽宁、黑龙江等地区。其野生资源稀少,被“国家重点保护野生药用动植物名录”列为一类保护植物[1-3]。人参有几千年的药用历史,具有滋补强壮、安神益智的作用,在国内外中药领域占有极其重要的地位[4]。近年来,随着人参需求量增加,野生人参已不能满足需求,人工栽培的规模不断扩大,人参各类病害也愈加严重等问题,制约了人参种植业的可持续发展。
人参连作障碍主要为根部病害,多从根部开始侵染,采用化学农药防治必须将其施入土壤[5]。由于土壤对农药的吸附、迁移等一系列复杂作用及土壤中微生物对农药的降解,严重影响了化学农药的防效;若过度加大用量,不仅会增加生产成本,而且导致人参根内农残量大幅度增加,失去药用价值。因此,根用药用植物的土传病害防治不能单纯依靠化学农药,必须探索新的防治途径。因而筛选对人参根部病害有抗菌作用的生防菌进行生物防治显得尤为必要[6]。
植物根际细菌,特别是药用植物根际细菌,作为一种新的资源引起了人们的广泛关注,目前,对人参根际菌的研究尚处在初级阶段。张一鸣等[9-10]开展了人参根际土壤提取物对人参病原菌和拮抗菌的影响研究。肖春萍等[11]开展了人参根际土壤微生物多样性及其生防真菌资源开发研究工作。本实验筛选出一株具有广谱抑菌活性的根际细菌,初步研究了其对人参常见病菌抑菌活性,旨在筛选出能产生抑菌活性物质的根际菌,为发酵生产抑菌活性物质及人参资源的综合开发奠定基础。
1 材料
1.1 土壤采集 土壤样品采自吉林通化集安三年生健康人参的根际土壤10 cm处。
1.2 供试培养基 LB培养基:胰蛋白胨 10 g;酵母提取物 5 g;NaCl 10 g。加水定容至1 L,调至pH 7.0。121 ℃,灭菌20 min,固体培养基琼脂为1.5%。
1.3 菌株分离 称取10 g土壤样品,于盛有90 mL無菌水的三角瓶中振荡30 min。取1 mL土壤悬浮液,依次10倍梯度稀释至1×10-7。分别取1×10-3,1×10-4,1×10-5浓度的土壤悬浮液各100 μL均匀涂布于LB平板上。每个浓度梯度重复3皿。28 ℃恒温培养24~48 h。从平板上挑取不同菌落形态的单菌落,于LB 平板上划线纯化培养,并编号保存。
2 方法
2.1 形态特征描述 依据伯杰氏细菌培养性状判定方法,描述分离菌在LB培养基上 37 ℃培养24 h后的单菌落特征。
2.2 菌株 RS-3的分子鉴定 根据16SrDNA序列对菌株进行分子鉴定。采用SDS法提取菌株RS-3基因组DNA。利用细菌16SrDNA序列通用引物F14(5′-AACAGGATTAGATACCCTG-3′)和R1492(5′-GGTTACCTTGTTACGACTT-3′)进行PCR扩增。PCR扩增体系及条件如下:2×PCR Mix,25 μL;模板 DNA,2 μL;引物各1 μL;ddH2O 补足至50 μL。扩增条件:94 ℃ 3 min;94 ℃ 30 s,65 ℃ 30 s,72 ℃ 90 s,共35个循环;最后72 ℃延伸10 min,4 ℃保存。
PCR扩增产物经胶回收,pEASY-T载体连接,Trans 5α转化涂板,蓝白斑筛选和菌液PCR验证的阳性克隆送北京华大生物技术有限公司测序。获得的序列在NCBI中比对搜索,确定分类地位。
2.3 RS-3对人参常见病原菌拮抗作用测定 平板对峙培养法测定拮抗作用。供试人参病原菌在PDA平板上培养8 d,取直径0.5 cm的菌饼接种于PDA培养基中心。然后用接种环蘸取细菌RS-3菌株在菌饼的两侧约4 cm处划线,25 ℃黑暗培养7 d,测量抑菌带的宽度,并记录统计。每个处理重复3次,观察并测量拮抗带[12]。带毒平板法:RS-3菌株于LB 液体培养基中,180 r·min-1,37 ℃恒温振荡培养至A6001.5。将菌悬液在12 000 r·min-1离心1 min,上清液经0.22 μm孔径的滤膜过滤得到无菌滤液。待 PDA 培养基冷却到50 ℃左右时加入无菌滤液(1∶9),混匀后倒平板。取直径0.5 cm病原菌菌饼置于 PDA 培养基平板中间,25 ℃恒温培养7 d,观察抑菌效果。
相对抑制率=[(对照菌落直径-处理菌落直径)/对照菌落直径] ×100%
3 结果与分析
3.1 RS-3菌株菌落形态描述及分子鉴定 该菌株可在LB培养基上迅速生长,菌落圆形,近乳白色且表面具皱褶。
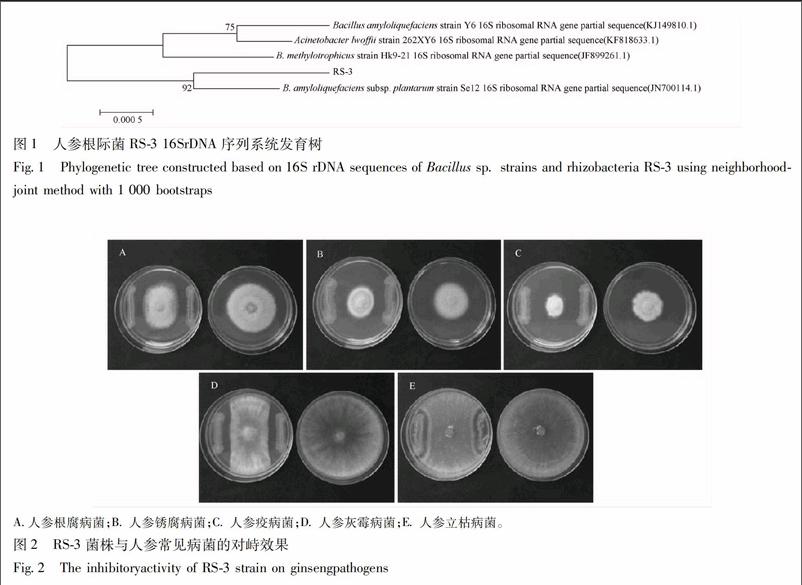
以菌株RS-3基因组DNA为模板,利用16SrDNA通用引物进行PCR扩增得到约1 436 bp的DNA片段。经克隆、测序和序列比对分析发现,所获得菌株的16SrDNA序列与解淀粉芽孢杆菌Bacillus amyloliquefaciens subsp. plantarum Se12菌株(JN700114.1),同源性为99%。结合该菌株的形态学特征和生理生化反应特性,确定RS-3菌株为解淀粉芽孢杆菌。与常见芽孢杆菌16SrDNA片段比较,分析系统进化结果可见,该菌株与解淀粉芽孢杆菌B. amyloliquefaciens亲缘关系最近(图1)。
3.2 根际菌RS-3 的拮抗作用评价 对峙平板法评价结果表明:根际菌RS-3具有广谱抑菌活性,对供试病原菌菌丝生长均有一定的抑制作用。其中,灰霉病菌效果最好,人参立枯病菌效果不佳。抑菌带分别为根腐病0.7 cm,锈腐病菌为0.7 cm,人参疫病菌为0.45 cm,灰霉病菌为0.7 cm,人参立枯病菌抑制效果不佳,为0.2 cm(图2)。
带毒平板法评价结果表明:该实验结果与平板对峙实验结果一致,根际菌RS-3对灰霉病菌的抑菌率最高,为54.4%,对人参立枯病菌抑菌效果较差,为13.18%。其他病原菌的抑菌率分别为:人参根腐病菌 30.0%,人参锈病菌 42.2%,人参疫病菌 33.3%。
4 讨论
目前,对于人参种植病害的防治方法主要有农业防治、化学防治、人参品种改良及使用哈茨木霉等广谱生防制剂等[13-14]。尽管针对人参连作障碍进行改善栽培措施、化学防治等了相关探索,并取得了一定效果,但仍未从根本上解决人参病害防治难的问题。植物根际有丰富的具有生防潜力的微生物资源,它们具有繁殖速度快的特点,大量繁殖后施入土壤中,可以调节植物根部微生态环境、限制土传病原真菌的繁殖和抑制土传病害的发生蔓延,且具有对环境安全、无污染、不易引起病原菌产生抗性等优点。因此,植物根际细菌作为一类新的生防资源,已成为植物病害防控的研究热点[15]。
拮抗细菌筛选研究报道多数针对单一病害,而获得新类型具有广谱抑菌的菌株较少[16]。本研究通过分离所获得的人参根际细菌RS-3为解淀粉芽孢杆菌,对人参常见病害的病原菌均有不同程度的抑制作用,尤其对人参灰霉病菌的抑制率高达54.4%。为人参根腐病、枯萎病等常见病害的生物防治提供更多的资源菌,为人参土传根部病害的科学防治提供理论依据。
芽胞杆菌内生芽胞,繁殖力强,利于工业化生产,且是自然界中广泛存在的非致病细菌,对人、畜无害,不污染环境。研究发现,芽胞杆菌属可以产生很多抗菌物质,抑制多种病原菌的生长[17-21]。因此,利用芽胞杆菌进行植物病害生物防治成一个研究热点。其中,解淀粉芽孢杆菌可以成功定殖于植物表皮,与病原菌竞争寄主周围的营养,分泌抗菌物质而抑制病原菌生长,同时可诱导寄主防御系统抵御病原菌入侵,从而起到生防的作用。Arrebola等从水果表面分离出解淀粉芽孢杆菌PPCB004,对7种不同的柑橘采后病原真菌具有抑制作用[22]。郝建安等研究表明,解淀粉芽孢杆菌NK10.BAhjaWT菌株对茄病镰刀菌Fusarinm solani、水稻纹枯病菌Rhizoctonia solani Kuhn、黑曲霉 Aspergillus niger V.Tiegh、黑痘病菌Elsinoe ampelina Shear等多種真菌都有较好的抑制作用,其中对黑痘病菌的抑制效果最好,生防效果达到80.3%[23]。一些国家已在实验室研制开发有效的生物制剂,一些拮抗菌已经进行了半商业化的实验,有的拮抗菌已经制成商品投放市场,2001年Gustafson将解淀粉枯草芽孢杆菌和枯草芽孢杆菌混合制成生防药剂Bio Yield[24]。因此,本研究中所筛选得到的解淀粉芽胞杆菌是一类具有很大生防潜力的生防菌,它对人参的生长乃至药材品质会有怎样的影响有待进一步研究。
[参考文献]
[1] 中国药典.一部[S]. 2010.
[2] 陈士林,肖培根.中药资源可持续利用导论[M].北京:中国医药科技出版社,2006.
[3] 程海涛,张亚玉,张连学,等.土壤环境与人参生长关系的研究进展[J].中药材,2011,34(2): 313.
[4] 郭辉岩,成善葵,陈慕英,等.简述人参的药理和临床应用[J].中医药学报,1996,44(4): 37.
[5] 张鸿雁,薛泉宏.人参连作障碍防治研究进展[J].江西农业学报,2010,28(6):68.
[6] 邵天蔚,李勇.利用生防微生物防治人参根部病害的研究进展[J].中国现代中药,2016,18(3):383.
[7] Vendan R T,Yu Y J,Lee S H,et al. Diversity of endophytic bacteria in ginseng and their potential for plant growth promotion [J]. J Microbiol,2010,48(5): 559.
[8] Cho K M,Hong S Y,Lee S M,et al. Endophytic bacterial communities in ginseng and their antifungal activity against pathogens[J].Microbial Ecol,2007,54(2): 341.
[9] 张一鸣. 人参根际土壤提取物对人参病原菌和拮抗菌的影响研究[D].长春:吉林农业大学,2014.
[10] 张一鸣,刘芳君,杨莉,等.人参根际土壤甲醇提取物对人参病原真菌和拮抗菌的影响[J]. 吉林农业大学学报,2014,36(4):436.
[11] 肖春萍.人参根际土壤微生物多样性及其生防真菌资源开发研究[D].长春:吉林农业大学,2015.
[12] 杨骁,李长田.人参内生生防真菌的筛选与鉴定[J].东北师大学报:自然科学版,2013,43(4):107.
[13] 陈书华,李梅,蒋细良,等. 防治人参锈腐病木霉菌的筛选及防治效果[J].中国生物防治学报,2016,32(2):265.
[14] 孙卓,杨利民.人参锈腐病生防细菌的筛选及鉴定[J]. 中国生物防治学报,2015,31(4):536.
[15] Qin S,Xing K,Jiang J H,et al. Biodiversity,bioactive natural products and biotechnological potential of plant-associated endophytic actinobacteria[J]. Appl Microbiol Biotechnol,2011,89(3): 457.
[16] 吴长宝,回云静,徐小明,等.枯草芽孢杆菌生物菌剂对人参病原菌室内抑菌实验研究[J]. 人参研究,2010,22(4):11.
[17] 何紅,蔡学清,洪永聪,等.辣椒内生细菌的分离及拮抗菌的筛选[J].中国生物防治,2002,18(4): 171.
[18] 刘静,王军,姚建铭,等.枯草芽孢杆菌JA抗菌特性的研究及抗菌肽的分离纯化[J]. 微生物学报,2004,44(4): 511.
[19] 徐刘平,尹燕妮.拮抗细菌对土传病原菌的作用机理[J].中国生物防治,2006,22(2): 10.
[20] 石志琦,胡梁斌,于淑池,等.细菌P-FS08的鉴定及其对几种植物病原菌的拮抗作用[J].南京农业大学学报,2005,28(3): 48.
[21] 谢晶,葛绍荣,陶勇,等.多粘类芽孢杆菌BS04拮抗成分分离纯化及其特性[J].化学研究与应用,2004,16(6): 775.
[22] Arrebola E,Jacobs R,Korsten L. Iturin A is the principal inhibitor in the biocontrol activity of Bacillus amyloliquefaciens PPCB004 against postharvest fungal pathogens[J].J Appl Microbiol,2010,108(2): 386.
[23] 郝建安,曹志辉,赵凤梅,等.解淀粉芽孢杆菌NK10.BAhjaWT抑真菌作用的研究[J].微生物学通报,2008,35(6):903.
[24] Sharma R R,Singh D,Singh R. Biological control of postharvest diseases of fruits and vegetables by microbial antagonists: a review [J]. Bilogical Control,2009,50(3):205.
[责任编辑 吕冬梅]
