酵母培养物对南美白对虾生长性能、消化酶活性及非特异性免疫的影响
2017-04-17李文辉杨凤娟谯仕彦
刘 明,李文辉,郭 丹,孙 敏,杨凤娟,谯仕彦,戴 刚*
(1.北京中农弘科生物技术有限公司,北京 102206;2.廊坊市农业局,河北廊坊 065000;3.中国农业大学动物科技学院,北京100193)
酵母培养物对南美白对虾生长性能、消化酶活性及非特异性免疫的影响
刘 明1,李文辉2,郭 丹1,孙 敏1,杨凤娟1,谯仕彦3,戴 刚1*
(1.北京中农弘科生物技术有限公司,北京 102206;2.廊坊市农业局,河北廊坊 065000;3.中国农业大学动物科技学院,北京100193)
本试验旨在研究酵母培养物(益康乐)对南美白对虾生长性能、蛋白酶活性及非特异性免疫的影响。选择南美白对虾600尾,随机分成4组,每组3个重复,每个重复50尾对虾,4组分别投喂基础日粮(对照组)和添加0.3%、0.5%、1.0%酵母培养物试验饲料。经过45 d池塘网箱养殖试验。结果表明:与对照组相比,添加0.3%、0.5%、1.0%酵母培养物组增重率分别提高了8.50%、16.74%、9.48%(P<0.05),饲料系数分别降低了7.69%、9.79%、9.09%(P<0.05);与对照组相比,添加0.3%、0.5%、1.0%酵母培养物组对虾肝胰腺蛋白酶活性分别提高了13.35%、16.26%、14.94%(P<0.05),添加酵母培养物有提高南美白对虾肠道蛋白酶活性的趋势(P>0.05);相比对照组,各试验组南美白对虾酚氧化酶和溶菌酶活性得到了显著提高(P<0.05),而添加酵母培养物对南美白对虾超氧化物歧化酶活性影响不显著(P>0.05)。综上可知,添加酵母培养物对南美白对虾具有明显的促生长作用,显著提高其肝胰腺消化酶活性,并改善部分非特异性免疫指标。
酵母培养物;南美白对虾;生长性能;蛋白酶活性;非特异性免疫
近年来,南美白对虾(Litopenaeus vannamei)养殖快速发展,成为我国养殖量最大的对虾养殖品种。但随着集约化养殖程度不断加深,导致南美白对虾养殖中出现疾病频发、抗生素滥用、环境恶化等诸多问题,严重制约了行业的健康持续发展。由于甲壳动物的免疫机制以非特异性免疫为主[1],因此,寻找绿色环保的饲料添加剂以改善南美白对虾自身免疫力是应对南美白对虾疾病爆发的重要途径。酵母培养物(Yeast Culture)是在一定工艺条件下酵母菌在特定培养基经过深度发酵而得到的微生态制品,含有丰富的寡糖、有机酸、小肽、维生素及未知生长因子等成分。已有研究表明,饲料中添加酵母培养物有提高水产动物生长性能、改善肠道健康和提高机体免疫力的作用[2-5]。本研究在南美白对虾基础饲料中添加不同浓度的酵母培养物,探讨酵母培养物对南美白对虾生长性能和免疫指标的影响,为其在南美白对虾饲料中的应用提供理论基础。
1 材料与方法
1.1 试验材料 酵母培养物(益康乐)由北京中农弘科生物技术有限公司提供,主要营养成分见表1,南美白对虾由福建漳州某水产养殖场提供。
1.2 试验设计与日粮组成 试验用虾经过1周驯化饲养后,选择规格一致、初始均重为(5.37±0.18)g、体质健壮的个体600尾,随机分成4组。以基础饲料作为对照组,在基础饲料中分别添加0.3%、0.5%、1.0%的酵母培养物作为3个试验组。每组3个重复,每个重复50尾,基础饲料配方及营养成分见表2。饲料原料粉碎后过60目筛,混合均匀后压制成粒径为1.5 mm的饲料,冷藏储存备用。
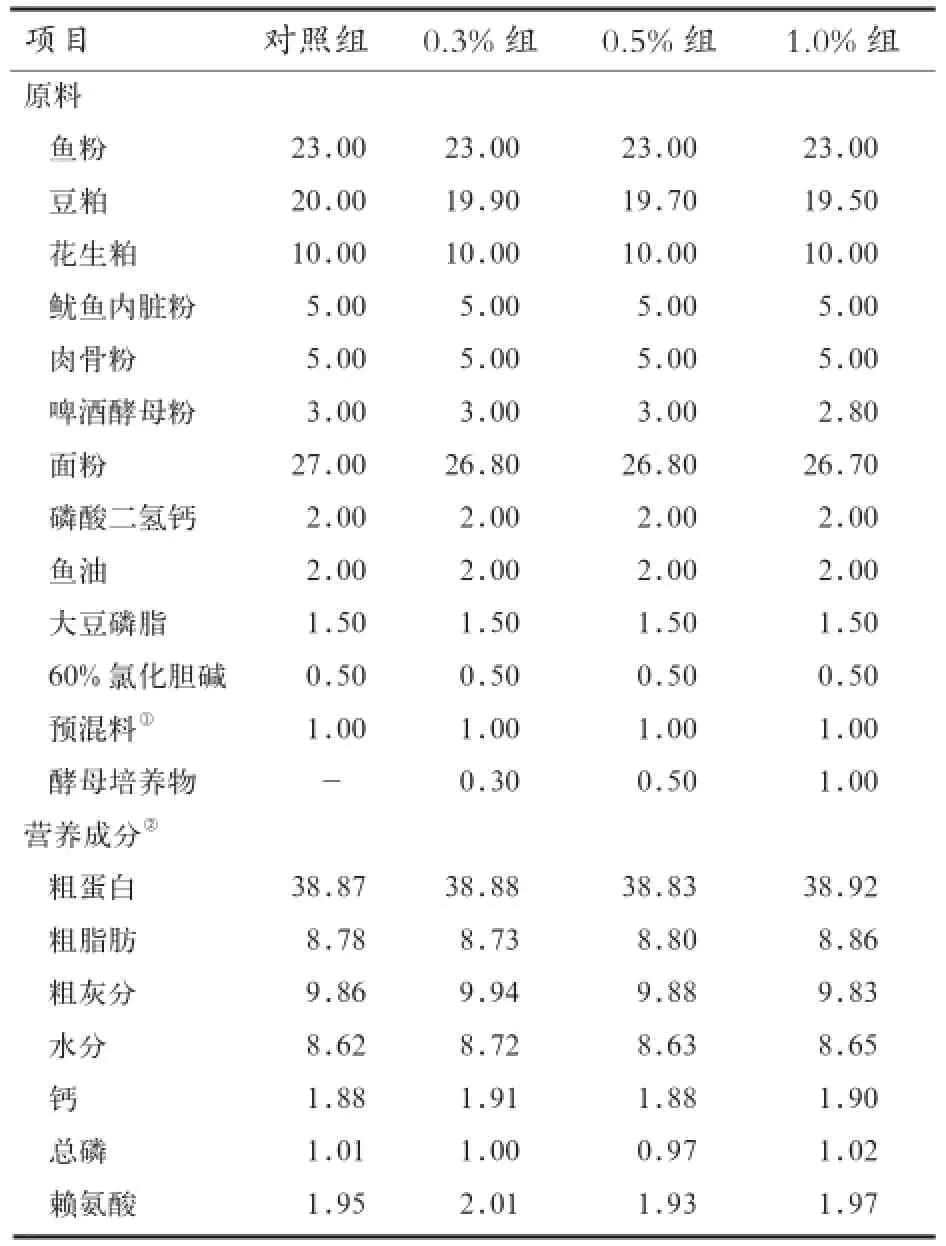
表2 基础日粮组成及营养成分 %
1.3 饲养管理 试验在福建漳州某水产养殖场内一个3 300 m2左右的池塘内进行,共12个网箱,网箱规格为1 m×1 m×1 m。试验期为45 d,饲料每天投喂3次(06:00、12:00和18:00),早晚投喂量占总量的60%,日投饲率为体重的5%左右。试验期间水温为(25±2.0)℃,溶解氧>5.0 mg/L,pH为7.5~8.5,氨氮<0.2 mg/L,亚硝酸盐<0.01 mg/L。
1.4 指标测定与方法
1.4.1 生长指标测定 养殖试验结束后,试验虾在网箱中停食24 h,然后逐箱起捕,计数、称重,计算增重率、饲料系数、成活率。
增重率=(末体质量-初体质量)/初体质量×100%
饲料系数=摄食量/(末体质量-初体质量)
成活率=试验末对虾尾数/试验初对虾尾数×100%
1.4.2 消化酶活性测定 养殖试验结束后,每个网箱随机选取对虾15尾,分别取出肠道和肝胰腺,肠道去除粪便,于-80℃冰箱保存备用。测定时,将上述组织在4℃解冻,于10倍体积双蒸水中冰浴匀浆。在4℃下离心30 min(10 000 r/min),取上清液备用。
蛋白酶活性的测定采用福林-酚法,以37℃每分钟水解酶蛋白产生1 μg酪氨酸为1个酶活力单位。酶液蛋白含量的测定采用考马斯亮兰法。
1.4.3 非特异性免疫指标测定 养殖试验结束后,试验虾在网箱中停食24 h,每个网箱取对虾15尾,用1 mL的无菌注射器抽取对虾心脏血液,4℃静置过夜,然后3 000 r/min离心10 min,取上清液于-20℃冰箱保存待测。
酚氧化酶活性测定采用Ashida[6]的方法。将100 μL浓度为0.01 mol/L的L-dopa加入到3.0 mL磷酸钾缓冲液(0.1 mol/L,pH为6.0)中,混匀,再加入100 μL血清,混匀,于490 nm波长下读取光密度值。以试验条件下每分钟OD490增加0.001为一个酶活力单位。
溶菌酶活性测定采用比浊法,参照Hultmark等[7]的方法,以溶壁微球菌(Micrococcus lysodeikticus)冻干粉(购于南京建成生物工程研究所)为底物,用 0.1 mol/L的PBS缓冲液(称取 13.97 g K2HPO4和2.69 g KH2PO4溶于蒸馏水中,定容到1 000 mL,pH为7.4)配制成底物悬液(OD570=0.3)。取3 mL悬液加入试管中,分别加入待测样品和标准品(购于南京建成生物工程研究所)混匀,分别测定570 nm处吸光度值T样0和T标0,然后将试液移入37℃水浴中30 min,取出后立即置于冰浴中10 min终止反应,测定其吸光度值T样和T标。溶菌酶活力UL计算公式:

超氧化物歧化酶采用南京建成生物工程研究所的试剂盒进行测定,具体方法参考试剂盒说明书进行。超氧化物歧化酶活性定义为每毫升血清中超氧化物歧化酶抑制率达50%时所对应的超氧化物歧化酶的量为1个酶活单位。
1.5 统计分析 数据统计采用SPSS 14.0版统计软件中One-Way过程进行方差分析,并进行Duncan's法多重比较,显著水平为0.05,结果采用平均值±标准差表示。
2 结 果
2.1 生长性能 由表3可知,相比对照组,0.3%、0.5%、1.0%酵母培养物组增重率分别提高了8.50%、16.74%、9.48%(P<0.05);饲料系数分别降低了7.69%、9.79%、9.09%(P<0.05)。对虾成活率在91.00%~96.00%,各组之间差异不显著(P>0.05)。
2.2 蛋白酶活性 由表4可知,与对照组相比,0.3%、0.5%、1.0%酵母培养物对虾肝胰腺蛋白酶活性分别提高了13.35%、16.26%、14.94%(P<0.05),添加酵母培养物有提高南美白对虾肠道蛋白酶活性的趋势(P>0.05)。
2.3 非特异性免疫酶活性 由表5可知,相比对照组,各试验组南美白对虾酚氧化酶和溶菌酶活性得到了显著提高(P<0.05),而添加酵母培养物对南美白对虾超氧化物歧化酶活性影响不显著(P>0.05)。
3 讨 论
在饲料中添加酵母培养物可促进水产动物生长已有大量报道。刘哲等[8]在建鲤饲料中添加0.5%的酵母培养物,显著提高了建鲤的生长性能,饵料系数降低了19.34%。李高锋等[9]报道,0.2%的酵母培养物能提高团头鲂特定生长率12.95%,饵料系数降低9.87%。Robinette等[10]研究表明,在饲料中添加0.12%酵母培养物提高了斑点叉尾增重率22%,饵料系数降低15%。在本研究中,饲料中添加0.5%酵母培养物能显著提高南美白对虾增重率25.81%,降低饵料系数12.59%。酵母培养物能提高动物的生长性能与其含有丰富的寡糖、有机酸、小肽、维生素等活性成分有关。酵母培养物通过改善肠道健康、促进消化酶活性,提高机体对营养物质的消化、吸收利用[11-12],从而促进水产动物生长。在本试验条件下,饲料中添加0.3%、0.5%、1.0%酵母培养物均能促进南美白对虾生长,最佳添加量为0.5%,但在栗雄高等[13]的报道中,饲料中仅添加0.075%和0.1%酵母培养物能显著提高南美白对虾生长性能,这可能与酵母培养物的生产工艺、产品剂型有关。
水产动物中肝胰脏及肠道蛋白酶活性能够直接影响机体对营养物质的吸收利用程度,从而影响水产动物的生长[14]。本研究中,酵母培养物能显著提高南美白对虾肝胰腺蛋白酶活性,同时有提高南美白对虾肠道蛋白酶活性趋势,但各组之间差异不显著,这与栗雄高等[13]的研究结果相似。酵母培养物对机体消化酶活性的影响可能与其含有丰富的有机酸有关,有机酸解离出的H+能够降低消化道pH,从而提高消化器官蛋白酶活性[15],具体机理有待进一步研究。
溶菌酶和酚氧化酶等指标常用来表征对虾等甲壳动物的非特异性免疫机能[16]。在本研究中,酵母培养物能显著提高南美白对虾酚氧化酶活性及溶菌酶活性,这与在牙鲆[17]、黄颡鱼[5]、刺参[18]等水产动物中的报道一致。酵母培养物是一种复杂的发酵产物,它能提高南美白对虾免疫指标可能与其含有丰富的β-葡聚糖、甘露寡糖、有机酸、核苷酸等多种活性成分有关。β-葡聚糖作为一种天然免疫增强剂,在多种甲壳动物中进行了大量的研究[19-21],它可激活甲壳动物酚氧化酶原系统,促进细胞因子的释放、溶菌酶等的分泌[22];甘露寡糖可提高吞噬细胞活性,能与某些病毒、毒素等抗原结合,减缓抗原吸收,还能促进有益菌的繁殖[23]。另外也有研究表明,有机酸、核苷酸对提高甲壳动物机体非特异性免疫也有积极作用[24-25],具体机理有待进一步研究。
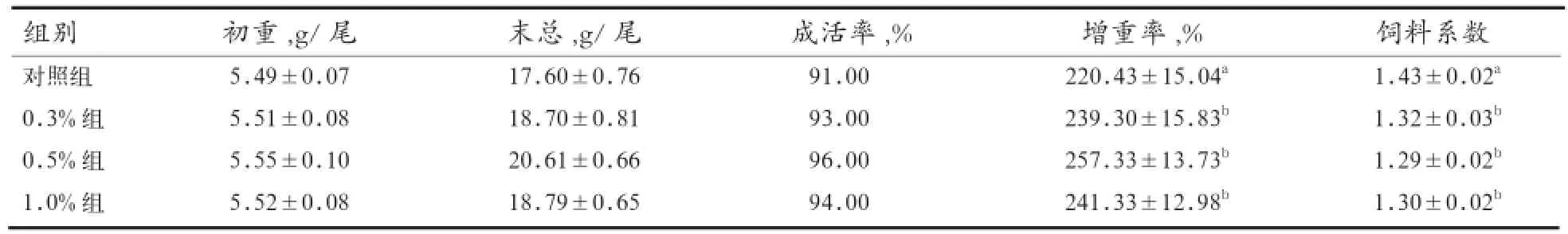
表3 酵母培养物对南美白对虾生长性能的影响

表4 酵母培养物对南美白对虾蛋白酶的影响 U/mg Prot

表5 酵母培养物对南美白对虾血清非特异性免疫酶活性的影响 U/mL
4 小 结
饲料中添加酵母培养物能显著提高南美白对虾生长性能和肝胰腺蛋白酶活性,可显著提高南美白对虾部分非特异性免疫指标。酵母培养物在南美白对虾饲料中最佳添加水平为0.5%。
[1] 王雷, 李光友. 甲壳动物的体液免疫研究进展[J]. 海洋科学, 1992, 16(3): 18-19.
[2] 李高锋, 叶元土, 张俊, 等. 酵母培养物对团头鲂生长的影响[C]. 昆明: 中国水产学会学术年会, 2008.
[3] 赵贵萍. 不同豆粕水平的饲料中添加一种酵母培养物(益康XP)对大菱鲆生长、组织学结构以及肠道菌群的影响[D]. 青岛: 中国海洋大学, 2008.
[4] 徐磊, 刘波, 谢骏, 等. 酵母培养物对异育银鲫生长、血液生化及免疫的影响[J]. 江苏农业科学, 2010, (6): 371-374.
[5] 陈昌福. 酵母培养物对黄颡鱼非特异性免疫功能的调节作用[J]. 饲料与畜牧:新饲料, 2013, (5): 9-12.
[6] Ashida M. Purification and characterization of prophenoloxidase from the hemolymph of the silkworm Bombyx morí[J]. Arch Biochem Biophys, 1971,144(2): 749-762.
[7] Hultmark D, Steiner H, Rasmuson T, et al. Insect immunity. Purification and properties of three inducible bactericidal proteins from hemolymph of immunized pupae of Hyalophora cecropia[J]. Eur J Biochem, 1980, 106(1): 7-16.
[8] 刘哲, 魏时来. 酵母培养物对建鲤生长性能影响的研究[J]. 饲料工业, 2003, 24(4): 52-53.
[9] 李高锋, 叶元土, 林炳贤, 等. 酵母培养物对团头鲂生长的影响[J]. 饲料工业, 2009, 30(22): 17-22.
[10] Robinette H R, Constance Y, 孟繁伊. 酵母培养物对斑点叉尾 幼鱼生长性能的影响[J]. 饲料工业, 2011, 32(6): 25-27.
[11] 邱燕, 叶元土, 蔡春芳, 等. 酵母培养物对草鱼(Ctenopharyngodon idellus)生长性能与肠道粘膜形态的影响[J]. 饲料工业, 2010, 31(18): 15-17.
[12] 姚仕彬, 叶元土, 蔡春芳, 等. 酵母培养物水溶物对离体草鱼肠道黏膜细胞生长及细胞膜完整性的影响[J]. 动物营养学报, 2014, 26(11): 3478-3484.
[13] 粟雄高, 李小勤, 冷向军, 等. 酵母培养物和芽孢杆菌对南美白对虾生长、蛋白酶活性和免疫性能的影响[J]. 海洋渔业, 2012, 34(2): 168-176.
[14] 唐黎, 王吉桥, 程骏驰, 等. 水产动物消化酶的研究[J].饲料工业, 2007, 28(2): 28-31.
[15] Luckstadt C, Luckstadt C. The use of acidifiers in fish nutrition[J]. Cab Reviews: Perspectives in Agriculture Veterinary Science Nutrition and Natural Resources, 2008, 3(44): 1-9.
[16] 黄旭雄, 周洪琪, 宋理平. 急性感染对中国明对虾非特异免疫水平的影响[J]. 水生生物学报, 2007, 31(3): 325-331.
[17] 温俊. 复合益生菌与酵母培养物对牙鲆(Paralichthys olivaceus)生长、免疫及抗病力的影响[D]. 青岛: 中国海洋大学, 2007.
[18] 张琴. 刺参(Apostichopus japonicus Selenka)高效免疫增强剂的筛选与应用[D]. 青岛: 中国海洋大学, 2010.
[19] 阳会军, 谭北平, 方怀义. 饲料中添加不同水平β-葡聚糖对斑节对虾生长、存活及其抗病力的影响[J]. 饲料工业, 2001, 22(9): 18-19.
[20] 陈云波, 周洪琪, 华雪铭, 等. 饲料中添加β-葡聚糖对南美白对虾的生长、存活及饲料系数的影响[J]. 淡水渔业, 2002, 32(5): 55-56.
[21] 余水法, 蔡春芳, 宋学宏,等. β-葡聚糖对河蟹免疫功能的影响[J]. 中国饲料, 2006, (5): 20-22.
[22] Cleary J A, Kelly G E, Husband A J. The effect of molecular weight and beta-1,6-linkages on priming of macrophage function in mice by (1,3)-beta-D-glucan[J]. Immunol Cell Biol, 1999, 77(5): 395-403.
[23] 陈小兵, 丁宏标, 乔宇. 甘露寡糖的益生作用、免疫机制与应用技术[J]. 中国畜牧兽医, 2005, 32(8): 6-8.
[24] Safari O, Shahsavani D, Paolucci M, et al. The ef f ects of dietary nucleotide content on the growth performance, digestibility and immune responses of juvenile narrow clawed crayfish, Astacus leptodactylus leptodactylus Eschscholtz, 1823[J]. Aquac Resh, 2015, 46(11): 2685-2697.
[25] Romano N, Koh C B, Ng W K. Dietary microencapsulated organic acids blend enhances growth, phosphorus utilization, immune response, hepatopancreatic integrity and resistance against Vibrio harveyi in white shrimp, Litopenaeus vannamei[J]. Aquaculture, 2015, 435(3): 228-236.
S945.1
A
10.19556/j.0258-7033.2017-04-108
2017-01-20;
2017-02-14
2016年北京市科技型中小企业促进专项项目(Z160 10101463)
刘明(1981-),男,山东莱阳人,硕士,主要从事绿色饲料及饲料添加剂研发工作,E-mail:liuming@ hongkebio.cn
* 通讯作者:戴刚,硕士,主要从事绿色饲料及饲料添加剂研发工作,E-mail:daigang@hongkebio.cn
