美洲大蠊提取物对大鼠卵巢卵泡发育的影响
2017-04-17隋世燕张成桂徐取尉杨杰予
隋世燕,张成桂,徐取尉,梁 先,杨杰予
(1. 大理大学云南省昆虫生物医药研发重点实验室,云南大理 671000;2. 大理大学农学与生物科学学院,云南大理 671003)
美洲大蠊提取物对大鼠卵巢卵泡发育的影响
隋世燕1,2,张成桂1,徐取尉2,梁 先2,杨杰予2
(1. 大理大学云南省昆虫生物医药研发重点实验室,云南大理 671000;2. 大理大学农学与生物科学学院,云南大理 671003)
实验旨在研究美洲大蠊提取物是否对大鼠卵巢卵泡发育产生影响。将成年SD大鼠随机分为3组,对照组(9 mL/kg,生理盐水)5只,低剂量组(9 mL/kg,0.03 g/mL美洲大蠊提取物)6只、高剂量组(9 mL/kg,0.09 g/mL美洲大蠊提取物)6只。每隔1 d灌胃一次,30 d后采集卵巢。结果表明:与对照组相比,低剂量组大鼠的卵巢重和卵巢体重比以及高剂量组大鼠的体重和卵巢重均显著增加(P<0.05);高、低剂量组大鼠卵巢原始卵泡的数目均显著减少(P<0.05),成熟卵泡显著增多(P<0.05);生长发育相关基因BMP4、GDF9的表达显著上调(P<0.05);低剂量组IGF-Ⅰ基因的表达有升高的趋势(P=0.058),但高剂量组则显著上调(P<0.05); 3个组间凋亡相关基因Bcl-2、BAX、Fas、FasL和Caspase-3的表达均无显著性差异;但高剂量组使增殖相关基因的表达有升高的趋势(P=0.06),使Ki67基因的表达显著升高PCNA(P<0.05)。本实验条件下,美洲大蠊提取物能够加快大鼠卵泡的发育,促进卵巢卵泡的成熟。
美洲大蠊提取物;卵巢发育;基因表达;卵泡数目;卵巢;大鼠
在养猪生产实践中,营养、环境和管理因素均可以引起猪机体氧自由基过量生成或细胞内抗氧化防御系统受损而产生氧化应激[1]。氧化应激会降低母猪的繁殖性能,使其产仔性能降低[2]。
美洲大蠊(Periplaneta Americana)俗称蟑螂,其提取物具有显著的抗菌、抗病毒、抗肿瘤、抗肝硬化和增强免疫的作用[3-4],有文献报道,日粮中添加2%的美洲大蠊虫粉能够使4、6、8、10周龄鸡的血清总SOD活力和GSH-PX活力显著升高,血清MDA含量显著降低[5]。可见,美洲大蠊具有较强的抗氧化功能。卵巢是影响雌性动物繁殖性能的重要器官,但是美洲大蠊提取物对卵巢发育方面的研究却未见报道。
在卵泡发生过程中,生长分化因子-9(Growth Differentiation Factor-9,GDF-9)是原始卵泡进一步发育的必须信号[6]。骨形态发生蛋白4(BoneMorphogenetic Protein 4,BMP4)能够促进卵巢原始卵泡向初级卵泡转变[7],BMP15能够调节卵母细胞的募集,促进其发育[8],卵泡的发育成熟还需要IGF-Ⅰ的推动[9]。
卵泡在发育的过程中伴随着闭锁和细胞凋亡,异常的细胞凋亡能够减少可用卵泡的数目,抑制动物的繁殖性能。目前,细胞凋亡有3种机制:一种是细胞表面受体通路,如凋亡蛋白-1/Fas配体(Fas/FasL)通路[7];第2种是线粒体介导的机制,如Bcl-2家族[10],BAX与Bcl-2二者的比值常被用来评价卵泡的凋亡水平[11];第3种是内质网应激介导的死亡通路。这3种机制最终都激活Caspase通路,引起细胞凋亡[12]。Caspase-3位于这些级联反应的下游,是细胞发生死亡的实施者[12]。PCNA和Ki-67抗原作为增殖基因能够促进卵巢上卵泡的发育 [10,13]。
因此,本实验以SD大鼠为研究对象,通过研究美洲大蠊提取物对成年大鼠卵巢卵泡数目和卵巢发育、凋亡以及增殖相关基因表达的影响,探讨其对动物卵巢功能的生理作用,为下一步的机理研究奠定基础。
1 材 料
1.1 研究对象
1.1.1 实验动物 实验使用17只体重为230~250 g的成年雌性SD大鼠,均购自大理大学实验动物中心。大鼠适应1周后,按照随机数字表并结合体重随机分为3组,分别为对照组5只、高剂量组6只、低剂量组6只。将大鼠按组分笼喂养,自由采食和饮水,动物房温度控制在20~24℃。
1.1.2 美洲大蠊提取物的制取和稀释 成年美洲大蠊处死后,晾干,将虫体粉碎,用15倍量的95%乙醇进行冷浸提取3次,然后去除脂肪,沉淀物放入-40℃保存备用。实验前,用蒸馏水将美洲大蠊提取物分别稀释为高剂量组(0.09 g/mL)和低剂量组(0.03 g/mL)。
1.1.3 实验大鼠处理 大鼠适应1周后进行灌胃,对照组灌胃生理盐水,高剂量组、低剂量组分别灌胃相应剂量的美洲大蠊提取物。基于前人研究[14],试验确定3个组的添加剂量为每千克体重添加9 mL生理盐水或美洲大蠊提取物。每隔1 d灌胃1次,每4 d测1次体重,实验大鼠喂养30 d后进行采样。
1.1.4 实验材料的采集 采样时腹腔注射10%的水合氯醛(2 mL/kg体重)麻醉大鼠,打开腹腔后快速摘取两侧的卵巢,称重后将左侧的卵巢和右侧的一半卵巢放入EP管中,右侧的另一半卵巢放入4%的多聚甲醛中,将卵巢置-40℃保存备用。
1.2 主要试剂 多聚甲醛购自上海凌峰化学试剂有限公司;Trizol试剂盒购自上海Life Technologies生物技术有限公司;反转录试剂盒购自北京天根生化科技有限公司;含SYBR Green的DNA聚合酶购自大连宝生物工程有限公司;引物由上海捷瑞生物技术有限公司合成;美洲大蠊提取物;10%水合氯醛;生理盐水;75%酒精。

表1 基因表达引物序列
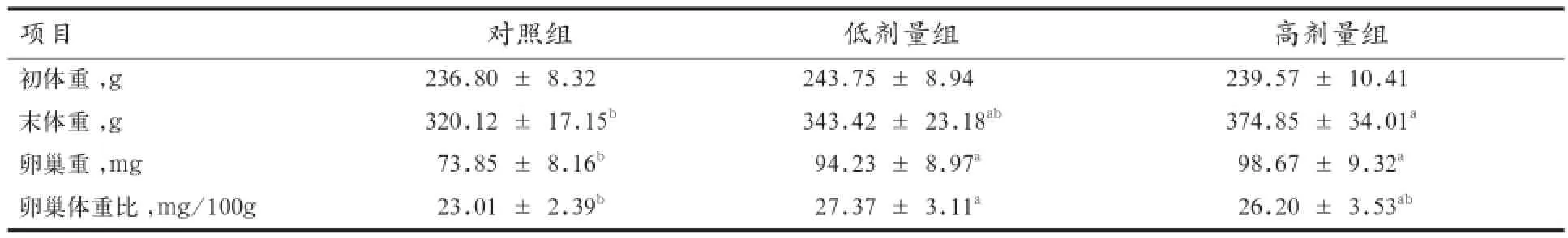
表2 大鼠的体重、卵巢重及卵巢体重比
1.3 主要仪器 光学显微镜(OLYMPUS,CX21),美国Thermo Fisher Scientific公司;NanoDrop分光光度计(ND-1000),美国Thermo公司;普通PCR仪(Gene Amp PCR system 9600), 美 国 Perkins Elmer公司;实时荧光定量PCR仪(Mx3000P),美国Stratagene公司。玻璃匀浆器,电子天平,移液枪,超净工作台,高压消毒锅,干燥箱,冰箱。
1.4 方法
1.4.1 组织切片的制作 卵巢固定12 h后,送到大理学院附属医院病理科制作组织切片,每个卵巢切4张片子。
1.4.2 卵泡数目的分析 依据Cheng等[15]报道的方法进行卵泡分类。在显微镜下记录各个切片中各级卵泡的数目,每张片子数2遍。
1.4.3 RNA的提取 根据商品说明书,使用Trizol试剂盒提取卵巢总RNA,然后用NanoDrop分光光度计测定总RNA的浓度,测得的值控制在2 000 ng/μL之内,最后取5 μg RNA稀释到500 ng/μL,用于RNA反转录。
1.4.4 反转录 根据反转录试剂盒说明书,在普通PCR仪上进行反转录。反转录产物放于4℃冰箱。
1.4.5 引物设计 内参基因GAPDH和目的基因的引物根据GenBank上大鼠的相关cDNA序列进行设计,软件为Primer premier 5.0,引物序列见表1。
1.4.6 PCR扩增反应 将cDNA原液稀释10倍,使用实时荧光定量PCR检测目的基因的mRNA表达,其体系:cDNA 2 μL,1 μmol/L目的或内参引物2 μL,高压三蒸水6 μL,含SYBR Green的DNA聚合酶10 μL,共20 μL。PCR反应条件:95℃预变性3 min;95℃变性30 s,64℃退火20 s,72℃延伸20 s,共40个循环。统计方法使用2-ΔΔCt法[16]。
1.5 统计分析 计算每张切片上各级卵泡的比例,分别把对照组化为1,基因表达的数据也把对照组化为1。所有数据用平均值±标准误表示,采用SPSS17.0 for Windows软件中单因素方差分析(One-Way ANOVA)进行统计分析,与对照组相比较,P<0.05为差异显著。
2 结 果
2.1 美洲大蠊提取物对大鼠体重、卵巢重及卵巢体重比的影响 由表2可知,实验开始时3个组大鼠的平均体重无显著差异(P>0.05),而实验结束时,高剂量组大鼠的平均体重显著高于对照组(P<0.05),高剂量组和低剂量组大鼠的卵巢重也显著高于对照组(P<0.05),而低剂量组卵巢体重比显著高于对照组(P<0.05)。
2.2 美洲大蠊提取物对大鼠卵巢卵泡数目的影响由图1A和1E知,与对照组相比,高剂量组和低剂量组的美洲大蠊提取物均使大鼠卵巢原始卵泡的数目显著减少(P<0.05),成熟卵泡的数目显著增加(P<0.05),高剂量组和低剂量组之间没有显著性差异(P>0.05)。由图1B、1C和1D知,卵巢上初级卵泡、次级卵泡和有腔卵泡的数目在3个组之间均没有显著性差异(P>0.05)。
2.3 美洲大蠊提取物对大鼠卵巢发育相关基因表达的影响 由图2A、2B可知,与对照组相比,高剂量组和低剂量组均显著升高了大鼠卵巢GDF9和BMP4基因的表达(P<0.05)。由图2C可知,3个组间BMP15基因的表达均无显著差异(P>0.05)。由图2D可知,与对照组相比,低剂量组有上调大鼠卵巢IGF-Ⅰ基因表达的趋势(P=0.058),而高剂量组则显著升高了该基因的表达(P<0.05)。
2.4 美洲大蠊提取物对卵巢凋亡和增殖相关基因表达的影响 由图3A、3B和3C知,3个组间卵巢凋亡相关基因BAX、Bcl-2、BAX/Bcl-2、Fas、FasL和Caspase-3的表达均无显著差异(P>0.05)。但是,由图3D知,与对照组相比,高剂量组大鼠卵巢PCNA基因的表达有升高的趋势(P=0.06),Ki67基因的表达显著上调(P<0.05)。
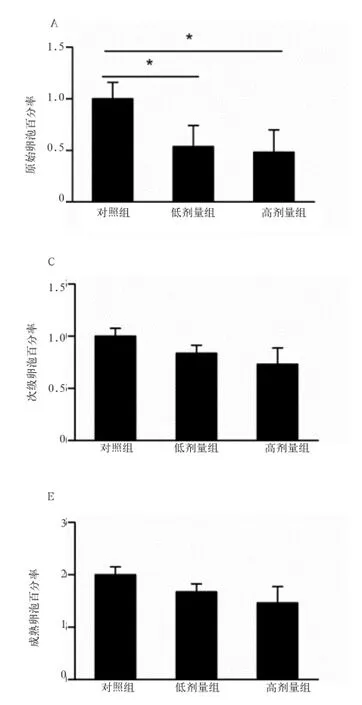
图1 美洲大蠊提取物对卵巢卵泡数目的影响
3 讨 论
通过实验发现,高剂量组的美洲大蠊提取物能够增加大鼠的体重和卵巢重,低剂量组的美洲大蠊提取物则提高了大鼠的卵巢重和卵巢体重比,说明一定剂量的美洲大蠊提取物对大鼠卵巢发育具有潜在的影响。
尽管有报道[17]称成年动物卵巢上有生殖系干细胞可以分化为原始卵泡,但目前仍然普遍认为雌性动物在出生时便拥有了一生中所有的原始卵泡,而且每一个原始卵泡均有3种状态:保持静止;被激活后在某一阶段发生闭锁;能够正常发育、成熟,最后排卵。原始卵泡按一定的速率不断发育成为初级卵泡、次级卵泡、有腔卵泡和成熟卵泡等各期生长卵泡,成熟卵泡的数目在一定程度上决定着动物的产子数。本实验结果表明,高剂量组和低剂量组的美洲大蠊提取物均使大鼠卵巢原始卵泡的数目显著减少,成熟卵泡的数目显著增加,这是因为美洲大蠊提取物可能加速了大鼠卵巢卵泡的发育,促进了成熟卵泡的形成,增加了大鼠可排卵的卵泡数目。为了初步探明原因,对卵巢发育和凋亡、增殖相关基因的表达水平进行了检测。
GDF9对早期卵母细胞分化和生长有重要的调节作用。在小鼠和绵羊上有研究发现,GDF9缺陷会导致卵巢虽能形成原始卵泡和初级卵泡,但初级卵泡形成后卵泡发育将停滞于单层颗粒细胞的初级阶段,卵泡不再继续发育,母体不能孕育后代[18]。本实验发现,高剂量组和低剂量组的美洲大蠊提取物均使大鼠卵巢GDF9基因表达显著升高,说明美洲大蠊提取物能够促进卵巢卵泡的发育。

图2 美洲大蠊提取物对卵巢发育相关基因表达的影响

图3 美洲大蠊提取物对卵巢凋亡和增殖相关基因表达的影响
BMP4能够促进原始卵泡向初级卵泡的转变。已有研究发现,使用外源BMP4体外培养大鼠,卵巢上初级卵泡的比例显著增加,而原始卵泡显著减少[18];相反,使用BMP4的抗体在体处理小鼠,卵巢上初级卵泡的数目显著减少,而原始卵泡的数目显著增加[19]。本研究发现,高剂量组和低剂量组的美洲大蠊提取物均使大鼠卵巢BMP4基因的表达显著升高,与GDF9基因的结果一致。
Bachelot等[18]研究发现,敲除IGF-Ⅰ基因后,小鼠的卵泡在无腔卵泡期或有腔卵泡的早期即停止了发育,并且不排卵,说明IGF-Ⅰ能够促进小鼠卵泡的发生。本实验发现,低剂量组的美洲大蠊提取物使大鼠卵巢IGF-Ⅰ基因的表达有显著升高的趋势,而高剂量组则显著上调了该基因的表达,进一步说明美洲大蠊提取物对卵巢卵泡发育的促进作用。
卵泡闭锁是一种正常的生理过程,细胞凋亡是卵泡闭锁的主要原因[20]。本实验发现,美洲大蠊提取物高、低剂量组对BAX、Bcl-2、BAX/Bcl-2、FasL、Fas和Caspase-3凋亡相关基因的表达均没有显著影响,但是高剂量组显著上调了卵巢增殖相关基因Ki67的表达,对PCNA基因的表达有显著升高的趋势。Ki-67被认为是细胞增殖的重要标记物[13],PCNA的表达对鉴别卵巢细胞的增殖有一定的实用价值[10]。
综上所述,一定量的美洲大蠊提取物能够加快大鼠卵巢卵泡的发育,促进成熟卵泡的形成,GDF9、BMP4和IGF-Ⅰ基因可能参与了其调控过程。但本实验只是从卵泡数目和相关基因表达方面进行了初步探讨,其分子机制还有待进一步研究。
[1] 陈伟, 曾勇庆. 猪的氧化应激及其遗传育种的研究进展[J]. 猪业科学, 2011, (12): 112-114.
[2] 高开国, 胡友军, 郑春田, 等. 母猪的氧化应激及营养调控策略[J]. 养猪, 2014, (5): 17-20.
[3] 王晶, 李鑫. 美洲大蠊提取物对人肝癌细胞Bel-7402作用机制的研究[J]. 中国现代应用药学, 2012, (10): 876-880.
[4] 段丽芳. 美洲大蠊提取物抗实验性小鼠肝纤维化的初步研究[D]. 昆明: 昆明医学院, 2010.
[5] 周琼, 李忠荣, 刘景. 美洲大蠊对肉鸡免疫功能与抗氧化能力的影响[J]. 福建农林大学学报(自然科学版), 2009, 38(2): 175-180.
[6] Knight P G, Glister C. TGF-β superfamily members and ovarian follicle development[J]. Reproduction, 2006, 132(2): 191-206.
[7] Nilsson E E, Skinner M K. Bone morphogenetic protein-4 acts as an ovarian follicle survival factor and promotes primordial follicle development[J]. Biol Reprod, 2003, 69(4): 1265.
[8] Martins F, Celestino J, Saraiva M, et al. Growth and differentiation factor-9 stimulates activation of goat primordial follicles in vitro and their progression to secondary follicles[J]. Reprod Fert Dev, 2008, 20(8): 916-924.
[9] Gomez J M, Mourot B, Fostier A, et al. Growth hormone receptors in ovary and liver during gametogenesis in femal rainbow trout (Oncorhynchus mykiss)[J]. J Reprod Fertil, 1999, 115(2): 275-285.
[10] Xu B, Hua J, Zhang Y, et al. Proliferating cell nuclear antigen (PCNA) regulates primordial follicle assembly by promoting apoptosis of oocytes in fetal and neonatal mouse ovaries[J]. PLoS One, 2011, 6(1): e16046.
[11] Rd R E, Dierisseau P, Wagner K U, et al. Bcl-x and Bax regulate mouse primordial germ cell survival and apoptosis during embryogenesis[J]. Mol Endocrinol, 2000, 14(7): 1038-1052.
[12] Liu J, Jiang Y, Mao J, et al. High levels of glucose induces a dose-dependent apoptosis in human periodontal ligament fibroblasts by activating caspase-3 signaling pathway[J]. Appl Biochem Biotechnol, 2013, 170(6): 1458-1471.
[13] 孙明霞, 梦雅平, 张军力. Ki-67抗原在临床疾病中的研究进展[J]. 内蒙古医学杂志, 2009, 41(11):1336-1337.
[14] 甘平, 张旭强, 何旭, 等. 美洲大蠊醇提物对小鼠急性肝损伤的保护作用[J]. 现代药物与临床, 2001, 26(2): 123-128.
[15] Cheng G, Weihua Z, Makinen S, et al. A role for the androgen receptor in follicular atresia of estrogen receptor beta knockout mouse ovary[J]. Biol Reprod, 2001, 66(1): 77-84.
[16] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2^-ΔΔCT method[J]. Methods, 2001, 25(4): 402-408.
[17] Johnson J, Bagley J, Skaznik-Wikiel M, et al. Oocyte generation in adult mammalian ovaries by putative germ cells in bone marrow and peripheral blood[J]. Cell, 2005, 122(2): 303-315.
[18] Bachelot A, Monget P, Imbert-Bolloré P, et a1. Growth hormone is required for ovarian follicular growth[J]. Endocrinology, 2002, 143(10): 4104- 4112.
[19] Tanwar P S, O'Shea T, McFarlane J R. In vivo evidence of role of bone morphogenetic protein-4 in the mouse ovary[J]. Anim Reprod Sci, 2008, 106(3): 232-240.
[20] Ding W, Wang W, Zhou B, et al. Formation of primordial follicles and immunolocalization of Pten, Pkb and Foxo3a proteins in the ovaries of fetal and neonatal pigs[J]. J Reprod Develop, 2010, 56(1): 162-168.
Ef f ect of Periplaneta Americana Extract on Follicular Development of Ovary in Rats
SUI Shi-yan1,2, ZHANG Cheng-gui1, XU Qu-wei2, LIANG Xian2, YANG Jie-yu2
(1. Yunnan Provincial Key Laboratory of Entomological Biopharmaceutical R&D, Dali University, Yunnan Dali 671000, China; 2. College of Agronomy and Bioscience, Dali University, Yunnan Dali 671003, China)
To study the ef f ect of periplaneta americana extract on follicular development of ovary in rats. The adult SD rats were randomly assigned to three groups. The control group of 5 rats were only f i lled with physiological saline (9 mL/ kg) through stomach perfusion. The 6 rats were used respectively in Low dose group (9 mL/kg, 0.03g/mL) and High dose group (9 mL/kg, 0.09 g/mL) which were f i lled with periplaneta Americana extract through stomach perfusion. Rats were treated every other day. After 30 days, the ovaries were collected. Compared with control group, Low dose group showed signif i cantly increased ovary weight and ovary weight relative to body weight, and High dose group showed signif i cantly increased ovary weight and body weight (P<0.05). High and low dose group all signif i cantly decreased the number of primordial follicles of rat ovaries (P<0.05), increased the number of graaf i an follicles (P<0.05). High and low dose group signif i cantly up-regulated mRNA expression of GDF9 and BMP4 (P<0.05). But the expression of IGF-Ⅰgene tended to be higher in Low dose group (P=0.058), and was up-regulated signif i cantly in High dose group (P<0.05). It had no signif i cant dif f erence about the expression of Bcl-2, BAX, Fas, FasL and Caspase-3 among the three groups. However, High dose group had significantly higher trend about the experssion of PCNA gene (P=0.06), and significantly up-regulated the mRNA expression of ki67 (P<0.05). Periplaneta americana extract can accelerate the development of ovarian follicles of rats, and promot the formation of graaf i an follicles.
Periplaneta americana extract; The development of ovary; Gene expression; The number of follicles; Ovary; Rats
S865.1+20.3
A
10.19556/j.0258-7033.2017-04-063

2016-11-25;
2016-12-17
云南省教育厅项目(2014C110Y);大理大学博士科研启动基金项目(KYBS201406);大理大学名师工作室校内访问学者项目(201518)
隋世燕(1981-),男,博士,讲师,主要从事动物营养与繁殖方面的研究,E-mail:sysui569@163.com
