山芝麻多糖的超声辅助提取工艺优化及对α—葡萄糖苷酶的抑制活性
2017-04-15刘钱薇葛小东张钱程德林许伟邵
刘钱薇++葛小东+张钱+程德林+许伟+邵荣+云志
摘要:以山芝麻粉为原料,以蒸馏水为提取剂,以多糖提取率为考察指标,采用超声辅助法提取山芝麻多糖。在单因素试验的基础上,设计响应面试验优化山芝麻多糖提取的工艺条件,并考察山芝麻多糖对α-葡萄糖苷酶的抑制率。结果表明,最佳工艺条件为提取时间42 min、提取温度83 ℃、液料比32 mL ∶[KG-*3]1 g,在此最优条件下,山芝麻多糖的提取率达到7.676%。山芝麻多糖的紫外、红外谱图分析可知,主要官能团有O—H键、糖类中甲基的C—H对称和非对称键、C[FY=,1]O键和吡喃型糖环。比较同浓度下阿卡波糖片和山芝麻多糖对α-葡萄糖苷酶的抑制率发现,当浓度大于30 μg/mL时,山芝麻多糖的抑制率高于阿卡波糖片。综合分析可知,山芝麻多糖有明显的降血糖功效,研究结果可为山芝麻降糖产品的开发提供参考。
关键词:山芝麻多糖;提取;响应面法;α-葡萄糖苷酶
中图分类号: R284.2文献标志码: A
文章编号:1002-1302(2017)05-0183-05
山芝麻(Helicteres angustifolia L.)为梧桐科植物,其味苦、性寒,可解表清热、解毒消肿。山芝麻始载于《生草药性备要》[1],是民间常用的中草药。国内目前对山芝麻的研究主要着眼于抗炎、抗病毒[2]。潘英采用山芝麻、地胆草等制成复方感冒颗粒,用于治疗感冒[3];郭宏炳等采用岗梅、水杨梅和山芝麻制成复方岗梅冲剂,用于急性咽喉炎的治疗[4];黄权芳等采用血清药理学方法,在乙型肝炎病毒(HBV)的体外细胞培养系统中进行山芝麻抗HBV作用观察[5]。日本筑波大学张振亚等发现,山芝麻的水提物和醇提物具有降血糖、抗肿瘤的功效[6-9]。山芝麻作为一种中药材,在总体药效方面得到了广泛的认可,但对于其有效活性成分的提取分离研究还不够深入。近年来研究表明,部分天然植物多糖具有降血糖[10]、降血脂[11]、抗氧化[12]、抗凝血[13]、抗衰老[14]、增強免疫[15]等多重功效,使其成为科研人员关注的重点。
超声波法提取多糖具有分散破坏植物组织、加快溶剂萃取、缩短浸提时间等优点,既弥补了传统水提法的高能耗、低提取率的缺点,也避免了酶提法的耗时和超临界萃取法对设备的高要求[16]。本研究采用超声辅助法提取山芝麻多糖,并采用响应面法优化提取工艺,同时比较同浓度山芝麻多糖、阿卡波糖片对α-葡萄糖苷酶的抑制率。
1材料与方法
1.1材料
试验原料为山芝麻根。
试验试剂:无水葡萄糖、浓硫酸、苯酚、无水乙醇、无水碳酸钠、磷酸氢二钠、磷酸二氢钠、4-硝基苯基-β-D-吡喃葡萄糖苷、谷胱甘肽、溴化钾,购自国药科技有限公司;α-葡萄糖苷酶,购自美国Sigma公司;阿卡波糖片,购自德国拜耳公司。以上试剂均为分析纯。
1.2主要仪器设备
主要仪器与设备:XO-SM50超声微波组合反应系统,南京先欧生物科技有限公司;TGLL-18K高速冷冻离心机,太仓市华美生化仪器厂;EYELAN-1100旋转蒸发仪,埃朗科技国际贸易(上海)有限公司;FD-1A-5D冷冻干燥箱,北京博医康医疗有限公司;IRTracer-100傅里叶变换红外光谱仪,日本岛津公司;UV2310Ⅱ紫外可见分光光度仪,上海天美科学仪器有限公司。
1.3试验方法
1.3.1原料预处理将山芝麻根洗净,于50 ℃烘干、粉碎,过100目筛,再将粉末于95%乙醇中浸泡48 h,去除其中的杂质,于50 ℃烘干备用。
1.3.2葡萄糖标准曲线绘制称取适量经过105 ℃干燥的无水葡萄糖,加蒸馏水配成浓度为0.1 mg/mL的葡萄糖标准溶液,分别精确量取葡萄糖对照品溶液0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8 mL于8支试管中,分别加蒸馏水至总体积为2.0 mL,另加2.0 mL蒸馏水于1支试管中作为空白对照。采用改良的硫酸-苯酚法[17-18],在490 nm处测吸光度,以稀释的葡萄糖标样浓度C(mg/mL)为横坐标,以D490 nm为纵坐标,绘制标准曲线方程:D490 nm=0.843 5C+0.170 3,r2=0.993。
1.3.3山芝麻多糖提取及其多糖含量测定精确称取10 g山芝麻根粉末(经“1.3.1”节方法处理),在不同提取温度、时间、料液比条件下提取山芝麻多糖,对提取液进行离心(8 000 r/min,15 min),取上清液,测定提取液的体积;取 1 mL 粗多糖溶液,稀释至50 mL,采用硫酸-苯酚法测定其多糖含量(D490 nm),根据标准曲线计算山芝麻多糖提取率。剩余的提取液于55 ℃减压蒸馏至原体积的1/8~1/10,在浓缩液中加入4倍体积的无水乙醇(最终乙醇体积分数为80%),并于 4 ℃ 下静置过夜、离心,得到固体沉淀物,加少量水至固体沉淀物完全溶解,冷冻干燥得山芝麻粗多糖。多糖的提取率(Y)按式(1)计算:
Y=(D490 nm-0.170 3)×50V/(m×0.843 5)×100%。[JY](1)
式中:Y为多糖的提取率,%;V为提取液体积,mL;m为山芝麻原料的质量,g。
1.3.4α-葡萄糖苷酶的抑制率测定量取1 mL多糖样品溶液于试管中,加入2 mL 67 mmol/L pH值6.8的磷酸盐缓冲溶液,再加入0.1 mL 1 μ/mL α-葡萄糖苷酶,混匀后于 37 ℃ 温孵10 min;然后加入0.1 mL 3 mmol/L谷胱甘肽溶液,再加入0.25 mL 10 mmol/L 4-硝基苯基-β-D-吡喃葡萄糖苷起始反应。该反应于37 ℃进行20 min,加入2 mL 0.1 mol/L Na2CO3终止反应,用紫外分光光度计测定400 nm处的吸光度D400 nm[19]。试验分组设计见表1。
[JZ(]Y=[SX(](D0-DC2)-(Di-DC1)(D0-DC2)[SX)]×100%。[JZ)][JY](2)
1.3.5山芝麻多糖紫外光谱分析将山芝麻多糖样品充分溶解于超纯水中,离心后取上清液,用紫外可见分光光度计扫描其水溶液在200~400 nm范围内的吸收光谱。
1.3.6山芝麻多糖红外光谱分析将干燥的山芝麻多糖与溴化钾(KBr)混合研磨后压片,采用红外光谱检测器在 4 000~400 cm-1范围内进行扫描。
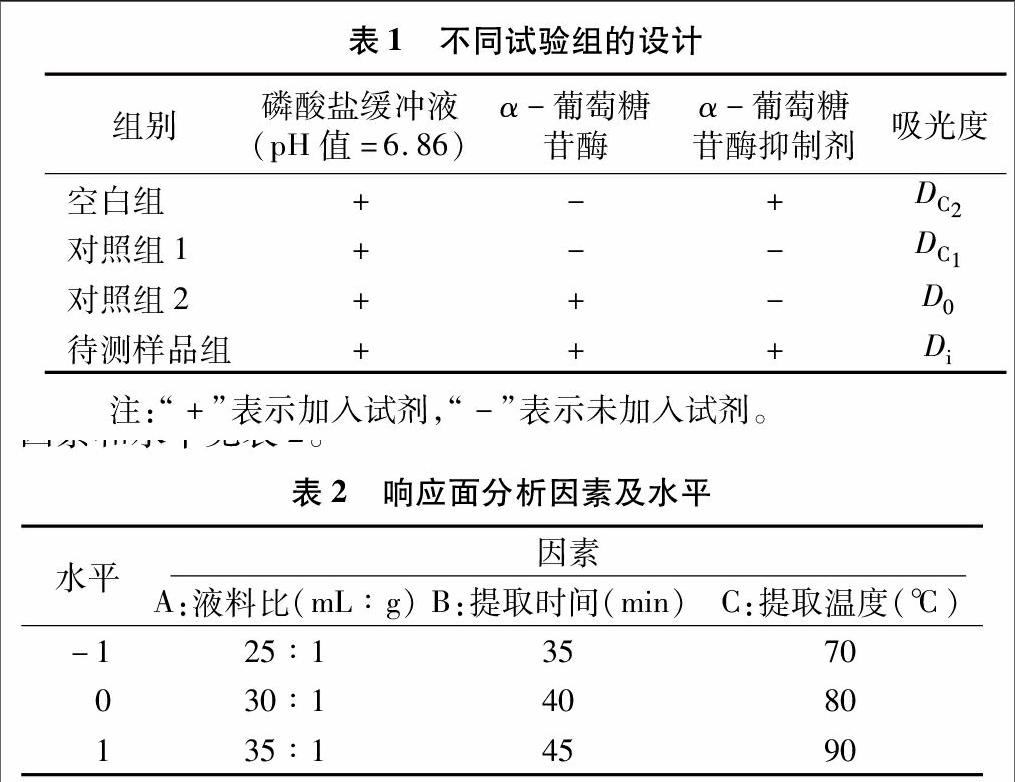
1.3.7单因素试验分别称取10 g山芝麻粉,按液料比 15 mL ∶[KG-*3]1 g、20 mL ∶[KG-*3]1 g、25 mL ∶[KG-*3]1 g、30 mL ∶[KG-*3]1 g、35 mL ∶[KG-*3]1 g、40 mL ∶[KG-*3]1 g加入蒸馏水,70 ℃超声40 min,离心(8 000 r/min,15 min),取上清液,测量提取液体积。
分别称取10 g山芝麻粉,液料比为30 mL ∶[KG-*3]1 g,在70 ℃环境下超声,时间分别为25、30、35、40、45、50 min,离心(8 000 r/min,15 min),取上清液,测量提取液的体积。
分别称取10 g山芝麻粉,液料比为30 mL ∶[KG-*3]1 g,分别在50、60、70、80、90、100 ℃超声40 min,离心(8 000 r/min,15 min),取上清液,测定提取液的体积。
以上试验结束后,均取1 mL粗多糖溶液稀释至50 mL,采用硫酸-苯酚法测定其多糖含量,并计算多糖提取率。
1.3.8响应面试验综合单因素试验结果,根据 Box-Benhnken 的中心组合试验设计原理[20],采用响应面法在3因素3水平上对山芝麻多糖的提取条件进行优化。试验因素和水平见表2。
2结果与分析
2.1单因素试验中各因素对多糖提取率的影响
由图1-a可知,当液料比从15 mL ∶[KG-*3]1g增加到30 mL ∶[KG-*3]1 g时,多糖提取率明显提高。原因是随着溶剂的增加,液固间质量浓度差增加,传质推动力加大,传质速率和提取率也相应提高[21]。当液料比达到30 mL ∶[KG-*3]1 g时,多糖的扩散达到极点,多糖提取率达到7.334%,这与郭希娟等超声提取南瓜多糖的工艺研究中的最佳液料比34 mL ∶[KG-*3]1 g接近[22]。随着液料比进一步提高到40 mL ∶[KG-*3]1 g,多糖提取率略有下降,这是由于固体内部存在传质极限,达到极限时即使增加溶剂,传质推动力也不会加大,且溶剂对超声有吸收损耗,降低了超声对细胞壁的破损[23]。考虑到浸提液在后续工序中需要浓缩,从节约原料角度考虑选择液料比为30 mL ∶[KG-*3]1 g。
由图1-b可知,随着提取时间的延长,多糖提取率在 40 min 前增加较为明显,40 min后多糖提取率略有下降。超聲的机械作用及空化效应加快了分子运动,使山芝麻细胞壁被破坏,加快溶质溶出,而超声时间过短,超声效应不明显,多糖提取率也较低[24]。在40 min多糖提取率达到极点,达到 7.502%,这与诸爱士等用超声提取海菜多糖工艺研究中的最佳提取时间45 min接近[25]。超声时间超过40 min时,提取出的山芝麻多糖会在超声作用下断键,使多糖提取率有所降低[26]。为减少能耗,节省时间,本研究选择提取时间为 40 min。
由图1-c可知,在80 ℃之前,随温度的升高,多糖提取率不断提高。原因是随着温度的升高,分子运动加快,使得溶剂交换速度增加,从而提高多糖提取率[27]。在80 ℃时,提取率达到最大值,这与刘岿等超声辅助提取大蒜多糖工艺研究中的最佳提取温度85 ℃接近[28]。温度超过80 ℃时,山芝麻多糖提取率缓慢下降,可能是由于温度过高,多糖会断键,使提取率降低[29]。因此,本研究选择提取温度为80 ℃。
2.2响应面试验结果与分析
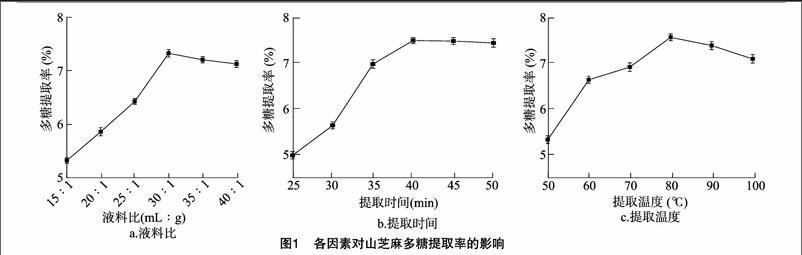
2.2.1回归方程建立与回归模型分析响应面试验设计及试验结果汇总如表3所示。在单因素试验结果基础上,以液料比(A)、提取时间(B)、提取温度(C)为自变量,以多糖提取率Y为响应值,采用Design-Expert 8.0程序对所得数据进行非线性回归,获得二次多项式回归模型,去掉不显著项,其回归模型可以简化为
对模型系数显著性分析可知,A、C、A2、C2对山芝麻多糖提取率的影响是极显著的,B、B2对山芝麻多糖提取率的影响是显著的。因素的F值可以判定因素对响应值的显著性,F值越大,表明该因素对山芝麻多糖提取率的影响越显著。一次项中各因素对山芝麻多糖提取率影响的显著性大小顺序为料液比(A)>提取温度(C)>提取时间(B)。
2.2.2响应面试验中双因素交互作用影响图2-a~图2-f分别直观地给出了各个因子交互作用的响应面和等高线。等高线的形状可反映交互效应的强弱,椭圆形表示2个因素交互作用较强,而圆形则反之[30]。山芝麻多糖提取率随液料比增加先升高后略降低,这是由于溶剂的增加使传质推动力增加,而达到传质极限时,传质推动力不再增加且细胞壁破损程度减弱。山芝麻多糖提取率随提取时间先快速升高后趋于平缓,原因是超声可以加快溶质从细胞内到溶剂的扩散和渗透过程,而山芝麻中的多糖含量是固定的,40 min后山芝麻多糖提取率趋于平缓。从图2也可以看出,提高温度可提高山芝麻多糖提取率,但温度超过80 ℃时,山芝麻多糖提取率呈下降趋势。因为提高温度可以加快分子运动,加快溶质扩散到溶剂中,而过高的温度则会使多糖键断裂,影响提取率。
2.3最佳工艺验证试验
经过Design-Expert设计得到山芝麻多糖提取的最佳条件:液料比32.64 mL ∶[KG-*3]1 g、提取时间41.86 min、提取温度 83.05 ℃,在此条件下的山芝麻多糖提取率达7.897%。考虑到实际操作的可行性,将提取条件修正为液料比32 mL ∶[KG-*3]1 g、提取时间42 min、提取温度83 ℃,在此条件下进行3次重复试验,得到的山芝麻多糖平均提取率为7.676%,验证性试验与设计试验的结果误差为1.67%,表明该模型是可行的。
2.4山芝麻多糖紫外谱图分析
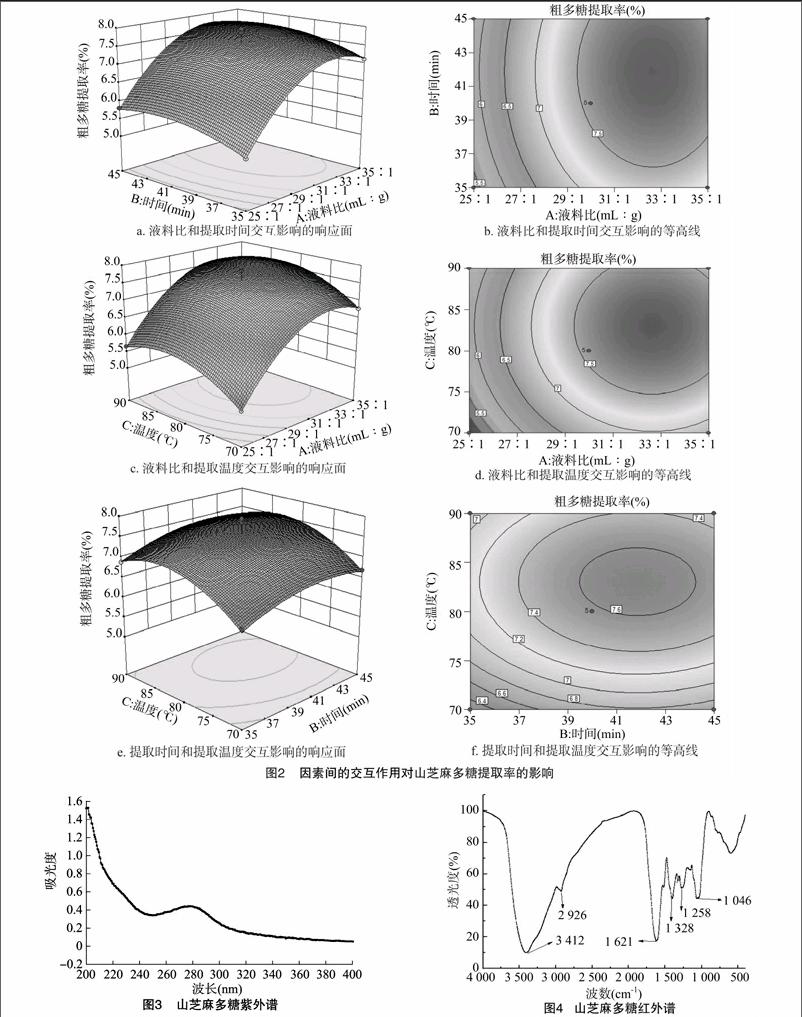
从图3可以看出,在200~400 nm范围内,曲线整体呈下降趋势,符合多糖特征;在280 nm处有弱吸收峰,表明含有少量的蛋白质[31]。
2.5山芝麻多糖红外谱
从图4可以看出,3 412 cm-1处有强宽峰,可能为山芝麻多糖主要官能团O—H伸缩振动引起;2 926 cm-1的峰由糖类中的甲基C—H对称和非对称伸缩振动引起;1 621cm-1处为 C[FY=,1]O 振动吸收峰;1 329cm-1为C—H弯曲振动吸收峰;1 258 cm-1 为C—H变角振动吸收峰;1 046 cm-1附近存在吡喃型糖环,这些均为糖的特征吸收峰[32]。
2.6山芝麻多糖對α-葡萄糖苷酶的抑制活性
阿卡波糖是市面上较为常见的治疗糖尿病的口服药物,其治疗原理是抑制小肠内的α-葡萄糖苷酶,从而抑制多糖
降解,减缓糖的吸收。以阿卡波糖作为对照,分别以阿卡波糖片、山芝麻多糖浓度为横坐标,对应的抑制率为纵坐标,绘制柱形图。
可以看出,当浓度≥30 μg/mL时,同浓度山芝麻多糖对α-葡萄糖苷酶的抑制率高于阿卡波糖片,表明山芝麻多糖有一定的降糖潜力。
3结论
在单因素试验的基础上,将响应面法应用于优化山芝麻多糖的提取。结果表明,液料比、提取时间、液料比的平方项和提取时间的平方项对多糖提取率的影响显著或极显著,一次项中各因素的显著性大小依次为液料比(A)>提取温度(C)>提取时间(B)。得到多糖提取的最佳条件:液料比 32 mL ∶[KG-*3]1 g、提取时间42 min、提取温度83 ℃,多糖的实际提取率为 7.676%。所得试验数据为山芝麻多糖提取工艺放大提供了参考。
对山芝麻多糖的紫外谱图、红外谱图分析可得,提取的山芝麻多糖含有少量的蛋白质,主要官能团有O—H、糖类中的甲基的C—H、C[FY=,1]O、吡喃型糖环。比较同浓度下的阿卡波糖片和山芝麻多糖对α-葡萄糖苷酶抑制率可知,当浓度≥ 30 μg/mL 时,山芝麻多糖对α-葡萄糖苷酶有更高的抑制率。综上所述,超声辅助法提取山芝麻多糖是可行的,且提取的山芝麻多糖具有明显的降糖功效,研究结果可为进一步开发降糖食品和药品奠定基础。
参考文献:
[1]国家中医药管理局《中华本草》编委会.中华本草(第5卷)[M]. 上海:上海科学技术出版社,1998:384-385.
[2]广东省食品药品监督管理局.广东省中药材标准[M]. 广州:广东科技出版社,2004:16-17.
[3]潘英. 复方感冒颗粒剂的制备及临床观察[J]. 医学文选,1999,18(3):399-400.
[4]郭宏炳,林文戈. 复方岗梅冲服剂的制备及临床疗效观察[J]. 广东医学院学报,1996,16(1):66-67.
[5]黄权芳,韦刚,杨辉,等. 山芝麻含药血清对HepG2.2.15细胞HBV复制的抑制作用[J]. 时珍国医国药,2012,23(7):封3-封4.
[6]Li K J,Yang X,Hu X S,et al. In vitro antioxidant,immunomodulatory and anticancer activities of two fractions of aqueous extract from Helicteres angustifolia L. root[J]. Journal of the Taiwan Institute of Chemical Engineers,2016,61:75-82.
[7]Hu X S,Cheng D L,Zhang Z Y. Antidiabetic activity of Helicteres angustifolia root[J]. Pharmaceutical Biology,2016,54(6):938-944.
[8]Li K J,Yu Y,Sun S,et al. Functional characterisation of anticancer activity in the aqueous extract of Helicteres angustifolia L. roots[J]. PLoS One,2016,11(3):e0152017.
[9]Hu X,Cheng D,Li K,et al. Glucose consumption and alpha-glucosidase inhibitory activities of aqueous root extract of Helicteres angustifolia[J]. European Review for Medical and Pharmacological Sciences,2016,20(7):1423-1429.[ZK)]
[10]Chen X H,Bai X,Liu Y H,et al. Anti-diabetic effects of water extract and crude polysaccharides from tuberous root of Liriope spicata var. prolifera in mice[J]. Journal of Ethnopharmacology,2009,122(2):205-209.
[11]Zhou X,Song G H,Zhang X M,et al. Beneficial effects of crude extract of Eupatorium lindleyanum DC. in hyperlipidemia and atherosclerosis[J]. Biotechnology & Biotechnological Equipment,2016,30(1):151-157.
[12]Ding Q Y,Yang D,Zhang W N,et al. Antioxidant and anti-aging activities of the polysaccharide TLH-3 from Tricholoma lobayense[J]. International Journal of Biological Macromolecules,2016,85:133-140.
[13]Muschin T,Budragchaa D,Kanamoto T,et al. Chemically sulfated natural galactomannans with specific antiviral and anticoagulant activities[J]. International Journal of Biological Macromolecules,2016,89:415-420.
[14]Jiang J Y,Kong F S,Li N S,et al. Purification,structural characterization and in vitro antioxidant activity of a novel polysaccharide from Boshuzhi[J]. Carbohydrate Polymers,2016,147:365-371.
[15]Fang Q,Wang J F,Zha X Q,et al. Immunomodulatory activity on macrophage of a purified polysaccharide extracted from Laminaria japonica[J]. Carbohydrate Polymers,2015,134:66-73.
[16]鐘玲,尹蓉莉,张仲林. 超声提取技术在中药提取中的研究进展[J]. 西南军医,2007,9(6):84-87.
[17]徐晓飞,陈健. 多糖含量测定的研究进展[J]. 食品科学,2009,30(21):443-448.
[18]Wang D F,Zhou X L,Li L,et al. A rapid quantitative method for polysaccharides in green tea and oolong tea[J]. European Food Research and Technology,2008,226(4):691-696.
[19]Wang P C,Zhao S,Yang B Y,et al. Anti-diabetic polysaccharides from natural sources:A review[J]. Carbohydrate Polymers,2016,148:86-97.
[20]Box G P,Hunter W G. Statistics for experiments:an introduction to design,data analysis and model building[M]. New Nork:John & Wiley,1990.
[21]Hammi M K,Hammami M,Rihouey C,et al. Optimization extraction of polysaccharide from Tunisian Zizyphus lotus fruit by response surface methodology:composition and antioxidant activity[J]. Food Chemistry,2016,212:476-484.
[22]郭希娟,马萍,张桂芳. 响应面法在南瓜多糖超声提取中的应用[J]. 粮油加工,2010,8:143-146.
[23]Qu Y,Li C X,Zhang C,et al. Optimization of infrared-assisted extraction of Bletilla striata polysaccharides based on response surface methodology and their antioxidant activities[J]. Carbohydrate Polymers,2016,148:345-353.
[24]Zhang G W,He L,Hu M M. Optimized ultrasonic-assisted extraction of flavonoids from Prunella vulgaris L. and evaluation of antioxidant activities in vitro[J]. Innovative Food Science & Emerging Technologies,2011,12(1):18-25.
[25]诸爱士,葛宁,张栋. 超声辅助海菜多糖提取[J]. 浙江科技学院学报,2016,28(3):211-215.
[26][JP2]Prakash Maran J,Mekala V,Manikandan S. Modeling and optimization of ultrasound-assisted extraction of polysaccharide from Cucurbita moschata[J]. Carbohydrate Polymers,2013,92(2):2018-2026.[JP]
[27]陆娟,常清泉,王思齐,等. 响应面法优化核桃青皮粗多糖超声提取工艺研究[J]. 北方园艺,2015(22):125-129.
[28]刘岿,葛勐. 超声辅助大蒜多糖提取研究[J]. 资源开发与市场,2012,28(3):208-210,261.
[29]王莹,王华,丁宁,等. 响应曲面法优化水溶性银杏叶多糖提取工艺[J]. 江苏农业科学,2015,43(5):268-270.
[30]Karazhiyan H,Razavi S M,Phillips G O. Extraction optimization of a hydrocolloid extract from cress seed (Lepidium sativum) using response surface methodology[J]. Food Hydrocolloids,2011,25(5):915-920.
[31]焦中高. 红枣多糖的分子修饰与生物活性研究[D]. 杨凌:西北农林科技大学,2012:36-40.
[32]Kacurakova M,Capek P,Sasinkova V,et al. FT-IR study of plant cell wall model compounds:pectic polysaccharides and hemicelluloses[J]. Carbohydrate Polymers,2000,43(2):195-203.
