Noxa基因表达与肝细胞癌的关系
2017-04-14朱卫东郭凌川
朱卫东,郭凌川
Noxa基因表达与肝细胞癌的关系
朱卫东,郭凌川
目的 探讨Noxa基因与人肝癌的临床病理关系及对人肝癌HepG2细胞的增殖抑制和促凋亡作用。方法 采用免疫组化法检测100例肝癌组织及癌旁组织中Noxa蛋白的表达,结合其临床病理参数和随访资料进行统计学分析。同时利用脂质体将真核表达载体pIRES2-EGFP-Noxa瞬时转染至人肝癌HepG2细胞,RT-PCR检测转染后Noxa基因mRNA的表达,Western blot法检测转染后Noxa蛋白表达,MTT比色法测定细胞增殖情况,流式细胞仪检测细胞凋亡。结果 免疫组化检测结果显示肝癌组织中Noxa阳性率为50%,明显低于癌旁正常肝组织(78%),两组相比差异有显著性(P<0.05)。Noxa蛋白表达与肝癌分化程度及TNM分期有关(P<0.05)。HepG2细胞中成功表达Noxa基因,转染后mRNA及蛋白表达随时间延长持续上升,差异有统计学意义(P<0.05)。与其它各组相比,转染24、48、72 h后,其吸光度值逐渐升高(P<0.05),流式细胞仪检测结果显示,其24 h、48 h、72 h凋亡率分别为(15.5±0.9)%、(24.6±0.8)%和(35.4±0.7)%,组间差异有统计学意义(P<0.05)。结论 Noxa表达与肝癌分化程度及TNM分期密切相关,其高表达可抑制人肝癌细胞HepG2的增殖并促进其凋亡。
肝肿瘤;肝细胞癌;Noxa;HepG2;凋亡;转染
肝癌是全球常见的恶性肿瘤之一,发病率高,严重危害人民的身体健康[1-2]。现阶段随着各种治疗方法的不断提高,尤其是新的特异的靶向药物的引进,使得患者存活率有所提高,但其总体存活率并不乐观。因此,探索新的靶点具有重要意义。Oda等[3]首次证明Noxa基因是BCL-2家族的促凋亡成员之一,并且是p53的下游靶基因之一。该基因定位于18q21-32,全长4 301 bp,仅仅含有一个BH3结构域,所以将其归类于BCL-2家族的BH3亚家族成员。其可被p53基因诱导使其表达上调,因为Noxa启动子上游有两个p53结合位点,由此发挥凋亡作用[4-5],其诱导细胞凋亡主要通过依赖p53或者不依赖p53等多种途径。目前以其促细胞凋亡理论为基础,发现了许多以分子靶向治疗为手段的抗癌药。Noxa又称APR(ATL-derived PMA-responsive gene)或PMAIP1(phorbol-12-myristate-13-acetate-induced protein 1)[6],是细胞凋亡的调节因子,在细胞凋亡和肿瘤发生、发展以及治疗中起重要作用,但是关于Noxa介导细胞凋亡的具体作用机制仍有许多不清楚之处。目前有关Noxa与肝癌发生、发展之间关系的报道极少,有研究表明其与结直肠癌的恶性程度、侵袭力及预后可能相关[7],本项实验主要从基因的表达与临床病理学及细胞学水平研究其与肝癌发生、发展的关系。
1 材料与方法
1.1 材料 收集苏州大学附属第一医院普外科2010年9月~2011年12月手术切除的100例肝癌标本,均经病理确诊。患者年龄32~77岁,男性60例,女性40例,男女比为3 ∶2;TNM分期:Ⅰ+Ⅱ期40例,Ⅲ+Ⅳ期60例;高+中分化80例,低分化20例。所有患者术前均未接受放疗、化疗或免疫治疗,癌旁组织取自癌组织边缘2 cm以外组织,标本均经10%中性福尔马林固定,石蜡包埋,4 μm厚连续切片。
1.2 试剂 Noxa单克隆抗体购自美国Santa Cruz公司;HepG2细胞由苏州大学提供;上海生物工程公司构建真核表达质粒pIRES2-EGFP-Noxa;上海生物工程公司合成Noxa基因和内参照GAPDH的PCR引物;Lipofectamine 2000和Trizol购自美国Invitrogen公司;PCR试剂购自Promega公司。
1.3 方法
1.3.1 免疫组化 按试剂说明书行Noxa单克隆抗体免疫组化染色(EnVision法),用PBS液代替一抗作为阴性对照。结果判断:阳性细胞为细胞质内出现棕褐色颗粒为原则,计数10个400倍高倍视野,按阳性强度计分:淡黄色为1分,黄色为2分,棕黄色为3分;按阳性细胞计数:阳性细胞数<5%为0分,5%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。将两项得分结果相乘:1~4分为弱阳性(+),5~8分为中等阳性(),9~12分为强阳性()。1~4分为低表达,5~12分为高表达。
1.3.2 细胞培养 HepG2细胞培养于含10%小牛血清的RPMI 1640培养液中,置于37 ℃、5%CO2培养箱中,后期调整细胞浓度用于实验。
1.3.3 细胞转染 按照Lipofectamine 2000说明书进行。转染前于6、24及96孔板中每孔分别种(3.0~8.0)×105、(1~2.5)×104及(4~10)×103个细胞,培养24 h,待细胞达到70%~90%时开始转染,用Opti-MEMI稀释质粒和转染试剂Lipofectamine 2000,再将两者混合,室温放置20 min后加至6孔板中,6 h后换液。该实验分为三组,空白对照组:只接种细胞,未转染质粒;阴性对照组:转染pIRES2-EGFP质粒;阳性对照组:转染pIRES2-EGFP-Noxa。以上三组均分别培养24、48和72 h。
1.3.4 RT-PCR检测Noxa mRNA表达 转染24、48和72 h后从6孔培养板收集各组细胞,按照Trizol试剂说明书提取总RNA,利用Prime 5.0软件设计引物,其上游引物为5′-AAAGAAAGCCAGGAAGAATG-3′,下游引物为5′-TCAACTTGTCGCCAAAGC-3′,产物大小为101 bp。内参GAPDH上游引物为5′-GGAAGATGGTGATGGGATT-3′,下游为5′-GGATTTGGTCGTATTGGG-3′,产物大小为205 bp。对产物进行琼脂糖电泳,凝胶成像,系统分析结果。
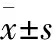
1.3.6 MTT比色试验 收集对数生长期各组细胞,调整细胞浓度接种于96孔板中,(4 000~10 000)个细胞/孔,置37 ℃、5%CO2培养箱中培养至细胞单层铺满孔底,进行细胞转染。转染24、48和72 h后加入MTT(5 mg/mL)溶液20 μL,继续培养4 h后吸掉上清液,每孔加入DMSO 150 μL,于摇床上低速振荡10 min,测量各孔的吸光度(A)值。
1.3.7 流式细胞仪检测细胞凋亡 各组细胞转染24、48和72 h后,从6孔板中收集所有悬浮及贴壁的细胞,离心后去除培养液,用PBS洗涤2次,加入1 mL预冷的70%乙醇4 ℃固定过夜后,离心后去除乙醇,加入RNase A(1 mg/mL) 20 μL,37 ℃水浴30 min后,再加入PI(100 μg/mL)染色液800 μL,混匀,4 ℃避光30 min,用流式细胞仪检测。

2 结果
2.1 Noxa在肝癌及癌旁组织中的表达及与临床病理参数的关系 在100例肝癌组织中,Noxa阳性率为50%(图1),在100例癌旁组织也有不同程度的表达,阳性率为78%(图2),Noxa在肝癌组织中的阳性率明显低于癌旁组织(P<0.05)。Noxa表达与肝癌患者性别、年龄及肿块大小无明显特定关系,与TNM分期和分化程度相关,差异有统计学意义(P<0.05,表1)。
2.2 细胞转染的结果
2.2.1 转染后Noxa mRNA的表达 收集转染后各组细胞的总RNA,经RT-PCR扩增出Noxa cDNA(图3)。阴性对照组、空白对照组无mRNA的表达,转染24、48、72 h后mRNA表达持续上升,差异有统计学意义(P<0.05,图3)。
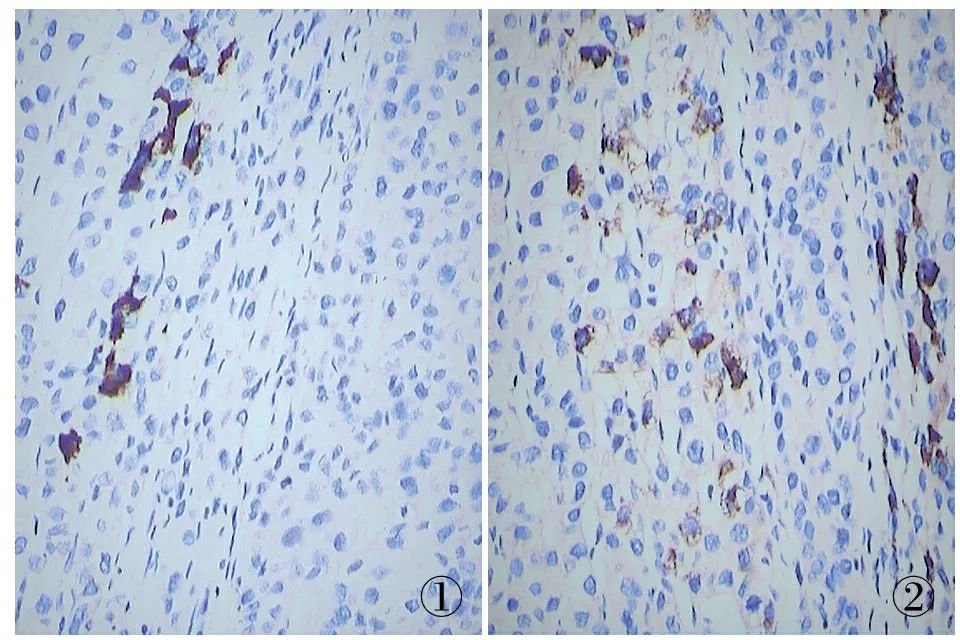
①②

图1 Noxa蛋白在肝癌组织中的表达,EnVision法 图2 Noxa蛋白在癌旁肝组织中的表达,EnVision法
*P<0.05
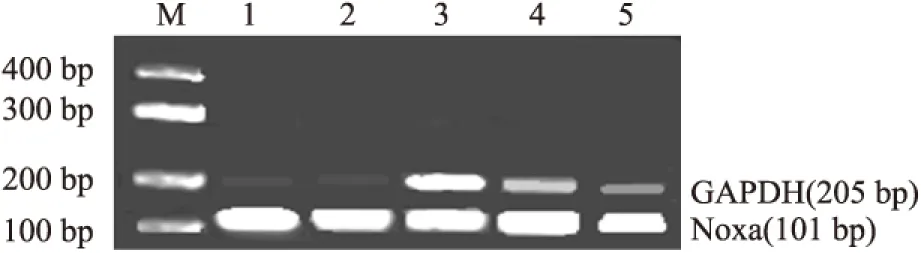
图3 RT-PCR检测Noxa mRNA表达
M.DNA Marker;1.对照组;2.转染pIRES2-EGFP组;3.转染pIRES2-EGFP-Noxa 72 h组;4.转染pIRES2-EGFP-Noxa 48 h组;5.转染pIRES2-EGFP-Noxa 24 h组
2.2.2 Western blot检测Noxa蛋白表达 Western blot结果显示,空白对照组和阴性对照组未见有目的蛋白特异条带。经成像系统分析,转染24、48和72 h后蛋白表达量持续升高,差异有统计学意义(P<0.05,图4)。

图4 Western blot检测转染后Noxa蛋白的表达
1.对照组;2.转染pIRES2-EGFP组;3.转染pIRES2-EGFP-Noxa 72 h组;4.转染pIRES2-EGFP-Noxa 48 h组;5.转染pIRES2-EGFP-Noxa 24 h组
2.3 Noxa表达对HepG2细胞增殖的影响 MTT结果显示,空白对照组和阴性对照组细胞增殖能力无明显变化,阳性对照组细胞的增殖速度随转染时间的延长逐渐降低,差异有统计学意义(P<0.05,表2)。

表2 转染pIRES2-EGFP-Noxa后HepG2细胞OD值的变化
与空白组相比,*P<0.05
2.4 Noxa表达对HepG2细胞凋亡的影响 流式细胞仪检测结果显示空白对照组及阴性对照组凋亡率分别为(1.71±0.9)%、(2.62±0.8)%,转染pIRES2-EGFP-Noxa 24、48和72 h组凋亡率分别为(15.5±0.9)%、(24.6±0.8)%和(35.4±0.7)%,组间差异有统计学意义(P<0.05),与空白组及阴性对照组相比差异有统计学意义(P<0.05,图5)。
3 讨论
目前放、化疗一直是治疗肿瘤的常规治疗措施,现在基因治疗及基因靶向治疗成为治疗肿瘤的一条崭新途径,并给肿瘤患者带来新的希望。Noxa基因是BCL-2家族的促凋亡成员,可通过多种途径调节细胞凋亡,既可被p53基因诱导使其表达上调,发挥凋亡作用[8],也可以通过转录因子E2F1、C-三肽分泌酶抑制剂(GSI)、缺氧、病毒感染和人类腺病毒5型早期区域1A(E1A)等p53非依赖途径诱导细胞凋亡[9]。

图5 流式细胞仪检测转染后细胞周期和凋亡A.空白组;B.阴性对照组;C.转染pIRES2-EGFP-Noxa 72 h组;D.转染pIRES2-EGFP-Noxa 48 h组;E.转染pIRES2-EGFP-Noxa 24 h组
有研究表明人乳腺癌细胞中使用腺病毒基因表达系统异位表Noxa基因,90%细胞发生凋亡[3]。Qin等[10-11]发现,硼替佐米能在不损伤正常黑素细胞的情况下杀伤黑素瘤细胞,其作用可能通过诱导不依赖p53的Noxa基因表达来实现的;而在治疗非小细胞肺癌中,该药物可通过线粒体途径上调Noxa促进肿瘤细胞凋亡。PS341(一种蛋白酶抑制剂)在人类各种不同类型的癌症中均能诱导Noxa表达上调[12]。紫杉醇杀伤胃腺癌细胞与诱导细胞凋亡有关,该凋亡可能与Noxa、Bim的表达上调有关[13]。Meng等[14]通过小干扰RNA剔除发现,棉酚(BH3天然模拟药物)治疗前列腺癌主要抑制BCL-xL,上调Noxa和Puma来诱导细胞凋亡来实现的。Perez-Galan等[15]的研究指出在治疗外套细胞淋巴瘤的过程中,GX15-070(BH3模拟药物)可单独或者与硼替佐米共同作用来上调Noxa基因的表达,从而激活Bak基因,进而诱导肿瘤细胞凋亡。在治疗神经外胚层肿瘤(神经母细胞瘤和黑素瘤)的过程中,抗肿瘤药物芬维A胺以非依赖p53的方式使Noxa表达上调,诱导肿瘤细胞的凋亡[16]。组蛋白脱乙酰基酶抑制剂主要使BCL-2家族抗凋亡成员失活及增加Bim和Noxa的表达来诱导细胞凋亡,这一机制在治疗慢性淋巴细胞白血病和淋巴瘤的过程中极大开阔了临床应用前景[17]。
本实验分析了Noxa在肝癌中的表达与临床病理参数的相关性,结果表明,Noxa表达与肿瘤分化程度、TNM分期相关;实验又从细胞学水平进一步研究其对人肝癌细胞的作用,本实验通过脂质体将Noxa基因成功瞬时转染入人肝癌HepG2细胞中,利用MTT、流式细胞仪检测其对该细胞的增殖抑制和凋亡作用。结果表明转染Noxa基因的阳性对照组细胞的增殖抑制和凋亡明显高于空白对照组和阴性对照组;这些结果表明Noxa表达与肝癌发生、发展存在一定的关系,同时其表达可以抑制人肝癌HepG2细胞的增殖并促进其凋亡。但其具体的分子作用机制还有待于进一步研究,推测其促进细胞凋亡的机制可能与p53基因或者线粒体途径相关,至于其与Bim基因是否存在协同作用还有待进一步的探讨。相信不久的将来Noxa基因会成为人肝癌基因治疗的新靶点。
[1] 陈建国, 陈万青, 张思维, 等. 中国2003-2007年肝癌发病率与死亡率分析[J]. 中华流行病学杂志, 2012,33(6):547-553.
[2] 陈陶阳, 朱源荣. 我国肝癌发病趋势及展望[J]. 肿瘤, 2008,28(10):908-909.
[3] Oda E, Ohki R, Murasaw A H,etal. Noxa, a BH3-only member of the Bcl-2 family and candidate mediator of p53-induced apoptosis[J]. Science, 2000,288(5468):1053-1058.
[4] Villunger A, Michalak E M, Couhas L,etal. p53-and drug-induced apoptotic responsesm ediated by BH 3-only proteins pum a and noxa[J]. Science, 2003,302(5647):1036-1038.
[5] Wang Z, Sun Y. Identificat ion and characterization of two splicing variants of human noxa[J]. Ant icancer Res, 2008,28(3A):1667-1674.
[6] Ishida M, Sunamura M, Furukawa T,etal. The PMA IP1 gen e on chromosome 18 is a candidate tumor suppressor gene in human pancreatic cancer[J]. Dig Dis Sci, 2008,53(9):2576-2582.
[7] 董 伟, 田淑君, 魏 志. PP2A的肿瘤抑制功能及与凋亡因子Noxa的关系[J]. 哈尔滨医科大学学报, 2015,49(2):127-130.
[8] Wang Z, Sun Y. Identification and characterization of two splicing variants of human Noxa[J]. Anticancer Res, 2008,28(3A):1667-1674.
[9] 赵 志, 吴爱国, 沈三弟. Noxa基因转染乳腺癌MCF-7细胞的增殖抑制和促凋亡作用[J]. 肿瘤防治研究, 2010,37(10):1104-1108.
[10] Qin J Z, Ziffra J, Stennett L,etal. Proteasome inhibitors trigger NOXA mediated apoptosis in m elanoma and myeloma cells[J]. Cancer Res, 2005,65(14):6282-6293.
[11] Fernandez Y, Verhaegen M, Miller T P,etal. Differential regulation of noxa in normal melanocytes and melanom a cells by proteasome inhibition: therapeutic implications[J]. Cancer Res, 2005,65(14):6294-6304.
[12] Perez-Galan P, Roue G, Villamor N,etal. The proteasome inhibition bortezom ib induces apoptosis in mantle-cell lymphoma through generation of ROS and Noxa activation independent of p53 status[J]. Blood, 2006,107(1):257-264.
[13] 叶 艳, 谢奇朋, 郝延璋, 等. BH3-only蛋白在紫杉醇诱导胃腺癌细胞凋亡中的表达[J]. 安徽医科大学学报, 2006,41(2):127-130.
[14] Meng Y, TangW, Dai Y,etal. Natural BH 3 mimetic(-)-gossypol chemosens it izes human prostate cancer via Bcl-xL inhibition accompanied by increase of Pum a and Noxa[J]. Mol Cancer Ther, 2008,7(7):2192-2202.
[15] Pérez-Galán P, Roué G, Villamor N,etal. The BH3-mimetic GX15070 synergizes with bortezom ib in mantle cell lymphom a by enhancing Noxa-mediated activation of Bak[J]. Blood, 2007,109(10):4441-4449.
[16] Armstrong J L, Veal G J, Redfern C P,etal. Role of Noxa in p53-independent fenretinide-induced apoptosis of neuroectodermal, tumours[J]. Apoptosis, 2007,12(3):613-622.
[17] Inoue S, Riley J, Gant T W,etal. Apoptosis induced by histone deacetylase inh bitors in leukemic cells is mediated by Bim and Noxa[J]. Leukemia, 2007,21(8):1773-1782.
Correlation of the expression of Noxa with hepatocellular carcinoma
ZHU Wei-dong, GUO Ling-chuan
(DepartmentofPathology,theFirstAffiliatedHospitalofSoochowUniversity,Suzhou215000,China)
Purpose To explore the correlation of Noxa gene with clinical pathology and its effect on proliferation and apoptosis of HepG2 cells. Methods Noxa protein in 100 hepatocellular carcinoma tissues and 100 paracancerous tissues were detected by immunohistochemical technique, clinicopathological parameters and follow-up data were statistically analyzed. The recombinant eukaryotic expression plasmid pIRES2-EGFP-Noxa was transiently transfected into HepG2 cells with lipofectamine. Both Noxa mRNA and protein were detected by RT-PCR and Western blot respectively. The inhibition of cell proliferation was evaluated by MTT assay. The cell apoptosis was detected by flow cytometry (FCM). Results Immunohistochemistry showed that in tumor tissue of hepatocellular carcinoma the positive rate of Noxa protein expression was 50%, while it was 78% in cancer adjacent normal mucosal tissue, with statistically significant difference (P<0.05). The expression of Noxa was related to TNM staging and the tumor differentiation. Exotic Noxa gene was expressed successfully in HepG2 cells after transfected with lipofectamine. The expression of Noxa mRNA and protein of HepG2 cells was significantly up-regulated after transfected 24 h, 48 h and 72 h (P<0.05). MTT assay showed that the Noxa expression inhibited HepG2 cell proliferation in a time-dependent manner for 24 h, 48 h and 72 h (P<0.05), which was significantly different from that of the control group (P<0.05). Apoptosis rate after transfected 24 h, 48 h and 72 h was (15.5±0.9) %, (24.6±0.8) % and (35.4±0.7) %, respectively. There were significant difference between Noxa and the control group (P<0.05). Conclusion The expression of Noxa in hepatocellular carcinoma tissue is closely related to TNM stage and the tumor differentiation. Noxa gene overexpression is able to effectively inhibit the proliferation and promote the apoptosis of HepG2 cell line.
liver neoplasms; hepatocellular carcinoma; Noxa; HepG2; apoptosis; transfection
时间:2017-2-27 10:14
http://kns.cnki.net/kcms/detail/34.1073.R.20170227.1014.012.html
苏州大学附属第一医院病理科,苏州 215000
朱卫东,男,主管技师。E-mail: 16586088@qq.com
R 735.7
A
1001-7399(2017)02-0139-05
10.13315/j.cnki.cjcep.2017.02.005
接受日期:2016-12-02
