长江口及邻近海域沉积物再悬浮对水体磷酸盐的影响的模拟研究
2017-04-14矫恒晨王盼盼简慧敏姚庆祯
矫恒晨,王盼盼,简慧敏,姚庆祯
(1.中国海洋大学 海洋化学理论与工程技术教育部重点实验室,山东 青岛 266100; 2.中国海洋大学 化学化工学院,山东 青岛 266100)
长江口及邻近海域沉积物再悬浮对水体磷酸盐的影响的模拟研究
矫恒晨1,2,王盼盼1,2,简慧敏1*,姚庆祯1,2
(1.中国海洋大学 海洋化学理论与工程技术教育部重点实验室,山东 青岛 266100; 2.中国海洋大学 化学化工学院,山东 青岛 266100)
以长江口及邻近海域为研究区域,采用改进后的SEDEX法对沉积物中各形态磷的含量进行了分析,并通过模拟实验探讨了沉积物再悬浮对上覆水体磷酸盐浓度的影响。结果表明:碎屑磷(De-P)是沉积物磷的主要赋存形态,占总磷(TP)的50%以上;其次是可提取态有机磷(Or-P)和非活性有机磷(Re-P);生物可利用磷(BAP)占总磷的比例约为21%,可提取态有机磷(Or-P)是生物可利用磷(BAP)的主要存在形态。沉积物再悬浮时,水体磷酸盐的浓度显著升高,说明沉积物再悬浮会引起沉积物中磷的释放;水体磷酸盐浓度升高主要源于沉积物中磷的释放,而间隙水的贡献较低。沉积物发生再悬浮时,厌氧条件相对于好氧条件,更有利于沉积物磷的释放。
长江口;沉积物再悬浮;磷形态;磷酸盐
1 引言
长江是中国第一大河,其径流携带着大量的营养盐,强大的径流不断向长江口、东海内陆架及中陆架输送营养盐,成为海洋生物生存和发展的基础。磷是水体中浮游植物生长的限制性营养元素之一,而过量的水体磷酸盐则是导致水体富营养化的最普遍因素[1]。随着对水体外源磷的有效控制,沉积物中内源磷的释放成为维持水体富营养化程度的关键[2—4]。沉积物是其主要的蓄积库[5]。无论在浅的近岸区域还是在深海中,沉积物再悬浮都是非常普遍的一个物理过程,尤其在河口地区,水动力条件活跃,再悬浮现象频繁发生。再悬浮使还原态沉积物暴露于有氧环境,改变沉积物性质(氧化还原电位、pH值、微生物活性等)以及磷在沉积物-水界面的分配平衡[6],使原本吸附或结合于沉积物中的磷得以释放进入上覆水体,进而提高磷的生物可利用性。
近年来,研究者对长江口及邻近海域沉积物-水界面营养盐的交换通量及其影响因素进行了一些研究[7—9]。这些研究一般都是研究的沉积物-水界面的静态过程,而沉积物再悬浮对物质的释放研究相对较少。因此本文通过对沉积物各形态磷、间隙水磷酸盐含量的测定及再悬浮过程的现场模拟实验,系统讨论了沉积物再悬浮对上覆水体磷酸盐的影响。研究结果为进一步深化高浑浊河口生源要素生物地球化学研究积累基础资料。
2 材料与方法
2.1 样品采集
2.1.1 柱状沉积物及间隙水
2014年7-8月乘“润江1号”采集了长江口及邻近海域的柱状沉积物样品(图1)。A6-4位于长江口泥质区,A13-2位于浙闽沿岸泥质区。
沉积物采用箱式采泥器采集后,柱状沉积物样品用PVC管采集,采集后立即进行切割分层(0~15 cm以1 cm为间隔,15 cm以后以2 cm为间隔)。采集的样品均放入洁净的聚乙烯密封袋中,于-20℃下冷冻保存。
将带孔的PVC柱状管插入箱式采泥器中,取出,用活塞密封两端。柱状沉积物采集好后,立即用Rhizon sampler取样器[10]分层(0~15 cm以1 cm为间隔,15 cm以后以2 cm为间隔)采集沉积物中的间隙水。所得的间隙水样于-20 ℃下冷冻保存,用于沉积物间隙水磷酸盐测定。

图1 长江口沉积物采样站位示意(据董爱国等[11])Fig.1 Distribution of the sampling stations in Changjiang Estuary(from Dong et al[11])
2.1.2 模拟实验
沉积物采用箱式采泥器采集后,用长30 cm,内径为10 cm的有机玻璃管采集8~10 cm的沉积物柱样。采集柱样时,直接将有机玻璃管插入保留有(部分)上覆水的沉积物中,以避免添加上覆水造成沉积物表层扰动。同时采集上覆水样10 L,用于补充沉积物柱样上覆水。样品采集后立即在船上进行模拟实验(表1)。利用电动搅拌器搅拌,搅拌速度逐渐增大,直至达到设定的再悬浮深度5 cm。同时设置对照组,对照组为沉积物和水样处于静置状态。
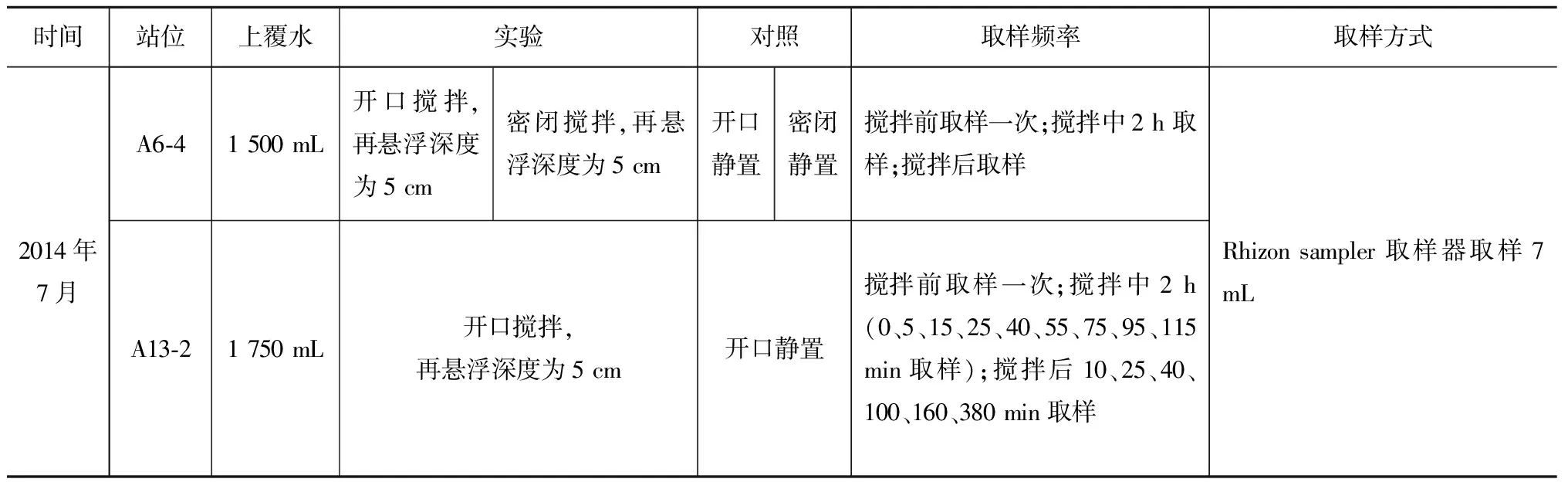
表1 模拟实验简介
悬浮深度的确定:海洋沉积物在垂向上可分为两部分,即表面混合层和下部积累层。表面混合层具有混合均匀的特点,部分上层泥沙在一定的动力条件下(如潮汐、波浪、流、飓风等)可以发生再悬浮和移动[12]。刘淑民[13]根据生物和物理混合引起的基本均衡的过剩210Pb 活度确定与A13-2站位相近区域表面混合层的厚度为5 cm,张晋华[14]根据沉积物样品中过剩的过剩210Pb确定与A6-4站位相近的区域表面混合层厚度同样为5 cm。因此,本研究将再悬浮深度设定为5 cm。
2.2 分析方法
2.2.1 沉积物颗粒磷赋存形态的测定
沉积物冷冻干燥后用研钵研碎,过筛、混匀后待测。本实验采用改进后的SEDEX法[15-17]测定沉积物颗粒磷的赋存形态(表2)。此方法依次采用MgCl2溶液、SDS(十二烷基硫酸钠)溶液、CDB(柠檬酸钠-连二亚硫酸钠-碳酸氢钠)溶液、醋酸缓冲溶液、盐酸溶液和灼烧+盐酸溶液将沉积物分为6种形态,分别为弱吸附态磷(Ex-P)、铁结合态磷(Fe-P)、可提取态有机磷(Or-P)、自生磷灰石磷(Au-P)、非活性有机磷(Re-P)和碎屑磷(De-P)。各步所得提取液中的磷酸盐含量采用磷钼蓝法在880 nm处用分光光度计进行测定;提取Fe-P的CDB提取液采用改进后异丁醇萃取法用分光光度计在720 nm处进行测定[18]。
2.2.2 磷酸盐的测定
磷酸盐在实验室内采用 QUAATRO 型营养盐自动分析仪(德国BRAN+LUEBBE公司)采用磷钼蓝法,880 nm波长处测定;其检出限为0.02 μmol/L,精密度为0.3%。

表2 改进后的SEDEX提取方法

图2 各形态磷垂向变化Fig.2 Vertical variations of the phosphorus fractions
3 结果与讨论
3.1 0~25 cm柱状沉积物磷的赋存形态及其垂向分布
研究区域0~25 cm柱状沉积物磷的垂向分布如图2所示,Or-P、Ex-P、Fe-P、Au-P、Re-P、De-P含量分别为1.88~4.52 μmol/g、0.33~1.00 μmol/g、0.17~0.66 μmol/g、0.44~2.35 μmol/g、2.31~4.56 μmol/g、7.18~15.9 μmol/g。沉积物各形态磷含量顺序为:De-P>Re-P或Or-P>Ex-P>Fe-P,两站位各磷形态含量相近。
弱吸附态磷(Ex-P)亦称为可交换态磷,主要以物理作用吸附在沉积物表面,是所有形态磷中与沉积物结合最弱的一种磷,很容易被释放到上覆水或间隙水中被生物所利用。A6-4站位0~19 cm范围内Ex-P含量在0~19 cm略有增加,19 cm后含量逐渐降低;A13-2站位Ex-P含量垂向变化比较复杂。这与两站位所处的沉积环境有关,A6-4位于长江口区域,水动力条件活跃,水体扰动会引起Ex-P的释放,因此上层Ex-P含量低;随着深度的增加,水体扰动逐渐减弱,Ex-P含量随深度增加而升高。随着沉积物深度的增加,磷在沉积物和上覆水体之间的迁移转化作用逐渐减弱,弱吸附态磷的含量一般越低[19],这也是A6-4站位19 cm以深Ex-P含量降低的原因。A13-2站位位于浙闽泥质区,沉积环境复杂,因此垂向分布较为复杂。
A6-4站位17 cm以浅Or-P含量有随深度增加而逐渐升高, 17 cm以深快速降低。A13-2站位Or-P含量垂向变化较复杂。长江口水动力条件活跃,再悬浮时有发生。沉积物的再悬浮、再沉积过程,形成了周期性的氧化还原循环,加快了有机物的矿化分解[16],越靠近表层Or-P矿化分解速率也会越快,可导致Or-P含量随深度增加而逐渐增加,如A6-4站位上层。剧烈的再悬浮还能改变Or-P本应随深度和时间变化而有序发生的早期成岩过程,如A13-2站位。A6-4站位17 cm以深Or-P含量的快速降低可能与沉积物粒度变化有关。
Fe-P含量上层分布较为复杂,但接近底层随深度增加含量略微降低。一般而言,随着沉积物深度的增加,还原性环境逐渐加强,Fe3+转化成Fe2+,Fe-P释放,导致Fe-P含量随深度增加而降低。此外,Fe-P含量的分布还与有机质的矿化分解有关。再悬浮过程中,有机质矿化分解,Or-P被解吸释放时,通常会伴随着沉积环境的氧化还原值Eh降低和pH值的升高等,有利于Fe-P解吸释放[20]。Or-P矿化分解所释放出的磷酸盐,有一部分又会被沉积物中活性Fe3+吸附、结合,转化为Fe-P。这些因素共同作用导致了Fe-P在上层分布比较复杂。
A6-4站位的Au-P含量略低于A13-2。这可能与A6-4临近长江河口,有大量颗粒物输入,对河口生物性颗粒物有稀释作用有关[17]。另外,Au-P也受盐度的影响,盐度增大,钙的活性增强[21],Au-P含量增大。A6-4受长江冲淡水影响,盐度低于A13-2站位,故导致其自Au-P含量偏低。从垂直分布上看,两个站位的Au-P的含量变化均较复杂。这不仅和研究区域沉积环境不稳定有关,还取决于Au-P自身的特性。在沉积物再悬浮过程中,有机磷矿化分解释放的磷酸盐,有一部分会被沉积物中活性Ca2+吸附、结合[22],转化成Au-P。另外,有机质矿化分解时,会释放出CO2,导致pH降低,有利于Au-P溶解。这些因素共同作用导致Au-P垂直变化复杂。
Re-P和De-P均主要来源于陆源输入,不易分解,为生物不可利用磷。A13-2站位的Re-P含量略高于A6-4站位。A6-4 Re-P含量在19~25 cm有显著降低,而在A13-2 站在6~7 cm也有明显低值。A6-4的De-P含量高于A13-2站位。垂直分布上,两站位De-P含量变化不尽相同,A6-4站位De-P的含量在0~2 cm显著增加,2~19 cm处略微降低,19~25 cm又大幅升高;A13-2站位De-P含量随深度变化复杂但总体呈降低趋势。这是因为Re-P和De-P是沉积磷中较惰性的组分,与其他形态磷之间不存在相互转化关系,A6-4 站位19 cm以深Re-P的降低和De-P的升高可能均与陆源排放有关。
A6-4站位,除了De-P和TP(图3)在19~25 cm有显著增加外,其他形态磷均呈现下降趋势,这可能与沉积物的粒径大小有关。何会军等[16]在关于长江口及近海沉积物中磷的分布特征的研究中发现,随着沉积物的粒径增大,De-P的含量显著增加,而其他形态磷相应的有减少的趋势。研究区域De-P为沉积物主要的磷赋存形态, De-P在19~25 cm的显著增加影响了TP的含量变化使其在19~25 cm出也呈现增加状态。

图3 各站位总磷的垂直分布Fig.3 Vertical distribution of total P in the sampling stations
3.2 总磷和生物可利用磷
研究区域0~25 cm沉积物中总磷(TP)含量的变化范围为14.7~20.5 μmol/g,平均含量为18.4 μmol/g。A6-4站位和A13-2站位TP含量相近,且两站位均是De-P含量最高,平均含量占TP的52.8%;其次是Or-P和Re-P,Fe-P和Ex-P含量则相对较低。垂向分布上,两站位TP含量随深度增加变化不尽相同(图3)。A6-4站位总磷含量随深度增加整体上呈上升趋势,其中上层0~5 cm、17~25 cm变化较为剧烈,中间部分较为稳定;A13-2站位TP含量随深度增加总体上呈下降趋势,其中上层变化较为剧烈,14 cm以后TP含量随深度增加基本不变。两站位上层变化剧烈可能与所处的沉积环境有关,A6-4位于长江口,水动力条件活跃,再悬浮时有发生,这可能是其近表层磷含量较低的原因。
生物可利用磷(BAP)是指可以从沉积物中释放并可以参与水体中磷的生物地球化学循环的磷,是弱吸附态磷(Ex-P)、铁结合态磷(Fe-P)以及可提取态有机磷(Or-P)的总称,亦称潜在活性磷[23]。研究区域0~25 cm沉积物中BAP的含量变化范围为2.86~5.58 μmol/g,平均含量是3.98 μmol/g,占TP的比例为21.6%。Or-P的含量占BAP含量的74.9%,为BAP的主要存在形态。生物可利用磷(BAP)在表层沉积物中的含量对上覆水体中磷的浓度和水体中藻类的生长有重要影响,其在表层沉积物中富集,会导致磷的释放潜力明显增加,当沉积物受到扰动引发再悬浮或理化环境发生变化时,会将这部分磷释放到水体中[17]。
3.3 沉积物间隙水磷酸盐的垂直分布
研究区域沉积物间隙水中磷酸盐的浓度范围为0.76~2.09 μmol/L,平均浓度为1.23 μmol/L,浓度与邹建军等[24]的研究相当。长江口及邻近海域间隙水中磷酸盐浓度相对较低,这不仅与氧化还原条件有关,还与沉积物中磷的赋存形态密切相关。长江口及邻近海域沉积物中BAP含量相对较低,其中Ex-P以及Fe-P含量极低,沉积物的这种磷形态分布可能是导致长江口及邻近海域沉积物间隙水中磷酸盐含量较低的原因。垂直分布上,两个站位的变化趋势不同(图4)。A6-4站位间隙水磷酸盐浓度随深度变化基本比较稳定,而A13-2间隙水磷酸盐浓度随深度增加而增大,19~25 cm则略有降低。间隙水中的磷酸盐不仅与有机质得降解有关,还受到沉积物中磷赋存形态的影响[25]。沉积物中非定型态铁的氢氧化物和氧化物具有很高的磷吸附能力[26]。在氧化环境中,磷酸盐会被铁的氢氧化物或氧化物所吸附,使其释放受到限制;在还原环境中,铁的氢氧化物或氧化物被还原,磷酸盐将得以释放,进入间隙水,这可能是A13-2站位间隙水中磷酸盐浓度随深度增加而升高的原因。
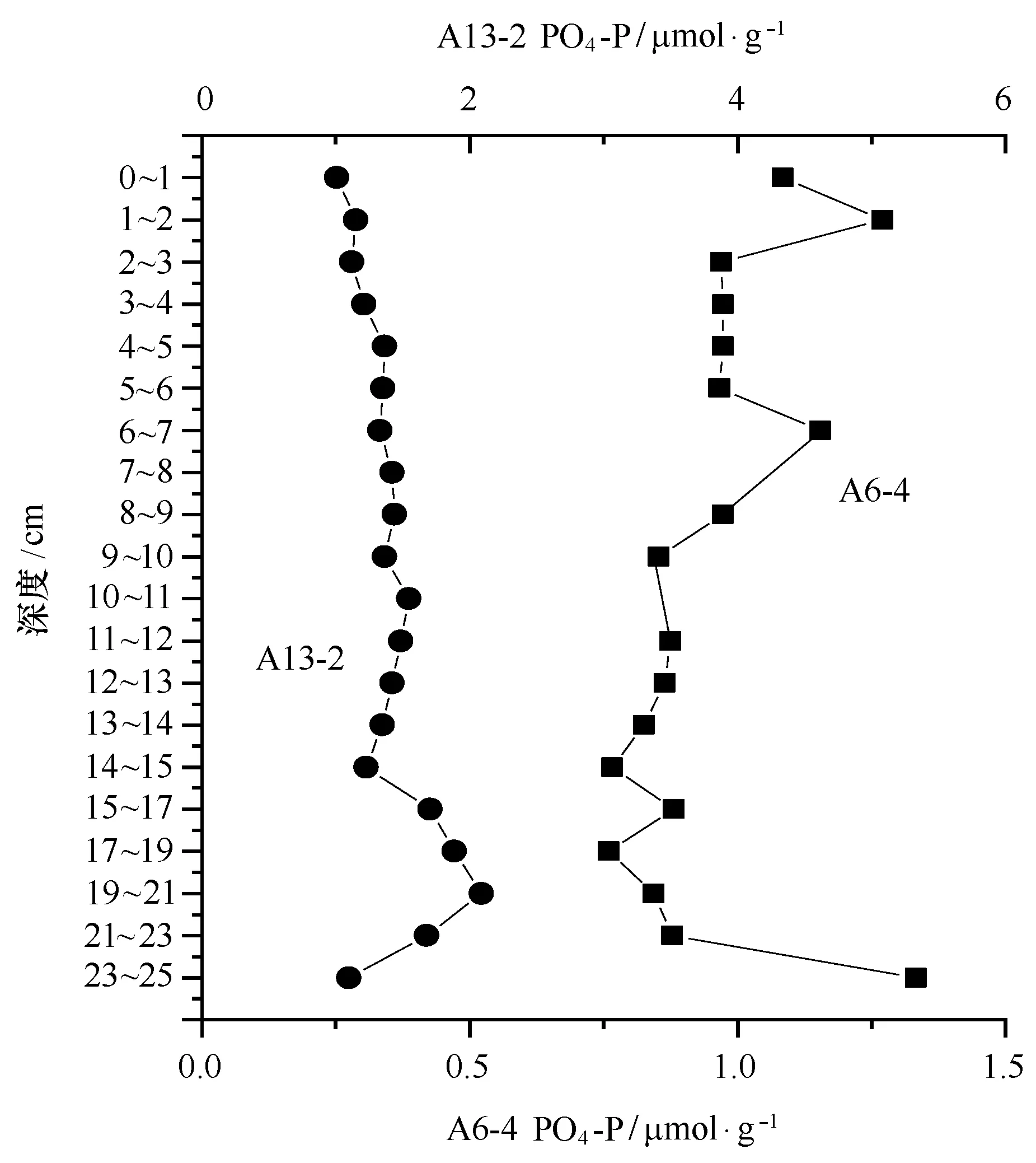
图4 间隙水磷酸盐的垂直分布Fig.4 Vertical distribution of PO4-P in interstitial water of sediments
3.4 沉积物再悬浮时水体磷酸盐浓度的变化过程
分别在A6-4、A13-2站位进行了沉积物再悬浮过程和沉降过程的模拟实验(图5、图6)。两个站位水体磷酸盐浓度随时间变化均呈现一定的波动性,且不同站位之间也呈现一定的差异性。

图5 A6-4站沉积物再悬浮和沉降过程水体磷酸盐的变化Fig.5 Variation of PO4-P in the resuspension and settlement process of sediment in station A6-4
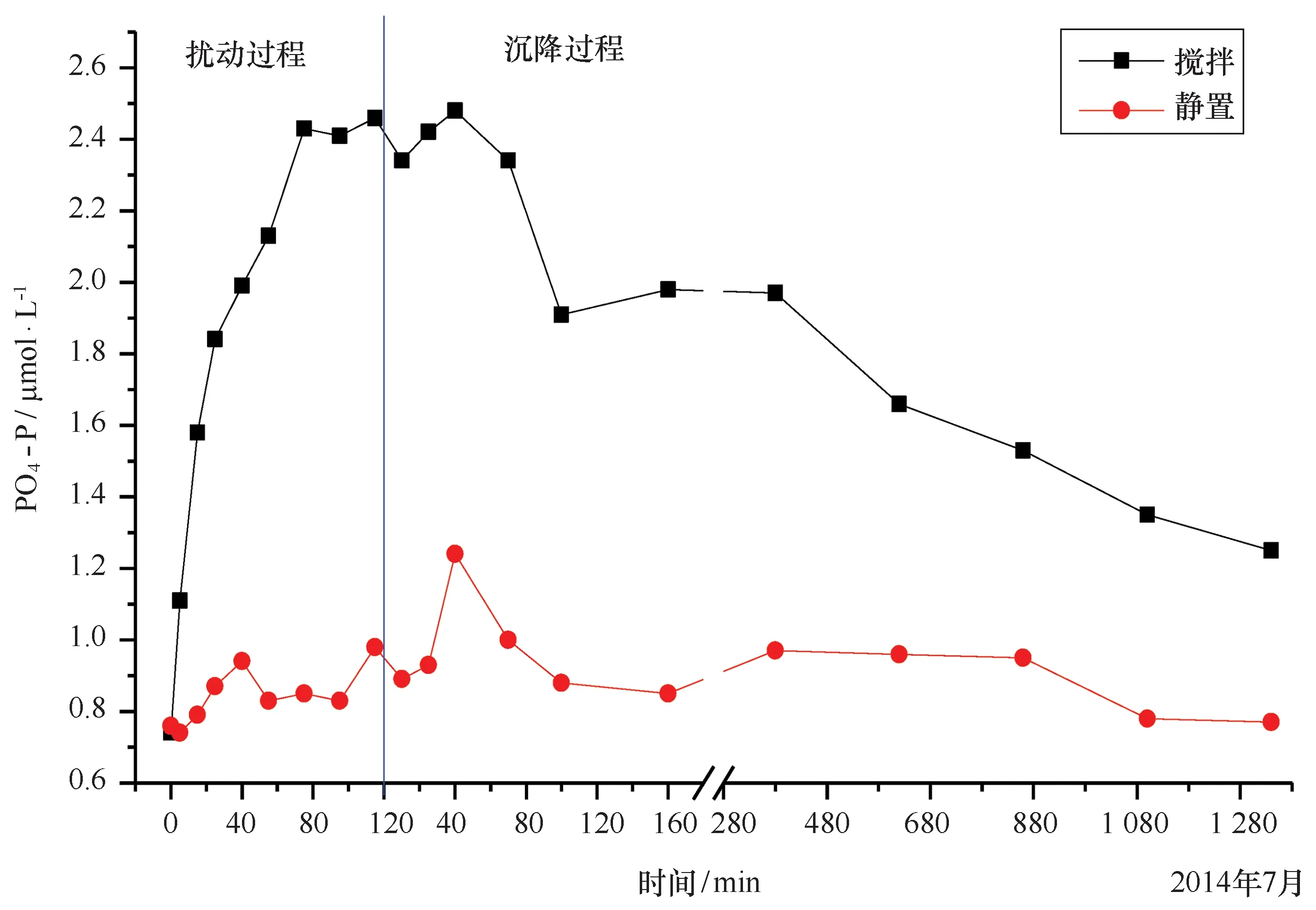
图6 A13-2 站沉积物再悬浮和沉降过程水体磷酸盐的变化Fig.6 Variation of PO4-P in the resuspension and settlement process of sediment in station A13-2
A6-4站实验组密闭处理及开口处理条件下磷酸盐浓度变化趋势基本一致,扰动阶段磷酸盐浓度均呈逐渐增加的趋势,而沉降阶段磷酸盐浓度均呈下降趋势,但从总体过程上看密闭处理和开口处理条件下磷酸盐浓度均有所升高(图5)。开口条件下,磷酸盐浓度从实验开始时的0.50 μmol/L增加到实验结束时的1.11 μmol/L,磷酸盐浓度增加了1.22倍。其中,扰动阶段磷酸盐浓度从0.50 μmol/L增加到1.73 μmol/L;沉降阶段磷酸盐浓度从1.73 μmol/L降低到1.11 μmol/L。密闭条件下,磷酸盐浓度从实验开始时的0.54 μmol/L增加到实验结束时的1.49 μmol/L,浓度增加了1.76倍,其中,扰动阶段磷酸盐浓度从0.54 μmol/L增加到1.98 μmol/L;沉降阶段磷酸盐浓度从1.98 μmol/L降低到1.49 μmol/L。可见厌氧条件更有利于沉积物磷的释放。对照组磷酸盐浓度几乎无变化,整个实验过程中密闭条件和开口条件再悬浮组磷酸盐浓度一直明显高于其对照组,这说明该区域沉积物再悬浮会导致磷酸盐的大量释放。
A13-2站实验组磷酸盐浓度总体上呈逐渐增加的趋势,其中扰动阶段磷酸盐浓度呈显著增加的趋势,而沉降阶段磷酸盐浓度逐渐降低(图6)。磷酸盐浓度从开始时的0.74 μmol/L增加到结束时的1.24 μmol/L,浓度增加了0.68倍。其中,扰动阶段磷酸盐浓度从0.74 μmol/L增加到2.34 μmol/L;沉降阶段磷酸盐浓度从2.34 μmol/L降低到1.24 μmol/L。对照组磷酸盐浓度基本保持恒定,且整个实验过程中,再悬浮组磷酸盐浓度一直显著高于对照组,这说明该研究区域沉积物再悬浮会导致磷酸盐的释放。

表3 沉积物及间隙水中PO4-P释放对水体PO4-P的影响
注:海水的密度为1.03×103g/L。①间隙水完全释放贡献的总量,②模拟实验结束时再悬浮的释放量。
大量研究[27—31]表明:沉积物再悬浮会使磷酸盐大量释放,导致上覆水磷酸盐浓度升高。模拟实验结果显示,经过扰动和沉降后,上覆水磷酸盐的浓度有了显著的升高,说明沉积物再悬浮会导致磷酸盐的释放。间隙水中磷酸盐的浓度是影响上覆水体磷酸盐浓度的一个重要因素。通过沉积物湿质量、含水率[含水率(%)=( 湿质量-干质量)/湿质量×100%,质量单位:g]和间隙水磷酸盐的浓度,粗略估算间隙水释放对水体磷酸盐浓度的贡献(假定再悬浮发生时,间隙水磷酸盐立即全部释放)。由表3可知,A6-4、A13-2间隙水磷酸盐完全释放,将为上覆水体磷酸盐贡献的量分别为0.19 μmol、0.21 μmol,占模拟实验结束时再悬浮释放量的18.6%和21.8%。说明沉积物发生再悬浮时,间隙水磷酸盐的释放对水体磷酸盐浓度升高有一定贡献,而水体磷酸盐浓度的上升主要源于沉积物中磷的释放。沉积物释放是影响水体磷酸盐浓度的重要因素,沉积物是水体中各形态磷的归宿,它也可以作为磷源向上覆水体释放磷[32]。本研究模拟实验扰动阶段体水磷酸盐浓度迅速显著升高,这是因为当再悬浮发生时,会导致沉积物中的BAP释放,从而引起水体中磷酸盐浓度升高。由于Ex-P以物理作用吸附在沉积物表面,与沉积物结合最弱,所以沉积物发生再悬浮时,Ex-P会迅速向水中释放。其次,再悬浮也会加速Fe-P化学键的断裂,Fe-P放转化为磷酸盐和Fe3+进入上覆水中[33]。再悬浮也促进了沉积物中Or-P的矿化[34],这一般被认为是再悬浮时水体磷酸盐浓度增加的主要原因。然而,随着模拟实验时间的增加,水体磷酸盐浓度增加幅度逐渐减慢甚至会略有降低,而后期磷酸盐浓度趋于稳定。这是因为沉积物发生再悬浮时,当沉积物释放磷酸盐达到一定程度后,磷酸盐释放进入“枯竭”状态,此时磷酸盐在沉积物和水体相之间处于一种释放与吸附的动态平衡状态[28],这和孙小静等[35]研究结果一致。模拟实验沉降阶段,水体磷酸盐浓度逐渐降低直至稳定。这是因为随着沉积物再悬浮的进行,水体中悬浮物颗粒物含量也显著升高,释放到体水中的一部分磷酸盐将会被悬浮颗粒物吸附甚至与沉积物中的Fe、Al、Mn、Ca等离子形成的氧化物或金属氧化物发生物理甚至是化学吸附。另外,随着再悬浮的进行,悬浮颗粒物碰撞几率增加,从而强化了细颗粒物的絮凝与聚集,使得吸附了大量磷酸盐的悬浮颗粒物沉降进入沉积物[36]。这一般被认为是再悬浮时水体磷酸盐浓度降低的原因。
A6-4站的(密闭和开口)模拟实验可以看出,厌氧条件相对于好氧条件,更有利于沉积物磷的释放。这是因为还原条件下,Fe3+转化成Fe2+,Fe-P发生释放。而且厌氧条件下,不易形成铁锰氧化物、铁锰氢氧化物胶体,导致悬浮颗粒物对磷酸盐的吸附作用也减弱,从而引起水体磷酸盐浓度较好氧条件高。
4 结论
(1)研究区域,De-P是沉积物磷的主要赋存形态,占总磷(TP)的50%以上;其次是Or-P和Re-P。BAP占TP的比例约为21.6%, Or-P的含量占BAP含量的74.9%,为BAP的主要成分。
(2)沉积物再悬浮导致水体磷酸盐浓度显著升高。再悬浮过程中水体磷酸盐浓度随时间呈逐渐升高的趋势,但增加速率逐渐减慢,再悬浮后期磷酸盐浓度趋于稳定;而沉降过程中水体磷酸盐浓度降低。沉积物中磷的释放是导致水体磷酸盐浓度升高的主要因素。
(3)沉积物发生再悬浮时,厌氧条件相对于好氧条件,更有利于沉积物磷的释放。
[1] Li Dapeng, Huang Yong, Fan Chengxin, et al. Contributions of phosphorus on sedimentary phosphorus bioavailability under sediment resuspension conditions[J]. Chemical Engineering Journal, 2011, 168(3): 1049-1054.
[2] Perkins R G, Underwood G J C. The potential for phosphorus release across the sediment-water interface in an eutrophic reservoir dosed with ferric sulphate[J]. Water Research, 2001, 35(6): 1399-1406.
[3] 郭建宁, 卢少勇, 金相灿, 等. 滇池福保湾沉积物不同形态磷的垂向分布[J]. 环境科学研究, 2007, 20(2): 78-83.
Guo Jianning, Lu Shaoyong, Jin Xiangcan, et al. Vertical distribution of various forms of phosphorus in the sediments of Fubao Gulf, Dianchi Lake[J]. Research of Environmental Sciences, 2007, 20(2): 78-83.
[4] 王圣瑞, 金相灿, 赵海超, 等. 长江中下游浅水湖泊沉积物对磷的吸附特征[J]. 环境科学, 2005, 26(3): 38-43.
Wang Shengrui, Jin Xiangcan, Zhao Haichao, et al. Phosphate adsorption characteristics onto the sediments from shallow lakes in the middle and lower reaches of the Yangtze River[J]. Environmental Science, 2005, 26(3): 38-43.
[5] 张洪梅, 刘鑫, 邓建才, 等. 太湖沉积物再悬浮对水体中磷形态和浓度时空差异性影响[J]. 农业环境科学学报, 2013, 32(11): 2251-2257.
Zhang Hongmei, Liu Xin, Deng Jiancai, et al. Tempo-spatial discrepancies in phosphorus species and concentrations in Lake Taihu water influenced by sediment resuspension from wind[J]. Journal of Agro-Environment Science, 2013, 32(11): 2251-2257.
[6] 郑西来, 张俊杰, 陈蕾. 再悬浮条件下沉积物内源磷迁移-转化机制研究进展[J]. 水科学进展, 2013, 24(2): 287-295.
Zheng Xilai, Zhang Junjie, Chen Lei. Advances in the study of migration and transformation mechanisms of endogenous phosphorus via sediment resuspension[J]. Advances in Water Science, 2013, 24(2): 287-295.
[7] Aller R C, Mackin J E, Ullman W J, et al. Early chemical diagenesis, sediment-water solute exchange, and storage of reactive organic matter near the mouth of the Changjiang, East China Sea[J]. Continental Shelf Research, 1985, 4(1/2): 227-251.
[8] 石峰, 王修林, 石晓勇, 等. 东海沉积物-海水界面营养盐交换通量的初步研究[J]. 海洋环境科学, 2004, 23(1): 5-8.
Shi Feng, Wang Xiulin, Shi Xiaoyong, et al. Benthic flux of dissolved nutrients at the sediment-water interface in the East China Sea[J]. Marine Environmental Science, 2004, 23(1): 5-8.
[9] 戚晓红, 刘素美, 张经. 东、黄海沉积物-水界面营养盐交换速率的研究[J]. 海洋科学, 2006, 30(3): 9-15.
Qi Xiaohong, Liu Sumei, Zhang Jing. Sediment-water fluxes of nutrients in the Yellow Sea and the East China Sea[J]. Marine Sciences, 2006, 30(3): 9-15.
[10] 刘素美, 张经. 沉积物间隙水的几种制备方法[J]. 海洋环境科学, 1999, 18(2): 66-71.
Liu Sumei, Zhang Jing. Sediment pore water sampling techniques[J]. Marine Environmental Science, 1999, 18(2): 66-71.
[11] 董爱国, 翟世奎, Matthias Z, 等. 长江口及邻近海域表层沉积物中重金属元素含量分布及其影响因素[J]. 海洋学报, 2009, 31(6): 54-68.
Dong Aiguo, Zhai Shikui, Matthias Z, et al. The distribution of heavy metal contents in surface sediments of the Changjiang Estuary in China and surrounding coastal areas[J]. Haiyang Xuebao, 2009, 31(6): 54-68.
[12] 赵军. 长江口与密西西比河口沉积有机碳生物地球化学比较研究: 以色素为生物标志物[D]. 青岛: 中国海洋大学, 2011.
Zhao Jun. Comparative research on biogeochemistry of sedimentary organic carbon in the Changjiang and Mississippi Estuaries: Using pigments as biomarkers[D]. Qingdao: Ocean University of China, 2011.
[13] 刘淑民. 长江口及邻近海域悬浮物和沉积物中生物硅的研究[D]. 青岛: 中国海洋大学, 2013.
Liu Shumin. Biogenic silica in suspended matter and sediments in the Yangtze River estuary and its adjacent sea[D]. Qingdao: Ocean University of China, 2013.
[14] 张晋华. 长江口及其邻近海域沉积物中磷形态的研究[D]. 青岛: 中国海洋大学, 2014.
Zhang Junhua. Phosphorus forms in sediments in the Yangtze River estuary and its adjacent sea[D]. Qingdao: Ocean University of China, 2014.
[15] Vink S, Chambers R M, Smith S V. Distribution of phosphorus in sediments from Tomales Bay, California[J]. Marine Geology, 1997, 139(1/4): 157-179.
[16] 何会军, 于志刚, 姚庆祯, 等. 长江口及毗邻海区沉积物中磷的分布特征[J]. 海洋学报, 2009, 31(5): 19-30.
He Huijun, Yu Zhigang, Yao Qinghzen, et al. Distribution of phosphorus in sediments from the Changjiang Estuary and its adjacent sea[J]. Haiyang Xuebao, 2009, 31(5): 19-30.
[17] 孟佳, 姚庆祯, 陈洪涛, 等. 北黄海表层沉积物中颗粒态磷的形态分布[J]. 环境科学, 2012, 33(10): 3361-3367.
Meng Jia, Yao Qingzhen, Chen Hongtao, et al. Forms and distributions of particulate phosphorus in the surface sediments of North Yellow Sea[J]. Environmental Science, 2012, 33(10): 3361-3367.
[18] Anschutz P, Zhong S J, Sundby B. Burial efficiency phosphorus and the geochemistry of iron in continental margin sediments[J]. Limnology and Oceanography, 1998, 43(1): 53-64.
[19] 张志斌, 张学阳, 张波, 等. 南四湖山湖微山湖区沉积物磷形态分布特征[J]. 环境科学, 2009, 30(5): 1345-1350.
Zhang Zhibin, Zhang Xueyang, Zhang Bo, et al. Distribution of phosphorus species in the sediment from Weishanhu District in Lake Nansihu[J]. Environmental Science, 2009, 30(5): 1345-1350.
[20] Meng Jia, Yao Peng, Yu Zhigang, et al. Speciation, bioavailability and preservation of phosphorus in surface sediments of the Changjiang Estuary and adjacent East China Sea inner shelf[J]. Estuarine, Coastal and Shelf Science, 2014, 144: 27-38.
[21] 徐明德, 韦鹤平, 李敏, 等. 长江口泥沙和沉积物中磷酸盐存在形态的研究[J]. 四川环境, 2006, 25(1): 52-54.
Xu Mingde, Wei Heping, Li Min, et al. Study on the phosphate forms in suspended sands and sediments in Yangtze River Estuary[J]. Sichuan Environment, 2006, 25(1): 52-54.
[22] Cha H J, Lee C B, Kim B S, et al. Early diagenetic redistribution and burial of phosphorus in the sediments of the southwestern East Sea (Japan Sea)[J]. Marine Geology, 2005, 216(3): 127-143.
[23] Boström B, Persson G, Broberg B. Bioavailability of different phosphorus forms in freshwater systems[J]. Hydrobiologia, 1988, 170(1): 133-155.
[24] 邹建军, 石学法, 刘季花, 等. 长江口及其邻近海域孔隙水地球化学特征[J]. 地球化学, 2010, 39(6): 580-589.
Zou Jianjun, Shi Xuefa, Liu Jihua, et al. Geochemical characteristics of pore water in the Yangtze Estuary and adjacent areas[J]. Geochimica, 2010, 39(6): 580-589.
[25] 昝逢宇, 霍守亮, 席北斗, 等. 巢湖近代沉积物及其间隙水中营养物的分布特征[J]. 环境科学学报, 2010, 30(10): 2088-2096.
Zan Fengyu, Huo Shouliang, Xi Beidou, et al. Characteristics of nutrient profiles in sediments and pore water of Lake Chaohu[J]. Acta Scientiae Circumstantiae, 2010, 30(10): 2088-2096.
[26] Slomp C P, Malschaert J F P, Van Raaphorst W. The role of adsorption in sediment-water exchange of phosphate in north sea continental margin sediments[J]. Limnology and Oceanography, 1998, 43(5): 832-846.
[27] 秦伯强, 胡维平, 高光, 等. 太湖沉积物悬浮的动力机制及内源释放的概念性模式[J]. 科学通报, 2003, 48(17): 1822-1831.
Qin Boqiang, Hu Weiping, Gao Guang, et al. Dynamics of sediment resuspension and the conceptual schema of nutrient release in the large shallow Lake Taihu, China[J]. Chinese Science Bulletin,2003, 48(17): 1822-1831.
[28] 钱嫦萍, 陈振楼, 胡玲珍, 等. 崇明东滩沉积物再悬浮对沉积物-水界面氮、磷交换行为的影响[J]. 环境科学, 2003, 24(5): 114-119.
Qian Changping, Chen Zhenlou, Hu Lingzhen, et al. Effects of sediment resuspension on nitrogen and phosphate exchange at the sediment-water interface in East Chongming Tidal Flat[J]. Environmental Science, 2003, 24(5): 114-119.
[29] Carrick H J, Aldridge F J, Schelske C L. Wind influences Phytoplankton biomass and composition in a shallow, productive lake[J]. Limnology and Oceanography, 1993, 38(6): 1179-1192.
[30] Ccanfield D E Jr, Hoyer M V. The eutrophication of lake okeechobee[J]. Lake and Reservoir Management, 1988, 4(2): 91-99.
[31] Robarts D R, Waiser M J, Hadas O, et al. Relaxation of phosphorus limitation due to typhoon-induced mixing in two morphologically distinct basins of Lake Biwa, Japan[J]. Limnology and Oceanography, 1998, 43(6): 1023-1036.
[32] Ribeiro D C, Martins G, Nogueira R, et al. Phosphorus fractionation in volcanic lake sediments (Azores-portugal) [J]. Chemosphere, 2008, 70(7): 1256-1263.
[33] 范成新, 张路, 秦伯强, 等. 风浪作用下太湖悬浮态颗粒物中磷的动态释放估算[J]. 中国科学: D 辑, 2003, 33(8): 760-768.
Fan Chengxin, Zhang Lu, Qin Boqiang, et al. The estimation of dynamic release of phosphorus in suspened particulate matter under the action of wind and waves[J]. Science in China Series D: Earth Sciences, 2004, 47(8): 710-719.
[34] Ståhlberg C, Bastviken D, Svensson B H, et al. Mineralisation of organic matter in coastal sediments at different frequency and duration of resuspension[J]. Estuarine, Coastal and Shelf Science, 2006, 70(1/2): 317-325.
[35] 孙小静, 朱广伟, 罗潋葱, 等. 浅水湖泊沉积物磷释放的波浪水槽试验研究[J]. 中国科学: D 辑, 2005, 35(Ⅱ): 81-89.
Sun Xiaojing, Zhu Guangwei, Luo Liancong, et al. Experimental study on phosphorus release from sediments of shallow lake in wave flume[J]. Science in China, Series D, 2006, 49(S1): 92-101.
[36] 李大鹏, 黄勇, 李伟光. 再悬浮条件下底泥中磷赋存形态的转化研究[J]. 环境科学, 2008, 29(5): 1289-1294.
Li Dapeng, Huang Yong, Li Weiguang. Transformation of phosphorus forms in the sediments under the conditions of sediments re-suspension[J]. Environmental Science, 2008, 29(5): 1289-1294.
Simulation study of the effects of sediment resuspension on phosphate loading in the Changjiang Estuary and its adjacent area
Jiao Hengchen1,2, Wang Panpan1,2, Jian Huimin1, Yao Qingzhen1,2
(1.KeyLaboratoryofMarineChemistryTheoryandTechnology,MinistryofEducation,OceanUniversityofChina,Qingdao266100,China; 2.CollegeofChemistryandChemicalEngineering,OceanUniversityofChina,Qingdao266100,China)
Two core sediment were collected in the Changjiang Estuary and its adjacent area as study areas. The SEDEX method was applied to determined the forms of phosphorus in the sediments. Effects of sediment resuspension on the phosphate in the water column was studied. The results indicated that Detrital P was the highest form, which accounted for above 50% of TP. The contents of organic P and refractory P were also higher than other forms. Bioavailable P was accounted for 21% of TP. Organic P was the major part of bioavailable P. The concentrations of phosphate in overlying water was significantly higher when sediment resuspension occurred. It shows that sediment resuspension can cause the phosphourus in sediment to release. The increase of phosphate concentration in water mainly comes from the release of phosphorus in sediments. And the contribution of phosphate interstitial water is less than sediments. In addition, It is more favorable to the release of phosphorus in sediment resuspension in the anaerobic condition than that in the aerobic condition.
Changjiang Estuary; sediment resuspension; phosphorous species; phosphate
10.3969/j.issn.0253-4193.2017.04.003
2016-05-20;
2016-10-23。
鳌山科技创新计划项目(2016ASKJ02);国家自然科学基金(41276070)。
矫恒晨(1991—),男,山东省青岛市人,主要研究方向为海洋环境要素测量方法研究。E-mail:hchjiao@163.com
*通信作者:简慧敏,工程师,主要从事河口与近海海洋营养元素、痕量元素循环的研究。E-mail:jianhm@ouc.edu.cn
P734.4
A
0253-4193(2017)04-0028-11
矫恒晨,王盼盼,简慧敏,等. 长江口及邻近海域沉积物再悬浮对水体磷酸盐的影响的模拟研究[J].海洋学报,2017,39(4):28—38,
Jiao Hengchen , Wang Panpan, Jian Huimin, et al. Simulation study of the effects of sediment resuspension on phosphate loading in the Changjiang Estuary and its adjacent area[J]. Haiyang Xuebao,2017,39(4):28—38, doi:10.3969/j.issn.0253-4193.2017.04.003
