藜、铁苋菜和苘麻对草甘膦的耐受性及其与莽草酸含量的关系
2017-04-14刘小龙李香菊
刘小龙 李香菊

摘要:采用整株生物测定法研究了藜、铁苋菜和苘麻对草甘膦的耐受性,药后14d测定结果表明,草甘膦对上述3种杂草的ED50分别为215.27、954.34、1522.54ga.i./hm2。通过比较杂草植株地上部莽草酸积累量的变化发现,草甘膦1230ga.i./hm2处理后,藜、铁苋菜和苘麻莽草酸积累量最大值分别为1400.65、1247.19、581.28μg/g,莽草酸积累量越少的杂草对草甘膦耐受性也越强。药后5d,對杂草不同部位莽草酸积累量的比较显示,3种杂草顶部叶片莽草酸积累量明显大于根部,敏感种和耐受种相比,顶部叶片莽草酸积累量的差异更为明显,该部位可以准确地评价杂草对草甘膦的耐受程度。
关键词:草甘膦;敏感性;莽草酸;藜;铁苋菜;苘麻;杂草
中图分类号:S451文献标志码:A文章编号:1003-935X(2016)02-0034-04
草甘膦长期、大面积单一使用,引起杂草群落演替,为杂草治理带来了新问题。一方面,杂草遗传、生理或生化改变,过去敏感杂草对草甘膦产生抗性;另一方面,草甘膦的长期使用杀除了对其敏感的杂草,耐药性杂草被保留下来,不可避免地造成了杂草种类和种群数量的变化[1],抗草甘膦转基因作物的推广种植更是加重了这一趋势。研究显示,在美国西部玉米带,连续5年使用草甘膦后,之前以地肤和稷为优势种的杂草群落演替成藜为优势种群[2],使得田间杂草治理难度增加。研究农田杂草对草甘膦的敏感性差别,明确对草甘膦具有耐受性的杂草种,从而根据田间杂草种类和数量的变化合理调整草甘膦施用剂量或轮换使用其他除草剂,是农药减施及杂草有效治理的重要途径。
草甘膦通过竞争性抑制莽草酸合成途径中5-烯醇丙酮莽草酸-3-磷酸合成酶(EPSPS)与底物莽草酸-3-磷酸(S3P)的结合,导致植物体内莽草酸积累,阻断芳香族氨基酸苯丙氨酸、酪氨酸和色氨酸的合成而使植株死亡[3]。因此,莽草酸可作为检测杂草对草甘膦敏感性的指示物质[4]。Lorraine-Colwill等发现,经草甘膦处理的抗草甘膦瑞士黑麦草体内莽草酸积累量明显低于敏感种群[5]。Chen等的研究显示,草甘膦处理后3个抗性牛筋草种群的莽草酸积累量皆明显低于敏感种群[6],表明杂草莽草酸积累量与其抗性相关。刘延等在对耐草甘膦田旋花的研究中发现,田旋花在草甘膦处理后莽草酸积累量明显低于敏感性较强的打碗花[7],亦有研究显示耐草甘膦刺毛黧豆草甘膦处理后其莽草酸积累量要明显低于敏感性较强的反枝苋[8],因此可以通过草甘膦施用后杂草体内莽草酸含量的变化来比较不同杂草对草甘膦的耐受性差异。但对藜、铁苋菜、苘麻等杂草体内莽草酸含量变化与其对草甘膦耐受性关系研究鲜有报道。
笔者在田间试验中发现,藜、铁苋菜、苘麻等对草甘膦具有较强的耐受性。上述杂草对草甘膦耐受性与施药后莽草酸含量变化是否相关,杂草不同部位对莽草酸积累程度是否有差异?基于此,本试验在对上述3种杂草耐受性生物测定的基础上,研究了草甘膦处理后其体内莽草酸积累动态及莽草酸在不同部位分布情况,以期建立杂草莽草酸含量变化与草甘膦敏感性的对应关系,为田间草甘膦耐受性杂草的检测提供技术支持。
1材料与方法
1.1材料与仪器
41%草甘膦异丙胺盐水剂(glyphosateisopropylaminesalt,41%AS)(美国孟山都公司);莽草酸(shikimate)标准品(纯度>99.0%,Sigma公司);高碘酸、NaOH、甘氨酸均为国产分析纯。
ASS-3型自动控制农药喷洒试验系统(国家农业信息化工程技术研究中心研制);UV-4802型紫外可见分光光度计;5810R低温离心机。
藜、苘麻和铁苋菜采自北京,采集点皆无草甘膦用药历史。
1.2试验方法
1.2.1试材培养选取成熟、饱满的杂草种子分别播种于装有壤土和草炭3∶[KG-*3]1的花盆中,花盆直径10.5cm,高8.5cm。播种后保持土壤湿润。杂草于6—8月在温室培养,2~3叶期间苗,每盆保留等量生长一致的植株。待杂草长至5叶1心期时,喷施草甘膦。
1.2.2不同杂草对草甘膦敏感性的测定41%草甘膦异丙胺盐水剂使用剂量分别为76.87、153.75、307.5、615、1230、2460、4920ga.i./hm2。药后14d剪取地上部分称量鲜质量,计算鲜质量抑制率,公式如下:
鲜质量抑制率=[SX(]对照鲜质量-处理鲜质量[]对照鲜质量[SX)]×100%。
用DPS统计软件求出毒力回归方程、抑制中浓度ED50及相关性系数r2。采用随机区组设计,每处理重复4次。
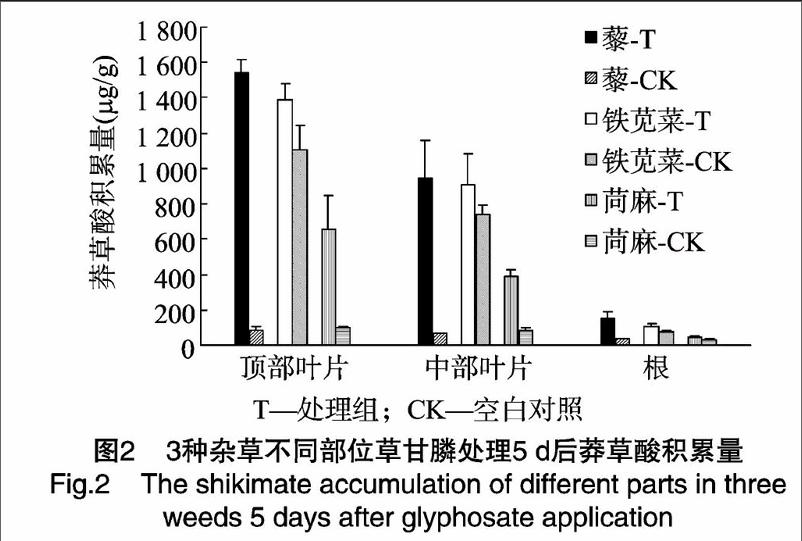
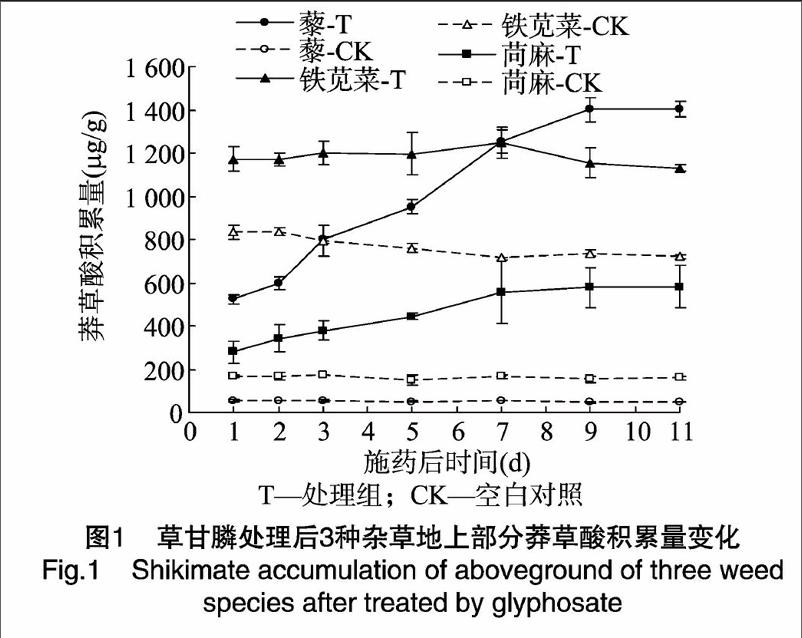
1.2.3莽草酸的提取杂草喷施浓度为1230ga.i./hm2草甘膦后于1、2、3、5、7、9、11d剪取杂草地上部茎叶,将样本剪碎,于研钵中用液氮研磨,取0.5g,加入1.0mL、0.25mol/L的HCl溶液,于4℃、12000r/min下离心30min,收集上清液,4℃保存待测。每处理重复3次。不同部分莽草酸含量测定分为顶部叶片、中部叶片和根3个部分,分别剪取顶部2片展开叶和心叶、其余茎部成熟叶片以及根,叶片皆从叶柄基部剪取。
1.2.4莽草酸含量的测定参照娄远来等的方法[9]。取200μL样品上清液,加入2.0mL1%过碘酸溶液,室温静置3h后再加入2.0mL1.0mol/LNaOH溶液,混匀后加入1.2mL0.1mol/L甘氨酸,静置5min,于380nm下比色,记录吸光度(D)。
1.2.5莽草酸标准曲线的绘制将莽草酸标准样品10mg溶于1mL0.25mol/LHCl中,分别取0、1.0、2.5、5.0、10.0、12.5、25.0μL于试管中,加0.25mol/L的HCL溶液至1mL,用与莽草酸含量测定相同的步骤测定D值。
2结果与分析
2.1不同杂草对草甘膦的敏感性
不同杂草种对草甘膦的敏感性存在差异。药后14d目测观察,草甘膦615ga.i./hm2处理时,藜仅少量存活,且生长受到明显抑制,苘麻、铁苋菜正常生长;草甘膦1230ga.i./hm2处理时,藜整株死亡,苘麻、铁苋菜依然存活,但生长受到较为明显的抑制;2460ga.i./hm2处理时,铁苋菜死亡,苘麻生长受到明显抑制但未死亡;4920ga.i./hm2處理时,苘麻整株死亡。将草甘膦对不同杂草的ED50列于表1。由此看出,草甘膦对藜、铁苋菜和苘麻3种杂草的ED50分别为215.27、954.34、1522.54ga.i./hm2,该药杀死供试苘麻的ED50是藜ED50的7倍以上。
2.2不同杂草地上部分莽草酸积累量的变化
草甘膦处理后,不同杂草体内莽草酸积累量有较大差异(图1)。藜、铁苋菜和苘麻的莽草酸最大积累量分别为1400.65、1247.19、581.28μg/g,对草甘膦表现越敏感的杂草种莽草酸积累量越高。
尽管药后3种杂草莽草酸积累量均表现逐渐上升,但变化幅度和峰值出现时间则有不同:用药后藜的莽草酸含量迅速上升,从药后1d的523.05μg/g上升到药后9d的最高值1400.64μg/g,铁苋菜和苘麻的莽草酸含量变化相对平缓,药后1d分别为1172.73、279.22μg/g,药后9d分别为1154.33、577.06μg/g,表明施用草甘膦后藜体内莽草酸迅速积累,使杂草受害。
上述莽草酸积累量所显示杂草对草甘膦敏感性的测定结果与整株生测法的敏感性测定结果一致。
2.3不同部位莽草酸积累量的比较
施用1230ga.i./hm2草甘膦5d后,杂草体内不同部位莽草酸积累量有较大差异(图2),顶部叶片莽草酸积累量最高,其次是中部叶片,积累量最低的部位为根。目测观察也发现,施药后,3种杂草顶部叶片最先表现受害症状,根部最后死亡。这可能与草甘膦的吸收和传导有关。3种杂草顶部叶片莽草酸积累量大于中部叶片和根,表明植株该部位是对草甘膦最为敏感的部位,也是最先受到草甘膦抑制的部位。
3讨论
喷施草甘膦后,3种杂草体内莽草酸积累,导致杂草受害,因此莽草酸积累量作为杂草对草甘膦耐受性的指标在检测耐药性杂草时同样适用,这与前人对杂草抗药性的研究结果一致。本试验中,草甘膦1230ga.i./hm2处理下,藜的莽草酸积累量在短时间内迅速上升,积累峰值明显大于另外2种杂草,生测结果也表明3种杂草中藜对草甘膦敏感,而铁苋菜与苘麻对草甘膦耐受性较强。
通过比较杂草体内不同部位的莽草酸积累量,可以发现,与中部成熟叶片和根相比,顶部叶片莽草酸含量变化最为明显,积累量最高,这可能是由顶部叶片内莽草酸途径代谢活跃以及草甘膦的吸收与传导所致[10-11]。杂草顶部叶片分生组织区莽草酸途径代谢活跃,草甘膦施用后对EPSP合成酶的抑制会导致莽草酸在短时间内迅速积累,同时顶部分生组织往往是草甘膦易于集中的部位[11],研究发现一些杂草可以通过减少草甘膦在分生组织区的积累而获得抗性[12-13],因此通过草甘膦施用后顶部叶片内莽草酸含量的变化来评估杂草对草甘膦的耐受性差异要比整株测定更为科学,并且对顶部叶片取样要比整株取样进行莽草酸含量的测定更为简便。
在以往国外报道中,藜对草甘膦具有一定的耐受性,这与本研究结果有所出入,分析原因可能与试材施药时的叶龄相关,藜叶龄较大时,对草甘膦耐受性增强,本试验选取5叶1心期藜的幼苗可能对草甘膦耐受性较差。已有研究表明,藜对草甘膦的敏感性会随着植株的生长显著下降[14-16],因此在田间藜种群数量较大情况下,使用草甘膦进行防治应选择在藜的低龄阶段用药。
国外已有许多关于耐草甘膦杂草的报道[17-19],我国也发现了对草甘膦具有耐受性的牛筋草、田旋花和铁苋菜[20-22],说明我国草甘膦的使用已引起了某些地区杂草群落的改变,使杂草群落朝着不利于草甘膦防除的方向发展。摸清不同杂草种群对草甘膦的敏感性反应,依据杂草种群选择合适的草甘膦剂量变量喷药,将为减量使用除草剂开辟途径。
参考文献:
[1]ShanerDL.Theimpactofglyphosate-tolerantcropsontheuseofotherherbicidesandonresistancemanagement[J].PestManagementScience,2000,56(4):320-326.
[2]WilsonRG,MillerSD,WestraP,etal.Glyphosate-inducedweedshiftsinglyphosate-resistantcornorarotationofglyphosate-resistantcorn,sugarbeet,andspringwheat[J].WeedTechnology,2007,21(4):900-909.
[3]AmrheinN,DeusB,GehrkeP,etal.ThesiteofinhibitionoftheshikimatepathwaybyglyphosateⅡ.Interferenceofglyphosatewithchorismateformationinvivoandinvitro[J].PlantPhysiology,1980,66(5):830-834.
[4]SinghBK.Rapiddeterminationofglyphosateinjurytoplantsandidentificationofglyphosateresistantplants[J].WeedTechnology,1998,12(3):527-530.
[5]Lorraine-ColwillDF,HawkesTR,WilliamsPH,etal.ResistancetoglyphosateinLoliumrigidum[J].PesticideScience,1999,55(4):486-503.
[6]ChenJC,HuangHC,ZhangCX,etal.MutationsandamplificationofEPSPSgeneconferresistancetoglyphosateingoosegrass(Eleusineindica)[J].Planta,2015,242(4):859-868.
[7]刘延,张朝贤,黄红娟,等.草甘膦对田旋花和打碗花体内莽草酸含量的影响[J].杂草科学,2008(2):11-12.
[8]Rojano-DelgadoAM,Cruz-HipolitoH,dePradoR,etal.Limiteduptake,translocationandenhancedmetabolicdegradationcontributetoglyphosatetoleranceinMucunapruriensvar.utilisplants[J].Phytochemistry,2012,73:34-41.
[9]娄远来,邓渊钰,沈晋良,等.甲磺隆和草甘膦对空心莲子草乙酰乳酸合酶活性和莽草酸含量的影响[J].植物保护学报,2005,32(2):185-188.
[10]WeaverLM,HermannKM.Dynamicsoftheshikimatepathwayinplants[J].TrendsPlantSci,1997,2(9):346-351.
[11]ShanerDL.Roleoftranslocationasamechanismofresistancetoglyphosate[J].WeedScience,2009,57(1):118-123.
[12]Lorraine-ColwillDF,PowlesSB,HawkesTR,etal.InvestigationsintothemechanismofglyphosateresistanceinLoliumrigidum[J].PesticBiochemPhysiol,2002,74(2):62-72.
[13]FengPC,TranM,ChiuT,etal.InvestigationintoGRhorseweed(Conyzacanadensis):retention,uptake,translocationandmetabolism[J].WeedSci,2004,52(4):498-505.
[14]SivesindEC,GaskaJM,JeschkeMR,etal.Commonlambsquartersresponsetoglyphosateacrossenvironments[J].WeedTechnology,2011,25(1):44-50.
[15]SchusterCL,ShoupDE,Al-KhatibK.Responseofcommonlambsquarters(Chenopodiumalbum)toglyphosateasaffectedbygrowthstage[J].WeedSci,2007,55(2):147-151.
[16]ZiskaLH,TeasdaleJR,BunceJA.Futureatmosphericcarbondioxidemayincreasetolerancetoglyphosate[J].WeedSci,1999,47(5):608-615.
[17]OwenMDK.Weedspeciesshiftsinglyphosate-resistantcrops[J].PestManagementScience,2008,64(4):377-387.
[18]MelindaK,YerkaAT,WiersmaR,etal.Reducedtranslocationisassociatedwithtoleranceofcommonlambsquarters(Chenopodiumalbum)toglyphosate[J].WeedScience,2013,61(3):353-360.
[19]RibeiroDN,NandulaVK,DayanFE,etal.Possibleglyphosatetolerancemechanisminpittedmorningglory(IpomoealacunosaL.)[J].JournalofAgriculturalandFoodChemistry,2015,63(6):1689-1697.
[20]楊浩娜,柏连阳.抗草甘膦杂草检测方法的研究进展[J].杂草科学,2014,32(3):30-33.
[21]张猛,刘延,张朝贤,等.田旋花对草甘膦的耐受性机制[J].植物保护学报,2011,38(6):551-556.
[22]李涛,沈国辉,钱振官,等.耐草甘膦杂草控制技术研究[J].上海农业科学,2009,25(3):54-58.
