谷氨酰胺转移酶对食品中蛋白质改性研究进展
2017-04-13付桂明刘成梅童火艳
李 斌,付桂明,*,刘成梅,万 茵,邹 彬,童火艳
(1.南昌大学食品科学与技术国家重点实验室,江西南昌 330047;2.南昌大学食品学院,江西南昌 330031;3.南昌大学中德食品工程中心,江西南昌 330047)
谷氨酰胺转移酶对食品中蛋白质改性研究进展
李 斌1,2,3,付桂明1,2,3,*,刘成梅1,2,3,万 茵1,2,邹 彬1,2,3,童火艳1,2,3
(1.南昌大学食品科学与技术国家重点实验室,江西南昌 330047;2.南昌大学食品学院,江西南昌 330031;3.南昌大学中德食品工程中心,江西南昌 330047)
谷氨酰胺转移酶是一类可以催化酰基转移反应的酶,能够促进蛋白质分子间发生交联反应,催化蛋白质之间异肽键的形成,并广泛应用于食品加工过程中蛋白质的改性。本文通过查阅近年来国内外研究进展,对谷氨酰胺转移酶的酶来源、酶学性质、酶的催化机理及其对食品蛋白质的改性、在食品中的应用进行了综述。
谷氨酰胺转移酶,食品,蛋白质,改性
谷氨酰胺转移酶是一种可以催化蛋白质或者多肽的谷氨酰胺残基的γ-甲酰胺基团与伯氨基化合物之间的酰基发生转移反应的酶,可以提升蛋白质功能特性和营养价值,影响产品的感官,广泛存在于哺乳动物、植物、鱼类、细菌、真菌、绿藻等生物中。由于其具有很好的交联特性,被称为“21世纪的超级粘合剂”,在食品、纺织、医药等领域有着广泛的应用。
1 谷氨酰胺转移酶简介
谷氨酰胺转移酶(Transglutaminase,TGase,EC 2.3.2.13)是二十世纪五十年代首先从豚鼠肝脏中分离得到的一类催化酰基转移反应酶,可以催化谷氨酰胺残基中γ-甲酰胺基团(供体)与不同化合物的ε-胺类基团(酰胺残基的受体)之间异肽键的形成,并诱导蛋白质之间发生交联反应[1]。这种催化作用会导致蛋白质理化性质发生显著改变,如溶解性、乳化性、发泡性和凝胶性等。
TGase按来源主要可分为两类:一类来自于哺乳动物(如几内亚猪和豚鼠)的肝脏、表皮等,其中来源于豚鼠肝脏的TGase已研究得比较透彻。另一类来自于链霉菌(Streptomyces)和枯草芽孢杆菌(Bacillussubtilis)等微生物,其中研究较多的是链霉菌来源的TGase。尽管这两类TGase有着相似的催化性质,但它们在氨基酸组成、酶学性质等方面存在较大差异。与动物来源的TGase相比,微生物TGase(MTG)表现出很多优势:酶活不依赖于Ca2+[2],对温度和pH的稳定性更高[3],可以通过微生物发酵来获取,成本低、产量大,现已广泛应用于食品加工中[4-5]。
2 TGase催化蛋白质改性机理
TGase可通过胺的导入、分子内和分子间的交联、脱胺基作用三种途径来使蛋白质的结构发生改变,从而可以使蛋白质形成高分子的聚合物或者改变其疏水性,导致蛋白质的凝胶性、乳化性、起泡性、粘度和持水能力等发生改变(如图1)[6]。其碱基受体可以是以下三种:
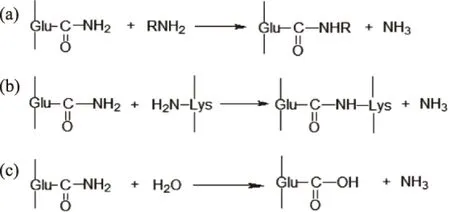
图1 谷氨酰胺转移酶的作用机理Fig.1 The mechanism of transglutaminase
(a)酰胺基发生转移反应
当TGase作用于蛋白质分子时,它可催化在蛋白质及肽键中的谷氨酰胺残基γ-羰基(胺基供体)和伯胺(胺基受体)之间的酰胺基发生转移反应,利用该反应可将赖氨酸引入蛋白质以改善蛋白质营养特性。
(b)共价交联作用
TGase以蛋白质中赖氨酸残基γ-氨基作为酰基受体,在蛋白质分子之内或分子之间形成 ε-(γ-谷氨酰胺基)赖氨酸(G-L)共价交联。通过该反应蛋白质分子发生交联,可以形成稳定的蛋白质网络结构,对蛋白质凝胶的形成具有重要意义[6]。另外,由于蛋白质分子发生交联,改变了蛋白质的表面疏水性,从而引起与蛋白质表面疏水性相关的蛋白质性质发生改变,如蛋白质的乳化性、起泡性和粘性等[7]。
(c)脱去胺基反应
当不存在伯胺时,水会成为酰基受体,谷氨酰胺残基脱去胺基生成谷氨酸残基。该反应改变蛋白质的等电点和溶解性[8]。
3 TGase对蛋白质改性作用与在食品加工中应用
谷氨酰胺转移酶要作为重要的蛋白质改性酶类,其主要功能如下:谷氨酰胺转移酶可以催化蛋白质之间发生交联作用,从而可以改善蛋白质的溶解性、凝胶性、乳化性、起泡性、持水能力和粘度等性质,被广泛的应用在食品工业中。
3.1 TGase对蛋白质溶解性的影响及在食品中应用
蛋白质的溶解性与蛋白质氨基酸残基上的亲水基团和疏水基团有着密切的联系。一般来说,蛋白质分子表面疏水基团越少,蛋白质的溶解性越大。蛋白质固有的物理化学特性和外在因素(如pH、离子强度、温度、有机溶剂等)均会影响蛋白质的溶解性,而且蛋白质溶解性的改变会引起蛋白质乳化性、起泡性和凝胶性发生相应的改变。
在低溶度蛋白质溶液中,TGase处理蛋白质可以诱发蛋白质的谷氨酰胺残基脱去胺基以提高蛋白质的溶解性,进而改善蛋白质的乳化性和起泡性[9]。Agyare等[10]研究发现,在特定的条件下(55 ℃ 1 h或5 ℃ 18 h),用TGase处理后水解小麦蛋白的溶解性可以提高3~29倍。Ali等[11]研究发现即使在高盐浓度下,添加TGase可以使豆科蛋白的溶解性得到明显的改善,溶液浊度分别由0.36和0.31均下降到了0.2左右。这主要是由于大豆分离蛋白具有TGase的识别位点,经过TGase处理后,形成的聚合物的游离氨基数水平较低。而且还降低了聚合物分子表面的疏水性,从而提高了蛋白质的溶解度。
而对于溶解性较高的蛋白,经TGase处理会降低其溶解度。在pH4.0和5.0条件下,在5%的乳清分离蛋白中加入50U/g的TGase,发现经过处理的乳清分离蛋白溶解性明显低于未经TGase处理的乳清分离蛋白。这归因于经TGase处理后乳清分离蛋白中的β-乳球蛋白热稳定性提高,使其更容易发生聚集。此外,TGase的交联作用使得赖氨酸残基的ε基胺类基团减少,显著改变了蛋白质分子表面疏水基团和亲水基团的比例,导致蛋白质在其等电点pH处易形成沉淀,溶解度降低[12]。并且在乳清蛋白和羧甲基壳聚糖制备的食品包装膜(WPC-CMC膜)中加入10U/g的TGase,37 ℃孵育4 h后,由于TGase的交联作用而生成了大分子聚合物,导致WPC-CMC膜的溶解度显著降低[13]。
3.2 TGase对蛋白质凝胶性的影响及在食品中应用
凝胶性是蛋白质最重要的功能特性之一,蛋白质凝胶类型主要决定于凝胶的分子形状,而凝胶的形成是一个动态过程,受溶液pH、离子强度、温度等影响。通过TGase的交联作用可以使蛋白质形成稳定、高弹性、不可逆的凝胶,即使在较低的蛋白浓度下,也可以达到同样效果。
TGase在生物大分子形成的凝胶基质中可以发挥关键作用[14],尤其是以肉类蛋白为主要基质通过TGase诱导交联形成凝胶[15-16]。将TGase加入明胶-CaCO3矿物质膜中,成膜的凝胶强度增加了17.24%[17]。对于不同种类的肉类蛋白,TGase对其交联形成凝胶的能力存在差异,如TGase易使肌球蛋白重链发生交联形成凝胶,但是很难使肌动蛋白形成凝胶[18]。对于非肉类蛋白,姜燕[19]等在可食用性PPI(花生分离蛋白)膜中加入8 U/g的TGase中后,凝胶强度得到了极大的增加,而不添加TGase的PPI膜则无法从制膜板上剥离。Tsevdou等[20]研究发现在高温高压条件下,将TGase加入到酸奶中可以加快牛奶中乳清蛋白和酪蛋白以及乳清蛋白与乳清蛋白的交联速率,其所制产品的凝胶强度和持水性也得到明显改善。凝胶强度增加是由于TGase促进蛋白间发生交联和聚合作用。TGase添加量过高,会引起凝胶强度降低。这是因为过度的交联会导致蛋白质所形成的网络结构遭到破坏[21]。
3.3 TGase对蛋白质乳化性和起泡性的影响及在食品中应用
蛋白质是天然两性物质,具有很好的乳化性,许多动物蛋白都通过乳化作用,形成水包油体系,如蛋黄酱、牛奶等。另外,蛋白质也是很好的发泡剂,在水相体系中蛋白质可以形成液膜包裹周围的气体,最终形成气泡。经过TGase的作用可以改善蛋白质的乳化性和起泡性。
Agyare等[22]发现经TGase处理的水解小麦面筋蛋白乳化能力提高了四倍以上。另外,在55 ℃、pH6.5、TGase处理1 h的水解小麦面筋蛋白与未经TGase处理的小麦面筋蛋白相比,其乳化活性指数提高了15倍。对于起泡能力,TGase处理使小麦面筋蛋白的等电点由pH5.5~6.0下降到了pH4.0,且蛋白在其等电点附近时起泡能力最好[23]。说明小麦面筋蛋白在特定pH条件下可以提高其起泡能力。对于面包的起泡性,Renzetti[9]等研究发现,在玉米面粉中加入10 U/g的TGase可以提高面包的抗形变能力,而面包的抗形变能力与起泡性有着很大的关系。Hong等[24]报导TGase可通过交联作用使猪肉肌原纤维蛋白的分子量增大,从而增加了其乳状液的稳定性。导致乳化能力的提高可能是由于TGase的脱胺基作用,使得谷氨酰胺残基、天冬氨酰胺残基脱去氨基,导致蛋白质分子的负电荷增加,从而改变了蛋白质亲水基团和疏水基团的比例,油水界面的表面张力降低,持水能力和乳化能力增强。
3.4 TGase对蛋白质持水性的影响及在食品中应用
持水性是蛋白质非常重要的性质之一,是指蛋白质分子通过物理方式截留并阻止自由水和结合水渗出的能力,与蛋白质的凝胶性、乳化性和起泡性也有着密切的联系,对肉类制品的颜色、多汁性、柔嫩程度以及面包类产品的质构品质有直接影响。
Renzetti等[9]研究发现添加TGase可以减少荞麦粉和大米粉烘烤过程中的损失,表明荞麦粉和大米粉中所含蛋白持水性增强。在大豆分离蛋白和面筋中加入TGase可以增加形成凝胶的持水能力[25]。马景球[26]通过正交实验发现在调理鸡肉中加入0.4%(w/w)的TGase,35 ℃保温1.5 h后,调理鸡肉的持水性能最佳。这也归因于TGase的脱胺基作用使蛋白质亲水性增强,同时TGase的交联作用使蛋白质间发生交联形成凝胶,这两者均有利于蛋白质持水能力的增强。但是Han等[27]研究发现在肌原纤维蛋白中添加过量的TGase会使得蛋白质分子间过度交联,影响了蛋白质与水之间相互作用力,破坏了蛋白质的持水能力。因此,TGase的适量添加能更好产生稳定的蛋白凝胶,更有效地将水截留于蛋白质分子所构成的基体,增强蛋白质的持水能力。
3.5 TGase对蛋白质黏度的影响及在食品中应用
在许多食品如酸奶、冰激凌中,黏度被作为最重要的指标之一。黏度与蛋白质的乳化性和凝胶性有着密切的联系。
Hong等[28]研究发现,TGase添加有助于猪肌原纤维蛋白表观黏度增加,并且在添加TGase的同时,添加0.3 mol/L NaCl可使猪肌原纤维蛋白表观黏度增加更加明显。Farnsworth[29]等在羊奶制备的酸奶中加入0.25U/g的TGase,与没有添加TGase的酸奶相比,其粘度增加了75%。马景球等[26]将TGase加入到调理鸡肉制品中后,随着反应温度升高,粘度由0.45上升到了0.58。主要的原因是由于TGase促使蛋白发生交联,使蛋白的表观粘度增加,从而增加了产物的粘度。
4 结论与展望
随着现代科学技术的发展,已经有越来越多的酶制剂应用在蛋白类食品的改良中,以此来提高蛋白类食品的加工性能、感官品质和营养特性,TGase无疑是其中最有潜力和发展前途的酶之一[30-31]。但是现阶段也存在着TGase原产菌株产量有限、酶的温度稳定性差[32]等缺点,所以异源表达和分子改造TGase已经成为了近年来的研究趋势,但是生产水平距离产业化还有较大差距[33]。而随着酶的保护剂、酶的固定化等技术的发展,将为TGase在食品行业中的应用提供巨大的帮助,并且有望解决现阶段TGase在食品行业应用中存在的问题。
[1]Buettner K,Hertel T C,Pietzsch M. Increased thermostability of microbial transglutaminase by combination of several hot spots evolved by random and saturation mutagenesis[J]. Amino Acids,2012,42(2):987-996.
[2]Motoki M,Seguro K. Transglutaminase and its use for food processing[J]. Trends in Food Science & Technology,1998,9(5):204-210.
[3]Zhao L,Li X,Zhao J,et al. A novel smart injectable hydrogel prepared by microbial transglutaminase and human-like collagen:Its characterization and biocompatibility[J]. Materials Science & Engineering C,2016,68(1):317-326.
[4]Sun X D,Arntfield S D. Gelation properties of salt-extracted pea protein isolate catalyzed by microbial transglutaminase cross-linking[J]. Food Hydrocolloids,2011,25(1):25-31.
[5]Yan M,Li B,Zhao X,et al. Physicochemical properties of gelatin gels from walleye pollock(Theragra chalcogramma)skin cross-linked by gallic acid and rutin[J]. Food Hydrocolloids,2011,25(5):907-914.
[6]Gaspar A L,de Góes-Favoni S P. Action of microbial transglutaminase(MTGase)in the modification of food proteins:a review.[J]. Food Chemistry,2015,171(1):315-322.
[7]Tang C H,Yang M,Liu F,et al. Stirring greatly improves transglutaminase-induced gelation of soy protein-stabilized emulsions[J]. Lebensmittel-Wissenschaft und-Technologie,2013,51(1):120-128.
[8]Silvana Pedroso de Góes-Favoni,Fábio Rodrigo Bueno. Microbial Transglutaminase:General Characteristics and Performance in Food Processing Technology[J]. Food Biotechnology,2014,28(1):1-24.
[9]Renzetti S,Bello F D,Arendt E K. Microstructure,fundamental rheology and baking characteristics of batters and breads from different gluten-free flours treated with a microbial transglutaminase[J]. Journal of Cereal Science,2008,48(1):33-45.
[10]Agyare K K,Xiong Y L,Addo K. Influence of salt and pH on the solubility and structural characteristics of transglutaminase-treated wheat gluten hydrolysate[J]. Food Chemistry,2008,107(3):1131-1137.
[11]Ali N A,Ahmed S H,Mohamed E S A,et al. Effect of Transglutaminase Cross Linking on the Functional Properties as a Function of NaCl Concentration of Legumes Protein Isolate[J]. International Journal of Biological & Life Sciences,2011,7(1):8-12.
[12]Damodaran S,Agyare K K. Effect of microbial transglutaminase treatment on thermal stability and pH-solubility of heat-shocked whey protein isolate[J]. Food Hydrocolloids,2013,30(1):12-18.
[13]Jiang S J,Zhang X,Ma Y,et al. Characterization of whey protein-carboxymethylated chitosan composite films with and without transglutaminase treatment.[J]. Carbohydrate Polymers,2016,153(1):153-159.
[14]Grossmann L,Wefers D,Bunzel M,et al. Accessibility of transglutaminase to induce protein crosslinking in gelled food matrices-Influence of network structure[J]. LWT-Food Science and Technology,2017,75(1):271-278.
[15]Hu Y,Liu W,Yuan C,et al. Enhancement of the gelation properties of hairtail(Trichiurus haumela)muscle protein with curdlan and transglutaminase[J]. Food Chemistry,2015,176(1):115-122.
[16]Jang H S,Hong C L,Chin K B. Evaluation of red bean protein[Vigna angularis]isolate on rheological properties of pork myofibrillar protein gels induced by microbial transglutaminase[J]. International Journal of Food Science & Technology,2015,50(7):1583-1588.
[17]刘安军,王跃猛,王稳航,等. 谷氨酰胺转移酶对明胶-CaCO3矿物质膜成膜性的影响[J]. 现代食品科技,2014(5):18-22.
[18]Herranz B,Tovar C A,Borderias A J,et al. Effect of high-pressure and/or microbial transglutaminase on physicochemical,rheological and microstructural properties of flying fish surimi[J]. Innovative Food Science & Emerging Technologies,2013,20(4):24-33.
[19]姜燕,温其标,唐传核,等. 谷氨酰胺转移酶对食物蛋白质成膜性能的影响[J]. 华南理工大学学报:自然科学版,2006,34(8):110-115.
[20]Tsevdou M S,Eleftheriou E G,Taoukis P S. Transglutaminase treatment of thermally and high pressure processed milk:Effects on the properties and storage stability of set yoghurt[J]. Innovative Food Science & Emerging Technologies,2013,17(1):144-152.
[21]Guo J,Jin Y C,Yang X Q,et al. Computed microtomography and mechanical property analysis of soy protein porous hydrogel prepared by homogenizing and microbial transglutaminase cross-linking[J]. Food Hydrocolloids,2013,31(2):220-226.
[22]Agyare K K,Addo K,Xiong Y L. Emulsifying and foaming properties of transglutaminase-treated wheat gluten hydrolysate as influenced by pH,temperature and salt[J]. Food Hydrocolloids,2009,23(1):72-81.
[23]Hammershoj M,Prins A,Qvist K B. Influence of pH on surface properties of aqueous egg albumen solutions in relation to foaming behaviour.[J]. Journal of the Science of Food and Agriculture,1999,79(6):859-868.
[24]Hong G P,Min S G,Chin K B. Emulsion properties of pork myofibrillar protein in combination with microbial transglutaminase and calcium alginate under various pH conditions.[J]. Meat Science,2012,90(1):185-93.
[25]Qin X S,Luo S Z,Cai J,et al. Transglutaminase-induced gelation properties of soy protein isolate and wheat gluten mixtures with high intensity ultrasonic pretreatment.[J]. Ultrasonics Sonochemistry,2016,31(1):590-597.
[26]马景球. 谷氨酰胺转移酶对生鲜调理鸡肉保水性影响的研究[J]. 食品工程,2015(1):35-38.
[27]Han M,Zhang Y,Ying F,et al. Effect of microbial transglutaminase on NMR relaxometry and microstructure of pork myofibrillar protein gel[J]. European Food Research and Technology,2009,228(4):665-670.
[28]Hong G P,Koobok C. Effects of microbial transglutaminase and sodium alginate on cold-set gelation of porcine myofibrillar protein with various salt levels[J]. Food Hydrocolloids,2010,24(4):444-451.
[29]Farnsworth J P,Li J,Hendricks G M,et al. Effects of transglutaminase treatment on functional properties and probiotic culture survivability of goat milk yogurt[J]. Small Ruminant Research,2006,65(65):113-121.
[30]Mark D,Christian S,Sybille N,et al. Texturisation and modification of vegetable proteins for food applications using microbial transglutaminase[J]. European Food Research and Technology,2007,225(2):287-299.
[31]Min B,Green B W. Use of microbial transglutaminase and nonmeat proteins to improve functional properties of low NaCl,phosphate-free patties made from channel catfish(Ictalurus punctatus)belly flap meat[J]. Journal of Food Science,2008,73(5):218-226.
[32]王美玲. 微生物谷氨酰胺转移酶及其在食品工业中的应用[J]. 山东食品发酵,2015(2):34-36.
[33]李鹏飞. 高效表达谷氨酰胺转胺酶的毕赤酵母工程菌构建及其分泌能力改造[D].海口:海南大学,2013.
Research progress on modification ofprotein in food with transglutaminase
LI Bin1,2,3,FU Gui-ming1,2,3,*,LIU Cheng-mei1,2,3,WAN Yin1,2,ZOU Bin1,2,3,TONG Huo-yan1,2,3
(1.State Key Laboratory of Food Science and Technology,Nanchang University,Nanchang 330047,China; 2.Food Science and Technology College,Nanchang University,Nanchang 330031,China; 3.Sino-German Food Engineering Center,Nanchang University,Nanchang 330047,China)
Transglutaminase(TGase)is an enzyme of the class of transferases widely known to modify protein functional properties in food systems. The main mechanisms of action are polymerisations,in which lead to the formation of isopeptide bond between protein-protein. This article reviews sources,characteristics,catalytic mechanism of transglutaminase,its application in protein modification and food field by summrizing the present study on transglutaminase in China and abroad.
transglutaminase;food;protein;modification
2016-10-19
李斌(1990-),男,硕士研究生,研究方向:发酵工程,E-mail:17698312959@163.com。
*通讯作者:付桂明(1972-),男,博士,教授,研究方向:食品科学、发酵工程,E-mail:fuguiming@ncu.edu.cn。
TS201.1
A
1002-0306(2017)07-0381-04
10.13386/j.issn1002-0306.2017.07.065
