氧化热处理对不锈钢基碳纳米管结构及其电化学检测性能的影响
2017-04-13程佳瑞陈荣生倪红卫
董 姗,程佳瑞,2,陈荣生,倪红卫
(1.武汉科技大学钢铁冶金及资源利用省部共建教育部重点实验室,湖北 武汉,430081;2.普渡大学工业工程学院,美国 西拉法叶市,47907)
氧化热处理对不锈钢基碳纳米管结构及其电化学检测性能的影响
董 姗1,程佳瑞1,2,陈荣生1,倪红卫1
(1.武汉科技大学钢铁冶金及资源利用省部共建教育部重点实验室,湖北 武汉,430081;2.普渡大学工业工程学院,美国 西拉法叶市,47907)
采用化学气相沉积法,以不锈钢基体中的Fe、Ni等成分为催化剂,直接在其表面生长碳纳米管并进行氧化热处理。采用场发射扫描电镜观察制备的碳纳米管形貌及尺寸,并采用接触角测量方法检测试样亲水性质,结合透射电镜、拉曼光谱和XPS检测分析氧化热处理引起的碳管形貌和特征差异,最后考察尿酸在碳纳米管电极上的电化学响应。结果表明,氧化热处理使碳纳米管平滑的表面变得粗糙,暴露出了更多的边平面结构,并且碳纳米管从疏水变为超亲水状态,使其在电化学反应过程中电极表面能够更好地与溶液中的物质接触,有利于材料电化学性能的提高;以经过氧化热处理的碳纳米管为电极,能够在大量抗坏血酸存在的条件下选择性地测定尿酸。
碳纳米管;不锈钢;化学气相沉积;氧化热处理;电化学检测;尿酸
碳纳米管(Carbon Nanotubes, CNTs)可看作由片状石墨卷曲而成,石墨片边平面暴露更多的活性位点,其电化学性能比基平面的高得多[1]。因此,对于碳纳米管而言,暴露更多的边平面有利于提高其电化学活性。基于碳纳米管的电化学传感器已成为当前的研究热点[2-3]。碳纳米管具有优良的生物兼容性[4-5],316L不锈钢又是生物医用不锈钢,如能采用合适的方法增加316L不锈钢基底上碳纳米管的边平面暴露程度,则有望发展出性能优良的电化学传感器。
目前碳纳米管多是通过在基底上分散催化剂粒子Fe、Ni等,采用化学气相沉积法(CVD)或等离子体增强化学气相沉积法(PECVD) 制备[6-8]。但是,纳米尺寸的催化剂粒径分布难以控制,并且容易团聚,往往影响其在基底材料上的均匀分散,使得碳纳米管的制备过程变得复杂。近年来有研究表明,利用不锈钢基体中的Fe、Ni等成分可直接催化不锈钢表面生长碳纳米管[9-10]。碳纳米管的电化学性能与其结构特性密切相关,在不锈钢表面直接生长的碳纳米管电化学活性低,为了提高活性,需要对其表面进行修饰。例如,文献[11]、文献[12]中分别对复合材料CNTs/PAM、 Nafion-MWCNT/β-CD的碳纳米管表面进行了功能化修饰,以提高其检测尿酸(UA)的电化学活性,但修饰过程都较为复杂,操作不便。为此,本文提出采用热处理的方式来扩大316L不锈钢基底上生长的碳纳米管的边平面,使碳纳米管活化,并将其用于测定UA,以验证此方法的有效性。
1 实验
1.1 原料和试剂
316L不锈钢片 (Goodfellow公司,英国)。
尿酸 (UA,AlfaAesar公司,美国),抗坏血酸(AA),以上试剂均为分析纯;0.1mol/L磷酸盐缓冲溶液(PBS,pH=7.0);体积比为5∶95的H2/Ar混合气体,C2H2(纯度大于99.9%)。
1.2 材料的制备
线切割0.5 mm厚的316L不锈钢片,得到尺寸为10 mm×10 mm的样片。采用不同型号砂纸(1000#,2000#)依次打磨,去除试样表面氧化物和油污,然后在KQ-100DE型超声波数控清洗仪上用无水乙醇和蒸馏水分别超声清洗10 min。以清洗后的样片为阳极,石墨片为阴极,在体积比为5∶95的HClO4+乙二醇溶液中进行电化学抛光,直流电源工作电压20 V,电解时间20 min,电解过程中用磁力搅拌器搅拌,反应温度控制为5 ℃。反应完毕后,再用无水乙醇、蒸馏水分别超声清洗10 min,待试样干燥备用,记为试样SS。将试样SS移入SK3-3-130型管式电阻炉内,以H2/Ar混合气为保护气氛,采用C2H2作为碳源,将温度升至800 ℃保持10 min,再降温到750 ℃,通入C2H2进行高温裂解,保温60 min,随后在保护气氛下缓慢冷却至室温,所得试样记为CNTs-1。再将制得的CNTs-1试样置于OTF-1200X型小型磁力滑动管式炉中,在500 ℃空气气氛下保温2 h,所得热处理试样记为CNTs-2。
1.3 试样的检测
利用FEI Nova 400 Nano场发射扫描电镜(SEM ) 对试样形貌进行表征。将不锈钢表面沉积的碳纳米管刮下后分散到无水乙醇里,使用JEM-2100 UHR透射电子显微镜 ( TEM ) 分析碳管形貌。采用ESCALAB 25Xi型X射线光电子能谱仪对碳纳米管进行元素分析。用OCA15PRO型接触角检测仪测试试样亲疏水性质。在LabRam HR型拉曼光谱仪上检测制备的碳材料结构及缺陷。
1.4 测定尿酸实验
将试样SS、CNTs-1和CNTs-2背面打磨处理后用导电银胶粘上铜棒,并用绝缘硅胶对其背面和侧面进行封装,保留正面10 mm×10 mm的有效工作面积。将封装好的样片作为工作电极,在CHI660E电化学工作站(辰华仪器有限公司,上海)上进行UA和AA测定,参比电极为饱和甘汞电极 (SCE),对电极为铂丝电极,检测过程保持室温约为25 ℃。记录循环伏安曲线 (CV)和差分脉冲伏安曲线 (DPV)。
2 结果与分析
2.1 材料表征
图1 所示为试样CNTs-1及经过热处理的试样CNTs-2的SEM照片。由图1 (a) 观察得出,试样CNTs-1表面已经生长出了碳纳米管,其直径约为120 nm,且互相缠绕。这种交错生长的方式暴露了更多的边平面,有利于碳纳米管获得更多的活性位点。由于碳纳米管直接在不锈钢上生长,并未借助外来催化剂,因此碳纳米管与基底不锈钢之间直接接触,碳管之间相互联结,使得整个材料成为一体。经过 500 ℃ 下空气气氛中保温2 h 处理,试样CNTs-2(图1 (b))的形貌与试样CNTs-1(图1 (a)) 基本一致,表明该试样仍具备碳纳米管的特征。

(a) CNTs-1 (b) CNTs-2
图1 试样的SEM照片
Fig.1 SEM images of the samples
借助TEM进一步检测碳纳米管热处理前后表面形貌的具体变化,结果如图2所示。由图2中可以看出,碳纳米管经热处理后表面形貌发生了明显的改变,试样CNTs-1的管壁近乎光滑;而热处理后试样 CNTs-2 碳管表面被烧蚀,管径变小,管壁非常粗糙,暴露出更多的边平面。
图3 所示为试样CNTs-1 和CNTs-2 的接触角检测结果。由图3中可以清晰地看出材料从疏水 (接触角为132°)到超亲水 (接触角小于5°)的变化,表明热处理有效地改善了碳纳米管的亲水性能。这是由于试样 CNTs-1的管壁较光滑,溶液较难附着;而试样 CNTs-2 粗糙的管壁有着大量的缺陷,同时裸露出更多的边平面,使得材料与溶液离子易于接触。当材料处于疏水状态时,与溶液离子难以接触,无法触发其活性位点,导电率较小,其接触电阻过大,进而难以用于电化学检测物质;而处于超亲水状态时,材料易被溶液离子触发,电子传输速率提高,感应电流增强,有利于其用于电化学传感检测[13]。

(a)CNTs-1

(b) CNTs-2

(a)CNTs-1 (b) CNTs-2
图3 试样的接触角检测照片
Fig.3 Contact angle measurement of the samples
对试样CNTs-1和CNTs-2进行拉曼光谱分析,结果如图4所示。由图4中可以看出,与试样CNTs-1相比,试样CNTs-2的D峰(1358 cm-1)和G峰(1580 cm-1)均有所加强,表明试样CNTs-2碳管缺陷相对增多,且石墨化程度降低。由图4数据计算得到试样CNTs-1、CNTs-2的ID/IG值分别为0.93和1.00,表明试样CNTs-2表面碳管的排列不如试样CNTs-1的有序,其单根碳管也不如试样CNTs-1的准直。两种试样都没有长出定向的碳纳米管阵列,且沉积有大量无定形碳。
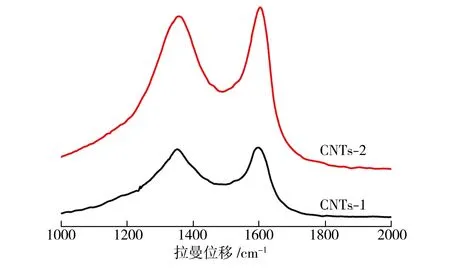
图4 试样的拉曼图谱
图5所示为试样CNTs-1和CNTs-2表面的XPS谱图。由图5(a)中可以观察到在284.2 eV和531.5 eV处出现了两个极强峰,分别对应于C1s峰和O1s峰;试样CNTs-2与原始碳纳米管CNTs-1相比,C1s峰的峰高基本一致,但O1s峰却明显强很多;其他部分并未出现较强的峰值,表明本试验所制得的碳纳米管表层主要化学成分为C和O。同时还可推测,利用不锈钢基底制备的碳纳米管,附着在其上的催化剂是很少量的,在进行电化学检测时所展现的电化学活性基本上都由碳纳米管本身所提供。由图5(b)中可以看出,C1s被分解为4个相关峰,分别对应于sp2杂化型C(284.2 eV)、sp3杂化型C(285.1 eV)、C—O (286.1 eV)和C=O (288.9 eV)[14-16],其中主峰为sp2、sp3杂化型C,伴峰为C—O 和C=O;相比较而言,试样CNTs-2的sp3杂化型C比例有所增加,这与拉曼检测得到的强度变化是一致的,同时,试样CNTs-2的C=O含量也得到了提高。由图5 (c)中可见,试样的O1s峰主要分为C=O峰(531.5 eV)和C—O—峰(533.4 eV)[17-18]。结合图5(a)中所示O1s峰加强的现象可知,热处理为原始碳纳米管引入了大量的含氧官能团,使得亲水性的羧基和羟基增多,从而使材料从疏水状态变为亲水状态。

(a)XPS全谱图 (b)C1s峰的XPS谱图 (c) O1s峰的XPS谱图
图5 试样的XPS谱图
Fig.5 XPS spectra of the samples
2.2 电化学性能分析
图6 所示为分别以SS、CNTs-1和CNTs-2作为电极在含有0.1 mmol/L UA、1 mmol/L AA和0.1 mmol/L UA+1 mmol/L AA的0.1 mol/L PBS电解液中,在-0.2~0.5 V电势范围和0.05 V/s扫描速率下测得的循环伏安曲线 (CV) 。由图6中可见,SS电极的 CV 曲线上无明显变化,表明不锈钢电极对 UA、AA 没有响应;CNTs-1 电极相对于 SS 电极的CV 曲线未有峰值变化发生,但在正电位时检测电流强度有小幅提高,这是由于CNTs-1电极虽对 UA、AA 没有响应,但因碳纳米管沉积在不锈钢表面后极大地增加了材料的比表面积,加上本身具有的电化学活性,使得其检测电流强度得到提高;在不同的电解液中,CNTs-2电极均表现出了 UA、AA 对应电势的氧化还原峰,电势差为300 mV,电流强度也较其他两种电极的电流强度有了较大的提高,表明以经过热处理的CNTs-2作为电极,不仅能够很好地分离 UA、AA 的氧化峰,其电化学性能也优于SS和CNTs-1电极。
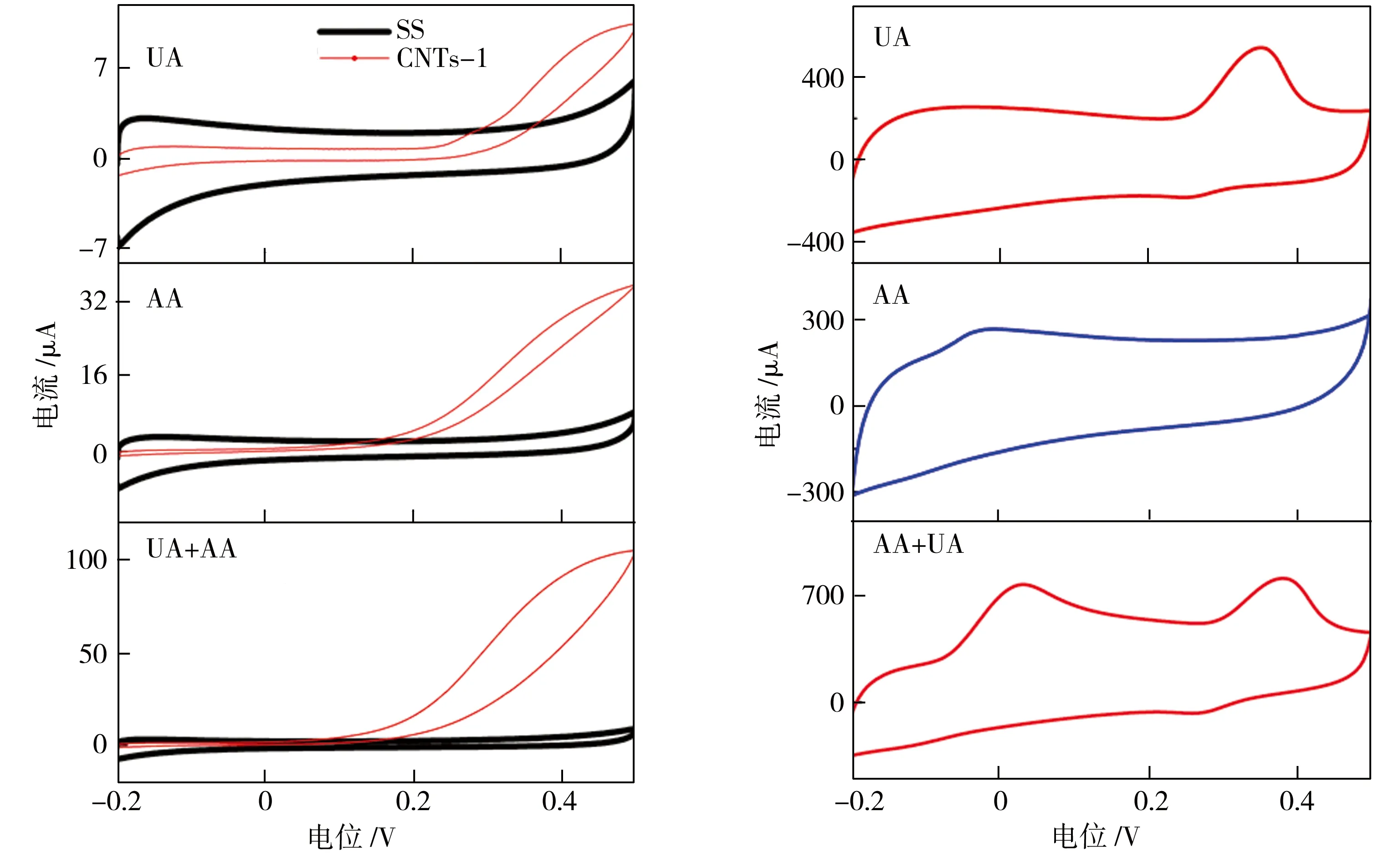
(a) SS和CNTs-1电极 (b) CNTs-2电极
图6 3种电极在不同电解液中的循环伏安曲线
Fig.6 CV curves of three kinds of electrodes in different electrolytes
鉴于 CNTs-2 电极对于 0.1 mmol/L UA+1 mmol/L AA 同时共存的溶液良好的电化学表现,进一步测定了CNTs-2电极对于该溶液中UA浓度发生变化时的电化学响应情况。图7所示为 CNTs-2 电极对于含有1 mmol/L AA 和不同浓度 UA 的0.1 mol/L PBS溶液的差分脉冲伏安曲线 (DPV),UA的浓度分别为0、10、20、30、50、80、100、120、150 μmol/L。从图7中可以看出,不同浓度 UA 在1 mmol/L AA存在的条件下,在 CNTs-2 电极均有两个独立对应的氧化还原峰出现。对于固定浓度的AA,其峰电流基本保持不变,而随着 UA 浓度的升高,UA 的峰电流值也逐渐升高。图8所示为不同UA浓度下CNTs-2 电极DPV曲线UA峰电流的变化情况。由图8中可见,随着UA浓度的增大,峰电流相应升高并呈很好的线性相关性。
综上分析可知,当碳纳米管在空气中高温退火处理后,碳管表面被部分破坏,但是仍然具备碳纳米管的形貌和基本特征。热处理后的碳纳米管不仅产生了更多的缺陷,暴露出更多的边平面,同时还引入了大量亲水性的含氧官能团,其用作电化学反应电极时促进了溶液离子的传递,提高了材料的导电性,因此使得其检测UA的电化学活性提高。
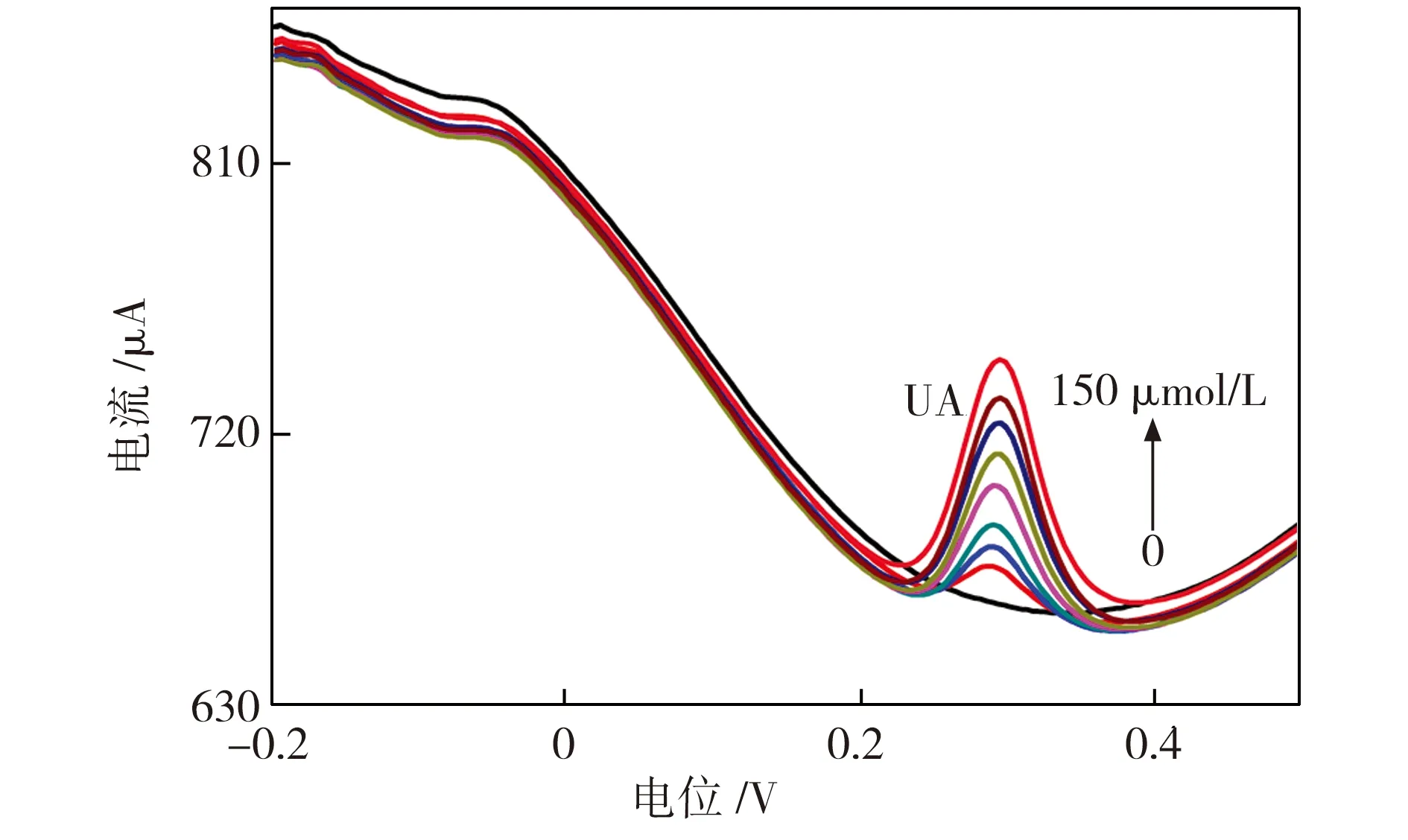
图7 CNTs-2电极在不同浓度的UA和1 mmol/L AA共存的 0.1 mol/L PBS溶液中的差分脉冲伏安曲线
Fig.7 DPV curves of the CNTs-2 electrode with different concentrations of UA in the presence of 1 mmol/L AA and 0.1mol/L PBS
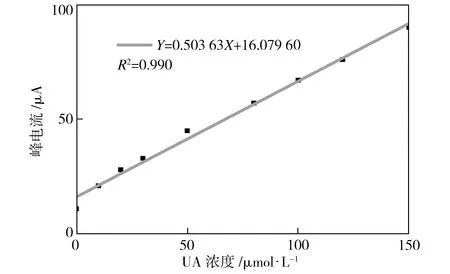
图8 图7中峰电流与UA浓度的关系曲线
Fig.8 Relationship between the oxidation peak currents and concentrations of UA
3 结语
通过CVD方法,在316L不锈钢表面直接制备出尺寸均匀的碳纳米管,在空气气氛下对所制备的碳纳米管进行热处理后,其表面特征和性能发生了变化。电化学检测尿酸结果表明,经过热处理的碳纳米管电极在对尿酸分子的检测中表现出良好的电化学响应。在不明显破坏碳纳米管石墨层结构的前提下,适当的热处理可以提高碳纳米管对尿酸的电化学检测性能。
[1] Pumera M. The electrochemistry of carbon nanotubes: fundamentals and applications[J]. Chemistry-A European Journal, 2009, 15(20):4970-4978.
[2] Nicholls I A, Andersson H S, Charlton C, et al. Theoretical and computational strategies for rational molecularly imprinted polymer design[J]. Biosensors and Bioelectronics, 2009, 25(3):543-552.
[3] Justino C I L, Rocha-Santos T A P, Duarte A C. Advances in point-of-care technologies with biosensors based on carbon nanotubes[J].Trends in Analytical Chemistry, 2013, 45(4):24-36.
[4] Li J H, Hong R Y, Luo G H, et al. An easy approach to encapsulating Fe3O4nanoparticles in multiwalled carbon nanotubes[J]. New Carbon Materials, 2010, 25(3):192-198.
[5] Leonhardt A, Hampel S, Müller C, et al. Synthesis, properties, and applications of ferromagnetic-filled carbon nanotubes[J]. Chemical Vapor Deposition, 2006, 12(6):380-387.
[6] Singh S, Verma N. Fabrication of Ni nanoparticles-dispersed carbon micro-nanofibers as the electrodes of a microbial fuel cell for bio-energy production[J]. International Journal of Hydrogen Energy, 2015, 40(2):1145-1153.
[7] Wu R B, Xue Y H, Qian X K, et al. Pt nanodendrites anchored on bamboo-shaped carbon nanofiber arrays as highly efficient electrocatalyst for oxygen reduction reaction[J]. International Journal of Hydrogen Energy, 2013, 38(36):16677-16684.
[8] Fan Y Y, Cheng H M, Wei Y L, et al. The influence of preparation parameters on the mass production of vapor-grown carbon nanofibers[J]. Carbon, 2000, 38(6):789-795.
[9] Camilli L, Scarselli M, Gobbo S D, et al. The synthesis and characterization of carbon nanotubes grown by chemical vapor deposition using a stainless steel catalyst[J]. Carbon, 2011, 49(10):3307-3315.
[10]Yamagiwa K, Ayato Y, Kuwano J. Liquid-phase synthesis of highly aligned carbon nanotubes on preheated stainless steel substrates[J]. Carbon, 2016, 98:225-231.
[11]Zhang H F, Zhang J, Zheng J B. Electrochemical behavior of modified electrodes with carbon nanotubes and nanofibers: application to the sensitive measurement of uric acid in the presence of ascorbic acid[J]. Measurement, 2015, 59:177-183.
[12]Wayu M B, Dipasquale L T, Schwarzmann M A, et al. Electropolymerization of β-cyclodextrin onto multi-walled carbon nanotube composite films for enhanced selective detection of uric acid[J]. Journal of Electroanalytical Chemistry,2016,783:192-200.
[13]Chodankar N R, Dubal D P, Gund G S, et al. A symmetric MnO2/MnO2flexible solid state supercapacitor operating at 1.6 V with aqueous gel electrolyte[J]. Journal of Energy Chemistry, 2016, 25(3):463-471.
[14]Yao N, Xie X, Chen S, et al. Towards effective utilization of nitrogen-containing active sites: Nitrogen-doped carbon layers wrapped CNTs electrocatalysts for superior oxygen reduction[J]. Electrochimica Acta, 2016, 187:153-160.
[15]Varga M, Izak T, Vretenar V, et al. Diamond/carbon nanotube composites: Raman, FTIR and XPS spectroscopic studies[J]. Carbon, 2017, 111:54-61.
[16]Wepasnick K A, Smith B A, Bitter J L, et al. Chemical and structural characterization of carbon nanotube surfaces[J]. Analytical and Bioanalytical Chemistry, 2010, 396:1003-1014.
[17]Hellgren N, Haasch R T, Schmidt S, et al. Interpretation of X-ray photoelectron spectra of carbon-nitride thin films: new insights from in situ XPS[J]. Carbon, 2016, 108:242-252.
[18]Baer D R, Engelhard M H. XPS analysis of nanostructured materials and biological surfaces[J]. Journal of Electron Spectroscopy and Related Phenomena, 2010, 178-179:415-432.
[责任编辑 郑淑芳]
Effect of oxidizing heat-treatment on the structural and electrochemical properties of carbon nanotube on stainless steel
DongShan1,ChengGaryJ.1,2,ChenRongsheng1,NiHongwei1
(1. Key Laboratory for Ferrous Metallurgy and Resources Utilization of Ministry of Education, Wuhan University of Science and Technology, Wuhan 430081, China;2. School of Industrial Engineering, Purdue University, West Lafayette 47907,USA)
Using Fe, Ni and other elements in stainless steel as catalysts, carbon nanotubes were fabricated directly on stainless steel by chemical vapor deposition and heat treatment. The morphology and size of carbon nanotubes were characterized by field emission scanning electron microscope. The contact angle was used to test the hydrophilic property of the sample and analyze in detail the differences of carbon nanotubes in morphology and characteristics caused by heat treatment with the aid of transmission electron microscopy, Raman and XPS. Finally, the electrochemical response of uric acid at the carbon nanotube electrode was investigated. Results show that heat treatment roughens the smooth surface of carbon nanotubes, exposes more of the edge plane structure, and transfers carbon nanotubes from hydrophobic to hydrophilic. As a result, in the process of electrochemical reaction, the surface of carbon nanotube electrode can better contact the solution, which is beneficial to the improvement of the electrochemical properties. After heat treatment, the electrode can selectively determinate uric acid in the presence of large amounts of ascorbic acid.
carbon nanotube; stainless steel; chemical vapor deposition; oxidizing heat-treatment; electrochemical detection; uric acid
10.3969/j.issn.1674-3644.2017.02.006
2016-12-15
国家自然科学基金资助项目(51171133, 51471122);湖北省自然科学基金重点项目(2015CFA128).
董 姗(1991-),女,武汉科技大学硕士生. E-mail:1264364771@qq.com
倪红卫(1966-),男,武汉科技大学教授,博士生导师. E-mail: nihongwei@wust.edu.cn
TB332
A
1674-3644(2017)02-0110-06
